Cyt c与NO配位反应及环境因素对其反应的影响
唐 乾,李如玉,史珊珊,曹洪玉,王立皓,郑学仿
(1. 大连大学 生命科学与技术学院, 辽宁 大连 116622;2. 大连大学 辽宁省生物有机化学重点实验室,辽宁 大连116622;3. 大连大学 环境与化学工程学院,辽宁 大连 116622)
0 引言
血红素类蛋白是生物体内一系列含有原卟啉Ⅸ辅基的金属蛋白质,在生物体中发挥着极其重要的生物功能[1]。由于血红素蛋白含有血红素辅基结构这一特殊性,因此他们能与不同的生物活性小分子进行配位。通过活性小分子配体与血红素蛋白相互作用的研究,人们能更好地解释血红素蛋白的生物功能。近年来血红素蛋白与各种活性小分子配体的结合过程、结合动力学等问题一直是众多学科专家研究的热点,而这其中的气体配体与血红素蛋白的相互作用研究是其中一项更富挑战性的研究课题[2,3]。已有研究表明:肌红蛋白能与一氧化碳(CO)、一氧化氮(NO)等小分子配体可逆地结合与释放,从而调控其它蛋白的生理、生化功能[4],李涛等[5]利用纳秒瞬态拉曼光谱技术研究了气体分子配体 NO与肌红蛋白结合的动力学过程。渠敏等[6]利用光声量热法通过测量碳氧血红蛋白光解反应的焓变和结构体积变化,研究了血红蛋白与其配合物的结合与解离过程中各反应分子的结构变化和能量变化的动力学过程以及作用机理。Karin Nienhaus等[7]采用傅里叶变换红外-温度导数光谱(FTIR-TDS)技术,在较低的温度下,研究了NO和血红素蛋白的结合,Ionascu等[8]人也提出NO和血红素蛋白的再结合动力学过程受温度的影响,外界环境的改变会影响血红素蛋白与NO的结合。
细胞色素C(Cytochrome c;Cytc)是一种含血红素的蛋白,它在呼吸链中将电子由复合物III传递给复合物 IV[9],它由一个含铁的血红素和其周围 104个氨基酸残基肽链构成的金属蛋白,血红素Fe与卟啉环的四个吡咯结构上的4个N形成配位键,而血红素Fe的第5和第6个位配位键的形成则分别与多肽链上的Met80和His18形成,同时借助在血红素原卟啉环上的乙烯基侧链上的S-H进行还原加成反应,生成的巯基键与肽链的Cys14和Cys17分别形成共价键[10]。在发生氧化还原反应的过程蛋白的构象也发生相应的变化[11]。Cytc在水溶液中以单体、多聚体两种形式存在,在极性溶剂中以多聚体形式为主,因此当溶液极性发生改变时,Cytc的血红素构象也会发生相应的变化[12],因此Cytc所在溶剂的微环境发生改变将会对Cytc的结构产生一定的影响。
NO分子一直受到各学科领域的高度关注[13-16],是生物体内很多重要反应的关键性细胞信号分子,可以控制和调节各种不同生理过程,例如血压的控制,引起肌肉松弛,导致血小板聚集,影响神经递质传递和免疫反应等。关于Cytc与NO的相互作用研究[17-18]主要利用紫外区 Q带进行分析而得出的,而关于紫外区的soret带的分析却没有提及,根据Gouterman提出的四轨道模型理论可知,Cytc分子的soret带由血红素卟啉中的外层电子跃迁产生的,把它归属为π-π*跃迁的第二电子激发单重态,血红素卟啉的变化情况可由它的变化来分析,这一区域的光谱变化与Q带相比是非常灵敏的,因此利用Soret带的变化来分析血红素卟啉的变化情况更全面和具有重要意义。而且,之前的研究也没有全面地分析外界因素对Cytc与NO配位反应的影响。本文通过光谱法研究Cytc与NO结合及解离反应,以及外界环境的影响,进而找到了其反应的最佳条件。
1 实验部分
1.1 试剂与仪器
马心肌来源的细胞色素C(Cytc)样品,购于美国Sigma公司,纯度>99%,测定用 PB缓冲溶液(0.01 mol/L、0.05 mol/L、0.1 mol/L、0.15 mol/L、0.2 mol/L,pH=5.4、6.4、7.4、8.4、9.4、10.4)配制成浓度为 1×10-5mol/L的溶液,避光于4℃保存,并尽快用于实验测定;proliNONOate ,或者写成proliNO/NO,20℃时,其半衰期为6 s,从Cayman公司购置。Tris-HCl缓冲溶液(pH=7.4);HAc-NaAc缓冲液溶(pH=7.4);Ficoll70及Dextran70(100 g/L,购于上海生物工程公司);试剂均为国产分析纯;实验用水为超纯水。
V-560型 UV光谱仪(日本,Jasco),FP-6500型荧光/磷光光谱仪(日本,Jasco),电子顺磁共振波谱仪(德国,Bruker);F-12型制冷和加热循环器(德国,Julabo公司),pH 酸度计(上海雷磁分析仪器厂,PHSJ-4A)。
1.2 实验方法
Cytc样品的制备:三价高铁形式的细胞色素C制备:添加过氧化氢;二价还原形式细胞色素 C制备:添加连二亚硫酸钠,现用现配。实验中所用的Cytc浓度均为1 uM,H2O2以及Na2S2O4试剂浓度分别配制为10 mM、0.5M。
将高浓度的Cytc溶解在不同离子强度、pH、温度的磷酸盐缓冲液,及不同缓冲溶液和拥挤试剂中,蛋白的终浓度为1×10-5mol/L;分别将样品通入一定量的NO,通气速率为100个气泡/分,时间为2 min;取通NO后的Cytc样品用氙灯进行光照。
紫外光谱的测定:将已处理的Cytc样品至于1 cm方形比色杯中测定,测定条件为:狭缝宽度:2 nm,扫描范围:220~700 nm,扫描速率:400 nm/min,响应时间:中等。
时间过程光谱测定:将细胞色素 C(未处理的,Cytc(WT))、高铁形式细胞色素C(Cyt c-Fe(III))和还原态细胞色素C(Cyt c-Fe(II))三种样品分别置于10 mm光径的方形石英比色皿中测定,测定条件:波长设置为416 nm、562 nm,灵敏度调置为高,响应时间间隔:2 s,其他条件同紫外-可见吸收光谱测定。
电子顺磁共振谱测定:液氮条件下,进行样品检测,仪器测定条件为:功率9.33 GHz,6-G,10.2 mW,扫描速度:83.97 s,扫描范围:2900~3900 G,时间常量:40.96 ms,温度:100 K,最终结果为扫描次数20次的平均结果。
2 结果与讨论
2.1 不同价态的Cyt c与NO之间配位反应过程的紫外吸收光谱
Cytc与NO相互作用的紫外吸收光谱如图1所示,图1A为Fe(III)-Cytc与NO相互作用的UV-Vis吸收光谱,由图1A可知Fe(III)-CytcSoret带的409 nm处吸收峰红移且吸收强度增大,Q带530 nm处的吸收峰强度增大,同时在562 nm处出现新的吸收峰,Fe(III)-Cytc与NO配位结合生成Cytc-NO配合物。图1B为亚铁细胞色素C(Fe(II)-Cytc)与NO相互作用的UV-Vis吸收光谱,由图1B可知随着NO通入量的增加,其soret带的吸收峰由415 nm蓝移到409 nm,Q带520 nm与550 nm处吸收峰消失,在530 nm处出现新的单一小峰,随着NO的继续增加Soret带的吸收峰由409 nm红移到416 nm,同时Q带在562 nm处出现新的吸收峰,逐渐生成细胞色素C-NO配合物(Cytc-NO)。因此,不同价态的Cytc与NO反应的过程为:Fe(II)-Cytc先被氧化为高铁细胞色素C(Fe(III)-Cytc),后者与NO配位形成Cytc-NO配合物[19]。根据Gouterman 四轨道模型理论,Cytc分子的 Soret带是由其卟啉中的外层电子跃迁所产生的,其归属为π-π*跃迁的第二电子激发单重态。当NO与Fe(III)-Cytc分子进行配位反应时,由于NO分子具有较强的亲核性,其电荷通过 Fe3+转移到卟啉环上,从而使得卟啉环上电子云密度增大,导致π轨道能量增加,与π*间的能级差减小,即π→π*能级差降低,从而造成 Soret带的红移[20]。根据之前的研究结果,推断出其配位反应机制为:NO气体在溶液中以NO·形式存在,促使Cytc分子微环境发生改变,同时,NO进入到Heme腔中使其极性改变,使Met80与Heme之间作用力减弱,导致Met与Heme之间的配位键断裂,经过分子间重排,血红素中心Fe与NO之间形成新的Fe-N配位键,但新形成的配位键不稳定,会发生断裂,解离再次生成五配位的 Fe,与溶液中的H2O分子结合,最终达到一个平衡。
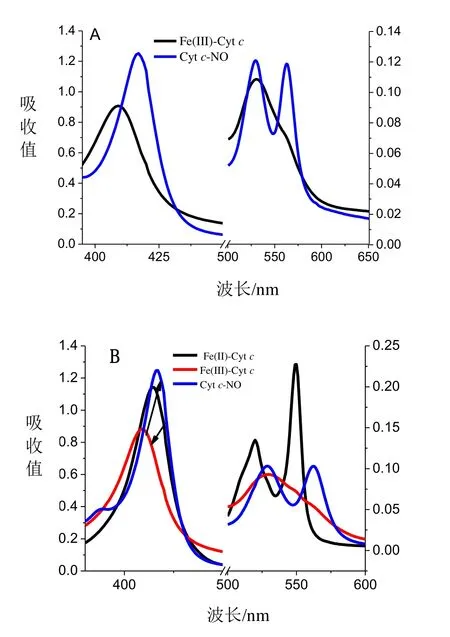
图1 Cyt c与NO相互作用的紫外吸收光谱
2.2 Cyt c与proliNONOate 相互作用的电子顺磁共振光谱
电子顺磁共振(electron paramagnetic resonance,EPR)是由不配对电子的磁矩发源的一种磁共振技术,可用于从定性和定量方面检测物质原子或分子中所含的不配对电子,并探索其周围环境的结构特性。研究生物组织中的顺磁金属离子,包括过渡族金属离子,对一些动物组织、植物材料和微生物都能见到铜(Ⅱ)、锰(Ⅱ)或铁的EPR信号。
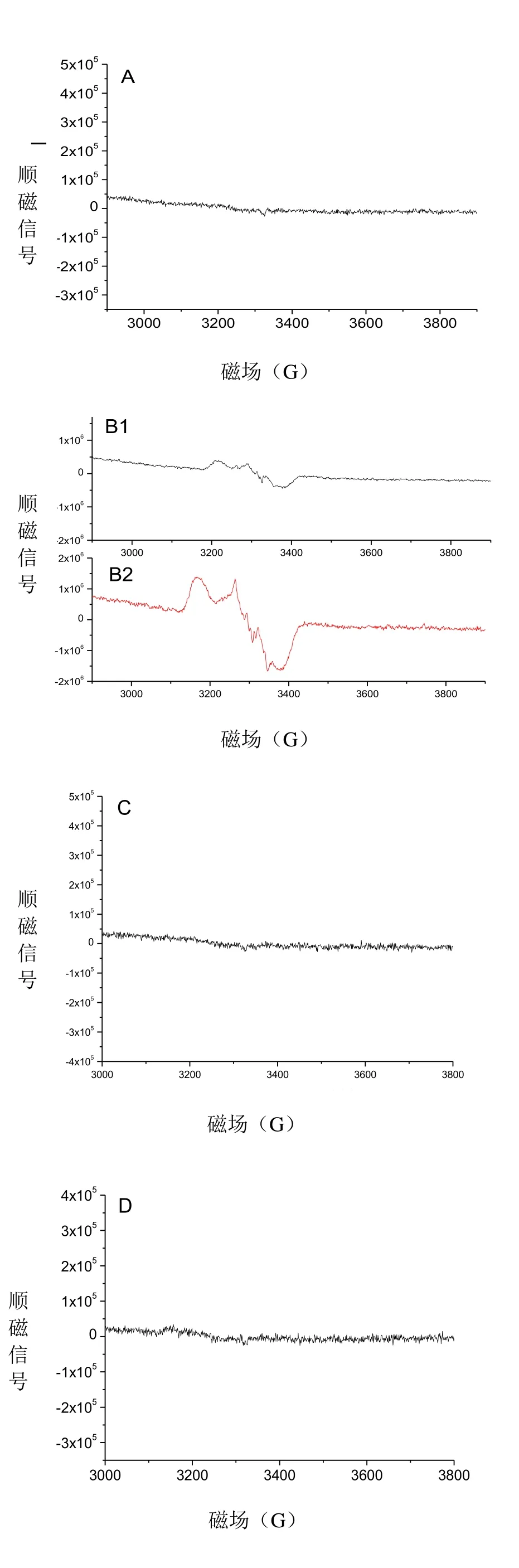
图2 细胞色素c与NO相互作用的电子顺磁光谱
图2A中显示单独存在的Cytc没有顺磁信号,但是在样品中添加了少量的proliNO/NO后,出现弱的顺磁信号,随着proliNO/NO添加量的增加,信号更加明显,见图 2B。但是生成的六配位的亚硝酰血红素铁不稳定,因此,随着时间的推移发生了解离,见图 2C,与 2.1的实验结果一致。图 2D显示,proliNO/NO直接加到缓冲液中也没有顺磁信号。
本文在此基础上研究不同环境因素对 Cytc与NO结合及解离的影响。由于Fe(II)-Cytc要先被氧化为Fe(III)-Cytc再与NO反应,因此实验过程中均以Fe(III)-Cytc进行后续实验。
2.3 不同外界条件对Cyt c与NO结合反应的影响
Cytc在生物体内与NO的结合受到环境中多种因素的影响,因此我们分别考察了氧气、离子强度、酸碱度、温度、不同缓冲体系、拥挤环境等因素对二者结合反应的影响。
2.3.1 O2对Cyt c与NO结合反应的影响
O2是需氧生物生存的必需条件,在呼吸链中必不可少,Cytc是呼吸链的主要成分之一,因此在研究Cytc与NO相互作用的过程中,O2是一个重要因素,可能会对其反应产生影响。图3A为通NO前,Cytc通入N230 min排除O2后与未排O2的UV-Vis吸收光谱,由图3A可知Cytc去O2前后光谱没有发生任何变化,说明O2对Cytc溶液本身没有影响。图3B为Cytc排O2前后与NO反应的UV-Vis吸收光谱,由图3B可知通入相同量的NO,排O2后Cytc与NO相互作用的UV-Vis吸收光谱的Soret带的特征峰在416 nm而含O2的Cytc在413 nm,Q带特征峰都在530 nm和562 nm,但前者吸收强度大于后者,说明生成的Cytc-NO更多,即O2对Cytc与NO之间的配位反应产生一定的阻力,但并不参与其反应。这与本实验室之前所做的metMb与NO反应时,少量的O2能够促进其反应的结果相反,其原因主要是两种蛋白的结构不同,metMb中血红素铁是五配位,而Cytc是六配位,同时在肌红蛋白的血红素中存在一个口袋结构而在细胞色素c中没有,因此在Cytc与NO反应的过程中O2无法进入到其内部,而是消耗一部分 NO,使其生成产物减少,反应速率减慢。实验中向Cytc中通入过量的O2,发现对其紫外吸收没有影响(结果与图3A相同,此处未列出)。
2.3.2 离子强度对Cyt c与NO结合的影响
在不同离子强度的缓冲溶液中,Cytc与NO反应时Soret带(416 nm)与Q带(562 nm)处峰面积变化如图4所示。由图4可知,随离子强度的增大反应速率逐渐降低,Soret带(416 nm)与Q带(562 nm)处的峰面积都逐渐减少,离子强度由 0.01 mol/L到 0.05 mol/L变化最明显,随离子强度的继续增加,变化逐渐减小,但仍有微弱的变化。在离子强度低的溶液中,Cytc易发生去折叠,形成伸展结构[21],所以NO进入到其Heme中受到的阻力小,但随离子强度的增大,Cyt c易发生折叠反应,血红素周围的结构更紧凑,NO进入CytcHeme中的阻力增大,以至Cytc与NO反应受阻,因此随着离子强度的增大,反应生成的Cytc-NO配合物逐渐减少。随缓冲溶液浓度的增强,其缓冲能力增大,但当溶液溶度过低时,缓冲溶液受外界离子的干扰过大,因此综合以上原因,实验过程选取0.05 mol/L的缓冲溶液。
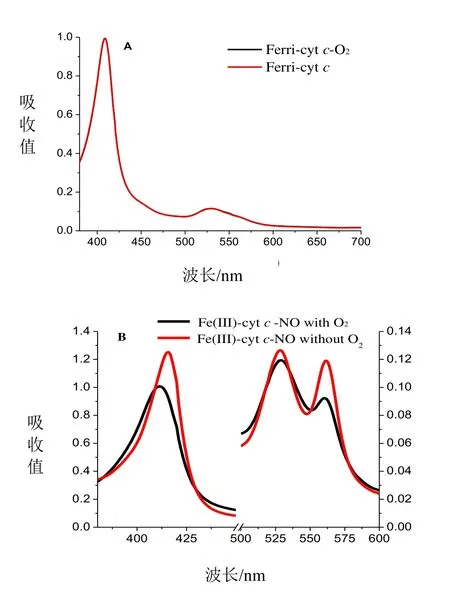
图3 O2对cyt c与NO相互作用的影响的紫外-可见吸收光谱
2.3.3 pH对Cyt c与NO结合的影响
图5为不同pH溶液中Cytc通NO前后Soret 带(416 nm)与Q带(562 nm)峰面积变化。由图5可知,在低于生理pH时,随pH的增大,Soret带(416 nm)与Q带(562 nm)峰面积通气前后变化逐渐减小,而当pH>8后,其变化基本不变。Cytc在低pH溶液中,其二级结构会发生变化,α-螺旋和β-转角会向β-折叠转变[22],溶液的pH越低对Cytc结构的影响越大,促使氧化态Cytc的生成,而氧化态的Cytc易与NO结合,因此其在Soret 带(416 nm)与Q带(562 nm)的吸收峰面积的变化越大,Cytc与NO结合的越多,随pH增大变化峰面积逐渐减小,结合速率减慢;但当pH由酸性变为碱性时,Cytc自身会向还原态转变,而还原态的Cytc不易与NO结合,因此Cytc与NO结合的反应速率下降。因为生理pH为7.4,所以实验过程中选取pH为7.4进行,所得的实验结果更具有参考价值。
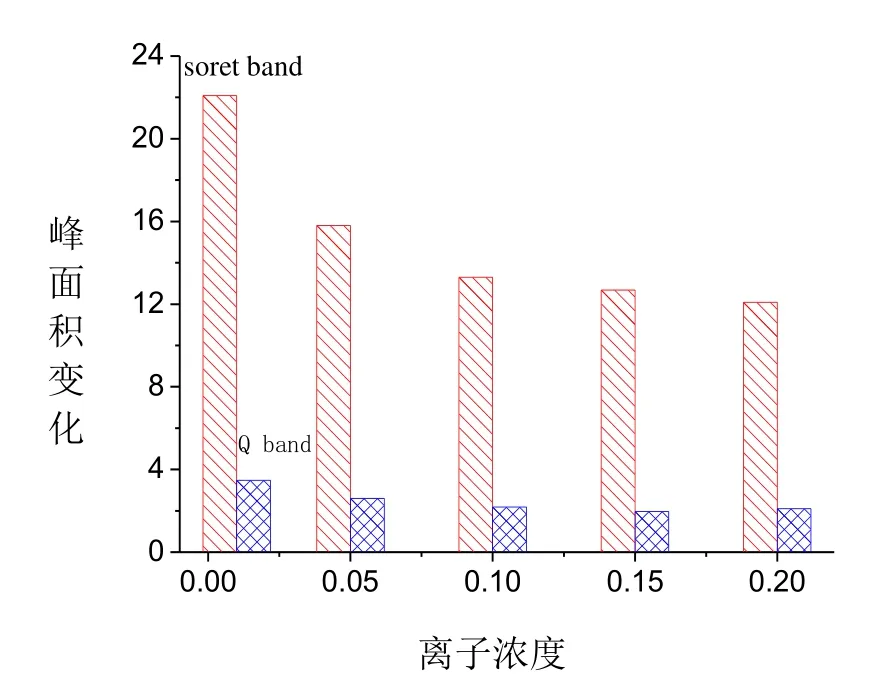
图4 不同离子强度中Cyt c与NO反应吸收峰面积变化
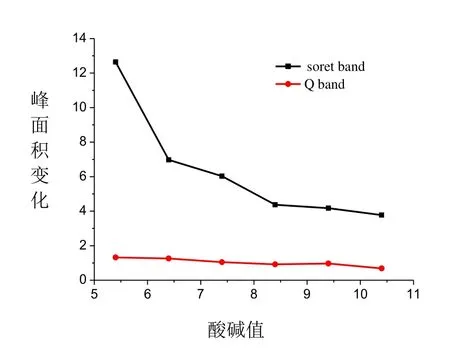
图5 不同 pH溶液中Cyt c通NO前后峰面积变化
2.3.4 温度对Cyt c与NO结合的影响
在不同的温度下,Cytc与NO的反应如图6所示。由图6可知随温度的升高,Soret带(416 nm)与Q带(530 nm和560 nm)的峰面积都是先上升后下降的趋势,Soret带在293 K时面积达到最大,Q带在283 K时峰面积最大,说明在283~293 K温度范围内为溶液反应的适合温度,反应完全。温度的改变引起Cytc蛋白构象的变化,而Cytc蛋白构象的变化会直接影响其血红素卟啉环与NO的结合速率,当温度较低时,Cytc自身结构稳定,处于低能状态,NO进入溶液后受到的阻力较大,不易与之结合,使得反应生成的配合物较少,但随着温度的升高,Cytc自身的能量升高,分子变得活泼,易与NO反应,生成的配合物增多,使其相应位置的吸收峰面积也增大,而当温度继续升高时,可能会破坏一部分Cytc的结构,使其构象发生改变,无法与NO反应,同时温度过高时NO在溶液中的溶解度降低,使得溶液中的NO量减少,因此Cytc与NO结合生成的配合物会迅速减少,吸收峰的面积也大量降低。因此Cytc与NO反应的温度应该控制在283~293 K之间,过高过低都会使得反应现象不明显。

图6 Cyt c与NO反应的峰面积随温度变化图
2.3.5 不同缓冲溶液对Cyt c与NO反应的影响
Cytc通NO前在不同缓冲溶液中的紫外吸收光谱如图7A所示,由于Cytc在酸性环境中以氧化态存在,在碱性环境中以还原态存在,因此实验中分别选取pH=7.4的酸性缓冲溶液(HAc-NaAc)、碱性缓冲溶液(Tris-Hcl)以及中性缓冲溶液(PB),由图7A可知在不同的缓冲溶液中,Cytc在soret带409 nm处的特征吸收峰的位置没有变化,只是其吸收峰的强度发生了微弱的变化;而 Q带变化明显,在 Tris-Hcl中Cytc部分被还原,HAc-NaAc中没有变化。不同缓冲溶液中Cytc中通入NO后,其soret带与Q带的峰面积变化如图7B所示,由图7B可知HAc-NaAc缓冲溶液的变化是最明显的,而Tris-Hcl 较PB缓冲溶液其面积变化减少,因为在HAc-NaAc溶液中有利于Fe(III)-Cytc的存在,而Fe(III)-Cytc易与NO结合,因此利于反应的进行,而碱性环境中Cytc主要以还原态存在,由于Fe(II)-Cytc在与NO结合的过程中要先生成Fe(III)-Cytc,因此在碱性缓冲溶液中,Cytc-NO配合物生成速率下降。为使实验条件更接近生理环境,因此实验中选取pH=7.4磷酸缓冲溶液更合适,得到的实验结果也更接近于生理条件。
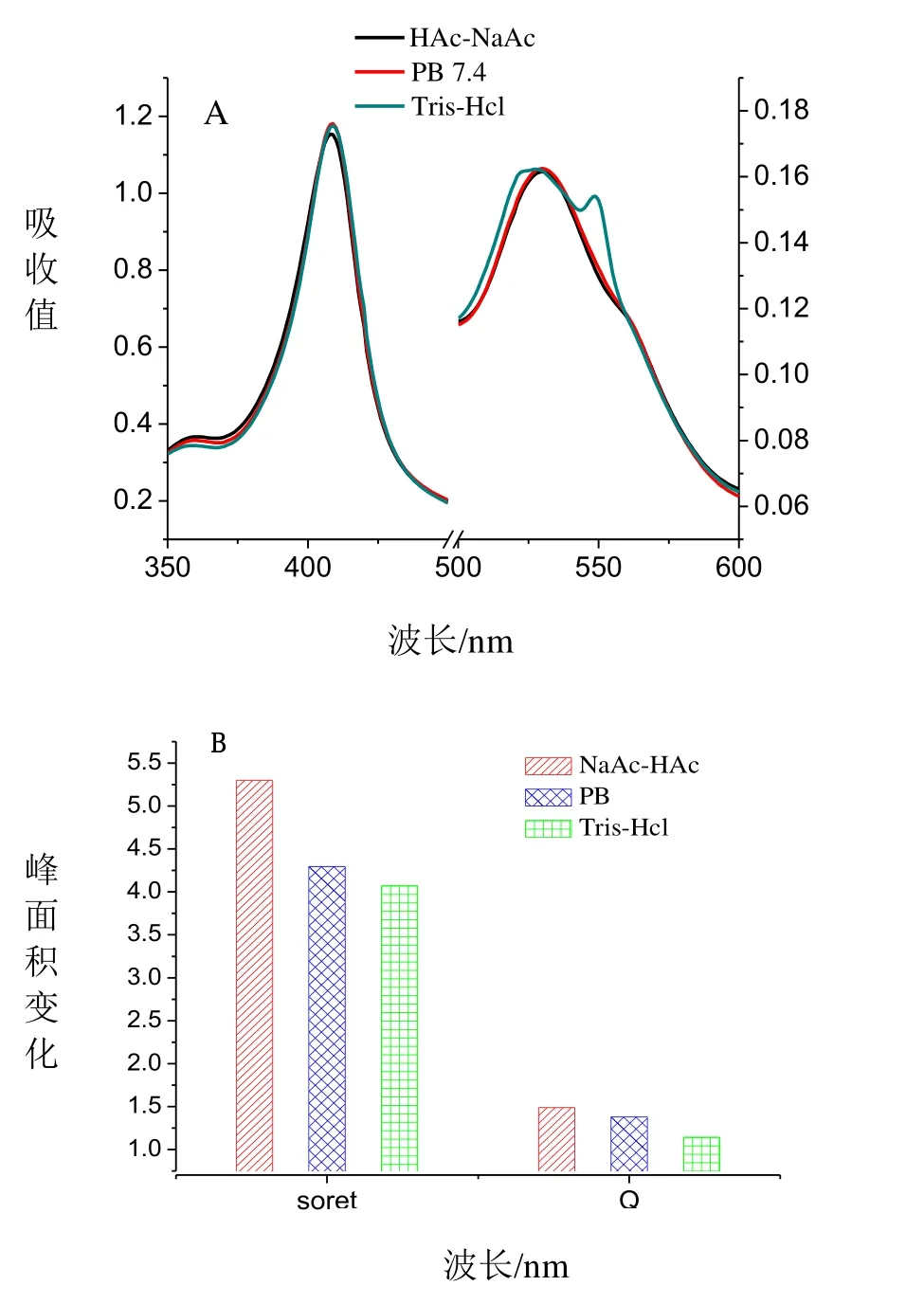
图7 不同缓冲液中Cyt c的紫外吸收光谱及其与NO相互作用后的峰面积的变化
2.3.6 拥挤试剂对Cyt c与NO结合的影响
通常所进行的蛋白质相关实验均以稀溶液作为缓冲体系完成的,但真实的细胞环境是非常复杂的,存在各种大分子,处在一个拥挤的环境中,Sasahara等[23]发现拥挤试剂可以促进折叠的蛋白质折叠为更为紧致的结构,此外McPhie等[24]也发现增加大分子拥挤试剂的浓度能促进折叠的脱辅基血红素蛋白向熔球态转变。本实验研究了不同拥挤环境中Cytc与NO相互作用,其soret带与Q带峰面积如图8所示,图8可知Dextran70与PB缓冲溶液中soret带与Q带的面积基本相同,而Ficoll 70其面积明显减少。Dextran 70是一种长度约为0.4 nm,无交联线性的,相对灵活的大分子聚合物,其在溶液中易形成准随机螺旋,排阻体积效应小[25],可以容纳更多的间隙空间,对Cytc的束缚能力较弱,而Ficoll 70是高度交联构成的刚性共聚体[26],造成溶液中可移动的空间减少,对Cytc的束缚能力较强,同时拥挤试剂形成的拥挤环境降低了NO的扩散系数,因此减弱了NO与Cytc的相互作用,且Ficoll 70对其影响较明显,说明其能够稳定了蛋白中血红素的结构,延迟了与溶液中NO分子的反应。

图8 不同的拥挤试剂中Cyt c与NO结合的峰面积变化
2.4 光照对亚硝酰细胞色素C解离的影响
光是生物有机体生活环境中必然存在的,而Cytc中含有一个血红素辅基结构,其能吸收特定波长的光,刘艳伟[27]等研究发现其在280 nm处的吸收最大,因此本文选取280 nm的波长进行光照,发现光照对Cytc-NO的解离具有促进作用。图9为Cytc-NO光照前后解离的面积变化图,其中曲线2为光照后的解离曲线。由图9可知光照与未光照Cytc-NO的解离都遵循方程(1)如下:

其中Y是面积,A是振幅,k是解离速率常数,y0是截距(表1),由表1可知,光照前后其反应速率k1/k2=0.5,光照后 Cytc-NO的解离速率是原来的 2倍,光照后血红素基团吸收能量,因此使得整个Cytc-NO分子的能量增高,血红素周围的电子分布发生改变,导致整个分子的稳定性降低,生成的Fe-N变弱,更易发生断裂,因此光照会促进Cytc-NO的解离。
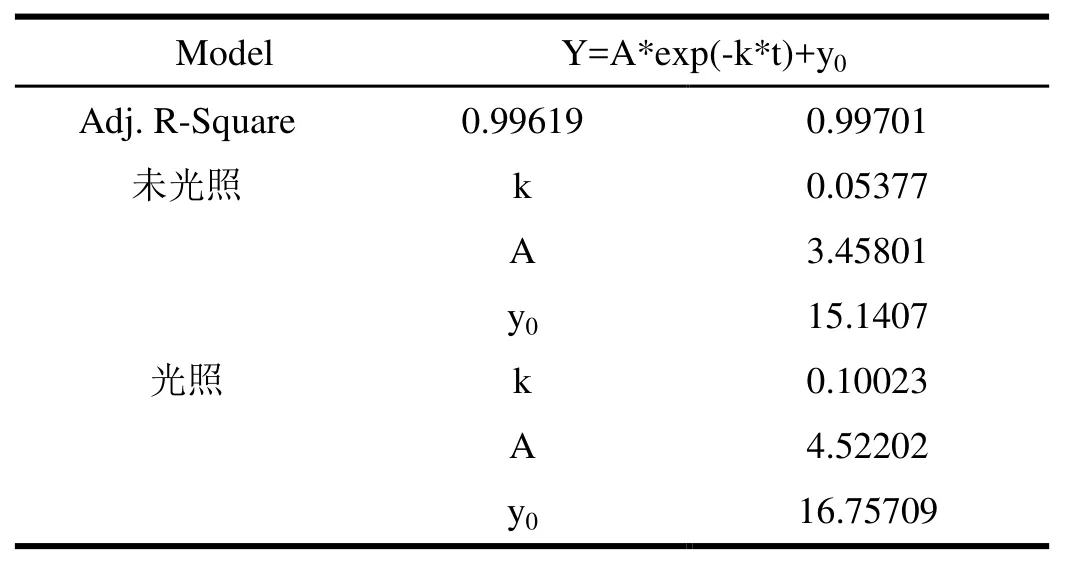
表1 Cyt c-NO光照和未光照下解离速率常数和相关参数值
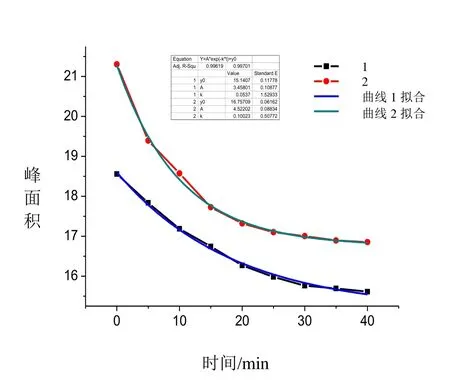
图9 光照前后Cyt c与NO反应配合物解离面积变化
3 结 论
本文采用光谱法证实了Cytc与NO能发生配位反应,并且研究了不同的外界条件,如离子强度、pH、温度、缓冲溶液、及拥挤试剂对Cytc与NO配位反应和光照对Cytc-NO解离反应的影响。实验结果发现,随离子强度的增大反应速率逐渐降低,酸性pH下有利于Cytc与NO配位,而碱性pH则会抑制其反应的进行,温度过高过低都不利于Cytc与NO配位反应的进行,控制温度在283~293 K之间,有利于反应的进行,酸性缓冲溶液较碱性缓冲溶液更有利于配位反应的进行,而拥挤试剂Ficoll 70对于稳定蛋白的结构效果更好,使Cytc不易与NO反应,光照会促进Cytc-NO的解离,因此控制温度在283~293 K之间,pH=7.4的0.05 mol/L的PB缓冲溶液的近生理条件是Cytc与NO配位结合反应的最佳条件。本研究对于进一步研究Cytc与NO配位反应动力学以及结合中间态的研究提供了最佳的反应条件。
[1]BURMESTER T, WEICH B, REINHARDT S, et al. A vertebrate globin expressed in the brain[J]. Nature, 2000,407(6803): 520-523.
[2]唐乾, 张越, 曹洪玉, 等. 光谱法研究高铁肌红蛋白活性中心与一氧化氮的配位反应[J]. 光谱学与光谱分析, 2015,5(7): 1967-1972.
[3]Ma J Y, ZHENG X fF, TANG Q, et al. Investigation on the photo-induced de-oxygenation process of myoglobin in aqueous solution by use of fluorescence spectroscopy[J].Science in China B, 2008, 51(5): 141-419.
[4]赵慧卿, 汪显阳. 一氧化氮、一氧化碳与血红素的配位化学及其生理作用[J]. 化学教育, 2004(03): 4-6.
[5]李涛, 吕荣, 于安池. 时间分辨拉曼光谱研究一氧化氮与肌红蛋白的结合过程[J]. 物理化学学报, 2010, 26(01): 18-22.
[6]渠敏, 李家璜, 张淑仪, 等. 时间分辨光声量热法研究碳氧血红蛋白的光解反应[J]. 声学学报: 中文版, 2008, 33(05): 425-429.
[7]NIENHAUS K, PALLADINO P, NIENHAUS G U. Structural Dynamics of Myoglobin: FTIR-TDS Study of NO Migration and Binding [J]. Biochemistry, 2007, 47(3): 935- 948.
[8]IONASCU D, GRUIA F, YE X, et al. Temperature-Dependent Studies of NO Recombination to Heme and Heme Proteins[J].Journal of the American Chemical Society, 2005, 127(48):16921-16934.
[9]LARSON S K, DWYER D S, LO H H, et al. Mitochondrial cytochrome c reacts with nitric oxide via S-nitrosation[J].Biochemical and Biophysical Research Communications,2006, 342(3): 991-995.
[10]CASSINA A M, HODARA R, SOUZA J M, et al.Cytochrome c nitration by peroxynitrite[J]. The Journal of Biological Chemistry, 2000, 275(28): 21409-21415.
[11]SIMONE M J, KREISHMAN G P. Determination of the formal reduction potential, the electron stoichiometry, and the magnitude of the conformational change upon reduction for cytochrome c from potential-dependent fluorescence spectra[J]. Analytical Biochemistry, 1983, 132(1): 142-146.
[12]杨昌英, 李敏, 付静,等. 脂质体对细胞色素 C 结构的稳定作用[J]. 分析科学学报, 2010, 26(02): 153-156.
[13]Bruhwyler J, Chleide E, Liegeois J F, et al. Nitric oxide: a new messenger in the brain[J]. Neurosci Biobehav Rev, 1993,17(4): 373-384.
[14]AJJURI R R, O'Donnell J M. Novel whole-tissue quantitative assay of nitric oxide levels in Drosophila neuroinflammatory response [J]. J. Vis. Exp., 2013, (82):50892.
[15]RATHNASIRI BANDARA S M. Migraine and psychiatric disorders comorbidity explained by sinus hypoxic nitric oxide theory ---a new hypothesis on the Sino rhinogenic theory [J].Medical Hypotheses, 2014, 82(3): 257-265.
[16]INAMDAR A A, BENNETT J W. A common fungal volatile organic compound induces a nitric oxide mediated inflammatory response in Drosophila melanogaster[J]. Scientific Reports, 2014(4): 3833.
[17]ORII Y, SHIMADA H. Reaction of Cytochrome c with Nitrite and Nitric Oxide: A Model of Dissimilatory Nitrite Reductase. Journal of Biochemistry, 1978, 84(6): 1543-1552.
[18]SHARPE M A, COOPER C E. Reactions of nitric oxide with mitochondrial cytochrome c: a novel mechanism for the formation of nitroxyl anion and peroxynitrite. Biochem. J.,1998, 332(1): 9-19.
[19]唐乾, 史珊珊, 曹洪玉, 等. 细胞色素c与NO反应机制[J].无机化学学报, 2015, 31(8): 1511-1519.
[20]王树军.光谱法研究硝基苯基卟啉锌与咪唑类的轴向配位反应[J].应用化学, 2010, 27(06): 721-726.
[21]GOTO Y, HAGIHARA Y, HAMADA D, et al. Acid-induced unfolding and refolding transitions of cytochrome c: A three-state mechanism in water and deuterium oxide[J].Biochemistry, 1993, 32(44): 11878-11885.
[22]BALAKRISHNAN G, HU Y, OYERINDE O F, et al. A conformational switch to beta-sheet structure in cytochrome c leads to heme exposure. Implications for cardiolipin peroxidation and apoptosis[J]. Journal of the American Chemical Society, 2007, 129(3): 504-505.
[23]SASAHARA K, MCPHI P, MINTON A P. Effect of Dextran on Protein Stability and Conformation Attributed to Macromolecular Crowding[J]. Journal of molecular biology,2003, 326(4): 1227-1237.
[24]MCPHIE P, NI Y S, MINTON A P. Macromolecular Crowding Stabilizes the Molten Globule Form of Apomyoglobin with Respect to Both Cold and Heat Unfolding[J]. Journal of molecular biology, 2006, 361(1):7-10.
[25]MUKHERJEE S, WAEGELE M M, CHOWDHURY P, et al.Effect of macromolecular crowding on protein folding dynamics at the secondary structure level[J]. J Mol Biol, 2009,393(1): 227-236.
[26]VENTUROLI D, RIPPE B. Ficoll and dextran vs. globular proteins as probes for testing glomerular permselectivity:effects of molecular size, shape, charge, and deformability y[J]. American Journal of Physiology - Renal Physiology, 2005,288(4): 605-613.
[27]刘艳伟, 曹洪玉, 唐乾, 等. 大分子拥挤条件下光诱导细胞色素C还原的光谱研究[J]. 化学学报, 2014,72: 246-252.

