利用重叠延伸PCR和同源重组克隆技术制备HLA- A*0201/HBc18-27单链三分子复合体
许涛,李晓娥,吴优,Khawar Ali Shahzad,王伟,张雷,沈传来
(东南大学医学院 病原生物学与免疫学系,江苏 南京 210009)
·论 著·
利用重叠延伸PCR和同源重组克隆技术制备HLA- A*0201/HBc18-27单链三分子复合体
许涛,李晓娥,吴优,Khawar Ali Shahzad,王伟,张雷,沈传来
(东南大学医学院 病原生物学与免疫学系,江苏 南京 210009)
目的:构建和表达HLA- A*0201/HBc18- 27单链三分子复合体。方法:利用重叠延伸PCR将HBc18- 27、(Gly4Ser)3、β2m、(Gly4Ser)4和HLA- A*0201胞外区依次串联为单链三聚体(single- chain trimer,SCT)融合基因,通过同源重组克隆技术插入到pET28a原核表达载体,用异丙基β- D- 硫代吡喃半乳糖苷(IPTG)在大肠杆菌BL21(DE3)中诱导表达,采用金属螯合亲和层析法纯化目的蛋白,通过稀释复性法折叠成HLA- A*0201/HBc18- 27的复合单体,并生物素化,将单体包被到直径4.5μm的磁性微球,用构象特异性单抗(W6/32)进行荧光染色,流式细胞术分析其空间构象。结果:pET28a- HLA- A*0201/HBc18- 27基因序列和蛋白大小与预测一致;纯化后融合蛋白纯度约93%;流式细胞术分析显示pET28a- HLA- A*0201/HBc18- 27单体具有正确的空间构象。结论:利用重叠延伸PCR和同源重组克隆技术成功制备了HLA- A*0201/HBc18- 27的单链复合体,无需限制性内切酶和连接酶,发展了主要组织相容性单链复合体技术,有效简化了pMHC Ⅰ类分子的制备过程。
重叠延伸聚合酶链式反应; 同源重组;主要组织相容性复合体
MHC Ⅰ- 肽(major histocompatibility complex class I/peptide,pMHC)四聚体技术是目前检测抗原特异性T细胞的金标准,最具准确性和特异性[1]。传统pMHC制备方法步骤繁琐、耗时长、复性产量低、需要合成抗原肽等,阻碍了四聚体技术的推广和应用[2]。2002年Yu等[3]将抗原肽、β2m和MHC Ⅰ类分子以2个柔性接头依次串联融合成一条肽链,称之为单链三聚体(single- chain trimer,SCT)。该技术省去了重链和β2m蛋白体外折叠、合成抗原肽等步骤,简化了制备流程,是对pMHC制备技术的重要改进。但SCT基因的克隆需要将5条不同基因片段连接在一起,其中的抗原肽和MHC I类分子的α链种类繁多,需要不同的限制性内切酶和连接酶,因此限制了很多特定pMHC融合基因的克隆表达。重叠延伸PCR(overlap extension PCR)可以将两条或者多条不同基因片段重叠拼接在一起,形成一条基因片段,不需限制性内切酶和连接酶等处理[4]。同源重组克隆技术是一种简单、快速、高效的DNA定向克隆技术,可将插入片段PCR产物通过同源重组的原理定向克隆至任意载体的任意位点,无需考虑插入片段自身携带的酶切位点,不依赖于连接酶及磷酸酶,克隆阳性率可达95%以上[5]。本研究首次将该两项技术联合应用于pMHC单链三聚体的构建,有效发展了pMHC SCT技术。
乙肝病毒核心蛋白第18- 27位氨基酸残基FLPSDFFPSV(HBc18- 27)是HLA- A*0201限制性的抗原表位肽,与HLA- A*0201具有高亲和力[6]。本研究利用重叠延伸PCR将HBc18- 27、(Gly4Ser)3、β2m、(Gly4Ser)4和HLA- A*0201(α1/α2/α3)依次串联为HLA- A*0201/HBc18- 27SCT基因,通过同源重组克隆技术插入pET28a原核表达载体,然后在BL21(DE3)中诱导表达、镍柱纯化、稀释复性和生物素化等,成功制备HLA- A*0201/HBc18- 27复合单体,经构象特异性单抗的荧光染色验证具有正确的空间构象。
1 材料与方法
1.1 材料
大肠杆菌BL21(DE3)、DH5α,载体pET- 28a、pET28- β2m和pET28- HLA- A*0201为本单位实验室保存。高保真DNA聚合酶、ClonExpress一步法克隆试剂盒均购自南京诺唯赞生物科技有限公司;Ni- Agarose His标签蛋白纯化试剂盒购自北京康为世纪生物科技有限公司;BirA酶购自美国Avidity公司;链酶亲和素购自上海生工生物工程有限公司;4.5μm磁性微球购自Invitrogen公司;PE- Anti- Human HLA- ABC(W6/32)单克隆抗体购自eBioscience公司;其他常规试剂均为国产分析纯试剂。
1.2 引物设计与合成
根据重叠延伸PCR技术和ClonExpressTM同源重组克隆技术的原理,参照文献[3,7]设计HLA- A*0201/HBc18- 27SCT重组质粒构建中所需要的PCR引物,如表1所示。所有引物均由上海桑尼生物科技公司合成。
1.3 HLA- A*0201/HBc18- 27SCT融合基因的构建
如图1所示,首先以pET28- β2m为模板,先后用引物对HF1/HR1和HF2/HR1进行2轮PCR扩增,获得HBc18- 27- (Gly4Ser)3- β2m融合基因;然后以pET28- HLA- A*0201为模板,先后用引物对HF3/HR2和HF4/HR2进行2轮PCR扩增,获得β2m94- 99- (Gly4Ser)4- HLA- A*0201(α1/α2/α3)- AviTag;最后用引物对HF2/HR2进行重叠延伸PCR扩增,以上述PCR产物为模板,将上述两个融合基因片段通过β2m的重叠序列连接起来,获得HBc18- 27- (Gly4Ser)3- β2m- (Gly4Ser)4- HLA- A*0201(α1/α2/α3)- AviTag融合基因。
表1 构建HLA- A*0201/HBc18- 27SCT重组质粒所用的PCR引物
Tab 1 Primers used in construction of HLA- A*0201/HBc18- 27SCT
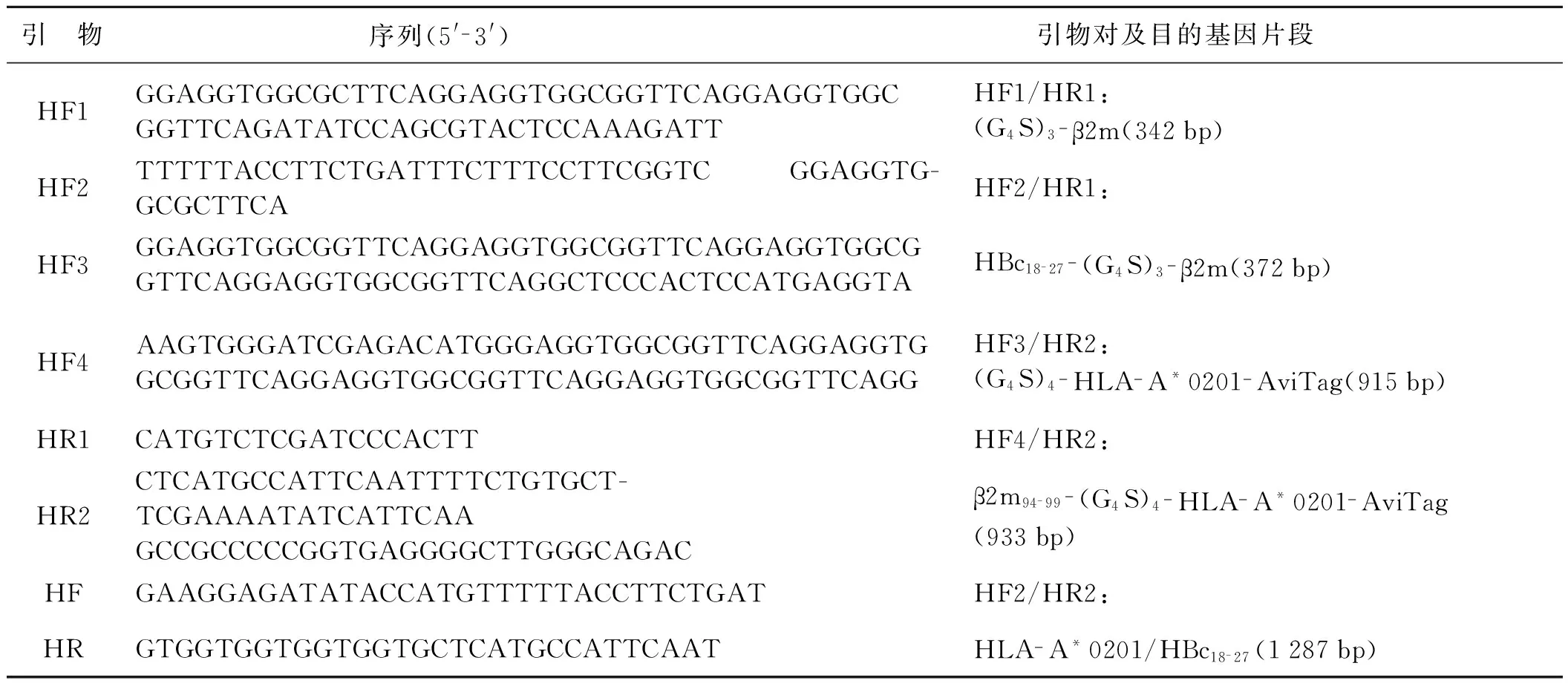
引 物序列(5'-3') 引物对及目的基因片段 HF1GGAGGTGGCGCTTCAGGAGGTGGCGGTTCAGGAGGTGGCGGTTCAGATATCCAGCGTACTCCAAAGATTHF1/HR1:(G4S)3-β2m(342bp)HF2TTTTTACCTTCTGATTTCTTTCCTTCGGTCGGAGGTG-GCGCTTCAHF2/HR1:HF3GGAGGTGGCGGTTCAGGAGGTGGCGGTTCAGGAGGTGGCGGTTCAGGAGGTGGCGGTTCAGGCTCCCACTCCATGAGGTAHBc18-27-(G4S)3-β2m(372bp)HF4AAGTGGGATCGAGACATGGGAGGTGGCGGTTCAGGAGGTGGCGGTTCAGGAGGTGGCGGTTCAGGAGGTGGCGGTTCAGGHF3/HR2:(G4S)4-HLA-A*0201-AviTag(915bp)HR1CATGTCTCGATCCCACTTHF4/HR2:HR2CTCATGCCATTCAATTTTCTGTGCT-TCGAAAATATCATTCAAGCCGCCCCCGGTGAGGGGCTTGGGCAGACβ2m94-99-(G4S)4-HLA-A*0201-AviTag(933bp)HFGAAGGAGATATACCATGTTTTTACCTTCTGATHF2/HR2:HRGTGGTGGTGGTGGTGCTCATGCCATTCAATHLA-A*0201/HBc18-27(1287bp)
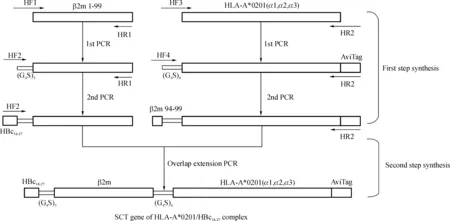
图1 重叠延伸PCR技术构建HLA- A*0201/HBc18- 27SCT融合基因
Fig 1 Schematic representation of overlap- extension PCR for the splicing of HLA- A*0201/HBc18- 27single- chain fusion gene
1.4 pET28a- HLA- A*0201/HBc18- 27表达载体的构建
如图2所示,利用同源重组技术将HLA- A*0201/HBc18- 27基因插入pET28a载体,同源重组酶复合物由RecE/Redα、RecT/Redβ和Recγ蛋白组成。首先,RecE/Redα结合到双链DNA片段,从5′- 3′端降解DNA,产生3′突出端;然后,RecT/Redβ蛋白结合到单链DNA上,介导互补单链DNA退火;Redγ蛋白可与细菌RecBCD酶结合,抑制其降解外源线性DNA的活性[8]。
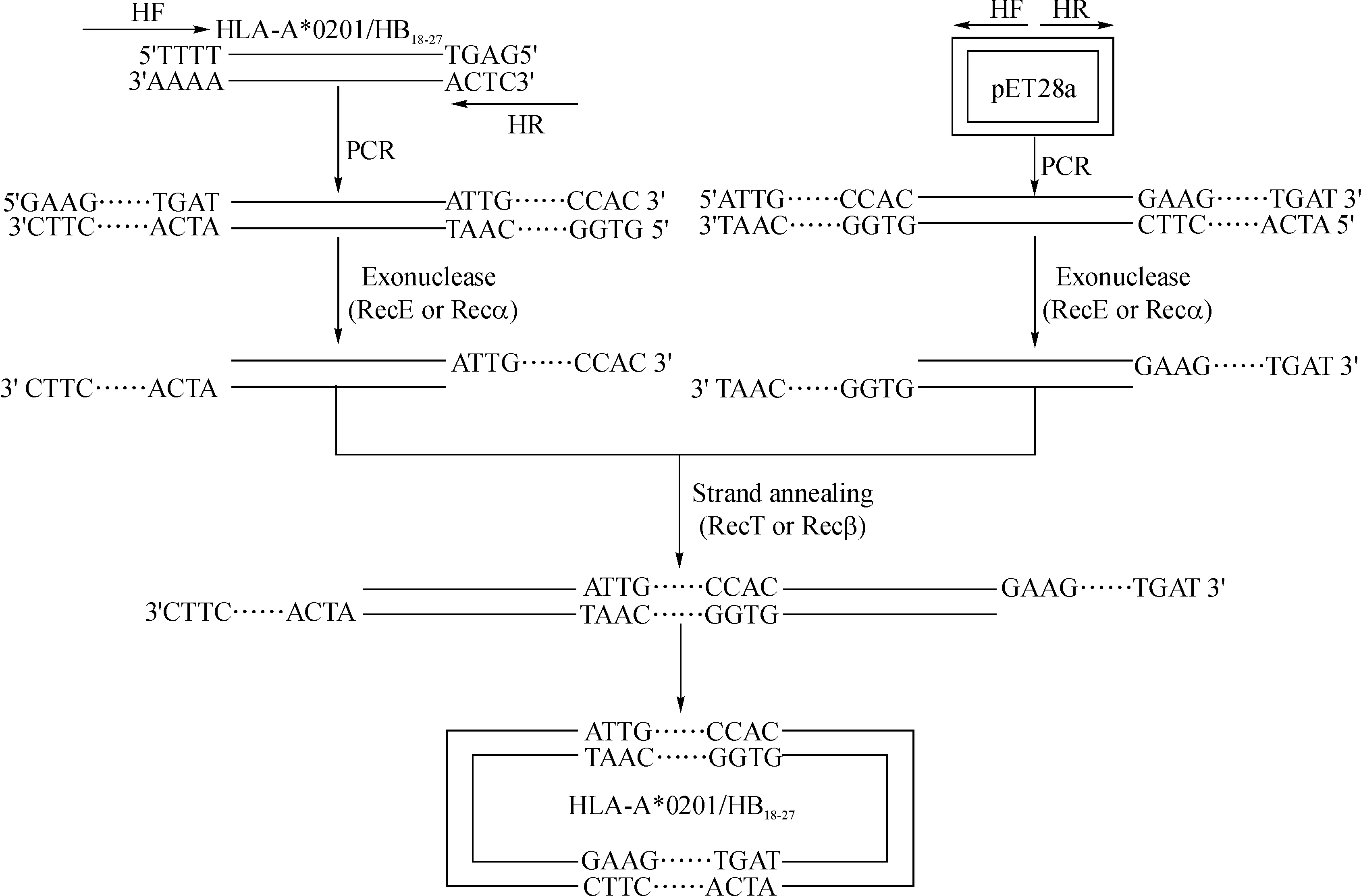
图2 同源重组克隆技术构建pET28a- HLA- A*0201/HBc18- 27表达载体
Fig 2 Schematic representation of homologous recombination cloning technique for the construction of recombinant plasmid pET28a- HLA- A*0201/HBc18- 27
分别以HLA- A*0201/HBc18- 27基因和pET28a载体为模板,以引物对HF/HR进行PCR扩增,获得线性化HLA- A*0201/HBc18- 27基因和pET28a。其中引物HF包括17nts pET28a载体5′端碱基序列和15nts HLA- A*0201/HBc18- 27基因5′端碱基序列,引物HR包括15nts pET28a载体3′端碱基序列和15nts HLA- A*0201/HBc18- 27基因3′端碱基序列。体外重组反应体系50 μl,HLA- A*0201/HBc18- 27基因60 μg,线性化pET28a 100 μg,5×CE II buffer 4 μl,ExnaseTMII 2 μl。于37℃反应30 min,立即将反应管置于冰水浴中冷却5 min。将反应产物转化至DH5α感受态中,重组载体羧基端编码生物素化蛋白和组氨酸His6标签蛋白。挑取单菌落进行菌落PCR扩增,将阳性菌株送至上海桑尼生物科技有限公司测序,选择测序正确的阳性菌株提取重组质粒。
1.5 HLA- A*0201/HBc18- 27单链重组蛋白的表达与纯化
将重组pET28a- HLA- A*0201/HBc18- 27质粒转化至BL21(DE3)感受态中,接种于含50μg·ml-1氨苄青霉素LB培养基,37℃培养过夜,再以1∶100接种于500 ml含50μg·ml-1氨苄青霉素LB培养基,培养至OD600为0.4~0.6时加入IPTG(0.1 mmol·L-1),37℃ 诱导6 h,于4℃ 6000 r·min-1离心20 min,收集菌体,用细菌裂解液(20 mmol·L-1Tris- HCl,5 mmol·L-1EDTA,1 mmol·L-1PMSF,1 mg·L-1Lysozyme,20 mg·L-1DNAase I,10 mmol·L-1MgCl2,pH 8.0)重悬菌体,冰浴超声波破碎,再于4℃ 6000 r·min-1离心20 min,分别收集上清和沉淀,将沉淀溶于包涵体溶解液(20 mmol·L-1Tris- HCl,500 mmol·L-1NaCl,8 M urea,pH 7.9)。取5 ml Ni- Agarose His胶与10 ml包涵体溶液,加入层析柱中,轻轻混匀,用15倍柱体积的包涵体溶解液冲洗柱子,洗去未结合杂蛋白,然后分别用含25、50、250、500 mmol·L-1咪唑的包涵体溶解液洗脱,分段收集洗脱液,用12% SDS- PAGE分析洗脱产物,BCA蛋白定量,-80℃保存。
1.6 HLA- A*0201/HBc18- 27复合物单体的复性折叠
参考King等[9]文献的稀释复性法,在400 ml折叠缓冲液(100 mmol·L-1Tris- HCl,400 mmol·L-1L- arginine,2 mmol·L-1EDTA,5 mmol·L-1Reduced glutathione,0.5 mmol·L-1Oxidised glutathione,0.1 mmol·L-1PMSF,1μg·ml-1Pepstatin,1μg·ml-1Leupeptin,pH 8.0)中,将20 mg HLA- A*0201/HBc18- 27包涵体蛋白分5次(每次4 mg)缓慢注射加入,每次间隔8~12 h,置4℃缓慢搅拌,48~72 h后超滤浓缩、透析,参照BirA酶使用说明书对折叠后的HLA- A*0201/HBc18- 27复合体进行生物素化,超滤去除游离生物素,用BCA法蛋白定量,分装后于-80℃保存。
1.7 HLA- A*0201/HBc18- 27复合物单体构象的鉴定
取直径4.5 μm磁性微球2×105管-1,PBS洗涤3次, 加入2.5 μg链酶亲和素,4℃过夜孵育;30% BSA- PBS室温封闭磁珠4 h,在磁场下用PBS洗涤3次; 加入10 μg生物素化HLA- A*0201/HBc18- 27复合单体,4℃孵育过夜,在磁场下用PBS洗涤3次,以BSA封闭组为空白对照,微球加链霉亲和素但不加HLA- A*0201/HBc18- 27复合体为阴性对照组;加入5 μl PE- Anti- Human HLA- ABC(W6/32)单克隆抗体,4℃避光孵育1 h,在磁场下用PBS洗涤3次,流式细胞仪检测微球表面的荧光强度。
2 结 果
2.1 HLA- A*0201/HBc18- 27SCT融合基因的扩增与重组质粒的构建
图3A结果显示,以pET28- β2m为模板,先后用引物对HF1/HR1和HF2/HR1进行两轮PCR扩增的产物分别为342bp(Lane 1)和372bp(Lane 2);以pET28- HLA- A*0201为模板,用HF3/HR2和HF4/HR2引物对扩增的产物分别为915bp(Lane 3)和933bp(Lane 4);以HBc18- 27- (G4S)3- β2m和β2m94- 99- (G4S)4- HLA- A*0201- AviTag为模板,用引物HF2/HR3进行重叠延伸PCR扩增的产物大小1287bp(Lane 5),上述扩增产物大小与预测一致。菌落PCR扩增结果(图3B)显示,在1500bp左右附近有目的片段的出现,与预测结果一致;重组质粒经上海桑尼生物科技有限公司测序分析,目标重组基因序列准确无误。
2.2 HLA- A*0201/HBc18- 27单链重组蛋白的表达与纯化
将重组质粒HLA- A*0201/HBc18- 27转化至BL21(DE3)中,经IPTG诱导表达、超声波破碎、离心后分别取上清和沉淀进行12% SDS- PAGE分析,结果见图4。在大约48 kD处出现与目的蛋白大小一致的蛋白条带,且大部分在沉淀中,表明表达产物主要以包涵体的形式存在。图5显示了包涵体蛋白经镍离子层析柱纯化的结果:流穿液中目的蛋白很少(泳道 2),表明目的蛋白已结合到镍柱上;含0、25、50 mmol·L-1咪唑洗涤缓冲液洗脱的主要为非目的蛋白(泳道 3~5);经250和500 mmol·L-1咪唑的洗涤缓冲液洗脱的为目的蛋白(泳道 6~9),且条带单一,浓度较高,电泳光密度扫描结果显示蛋白纯度为93%,满足后续实验要求。
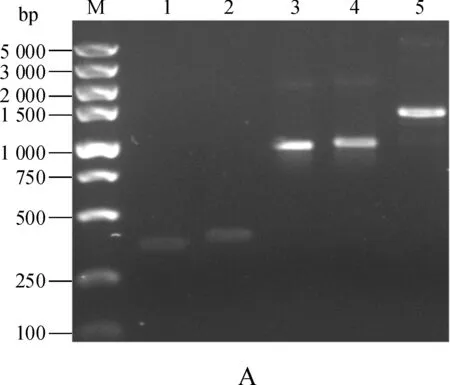
M. DNA Marker;1. (G4S)3- β2m(342bp);2. HBc18- 27- (G4S)3- β2m(372bp);3. (G4S)4- HLA- A*0201- AviTag(915bp);4. β2m94- 99- (G4S)4- HLA- A*0201- AviTag(933bp);5. HLA- A*0201/HBc18- 27(1 287bp)
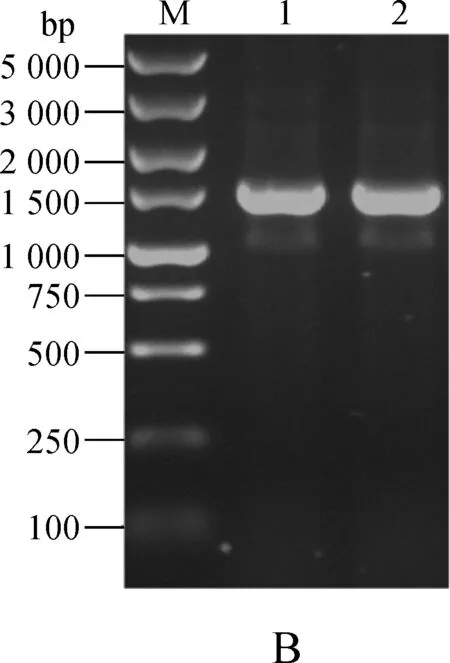
M. DNA Marker;1. 1号克隆;2. 2号克隆
A.HLA- A*0201/HBc18- 27重叠延伸PCR产物;B.菌落PCR产物
图3 HLA- A*0201/HBc18- 27重叠延伸PCR和菌落PCR产物
Fig 3 Electrophoresis analyses of overlap- extension PCR and colony PCR products

M. 蛋白分子量标准;1. 细菌总蛋白;2. 细菌培养上清;3. 细菌沉淀
图4 HLA- A*0201/HBc18- 27融合蛋白在BL21(DE3)中的表达
Fig 4 HLA- A*0201/HBc18- 27single- chain protein was expressed in E.coli BL21(DE3)
2.3 HLA- A*0201/HBc18- 27复合体构象鉴定
本实验中所用磁性微球表面布满环氧化基团,可以迅速将蛋白共价偶联到微球表面。先将链霉亲和素包被到磁性微球表面,BSA封闭多余的蛋白结合位点后再将生物素化的HLA- A*0201/HBc18- 27单体与微球孵育。在微球表面,一个链霉亲和素分子可能结合1- 4个生物素化的HLA- A*0201/HBc18- 27单体。W6/32是一种特异性针对HLA Ⅰ类分子重链与β2m非共价结合的复合体构象的单克隆抗体,不与单独的轻链或重链结合[9]。磁性微球大小为4.5 μm,与细胞大小相当,可以通过流式细胞仪检测W6/32荧光单抗与磁珠表面HLA- A*0201/HBc18- 27复合体的结合强度,以验证其是否折叠成正确的MHC I类分子空间构象。
结果如图6所示,HLA- A*0201/HBc18- 27复合体与包被链霉亲和素的磁性微球结合后能展示其正确的空间构象,从而与能荧光标记的MHC I类分子构象特异性抗体W6/32有效结合,染色阳性率为96.97%,平均荧光强度为26.69,而空白对照微球(0.20%)及阴性对照微球(0.15%)的平均荧光强度为6.47和6.39,差异明显。
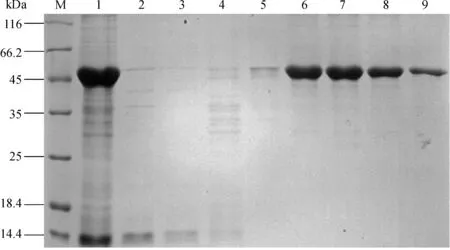
M. 蛋白标准分子量;1. 纯化前;2. 流穿液;3~9. 0、25、50、250、250、250、500 mmol·L-1洗脱液
图5 镍柱纯化HLA- A*0201/HBc18- 27包涵体蛋白
Fig 5 Inclusion body was purified by passing through the Ni+- chelating affinity column of Ni+- NTA agarose resin
3 讨 论
SCT复合物的3个组分是通过共价键连在一起,即使抗原肽从MHCⅠ类分子的抗原结合槽中脱落,仍可重新折叠形成正确的构象。因此,SCT中共价结合的抗原肽与MHCⅠ类分子的亲和力比传统四聚体技术中的抗原肽强数倍[3]。但是,传统构建SCT表达载体的方法,需要先分别扩增获得抗原肽、β2m轻链和重链的基因,然后再进行酶切、连接、酶切、连接等步骤,最后通过特定的酶切位点重组克隆到拥有相应酶切位点的质粒载体中[7]。其中的抗原肽和MHC Ⅰ类分子的α链种类繁多,需要不同的限制性内切酶,因此限制了很多特定pMHC融合基因的克隆表达[10]。以常用的高效原核表达载体pET28a为例,该载体转录起始密码子ATG位于限制性内切酶NcoⅠ(CCATGG)内,因此,插入目的基因的起始核苷酸位点必须为G,而起始核苷酸位点为A、T和C的目的基因则不能正确插入pET28a载体中,需要更换限制性内切酶或表达载体[11]。近年来,一种基于λ噬菌体Red操纵子的同源重组克隆技术广泛应用于DNA定向克隆[8]。该技术可将目的基因片段定向克隆至任意载体的任意位点,不需要特定限制性内切酶和连接酶,有效地避免了在克隆过程中遇到的合适内切酶的选择、磷酸化、补平、加A以及使用中间载体等的一系列复杂步骤。
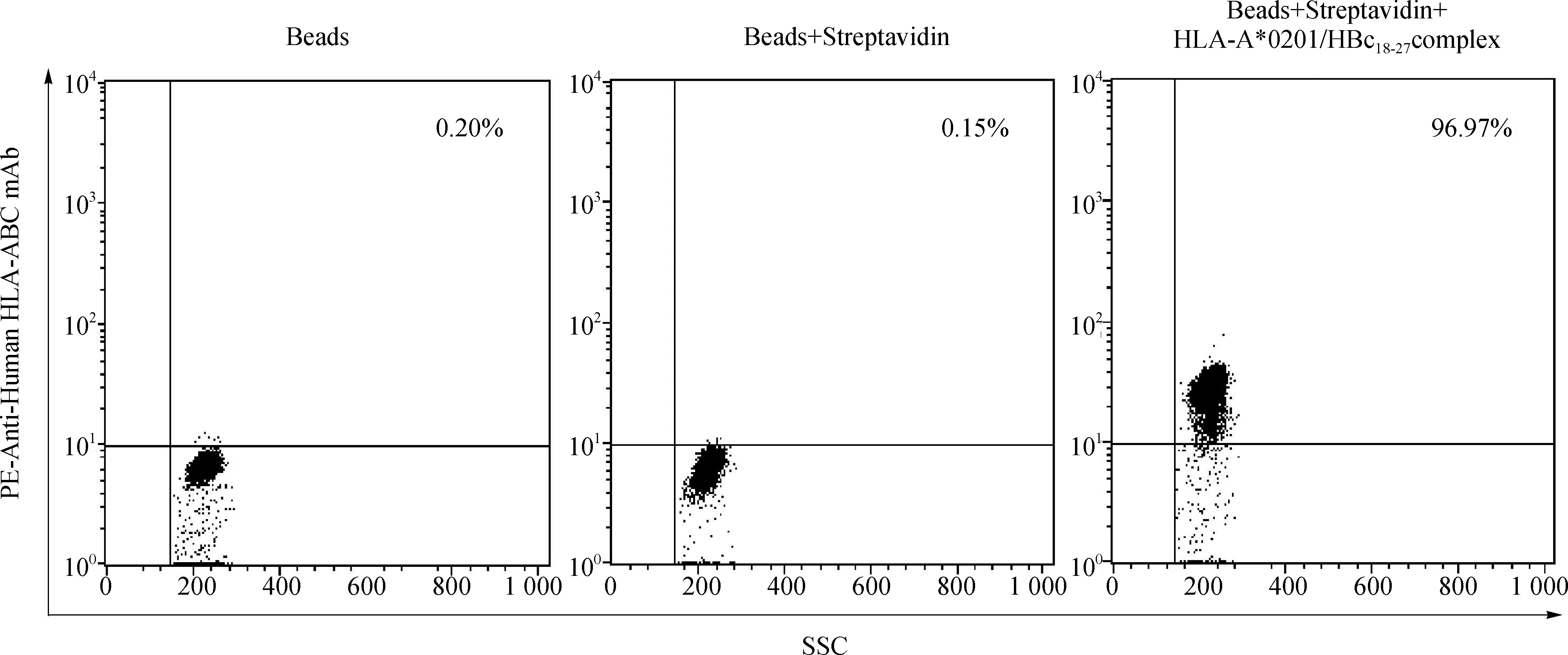
图6 HLA- A*0201/HBc18- 27单体与W6/32单抗的有效结合
Fig 6 HLA- A*0201/HBc18- 27SCT binds effectively with W6/32 mAb
为此,本实验首次通过重叠延伸PCR将HBc18- 27、(GS4)3、β2m、(GS4)4和HLA- A*0201(α1/α2/α3)依次串联为HLA- A*0201/HBc18- 27SCT基因,在联合同源重组克隆技术将其插入pET28a原核载体,成功构建和表达了pET28a- HLA- A*0201/HBc18- 27单链三分子复合体,且不需要任何限制性内切酶和连接酶,发展了pMHC SCT制备技术,有效简化了pMHC复合体的制备步骤,为以后制备四聚体及其他多聚体提供了新的制备方法。
[1] DOHERTY P C.The numbers game for virus- specific CD8+T cells[J].Science,1998,280(5361):227.
[2] SHEN C,HE Y,MENG F,et al.Characterization of MHC/peptide complexes refolded by a one- step ion- exchange chromatography[J].J Immunol Methods,2011,369:81- 90.
[3] YU Y Y,NETUSCHIL N,LYBARGER L,et al.Cutting edge:Single- chain trimers of MHC class I moleculesform stable structures that potently stimulate antigen- specific T cells and B cells[J].J Immunol,2002,168:3145- 3149.
[4] HECKMAN K L,PEASE L R.Gene splicing and mutagenesis by PCR- driven overlap extension[J].Nat Protoc,2007,2(4):924- 932.
[5] JACOBUS A P,GROSS J.Optimal cloning of PCR fragments by homologous recombination inEscherichiacoli[J].PLoS One,2015,10(3):e0119221.
[6] CHEN X,TANG Y,ZHANG Y,et al.Tapasin modification on the intracellular epitope HBcAg18- 27enhances HBV- specific CTL immune response and inhibits hepatitis B virus replicationinvivo[J].Lab Invest,2014,94(5):478- 490.
[7] HANSEN T,YU Y Y,FREMONT D H.Current Protocols in Immunology[M].New Jersey:John Wiley & Sons,Inc.2009:17.5.1- 17.5.17.
[8] REDDY T R,FEVAT L M,MUNSON S E,et al.Lambda red mediated gap repair utilizes a novel replicative intermediate inEscherichiacoli[J].PLoS One,2015,10(3):e0120681.
[9] KING B C,HAMBLIN A D,SAVAGE P M,et al.Antibody- peptide- MHC fusion conjugates target non- cognate T cells to kill tumour cells[J].Cancer Immunol Immunother,2013,62(6):1093- 1105.
[10] 黄庆海,吴亚萌,李震,等.基于HLA等位基因频率的全球人群亲缘关系初探[J].东南大学学报:医学版,2014,33(4):429- 435.
[11] 孟凡岩,沈传来,郭薇,等.利用CEA694- 702- β2m融合蛋白制备HLA- CEA694- 702复合体[J].东南大学学报:医学版,2009,28(5):366- 370.
Preparation of HLA- A*0201/HBc18- 27single- chain trimer with overlap extension PCR and homologous recombination techniques
XU Tao,LI Xiao- e,WU You,KHAWAR Ali Shahzad,WANG Wei,ZHANG Lei,SHEN Chuan- lai
(DepartmentofPathogenicBiologyandImmunology,MedicalSchool,SoutheastUniversity,Nanjing210009,China)
Objective: To construct and express the single- chain trimer(SCT) gene of HLA- A*0201/HBc18- 27complex. Methods: The SCT gene of HBc18- 27peptide- (G4S)3- β2m- (G4S)4- HLA- A*0201(α1,α2,α3) was constructed and inserted into plasmid pET28a with overlap extension PCR and homologous recombination techniques.The SCT protein of HLA- A*0201/HBc18- 27was expressed by the addition of IPTG inEscherichiacoliBL21(DE3),then purified by passing through a Ni+- chelating affinity column.Soluble inclusion bodies were refolded by dilution refolding method using the redox- shuffling refolding buffers.The refolded SCT protein was biotinylated,and then coupled onto the cell- sized magnetic beads(4.5 μm) which pre- coated with streptavidin.PE- labeled anti- Human HLA- ABC mAb(W6/32) was used as a probe to monitor the structural conformations of HLA- A*0201/HBc18- 27molecule by flow cytometric analyses. Results: The recombinant plasmid of pET28a- HLA- A*0201/HBc18- 27was confirmed by nucleotide sequencing and SDS- PAGE analysis.The fractions containing HLA- A*0201/HBc18- 27protein was eluted using elution buffer(250 mmol·L-1imidazole) with a purity of about 93% as estimated by densitometry analysis of SDS- PAGE.The strong binding of mAb W6/32 with HLA- A*0201/HBc18- 27SCT- coated magnetic beads implied the correct structural conformation of the SCT molecules. Conclusion: The overlap extension PCR and homologous recombination technique simplifies the construction of single- chain MHC class I molecules bypass the requirement of restriction sites,and will facilitate the preparation of soluble MHC class I/peptide complexes.[Key words] overlap- extension polymerase chain reaction; homologous recombination; major histocompatibility complex
2016- 05- 13
2016- 06- 20
江苏省科技厅科技支撑计划项目(BE2012739);国家自然科学基金资助项目(81172823;81372448)
许涛(1985-),男,满族,山东菏泽人,在读博士研究生。E- mail:nxtaoxu@163.com
沈传来 E- mail:chuanlaishen@seu.edu.cn
许涛,李晓娥,吴优,等.利用重叠延伸PCR和同源重组克隆技术制备HLA- A错误的标签:span.emphasis_subscript0201/HBc18- 27单链三分子复合体[J].东南大学学报:医学版,2016,35(6):825- 831.
Q784
A
1671- 6264(2016)06- 0825- 07
10.3969/j.issn.1671- 6264.2016.06.001

