RGD与特定形貌金红石表面相互作用的分子动力学模拟
吴春亚,郭闯强,郑庭,陈妮,陈明君,赫晓东
(1哈尔滨工业大学材料科学与工程博士后流动站,黑龙江 哈尔滨 150001;2哈尔滨工业大学机电工程学院,黑龙江 哈尔滨 150001)
RGD与特定形貌金红石表面相互作用的分子动力学模拟
吴春亚1,2,郭闯强2,郑庭2,陈妮2,陈明君2,赫晓东1
(1哈尔滨工业大学材料科学与工程博士后流动站,黑龙江 哈尔滨 150001;2哈尔滨工业大学机电工程学院,黑龙江 哈尔滨 150001)
精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)序列是细胞膜整合素受体与细胞外配体相结合的识别位点,利用其对材料表面进行仿生修饰可以提高植入体的生物相容性。采用全原子分子动力学方法,模拟研究了 RGD与理想和具有不同深度凹槽结构的金红石型 TiO2(110)表面的结合模式和结合稳定性。研究结果表明,在纯水环境下,RGD在金红石表面存在锚定点是该序列中带负电的羧基基团与表面Ti原子直接键合的前提。凹槽侧壁表层的不饱和原子是 RGD形成吸附的潜在作用点,故在金红石表面引入凹槽结构能在一定程度上影响该序列同基底之间的结合模式。当RGD通过羧基基团与槽底原子稳定键合之后,若剩余部分的长度足以触及至槽壁区域,则肽链中带正电的氨基或胍基基团与槽壁原子形成氢键的概率较大;若 RGD通过两侧末端基团分别同槽底形成了稳定作用,则会显著抑制该序列与槽壁原子之间氢键的形成。RGD序列同金红石表面结合作用的强弱取决于结合点的数量以及相互作用的具体类型。
金红石;表面拓扑结构;肽;分子模拟;水溶液
引 言
对于植入体而言,基于生物黏附/增殖因子的预涂层仿生修饰能够提高其表面对细胞的亲和力,为细胞的黏附、延展、增殖和分化提供生物功能化界面,从而促成植入体与机体之间的有效整合[1-2]。因此,将具有生物活性的细胞外基质(extracellular matrix,ECM)黏附蛋白、肽序列等预先涂覆在植入材料表面,通过预涂层在植入体和细胞环境之间的媒介导向作用来提高植入体的生物相容性,是颇具前景的一种方法[3-4]。在该前提下,细胞对植入材料表面的响应主要依赖于表面结合蛋白/肽序列的类型、结合模式、构象和取向等,与此同时,植入材料的表面特性亦需经由吸附蛋白/肽序列层来间接表达,因此对蛋白质/肽序列在材料表面的吸附状态进行深入探讨非常关键。
钛及其合金由于出色的生物相容性、耐腐蚀性以及与骨骼相近的弹性模量而被广泛用作外科植入材料,当钛及其合金暴露于空气或体液中,其表面会自然形成以TiO2为主要成分的氧化钝态薄膜。在钛基植入材料表面修饰方面,纯化的ECM蛋白质以及含有精氨酸-甘氨酸-天冬氨酸序列(Arg-Gly-Asp,RGD)的合成肽链应用相对比较广泛。RGD序列对整联蛋白受体具有高度特异性,能与细胞表面黏附家族中的整合素配体键合以实现对细胞黏附的调控,而且RGD作为短肽链,其生物活性不依赖于三维结构,高纯度合成技术发展亦相对成熟。因此,为提高钛基植入材料表面的生物相容性,国内外学者以RGD或含RGD的合成肽链作为仿生涂层,开展了大量的实验研究[5-11]。Elmengaard等[7]和 Ferris等[8]发现在钛基材料表面固定RGD预涂层对植入体周围新生骨的形成和生长具有积极作用。Rezania等[9]和Quirk等[10]获得了RGD能够对骨细胞的黏附和增殖产生显著促进的密度范围。Verrier等[11]比较了线状和环状RGD对成骨细胞黏附的促进效果。由此可见,RGD序列在钛基材料表面的吸附行为、空间构象和分布密度将在很大程度上影响该类材料的生物相容性。
为了从分子水平上阐明蛋白质/肽序列在材料表面的吸附特性,实现不同对象之间相互作用微观过程的可视化,迫切需要引入基于计算机模拟的理论预测工具,以期与先进的实验手段相得益彰。随着计算机运算速度的指数级增长以及大规模并行超级计算机的阶跃式发展,分子动力学(molecular dynamics,MD)模拟方法在蛋白质/肽序列吸附分析方面的应用愈加广泛。金红石是TiO2的稳定相,其中(110)晶面是金红石相TiO2中最为稳定、总表面能最小的晶面,故金红石(110)表面是目前蛋白质/肽序列吸附模拟研究的主要备选基底。Skelton等[12]推测 RKLPDA六肽上具有相反电荷的残基对可以通过近表面水层的介导与金红石(110)形成间接吸附。Monti等[13]通过自由能计算,确定了胍基基团能够与金红石(110)表面形成氢键。前期的研究工作亦表明,当不同初始构象的RGD自发沉积至电中性金红石(110)表面之后,胍基或氨基基团与基底表面之间的直接氢键是RGD实现吸附的主要模式[14],然而在电负性金红石(110)表面上,阳离子的桥接作用是促成带负电的Asp残基被间接“锁定”在电负性基底表面的主要驱动力[15-16]。上述模拟研究表明,氢键连接、表面水合层或离子的介导作用是推动肽链在金红石(110)表面形成吸附的主要驱动力。
另有实验研究显示,甲酸分子能够通过羧基基团与表面Ti原子直接键合[17];天冬氨酸主要通过羧基基团与表面 Ti原子之间的桥式二齿配位形成吸附;谷氨酸的吸附模式则是羧基基团与表面Ti原子之间的二齿配位和螯合配位的综合体[18]。对于RGD序列而言(图1),其主链N端、Arg侧链末端分别带有1个单位的正电荷,主链C端和Asp侧链末端则分别带有1个单位的负电荷。因此,除前期模拟研究中涉及到的带正电基团与表面氧原子之间的氢键连接,以及阳离子在带负电基团与带负电表面之间的媒介作用之外,本文旨在利用 MD模拟验证RGD在金红石(110)表面上能否通过羧基基团与表面Ti原子形成直接键合,并通过在基底表面引入纳观尺度的凹槽结构,考察表面拓扑形貌能否对RGD与基底之间的相互作用产生影响。
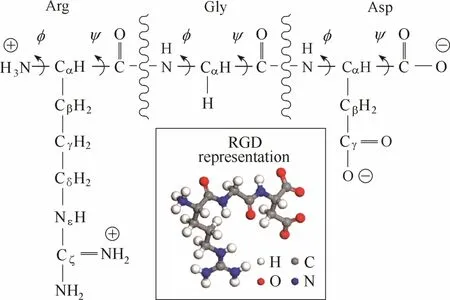
图1 RGD的分子结构Fig.1 Representation of RGD sequence
1 模拟方案
1.1 模型建立
模型的建立如图2所示,3个基底的外观尺寸均为5.3 nm×6.5 nm×5.2 nm。表面Ⅰ是电中性金红石(110)理想表面,表面Ⅱ和Ⅲ分别是在表面Ⅰ基础上通过移除部分原子形成了顶部凹槽。对于RGD而言,若凹槽尺寸过大则槽内区域等同于完美表面,若凹槽尺寸过小则不足以容纳该序列。将来源于PDB数据库[19]的RGD肽链完全展开后进行测量,得到整链的展开长度约为1.8 nm,同时为确保金红石基底表面的电中性,在凹槽的构建过程中按单位晶格去除顶部原子,故最终形成了尺寸分别为2.4 nm×3.2 nm×0.325 nm和2.4 nm×3.2 nm× 0.65 nm的矩形凹槽。
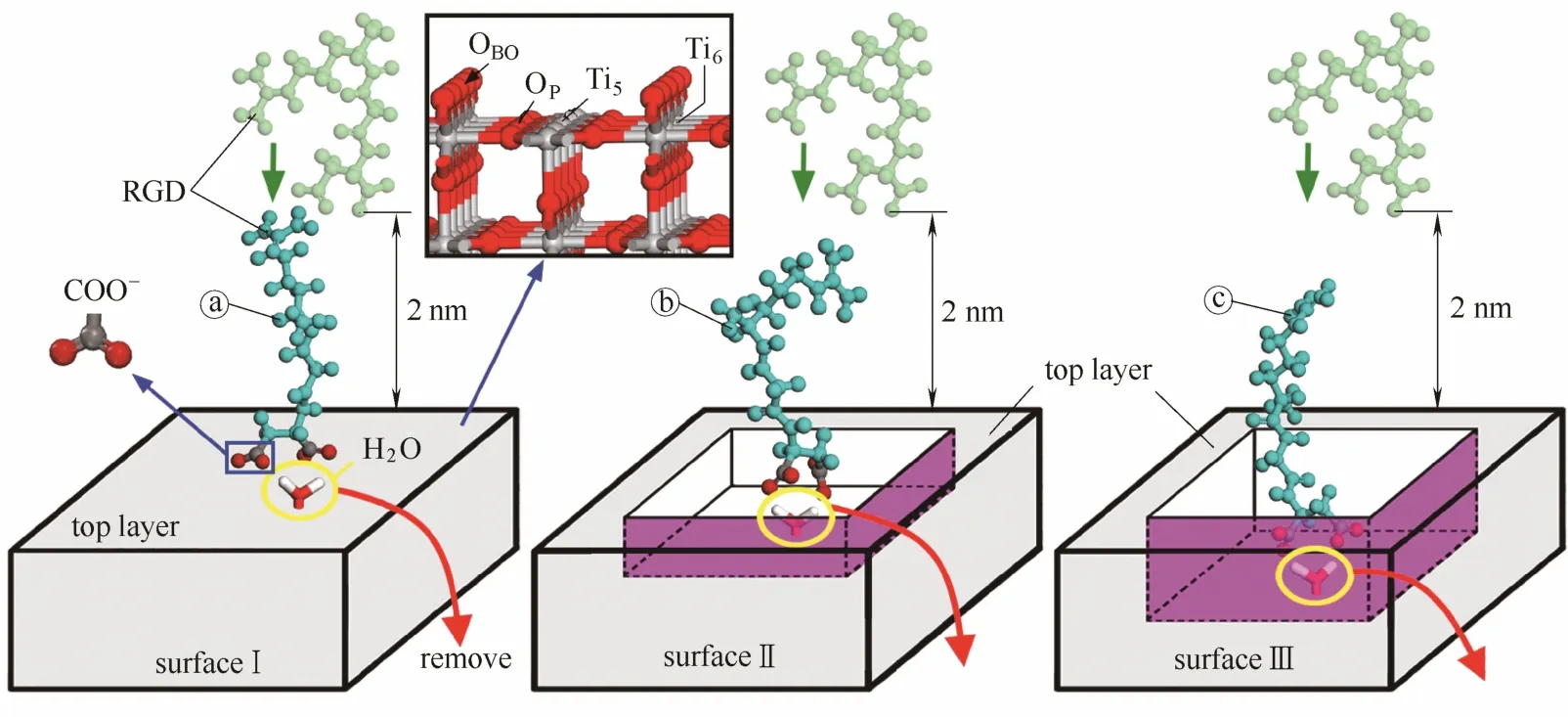
图2 模拟模型的建立过程Fig.2 Setup of simulation models
初始将相同构象的RGD序列(图2,绿色显示)分别置于各基底正上方,保持肽链最低点和基底最顶层相距约2 nm。首先固定RGD和金红石表面,对水溶剂进行能量最小化和空间排布随机化处理,随后允许 RGD在无约束状态下自由弛豫,然后对RGD中的羧基氧原子(OCOO−)施加一个沿z轴向下的速度,人为地将肽链拖拽至基底附近。
RGD的构象在上述过程之后相对于初始状态(图2,绿色显示)发生了不同程度的改变,故以a、b、c为标识符对不同表面上的RGD(图2,青色显示)加以区分。OCOO−在模拟前期向下运动,但在挤入第2水层之后即停滞不前,这是水分子的吸附模式所导致的。实验研究人员普遍认为,水在理想TiO2表面上以分子态形成吸附[20-22],Wesolowski等[23]在时间跨度为1~2 ns的MD模拟中观察到,以分子态吸附的第1水层未发生扩散,其他模拟研究亦证实了第1水层吸附的稳定性[24]。由此可见,第1水层与表面五配位Ti(Ti5,命名见图2)之间结合牢固,OCOO−原子很难通过主动挤走第1水层分子来实现其同表面 Ti5之间的直接作用。因此,本文采取了一定的干预措施,人为地去除了与羧基基团相距最近的1个第1水层分子(图2,红色箭头),为羧基和表面 Ti5之间的键合腾出空间。最后,解除施加在 OCOO−上的外界力,对整个模型进行 MD平衡模拟(T=310 K,历时3.5 ns)。
1.2 模拟条件
本文以LAMMPS软件包[25]为工具,采用Matsui等[26]提出的力场参数表征金红石表面,Amber力场[27]描述RGD序列,SPC/E[28]为水分子模型,RGD/水与金红石之间的相互作用势则来源于文献[29]。整个模拟在 NVT系综下进行,基底底部的两个Ti—O层始终保持固定,其余层允许弛豫。整个模型在x、y方向上受周期性边界条件限制,在z方向上受固定边界条件限制。SHAKE算法[30]用于约束与 H原子相连的键长及 HOH∠ 键角,PPPM(particle-particle particle-mesh solver)方法处理粒子间的长程相互作用,时间步长为1 fs。
2 结果与讨论
将具有不同标识符的RGD与各基底表面配对组合,共计得到5个模型(M1~M5,表1),分析RGD通过羧基与基底表面直接键合的可能性,并评价该键合作用的稳定程度。下文图表数据若无特殊说明,均为平衡模拟最后1 ns的平均值,其中z向零点为基底最顶层Ti5原子z向坐标的平均值。针对后续将提及的表面Ti(Tis)和表面O(Os)原子作如下说明:表面Ⅰ中的Tis和Os分别表示Ti5和表面桥氧(OBO);表面Ⅱ和Ⅲ中的Tis(或Os)表示整个基底最顶层和凹槽底部最表层的Ti5(或OBO),以及凹槽内壁最外层的不饱和原子。图1中的C端和侧链羧基氧原子分别用 OCOO−-ter和 OCOO−-side表示,胍基基团的氮原子用NNH2表示,氨基基团的氮原子则用NNH3+表示。
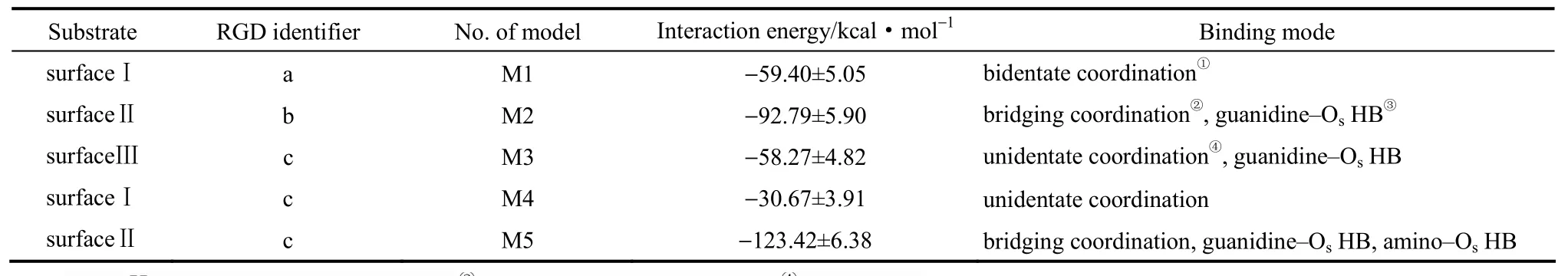
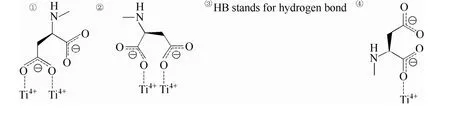
表1 模型参数及RGD-rutile相互作用结果Table 1 Model parameters and RGD-rutile interaction results
本文采用径向分布函数(radial distribution function,RDF)、z向密度分布函数和x-y平面内的二维密度分布函数作为表征RGD与基底之间相互作用的特征参数。需要说明一点:在与凹槽表面相关的二维密度分布图的绘制过程中,图例中的Ti5、Ti6、OBO、OP均指凹槽生成之前对应位置原子的配位状态。理想表面在移除原子形成凹槽之后,槽壁原子的配位数势必减小,但为简明起见,仍统一采用原来的配位状态。
2.1 不同初始位向RGD与基底的结合特性分析
标识符为a、b、c的RGD依次位于表面Ⅰ~Ⅲ上,在去除与羧基基团相距最近的1个第1水层分子之后,即形成了模型M1~M3,故将此部分归类为“不同初始位向RGD与基底的结合特性分析”。2.1.1 M1中 RGD-rutile相互作用 理想金红石(110)表面原子与RGD功能基团之间的RDF曲线[图3(a)]显示,只有Tis—OCOO−-sideRDF的第一峰(rfmax)集中在约0.2 nm处。参照文献给出的室温下金红石Ti—O原子间平均距离(Matsui等[26]:实验值为0.196 nm,计算值为0.195 nm;Kim等[31]:实验值和计算值均为0.196 nm),判断得到仅有Asp侧链羧基能与Tis直接键合;同时,密度分布曲线[图3(b)]表明OCOO−-side在z向同基底顶层相距亦约为0.2 nm。综上推断,OCOO−-side位于同其键合的 Tis的正上方。图3(a)右上角的二维密度分布图证实了两个OCOO−-side原子在平衡模拟最后1 ns的分布密度非常集中,几乎是锚定在两个相邻的 Tis的正上方,即RGD在理想表面上通过两个OCOO−-side原子与Tis的直接键合形成了稳定作用。轨迹文件显示,当人为地去除与羧基相距最近的1个第1水层分子之后,其一OCOO−-side很快与裸露的Tis成键,另一OCOO−-side则绕着 OCOO−-side-Tis结合点作小幅摆动,最终挤走了吸附在邻近Tis上的第1水层分子。
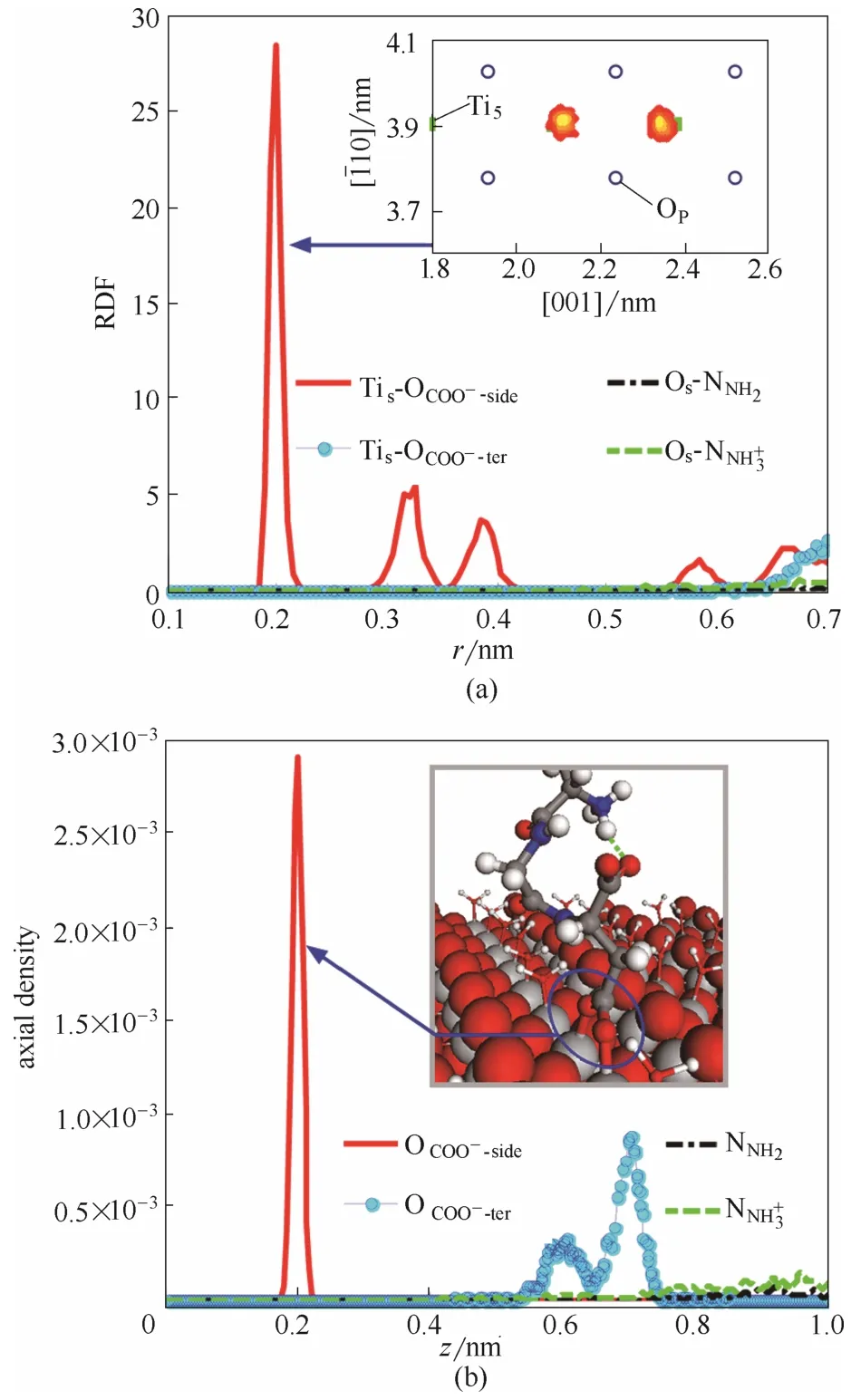
图3 金红石表面原子与RGD功能基团之间的RDF曲线(a)和RGD功能基团在z向的密度分布曲线(b)(模型M1)Fig.3 RDF curves between surface atoms of rutile and functional groups of RGD(a) and density curves for functional groups of RGD in z direction (b) (model M1)
2.1.2 M2中RGD-rutile相互作用 模型M2中的基底包含矩形凹槽,故除 RGD与基底的结合模式之外,凹槽内壁表层不饱和原子是否对肽链中的带电基团具有特殊吸引力亦是需要关注的一个重点。

图4 金红石表面原子与RGD功能基团之间的RDF曲线(a)和RGD功能基团在x-y平面内的二维密度分布(b)(模型M2)(图上虚线代表凹槽边界所在位置)Fig.4 RDF curves between surface atoms of rutile and functional groups of RGD(a) and 2D density distribution for functional groups of RGD in x-y plane (b) (model M2)(Dashed lines represent the edges of groove)
图4(a)显示,胍基、C端和侧链羧基均能与基底表层原子形成直接作用,但单凭RDF曲线无法确定与 RGD发生作用的表层原子位置,故在图 4(b)中引入了上述功能基团在x-y平面内的二维密度分布情况。OCOO−-side和 OCOO−-ter与两侧槽壁相距均超过0.6 nm,即不存在羧基与槽壁Tis直接键合的可能性,由此确定C端和侧链羧基中各有一原子与槽底 Tis键合且分布密度集中,呈稳定的桥式配位模式。同样,胍基与槽壁之间的距离亦远超氢键的形成阈值,故可知NNH2与槽底Os形成了氢键作用。从构象可见,RGD以马靴式结构与具有凹槽的表面Ⅱ直接结合[32],即Arg和Asp残基侧链分别同基底表面形成了稳定作用,同时胍基基团中的 NH与自由的OCOO−-side原子形成了分子内氢键作用,该氢键在平衡模拟最后1 ns的存在率达到97%。
2.1.3 M3中RGD-rutile相互作用 模型M3中的两个OCOO−-side呈一上一下的分布模式,位于下方者与槽底Tis键合,位于上方者和C端羧基在凹槽内部保持悬空(图5)。Os-NNH2RDF第一峰位于r=0.29 nm处,NNH2在z向集中于−0.15~0.12 nm,由此可以推断,胍基存在同位于槽壁或顶层与槽壁交界棱边处的Os原子形成氢键的可能性,但氨基与表面原子未形成任何直接作用。结合图5(a)和图6可知,两个羧基均远离两侧槽壁,其中侧链羧基以单齿配位模式与基底作用,与Tis键合的OCOO−-side原子分布密度集中,另一未键合原子与胍基基团中的 NH形成分子内氢键作用(氢键存在率为 88%),分布略为分散。C端羧基在凹槽内部虽处于悬空状态,但运动幅度在一定程度上受到了COO−side—Tis结合点的限制,故密度分散程度亦较轻。胍基与槽壁上部Os(平行于[001]方向由虚线连接的OP原子)形成了氢键,且在同槽壁维持氢键作用的同时,沿[001]方向有一定的位移,故NNH2在x-y平面上的密度分布呈与槽壁平行的细条状。
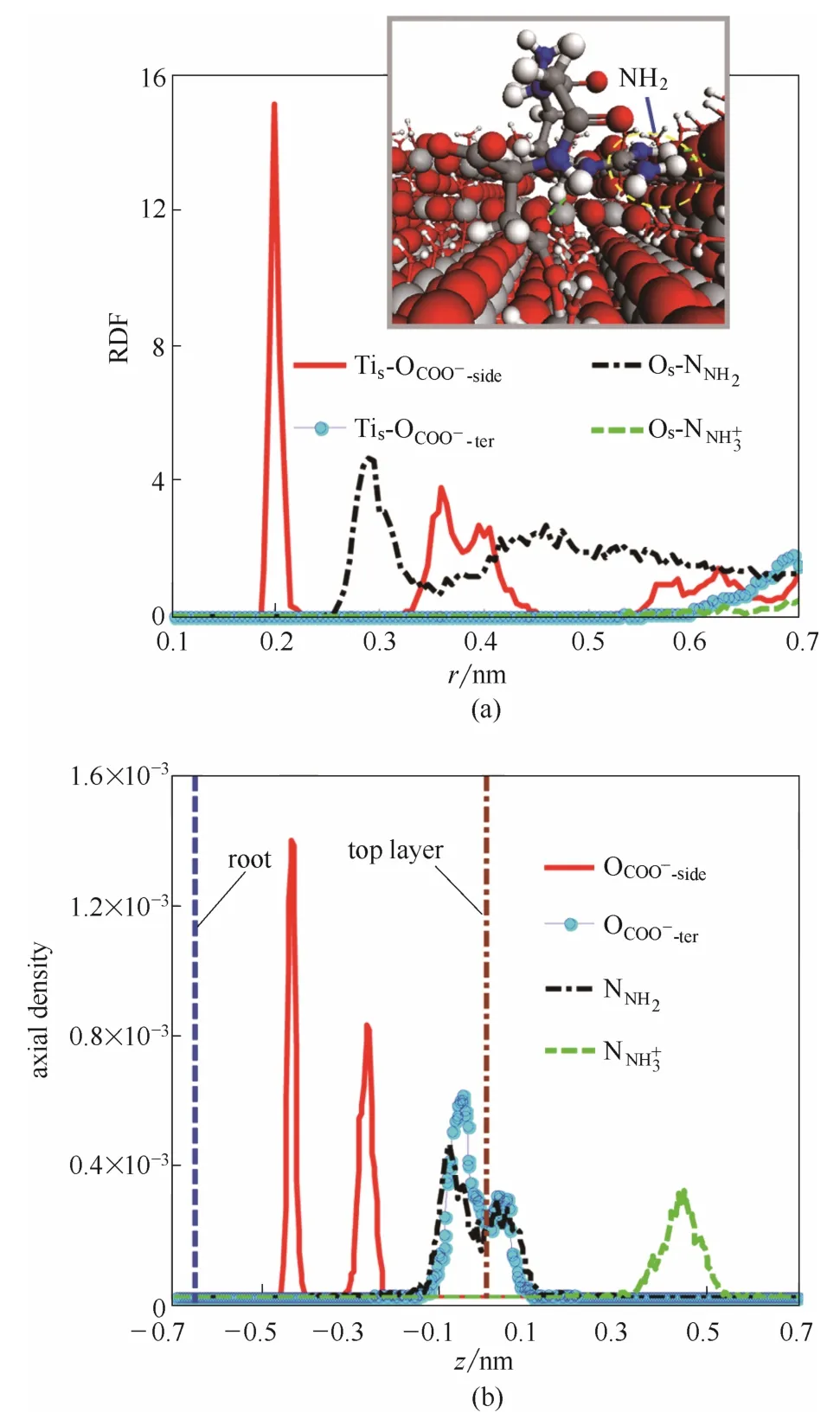
图5 金红石表面原子与RGD功能基团之间的RDF曲线(a)和RGD功能基团在z向的密度分布曲线(b)(模型M3)Fig.5 RDF curves between surface atoms of rutile and functional groups of RGD (a) and density curves for functional groups of RGD in z direction (b) (model M3)
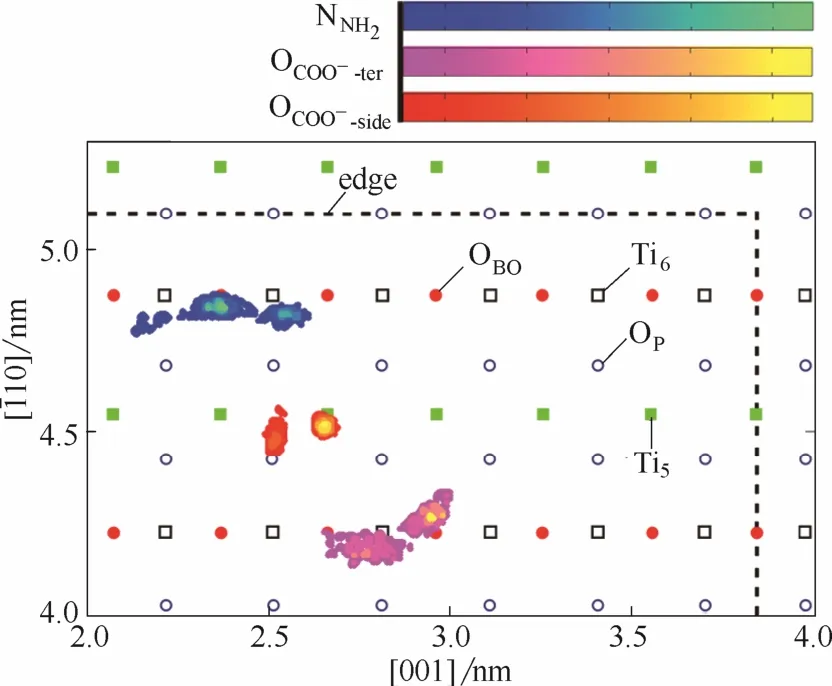
图6 RGD功能基团在x-y平面的二维密度分布(模型M3)(图上虚线代表凹槽边界所在位置)Fig.6 2D density distribution for functional groups of RGD in x-y plane (model M3)(Dashed lines represent the edges of groove)
2.2 相同初始位向RGD与基底的结合特性分析
由上述分析可知,不同初始位向的RGD在理想和不同深度凹槽表面呈现出截然不同的结合模式,为消除其他因素的干扰,着重考察表面拓扑特征对肽链与基底相互作用的影响效果,将标识符为c的RGD分别放置在表面Ⅰ和Ⅱ上方,保持羧基最低点与最近邻Tis在z向相距约0.4 nm,由此得到模型M4和M5。需要说明一点:M3中RGD(标识符为c)的侧链与平行于[001]方向的槽壁原子形成了氢键连接,故在向表面Ⅱ移植的过程中,有意将RGD沿远离该槽壁方向稍作平移。
2.2.1 M4中RGD-rutile相互作用 根据图7可知,侧链羧基中仅有单个OCOO−-side原子能与表面Tis形成键合作用,其余功能基团均与表面相距过远而未形成任何直接作用。然而,Tis-OCOO−-side单齿配位模式依然能将整个肽链锚定在基底表面,另一OCOO−-side原子绕锚定点作小幅运动,同时悬空的 C端羧基与胍基形成了多个分子内氢键,在很大程度上约束了整个肽链的结构变化。

图7 金红石表面原子与RGD功能基团之间的RDF曲线及侧链羧基在z向的密度分布曲线(模型M4)Fig.7 RDF curves between surface atoms of rutile and functional groups of RGD, as well as density curve for side-chain carboxyl group of RGD in z direction (model M4)
2.2.2 M5中RGD-rutile相互作用 在表面Ⅱ上,图8(a)所示的RDF曲线第一峰中心表明,C端和侧链羧基均能与Tis键合,胍基和氨基与Os之间的距离亦均在氢键键长范围之内。结合二维密度分布图[图8(b)]判断可得,RGD与基底表面的相互作用方式为:羧基一律远离槽壁,OCOO−-ter和OCOO−-side原子对均保持一上一下(一锚定一悬空)的分布结构,下方OCOO−与槽底Tis键合。氨基位于[001]方向的槽壁附近,分布密度集中,胍基中的1个NNH2位于两壁交汇处,另一NNH2与槽壁相距略远。将构象在去除遮挡原子之后局剖[图 8(a)插图]可以发现,整个Arg侧链几乎与[001]方向平行,氨基和胍基同凹槽侧壁最上沿的 Os原子形成氢键作用,羧基则以桥式配位模式与槽底Tis键合。
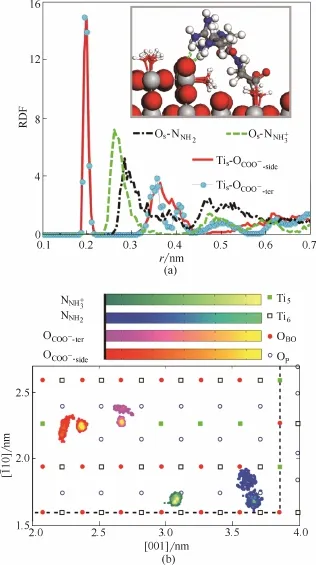
图8 金红石表面原子与RGD功能基团之间的RDF曲线(a)和RGD功能基团在x-y平面内的二维密度分布(b)(模型M5)(图中虚线代表凹槽边界所在位置)Fig.8 RDF curves between surface atoms of rutile and functional groups of RGD(a) and 2D density distribution for functional groups of RGD in x-y plane (b) (model M5)(Dashed lines represent the edges of groove)
2.3 RGD-rutile相互作用小结
通过上述分析可知,尽管OCOO−原子在z向外力辅助下无法冲破第1水层的屏障,与表面Ti形成直接作用,但倘若C端或Asp侧链羧基在表面存在一个稳定锚定点,那么剩余的某个或某几个 OCOO−原子很有可能剔除掉吸附在邻近 Tis上的水分子,形成二齿配位或桥式配位模式(表1),然而在文献[18]中,Asp通过C端和侧链羧基与TiO2表面形成了桥式二齿配位。究其原因,可能是该文献以Asp为独立研究对象,而本文以RGD三肽整体作为研究对象,故RGD与金红石表面的相互作用模式与各组成残基的动态特性均密切相关。倘若RGD仅通过C端或Asp侧链的羧基与表面Ti键合(如M1和M4),则自由的Arg和Gly残基倾向于朝着溶剂空间伸展,以期与周围水层形成稳定的氢键网络;倘若RGD中除羧基与表面Ti键合之外,胍基或氨基还能同表面O形成氢键(如M2、M3和M5),则 Asp残基与基底的结合模式会受到肽链N端和Arg侧链动态行为的牵制,即RGD各组成残基在吸附过程中会不断地进行位置调整,相互协作以得到能量有利的吸附构象,故Asp与金红石表面的结合模式与文献略有不同。
在本文所建立的模型中,理想表面上仅有侧链羧基同Tis原子形成了1对(M4)或2对(M1)键合关系,肽链N端的氨基或Arg侧链胍基均未与表面形成任何直接作用。相比之下,在含有凹槽的基底表面,当C端或Asp侧链末端以单配位(M3)或桥式配位(M5)模式锚定于凹槽底部之后,假如肽链剩余部分的长度足以延伸至槽壁,那么氨基或胍基基团与槽壁Os形成氢键的可能性将大大增加。然而,假如RGD以马靴式结构与槽底形成了多位点结合,即肽链两端分别同基底表面稳定结合,那么氨基和胍基基团与槽壁原子形成氢键的概率将大大降低(M2)。综上可见,由于凹槽侧壁裸露的不饱和原子能为肽链与基底的结合提供更为丰富的潜在作用点,凹槽的存在确实能够在一定程度上影响RGD同基底表面之间的作用模式。
为量化肽链与基底之间的结合强度,表1给出了各模型对应的RGD—rutile相互作用能(最后1 ns)。可以发现,RGD—rutile相互作用能大小与基底表面拓扑结构没有绝对的对应关系(凹槽尺寸小至无法容纳整个肽链则另当别论),而是主要取决于肽链与基底表面结合位点的数量及相互作用的类型。例如,RGD与理想表面之间的结合位点最少(1或2个),但由于Tis—OCOO− 键合作用能远大于氢键作用能,故与在凹槽Ⅱ表面上形成多位点结合的RGD相比,M1中以Tis—OCOO−-side二齿配位模式结合的 RGD—rutile相互作用能比 M3中以“Tis—OCOO−-side单配位”+“胍基-Os氢键”复合模式结合的RGD—rutile相互作用能略大。在RGD与凹槽Ⅰ表面的相互作用过程中,羧基一律以桥式配位模式同槽底键合,但由于M5中氨基和胍基均能同槽壁Os形成多个稳定氢键,数量远大于 M2,因此 M5对应的RGD-rutile相互作用能远大于M2(−123.42 kcal·mol−1vs −92.79 kcal·mol−1)。
3 结 论
本文以全原子MD模拟作为研究手段,选取金红石型 TiO2(110)表面作为基底材料,重点考察了广泛存在于ECM蛋白黏连结构域中的RGD序列能否通过带负电的羧基基团与表面 Ti原子形成直接键合的可能性,同时分析探讨了纳观尺度的表面凹槽结构是否会对 RGD与基底表面的结合模式和结合稳定程度产生影响,得到如下结论。
(1)RGD在金红石表面存在稳定锚定点是其C端或Asp侧链上的羧基基团突破第1水层屏障,与表面Ti原子形成直接相互作用的前提。
(2)凹槽侧壁表层的不饱和原子能够为肽链提供潜在作用点,当RGD通过羧基与表面Ti之间的键合锚定于槽底时,N端氨基或Arg侧链胍基在链长许可条件下,向槽壁延伸并形成氢键的概率较大;当RGD两端以马靴式结构与槽底稳定结合,则会显著抑制肽链与槽壁之间氢键的形成。
(3)表面凹槽的存在能在一定程度上影响RGD同金红石表面之间的结合模式,但两者结合作用的强弱主要取决于结合位点的数量以及相互作用类型,与基底表面拓扑结构没有绝对关系。
蛋白质/肽序列的吸附是受各种因素综合影响的复杂过程,表面拓扑结构特征虽然只是材料表面性质的一个方面,但在植入材料表面引入并构筑特定的三维纳米拓扑结构,考察其对蛋白质/肽序列与基底之间结合行为的影响,有助于启发人们如何通过优化设计植入材料表面的拓扑结构,空间调控仿生修饰因子在材料表面的分布模式,最终达到改善介入诊疗材料生物相容性的目的。因此,本文的研究工作可以为基于蛋白质/肽序列修饰的钛系植入材料的相关研究提供一定的理论指导。
[1]VALLEE A, HUMBLOT V, PRADIER C M. Peptide interactions with metal and oxide surfaces[J]. Accounts of Chemical Research, 2010, 43(10): 1297-1306.
[2]COSTA D, GARRAIN P A, BAADEN M. Understanding small biomolecule-biomaterial interactions: a review of fundamental theoretical and experimental approaches for biomolecule interactions with inorganic surfaces[J]. Journal of Biomedical Materials Research Part A, 2013, 101A(4): 1210-1222.
[3]OZBOYACI M, KOKH D B, CORNI S, et al. Modeling and simulation of protein-surface interactions: achievements and challenges[J]. Quarterly Reviews of Biophysics, 2016, 49: 1-45.
[4]WANG X, HERTING G, WALLINDER I O, et al. Adsorption of lysozyme on silver and its influence on silver release[J]. Langmuir, 2014, 30: 13877-13889.
[5]KIM G H, KIM I S, PARK S W, et al. Evaluation of osteoblast-like cell viability and differentiation on the Gly-Arg-Gly-Asp-Ser peptide immobilized titanium dioxide nanotube via chemical grafting[J]. Journal of Nanoscience and Nanotechnology, 2016, 16(2): 1396-1399.
[6]CHENG K, WANG T T, YU M L, et al. Effects of RGD immobilization on light-induced cell sheet detachment from TiO2nanodots films[J]. Materials Science & Engineering C-Materials for Biological Applications, 2016, 63: 240-246.
[7]ELMENGAARD B, BECHTOLD J E, SOBALLE K. In vivo study of the effect of RGD treatment on bone ongrowth on press-fit titanium alloy implants[J]. Biomaterials, 2005, 26(17): 3521-3526.
[8]FERRIS D M, MOODIE G D, DIMOND P M, et al. RGD-coated titanium implants stimulate increased bone formation in vivo[J]. Biomaterials, 1999, 20: 2323-2331.
[9]REZANIA A, HEALY K E. The effect of peptide surface density on mineralization of matrix deposited by osteogenic cells[J]. Journal of Biomedical Materials Research, 2000, 52(4): 595-600.
[10]QUIRK R A, CHAN W C, DAVIES M C, et al. Poly (L-lysine)-GRGDS as a biomimetic surface modifier for poly (lactic acid)[J]. Biomaterials, 2001, 22(8): 865-872.
[11]VERRIER S, PALLU S, BAREILLE R, et al. Function of linear and cyclic RGD-containing peptides in osteoprogenitor cells adhesion process[J]. Biomaterials, 2002, 23(2): 585-596.
[12]SKELTON A A, LIANG T, WALSH T R. Interplay of sequence, conformation and binding at the titania-peptide interface as mediated by water[J]. ACS Applied Materials & Interfaces, 2009, 1(7): 1482-1491.
[13]MONTI S, WALSH T R. Free energy calculations of the adsorption of amino acid analogues at the aqueous titania interface[J]. The Journal of Physical Chemistry C, 2010, 114(50): 22197-22206.
[14]WU C Y, CHEN M J, GUO C Q, et al. Peptide-TiO2interaction in aqueous solution: conformational dynamics of RGD using different water models[J]. The Journal of Physical Chemistry B, 2010, 114(13): 4692-4701.
[15]WU C Y, SKELTON A A, CHEN M J, et al. Modeling the interaction between integrin-binding peptide (RGD) and rutile surface: the effect of cation mediation on Asp adsorption[J]. Langmuir, 2012, 28(5): 2799-2811.
[16]WU C Y, CHEN M J, SKELTON A A, et al. Adsorption of arginine-glycine-aspartate tripeptide onto negatively charged rutile (110) mediated by cations: the effect of surface hydroxylation[J]. ACS Applied Materials & Interfaces, 2013, 5(7): 2567-2579.
[17]DIEBOLD U. The surface science of titanium dioxide[J]. Surface Science Reports, 2003, 48(5/6/7/8): 53-229.
[18]RODDICK-LANZILOTTA A D, MCQUILLAN A J. An in situ infrared spectroscopic study of glutamic acid and of aspartic acid adsorbed on TiO2: implications for the biocompatibility of titanium[J]. Journal of Colloid and Interface Science, 2000, 227: 48-54.
[19]DICKINSON C D, VEERAPANDIAN B, DAI X P, et al. Crystal structure of the tenth type III cell adhesion module of human fibronectin[J]. Journal of Molecular Biology, 1994, 236: 1079-1092.
[20]HUGENSCHMIDT M B, GAMBLE L, CAMPBELL C T. The interaction of H2O with a TiO2(110) surface[J]. Surface Science, 1994, 302(3): 329-340.
[21]BENKOULA S, SUBLEMONTIER O, PATANEN M, et al. Water adsorption on TiO2surfaces probed by soft X-ray spectroscopies: bulk materials vs. isolated nanoparticles[J]. Scientific Reports, 2015, 5, Article number: 15088.
[22]BRINKLEY D, DIETRICH M, ENGEL T, et al. A modulated molecular beam study of the extent of H2O dissociation on TiO2(110)[J]. Surface Science, 1998, 395(2/3): 292-306.
[23]WESOLOWSKI D J, SOFO J O, BANDURA A V, et al. Comment on "structure and dynamics of liquid water on rutile TiO2(110)"[J]. Physical Review B, 2012, 85(16): 3603-3612.
[24]SHI H, LIU Y C, ZHAO Z J, et al. Reactivity of the defective rutile TiO2(110) surfaces with two bridging-oxygen vacancies: water molecule as a probe[J]. The Journal of Physical Chemistry C, 2014, 118(35): 20257-20263.
[25]LAMMPS Molecular Dynamics Simulator Home Page[EB/OL]. http://lammps.sandia.gov.
[26]MATSUI M, AKAOGI M. Molecular dynamics simulation of the structural and physical properties of the four polymorphs of TiO2[J]. Molecular Simulation, 1991, 6: 239-244.
[27]CORNELL W D, CIEPLAK P, BAYLY C I, et al. A second generation force field for the simulation of proteins, nucleic acids, and organic molecules[J]. Journal of the American Chemical Society, 1995, 117: 5179-5197.
[28]BERENDSEN H J C, GRIGERA J R, STRAATSMA T P. The missing term in effective pair potentials[J]. Journal of Physical Chemistry, 1987, 91(24): 6269-6271.
[29]CARRAVETTA V, MONTI S. Peptide-TiO2surface interaction in solution by ab initio and molecular dynamics simulations[J]. The Journal of Physical Chemistry B, 2006, 110: 6160-6169.
[30]RYCKAERT J P, CICCOTTI G, BERENDSEN H J. Numerical integration of the cartesian equations of motion of a system with constraints: molecular dynamics of nalkanes[J]. Journal of Computational Physics, 1977, 23(3): 327-341.
[31]KIM D W, ENOMOTO N, NAKAGAWA Z, et al. Molecular dynamic simulation in titanium dioxide polymorphs: rutile, brookite, and anatase[J]. Journal of the American Ceramic Society, 1996, 79(4): 1095-1099.
[32]SANO K I, SHIBA K. A hexapeptide motif that electrostatically binds to the surface of titanium[J]. Journal of the American Chemical Society, 2003, 125(47): 14234-14235.
Molecular dynamics simulations of interplay between RGD and rutile surfaces with designed topographies
WU Chunya1,2, GUO Chuangqiang2, ZHENG Ting2, CHEN Ni2, CHEN Mingjun2, HE Xiaodong1
(1Postdoctoral Station of Materials Science and Engineering, Harbin Institute of Technology, Harbin 150001, Heilongjiang, China;2School of Mechatronics Engineering, Harbin Institute of Technology, Harbin 150001, Heilongjiang, China)
The Arg-Gly-Asp sequence (RGD), a ubiquitous adhesive motif in extracellular matrix proteins, exhibits a high affinity to the predominant osteoblast integrin; thus it has been regarded as a promising candidate for biomimic coating to emulate biology in the fabrication of bone-anchored implant surfaces, especially the widely used titanium-based materials. The present study aims to explore the molecular scale events that occur when RGD is placed close to the rutile TiO2(110) surface by employing classical all-atom molecular dynamics simulations. Local grooves with different depths were introduced in the substrate surfaces to figure out the effect of surface topography on the binding modes of RGD with rutile. The simulation results show that the negatively charged carboxyl groups of RGD are able to break through the barriers from surface hydrations, forming direct bonds with the surface Ti atoms. However, this occurs on the premise that an anchoring site on the rutile surfacehas been provided to the peptide with an external intervention. Since the unsaturated atoms on the top-layer of groove walls seem to be underlying active sites for peptide adsorption, the presence of surface grooves will largely affect the RGD-rutile binding modes. If RGD can be locked on the bottom of groove via the direct bonds between carboxyl groups and surface Ti atoms, the positively charged groups (guanidine or amino group) are inclined to form hydrogen bonds with surface O atoms on the groove walls, when the length of the rest chain allows. However, once RGD is connected to the bottom of groove with both Arg and Asp side chains "trapped" in a "horseshoe" configuration, the formation of hydrogen bonds between the peptide and the groove walls will be greatly suppressed. The results also indicate that the dominant factors determining the binding strength of RGD-rutile complex are the concrete types of interaction and the number of jointing points. It is anticipated that the findings presented here will ultimately contribute to the biomimetic modification of implants, by suggesting how to tailor the surface topography of implants to induce the desirable biological function.
rutile; surface topography; peptide; molecular simulation; aqueous solution
GUO Chuangqiang, guochuangqiang@126.com
TG 146.2+3
:A
:0438—1157(2017)01—0199—09
10.11949/j.issn.0438-1157.20160784
2016-06-06收到初稿,2016-09-09收到修改稿。
联系人:郭闯强。
:吴春亚(1982—),女,博士,副教授。
国家自然科学基金委员会创新研究群体科学基金项目(51521003);中央高校基本科研业务费专项资金(AUGA5710058415);中国博士后基金项目(2015M581439);高等学校学科创新引智计划项目(B07018)。
Received date: 2016-06-06.
Foundation item: supported by the Foundation for Innovative Research Groups of the National Natural Science Foundation of China (51521003), the Fundamental Research Funds for the Central Universities (AUGA5710058415), the China Postdoctoral Science Foundation (2015M581439) and the Program of Introducing Talents of Discipline to Universities (B07018).
——以金红石为例

