超疏水金红石型纳米钛硅复合氧化物的制备与表征
侯磊鑫,方莉,闫光红,王永康
(1山西大学化学化工学院,山西 太原 030006;2山西亮龙涂料有限公司,山西 晋中 030600)
超疏水金红石型纳米钛硅复合氧化物的制备与表征
侯磊鑫1,方莉1,闫光红2,王永康2
(1山西大学化学化工学院,山西 太原 030006;2山西亮龙涂料有限公司,山西 晋中 030600)
以正硅酸乙酯为硅源、钛酸异丙酯为钛源,采用改进的溶胶-凝胶法制备了不同钛硅摩尔比的复合气凝胶,在不同温度下进行煅烧,得到金红石型钛硅(TiO2-SiO2)复合氧化物纳米颗粒,然后通过三甲基氯硅烷(TMCS)改性,制得超疏水金红石型 TiO2-SiO2纳米材料。探讨了钛硅摩尔比和煅烧温度对钛硅复合氧化物纳米颗粒晶型的影响,并通过XRD、XPS、BET、SEM和FTIR等手段对产物进行了表征,采用水接触角测试(WCA)对纳米材料改性后的疏水性能进行了表征。结果表明:当钛硅摩尔比为5∶1时制得的气凝胶在1100℃煅烧及TMCS改性后,所制备的超疏水金红石型纳米钛硅复合氧化物的比表面积大,疏水性能优异,其比表面积达348 m2·g−1,水接触角达到154.7°,在构建具有纳微分层结构的外墙装饰材料的面漆方面具有潜在的应用前景。
超疏水;溶胶-凝胶法;钛硅复合氧化物;纳米粒子;制备;烧结;金红石型
引 言
近年来,全国各地屡屡报道高空坠楼的“瓷砖雨”砸车伤人的事故,严重威胁城市居民的人身安全。1997年以来,一些省市纷纷出台相关规定,禁用石材类建筑外墙面砖,因此,开发具有装饰性好、自清洁能力强、耐候性好、成本低的多功能外墙装饰材料逐渐成为该领域的研究热点。但是,国内生产的外墙涂料存在装饰性和耐候性差的缺陷,也不具备自清洁功能,难以真正替代石材类外墙装饰材料。而要想制备具有自清洁能力、耐候性好的外墙装饰材料,超疏水表面涂层的制备是关键。
目前,制备超疏水表面的主要方法是先构建具有微纳分层粗糙结构的表面,然后采用低表面能物质(硅烷偶联剂、含氟树脂等)对表面进行超疏水改性[1]。构建微纳分层粗糙结构常用的无机纳米材料包括ZnO、TiO2、Co3O4、SnO2、SiO2等[2]。
纳米二氧化钛(TiO2)主要有锐钛矿型(anatase)和金红石型(rutile)两种结晶形态,其中锐钛矿型TiO2因具有优异的光催化和热稳定性而广泛用于光催化及光电传感器等领域[3-4],而金红石型 TiO2因具有更高的热稳定性和耐候性而应用于建筑涂料、航空材料、海水淡化等领域[5]。但是,由于TiO2粉体存在比表面积小、表面孔道少、机械强度差等缺陷,需通过掺杂SiO2、Fe2O3、CeO2等制备具有低密度[6]、高比表面积[7]和高孔隙率[8]的复合氧化物材料,以用于多相催化[9]、绝缘材料[10]、传感器[11]、药物输送[12]、重金属吸附[13]等领域中。其中,掺杂SiO2制备的 TiO2-SiO2复合氧化物因具备较高的比表面积、孔隙率、热稳定性和光催化活性等特点而受到更多的关注[14-16]。
TiO2-SiO2复合氧化物的制备方法主要有溶胶-凝胶法[17]、水解沉淀法[18]、水热法[19]、微乳液法[20]和离子交换法等[21]。Baiju等[17]以硅铝混合氧化物作为添加剂,采用连续溶胶-凝胶法制备了 TiO2复合凝胶,经煅烧处理后获得比表面积为63 m3·g−1的复合氧化物。研究发现硅铝化合物的加入提高了TiO2的稳定性及晶型转变温度,当温度达到 1100℃时,复合物中TiO2的晶型仍保持锐钛矿相,展示了优异的光敏性和热稳定性。Iannazzo等[18]以钒氧化物和钛醇盐为前体,以硅胶作为模板载体,于异丙醇中采用水解沉淀法制备了复合催化剂,通过异丁烷氧化脱氢反应测试了催化剂的活性,结果表明,硅胶上接枝双金属醇盐可制备具有优异选择性的复合催化剂。此外,该制备钛基催化剂的方法省时,且在催化选择性上有了显著提高。Li等[19]以正硅酸乙酯(TEOS)和钛醇盐为前驱体,采用水热合成法制备了TiO2-SiO2复合氧化物,发现1000℃煅烧处理后的钛硅复合氧化物仍为锐钛矿相,比表面积达到129.7 m3·g−1,具有优异的热稳定性和光催化性能。Hong等[20]通过钛酸异丙酯和TEOS在表面活性剂2-乙基己基琥珀酸酯磺酸钠(AOT)形成的反向微乳液中水解获得了 Ti/Si摩尔比为 7∶3的TiO2-SiO2复合氧化物,其比表面积达到 275 m3·g−1。研究表明,钛硅复合氧化物在800℃煅烧后仍为锐钛矿相,在对硝基苯酚的光催化分解中表现出极高的活性。到目前为止,尚未见到有关超疏水纳米金红石型钛硅复合氧化物制备及其在建筑外墙涂料中应用的报道。
本研究以钛酸异丙酯为钛源,正硅酸乙酯为硅源,采用改进的溶胶-凝胶法制备了TiO2-SiO2复合气凝胶,探究了制备高比表面积的纳米金红石型钛硅复合氧化物的最佳条件,最后以三甲基氯硅烷为表面改性剂对复合氧化物进行了表面疏水处理,并对改性后的金红石型钛硅复合氧化物的表面的微观形貌和疏水性能进行了表征和测试。
1 实验材料和方法
1.1 材料
正硅酸乙酯(TEOS)、钛酸异丙酯(TTIP)、无水乙醇、乙酰丙酮、三甲基氯硅烷(TMCS)、正己烷,以上试剂均为AR级,国药集团化学试剂有限公司;氨水、浓硝酸,优级纯,北京化工厂;实验用水为去离子水。
1.2 分析测试仪器
X射线衍射仪,D8-Advance型[CuKα辐射,工作条件为40 kV·40 mA−1,扫描速率10 (°)·min−1],德国Bruker公司;X射线光电子能谱仪,PHI-5300 ESCA型,PerkinElmer股份有限公司;傅里叶变换红外光谱仪,Tensor 27,德国Bruker公司;冷场发射扫描电子显微镜,JSM-6701F,日本电子株式会社;全自动快速比表面积及介孔/微孔分析仪,ASAP 2020,美国Micromeritics公司;接触角测量仪,C20型,上海梭伦公司。
1.3 实验方法
1.3.1 金红石型 TiO2-SiO2复合氧化物纳米颗粒的制备 取10 ml正硅酸乙酯(TEOS)在搅拌下加入到80 ml无水乙醇中,然后加入20 ml硝酸溶液(0.1 mol·L−1),调节pH=2~3,充分搅拌30 min后室温下陈化36~48 h;另取5 ml钛酸异丙酯(TTIP)在搅拌下加入到120 ml无水乙醇中,然后加入1.2 ml氨水和2.0 ml乙酰丙酮,调节溶液的pH=8~9,充分搅拌30 min后室温下陈化24 h。乙酰丙酮主要用于抑制 TTIP过早水解,控制凝胶速率,以获得均匀复合的气凝胶。按不同Ti/Si摩尔比(3∶1、4∶1、5∶1)将SiO2溶胶逐滴加入TiO2溶胶中,继续搅拌30 min,然后超声处理60 min,陈化24 h,制得不同SiO2含量的TiO2-SiO2气凝胶,分别记作TS3、TS4、TS5。最后,将所制备的TiO2-SiO2气凝胶在60℃下真空干燥 36 h后,置于马弗炉中分别在1000、1100、1200℃下煅烧 4 h,冷却后研磨得到TiO2-SiO2纳米复合氧化物[22-23]。
1.3.2 复合氧化物纳米颗粒的超疏水改性 将制得的金红石型 TiO2-SiO2纳米颗粒分散于正己烷(hexane)和TMCS质量分数8.0%的混合液中,室温反应6 h后,用适量的正己烷冲洗纳米颗粒2~3次,最后60℃真空干燥12 h,得到改性的金红石型TiO2-SiO2纳米复合氧化物材料,通过水接触角测量对其疏水性能进行测试[24]。
2 结果与讨论
2.1 TiO2-SiO2复合氧化物的XRD表征与分析
图1(a)~(c)分别为TS3、TS4和TS5复合气凝胶在1000、1100和1200℃煅烧4 h后的XRD图谱。从图 1(a)可以看出,当钛硅比为 3∶1时(TS3),1000℃煅烧产物中TiO2的晶型以锐钛矿为主,如2θ角在25.2°的强衍射峰,以及37.6°、48.1°、62.8°的特征衍射峰可分别归属于锐钛矿型TiO2的(101)和(004)、(200)、(204)晶面;而在 2θ角为27.4°、36.1°、41.2°出现的比较弱的衍射峰,可分别归属于金红石型TiO2的(110)、(101)、(111)晶面。当温度升高至1100℃时,2θ角为25.2°处属于锐钛矿型 TiO2的(101)晶面的衍射峰显著降低,而 27.4°处属于金红石型TiO2的(110)晶面衍射峰急剧增强,说明升高温度使锐钛矿型减少,金红石型增加;继续升温至1200℃,锐钛矿型的特征衍射峰非常弱,而金红石型的特征衍射峰非常强,说明此时煅烧产物以金红石型为主,但是仍然有少量锐钛矿型存在[25]。当钛硅比增大到4∶1时[图1(b),TS4],1000℃煅烧后,虽然产物中的金红石型略有增加,但是仍然以锐钛矿为主;1100℃时,金红石型的衍射峰急剧增强,只有少量的锐钛矿型存在;1200℃时,锐钛矿型几乎消失。当钛硅比为5∶1时[图1(c),TS5],1100℃煅烧后,几乎所有的锐钛矿型都转变为金红石型。
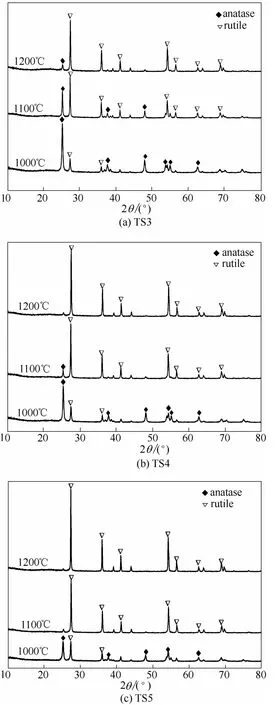
图1 1000~1200℃煅烧后TiO2-SiO2气凝胶的XRD谱图Fig.1 XRD patterns of TiO2-SiO2aerogels calcined rangingfrom 1000 to 1200℃
随着 Ti/Si摩尔比的增大,SiO2含量的减少,锐钛矿型TiO2的高温稳定性变差,部分逐渐转变为金红石型 TiO2,这是由于 SiO2的空间位阻作用对TiO2晶粒的大小的影响减弱,根据临界尺寸效应,TiO2颗粒的粒径越大,此晶型转变温度就越低,即克服锐钛矿型TiO2-金红石型TiO2晶型转变的能量势垒降低[26-27]。此外,随着煅烧温度的增大,锐钛矿型 TiO2的稳定性变差,逐步转变为金红石型TiO2。当煅烧温度达到1100℃时,TiO2-SiO2复合氧化物粉体中的锐钛矿型 TiO2全部转变为金红石型TiO2,此时,TiO2-SiO2复合氧化物的稳定性最好。因此,选定Ti/Si摩尔比为5∶1的复合气凝胶在1100℃煅烧处理作为制备金红石型 TiO2-SiO2复合氧化物的最佳制备条件。
2.2 TiO2-SiO2复合氧化物的XPS表征与分析
图2(a)、(b)分别为纯TiO2以及TS3、TS4、TS5气凝胶在1100℃煅烧处理后的Ti 2p和O 1s的XPS谱图。从图2(a)可以看出,相对于纯TiO2位于459.0 eV处的 Ti 2p3/2结合能峰,钛硅复合氧化物的 Ti 2p3/2结合能峰均发生了负向位移,即随着SiO2含量的增加,Ti 2p3/2结合能由458.9 eV减小至458.2 eV,且其峰强度也逐渐减弱,说明钛原子取代了 SiO2网状结构中的Si原子,形成了Ti—O—Si键[28]。值得注意的是,TS4、TS5样品的Ti 2p3/2峰的负移程度以及峰强度的减弱,相比于TS3而言并不十分明显,说明1100℃煅烧时,SiO2的少量掺杂对复合氧化物中金红石相TiO2的结晶度影响不大,这与XRD分析的结果相一致。
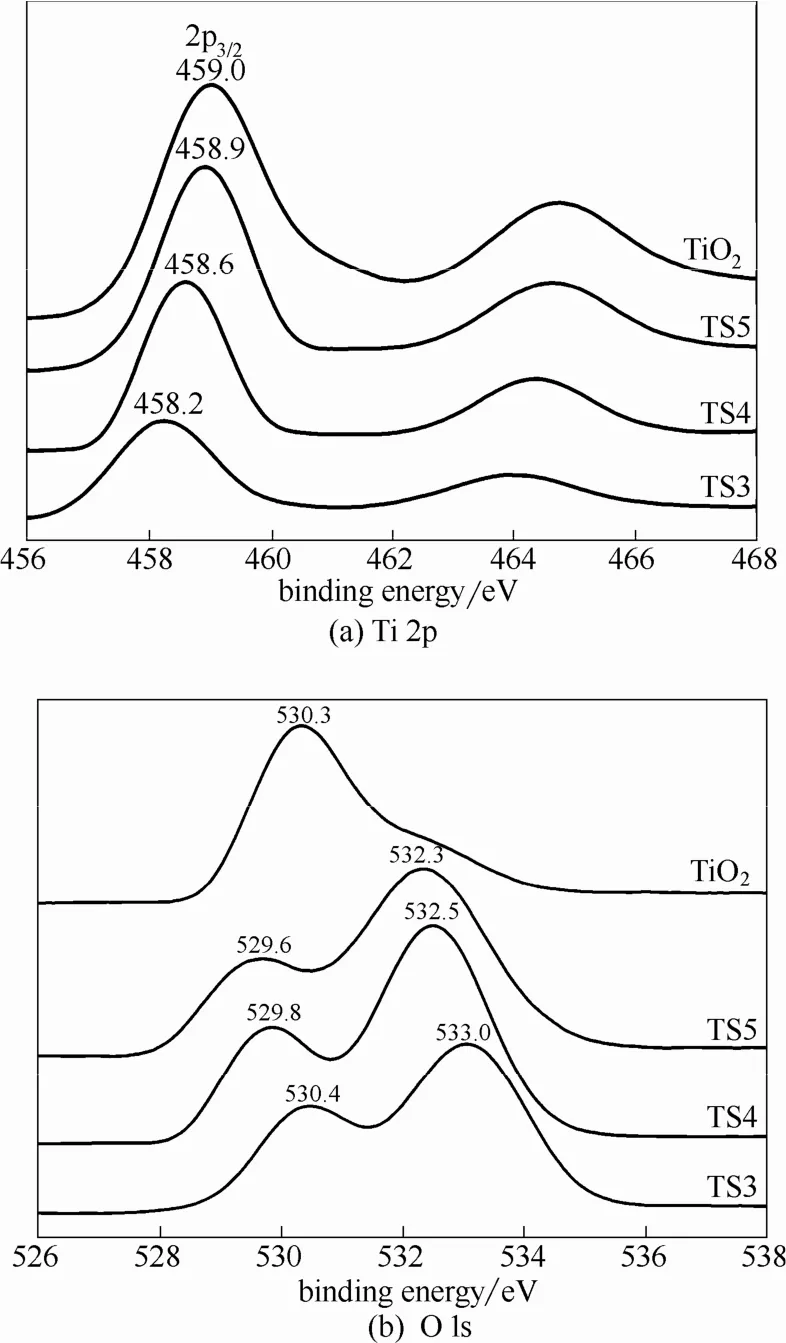
图2 TiO2和不同钛硅比的TiO2-SiO2气凝胶1100℃煅烧后的XPS谱图Fig.2 XPS spectra of TiO2and TiO2-SiO2aerogels calcined at 1100℃
由图2(b) O 1s能谱图可知,纯TiO2的Ti—O—Ti键的O 1s 结合能峰只有位于530.3 eV处的单峰,而由文献可知,Si—O—Si键的O 1s 结合能为533.5 eV,因此对于TS5、TS4、TS3样品,结合能位于530.3~533.5 eV之间的532.3、532.5和533.0 eV处的峰,均可归属于Ti—O—Si键的O 1s,标志着Ti—O—Si键的形成[29-30]。此外,3种钛硅复合氧化物的O 1s 结合能峰均分裂为双峰[图2(b)],即分别在529.6、529.8和530.4 eV出现了TiO2的结合能峰,这可能是因为金红石相TiO2具有非常高的结晶度,只有部分Ti4+进入SiO2网状结构形成Ti—O—Si键,且随着SiO2含量增大,Ti—O—Si键的O 1s结合能逐渐增强。
2.3 TiO2-SiO2复合氧化物改性前后的BET、SEM和FTIR表征
根据TiO2-SiO2复合氧化物的XRD和XPS分析可知,采用钛硅摩尔比为5∶1(TS5)制得的气凝胶于1100℃煅烧后,可以得到金红石型的TiO2-SiO2复合氧化物。图3(a)~(c)分别为所制备的TS5气凝胶在60℃干燥、1100℃煅烧以及TMCS改性处理后的吸附-脱附曲线和孔径分布。显然,所有样品的N2吸附-脱附等温线均属于Ⅳ型吸附等温线,表明TS5样品是具有介孔结构的纳米材料[31]。其中,60℃干燥所得TS5气凝胶的比表面积为398.8 m2·g−1,孔径分布较窄,在4.4 nm左右;1100℃煅烧处理后,由于高温下纳米粒子发生一定的团聚,比表面积降为368.8 m2·g−1,而由于煅烧过程中残留在孔内的溶剂挥发,孔径增大至8.8 nm左右;经TMCS改性后,比表面积减小为 348 m2·g−1,孔径减小为6.8 nm[32]。
图4(a)~(c)分别为所制备的TS5气凝胶在60℃干燥、1100℃煅烧以及TMCS改性处理后的SEM图。从图4(a)可以看出,60℃干燥得到的气凝胶为内部结构松散的球形纳米颗粒,具有较好的分散性,这是因为常压干燥过程可降低样品的毛孔收缩效应,形成有序的多孔网状结构[33];1100℃煅烧后,形成了金红石型纳米 TiO2-SiO2复合氧化物[图4(b)],随着煅烧温度的增加,样品的团聚现象严重,样品颗粒变为致密堆积,样品的比表面积和孔体积减小[34-35],这与BET分析结果一致;TMCS改性后[图4(c)],由于表面引入长链的疏水基团—CH3,不仅减少了表面亲水基团-OH的数目,同时使纳米TiO2-SiO2复合氧化物表面形成一种平整、有序的微纳网状结构,这是 TiO2-SiO2纳米复合氧化物表面具备超疏水性的主要原因[36]。

图3 TiO2-SiO2气凝胶(TS5)的氮气吸附-脱附等温线和孔径分布Fig.3 N2adsorption-desorption isotherms of aerogels and pore size distribution plot of TS5 aerogels

图4 TiO2-SiO2气凝胶(TS5)的SEM图Fig.4 SEM images of TiO2-SiO2aerogels
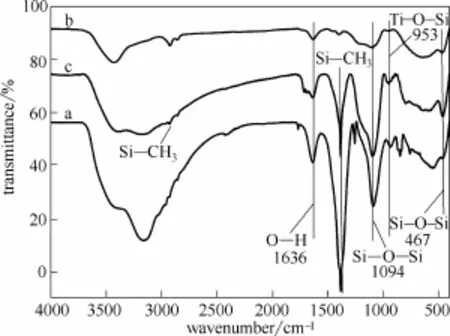
图5 TiO2-SiO2气凝胶(TS5)的红外光谱图Fig.5 FTIR spectra of TS5 aerogels
图5曲线a~c分别为样品TS5在60℃干燥、1100℃煅烧和TMCS改性后的FTIR图。显然,3条曲线均在467、1094 cm−1处出现了Si—O—Si键的弯曲振动和非对称性伸缩振动吸收峰,而 631 cm−1处的特征振动吸收峰可归属于Ti—O—Ti键[37],953 cm−1处出现的微小吸收峰可归属于Ti—O—Si键[38-39]。曲线a在3000~3400 cm−1之间强而宽的吸收峰以及1636 cm−1处的峰,可分别归属于60℃干燥后气凝胶中Si—OH的特征吸收,1100℃煅烧后(曲线b),该特征峰显著减弱;曲线a在1383 cm−1处尖锐的吸收峰可归属于未除去的有机原料的C—H弯曲振动,1100℃煅烧后(曲线b),该特征峰几乎完全消失,表明原料中的烃类化合物完全去除;TMCS改性后(曲线c),1383、2964 cm−1处的吸收峰可分别归属于Si—CH3的弯曲振动和不对称伸缩振动[40],这是因为 TiO2-SiO2纳米复合氧化物表面的—OH被—CH3所取代,也是该表面具备疏水性能的另一重要因素。
2.4 WCA分析
水接触角(WCA)是表征材料疏水性能的重要参数,所谓的超疏水性表面是指与水的接触角大于150°的表面。图6(a)~(c)分别为样品TS5气凝胶在60℃干燥、1100℃煅烧和TMCS改性后的水接触角图像,3个样品测得的水接触角分别为 59.6°[图6(a)]、72.5°[图6(b)]和154.7°[图6(c)]。气凝胶在60℃干燥后,具有一定亲水性,但其亲水性并不强。从FTIR光谱看,虽然60℃干燥后的气凝胶(图5曲线a)表面有大量—OH,但生成的产物比表面积大,具有纳米介孔结构,导致水对其表面浸湿相对困难;1100℃煅烧后生成的纳米复合氧化物的微纳结构更规整,加上表面—OH急剧减少,使其亲水性进一步降低;TMCS改性后,由于表面剩余的—OH几乎完全被—CH3所取代,接触角显著增大为154.7°,展现了优异的超疏水性能。

图6 TiO2-SiO2气凝胶(TS5)的水接触角图像Fig.6 Images of WCA of TS5 aerogels
3 结 论
(1)以TEOS为硅源,TTIP为钛源,采用改进的溶胶-凝胶法制备了TiO2-SiO2复合气凝胶,当钛硅摩尔比为5∶1时,1100℃煅烧处理得到金红石型TiO2-SiO2纳米复合氧化物,最后经TMCS表面改性,制备了超疏水性能优异的金红石型 TiO2-SiO2纳米复合氧化物,其比表面积达348 m2·g−1,水接触角达到154.7°。
(2)改进的溶胶-凝胶法因具有工艺简单、反应条件温和、可控性强等优点,容易实现规模生产,在构建具有纳微分层结构的外墙装饰材料的面漆方面具有潜在的应用前景,可显著提高建筑物外墙装饰材料的热稳定性、耐候性、耐污性和自清洁性能。
[1]CHU Z L, SEEGER S. Superamphiphobic surfaces [J]. Chem. Soc. Rev., 2014, 43(8): 2784-2798.
[2]YU S, GUO Z G, LIU W M. Biomimetic transparent and superhydrophobic coatings: from nature and beyond nature [J]. Chem. Commun., 2015, 51(10): 1775-1794.
[3]纪拓, 陈献富, 季兴宏, 等. Al2O3@TiO2复合生物载体的制备及其BSA吸附特性[J]. 化工学报, 2014, 65(5): 1920-1927. JI T, CHEN X F, JI X H, et al. Preparation of Al2O3@TiO2biological composite support and adsorption of bovine serum albumin [J]. CIESC Journal, 2014, 65(5): 1920-1927.
[4]倪金雷, 彭若帆, 童少平, 等. 不同物相TiO2对H2O2/O3氧化效能的影响[J]. 化工学报, 2015, 66(10): 3950-3956. NI J L, PENG R F, TONG S P, et al. Effect of TiO2crystal phase on oxidation efficiency of H2O2/O3[J]. CIESC Journal, 2015, 66(10): 3950-3956.
[5]ZHANG P, LV F Y. A review of the recent advances insuperhydrophobic surfaces and the emerging energy-related applications [J]. Energy, 2015, 82: 1068-1087.
[6]RAO A V, PAJONK G M, BHAGAT S D, et al. Comparative studies on the surface chemical modification of silica aerogels based on various organosilane compounds of the type RnSiX4−n[J]. J. Non-Cryst. Solids, 2004, 350(350): 216-223.
[7]CAO S L, YAO N, YEUNG K L. Synthesis of freestanding silica and titania-silica aerogels with ordered and disordered mesopores [J]. J. Sol-Gel Sci. Techn., 2008, 46(3): 323-333.
[8]RAO A P, RAO A V, PAJONK G M. Hydrophobic and physical properties of the ambient pressure dried silica aerogels with sodium silicate precursor using various surface modification agents [J]. Appl. Surf. Sci., 2007, 253(14): 6032-6040.
[9]CAO S L, YEUNG K L, YUE P L. An investigation of trichloroethylene photocatalytic oxidation on mesoporous titania-silica aerogel catalysts [J]. Appl. Catal. B: Environ., 2007, 76(1/2): 64-72.
[10]SCHMIDT M, SCHWERTFEGER F. Applications for silica aerogel products [J]. J. Non-Cryst. Solids, 1998, 225(1): 364-368.
[11]CHEN X, MAO S S. Titanium dioxide nanomaterials: synthesis, properties, modifications, and applications [J]. Chem. Rev., 2007, 107(7): 2891-2959.
[12]SCHAEFER D W, KEEFER K D. Structure of random porous materials: silica aerogel [J]. Phys. Rev. Lett., 1986, 56(20): 2199-2202.
[13]YAO N, CAO S L, YEUNG K L. Mesoporous TiO2-SiO2aerogels with hierarchal pore structures [J]. Micropor. Mesopor. Mat., 2009, 117(3): 570-579.
[14]RAO A P, RAO A V, PAJONK G M. Hydrophobic and physical properties of the two step processed ambient pressure dried silica aerogels with various exchanging solvents [J]. J. Sol-Gel Sci. Techn., 2005, 36(3): 285-292.
[15]BHAGAT S D, RAO A V. Surface chemical modification of TEOS based silica aerogels synthesized by two step (acid-base) sol-gel process [J]. Appl. Surf. Sci., 2006, 252(12): 4289-4297.
[16]DARMANIN T, GUITTARD F. Recent advances in the potential applications of bioinspired superhydrophobic materials [J]. J. Mater. Chem. A, 2014, 2: 16319-16359.
[17]BAIJU K V, PERIYAT P, PILLAI P K, et al. Enhanced photoactivity and anatase thermal stability of silica-alumina mixed oxide additives on sol-gel nanocrystalline titania [J]. Mater. Lett., 2007, 61(8/9): 1711-1755.
[18]IANNAZZO V, NERI G, GALVAGNO S, et al. Oxidative dehydrogenation of isobutane over V2O5-based catalysts prepared by grafting vanadyl alkoxides on TiO2-SiO2supports [J]. Appl. Catal. A Gen., 2003, 246(1): 49-68.
[19]LI Z J, HOU B, XU Y, et al. Hydrothermal synthesis, characterization, and photocatalytic performance of silica-modified titanium dioxide nanoparticles [J]. J. Colloid Interf. Sci., 2005, 288(1): 149-154.
[20]HONG S S, LEE M S, PARK S S, et al. Synthesis of nano-sized TiO2/SiO2particles in the microemulsion and their photocatalyticactivity on the decomposition of p-nitrophenol [J]. Catal. Today, 2003, 87(1/2/3/4): 99-105.
[21]WEI W, LU X M, JIANG D, et al. A novel route for synthesis of UV-resistant hydrophobic titania-containing silica aerogels by using potassium titanate as precursor [J]. Dalton T., 2014, 43(25): 9456-9467.
[22]PINHO L, MOSQUERA M J. Photocatalytic activity of TiO2-SiO2nanocomposites applied to buildings: influence of particle size and loading [J]. Appl. Catal. B: Environ., 2013, 134/135(17): 205-221.
[23]KIM Y N, SHAO G N, JEON S J, et al. Sol-gel synthesis of sodium silicate and titanium oxychloride based TiO2-SiO2aerogels and their photocatalytic property under UV irradiation [J]. Chem. Eng. J., 2013, 231(9): 502-511.
[24]XU L Y, ZHU D D, LU X M, et al. Transparent, thermally and mechanically stable superhydrophobic coating prepared by an electrochemical template strategy [J]. J. Mater. Chem. A, 2015, 3(7): 3801-3807.
[25]ZHOU F, LIANG K M, WANG G L, et al. Crystallization behavior of Li+-doped SiO2-TiO2films perpared by sol-gel dip coating [J]. J. Cryst. Growth, 2004, 264(1/2/3): 297-301.
[26]ZHAO L, YU J G, CHENG B. Preparation and charactertion of SiO2/TiO2composite microspheres with microporous SiO2core/mesoporous TiO2shell [J]. J. Solid State Chem., 2005, 178(6): 1818-1824.
[27]LI Z J, HOU B, XU Y, et al. Comparative study of sol-gel-hydrothermal and sol-gel synthesis of titania-silica composite nanoparticles [J]. J. Solid State Chem., 2005, 178(5): 1395-1405.
[28]KRIVTSOV I, ILKAEVA M, AVDIN V, et al. A hydrothermal peroxo method for preparation of highly crystalline silica-titania photocatalysts [J]. J. Colloid Interf. Sci., 2015, 444: 87-96.
[29]KIBOMBO H S, PENG R, RASALINGAM S, et al. Versatility of heterogeneous photocatalysis: synthetic methodologies epitomizing the role of silica support in TiO2based mixed oxides [J]. Catal. Sci. Technol., 2012, 2: 1737-1766.
[30]LI J Z, ZHONG J B, ZENG J, et al. Improved photocatalytic activity of dysprosium-doped Bi2O3prepared by sol-gel method [J]. Mat. Sci. in Semicon. Proc., 2013, 16(2): 379-384.
[31]LI W C, LU A H, GUO S C. Control of mesoporous structure of aerogels derived from cresol-formaldehyde [J]. J. Colloid Interf. Sci., 2002, 254(1): 153-157.
[32]BHAGAT S D, KIM Y H, SUH K H, et al. Superhydrophobic silica aerogel powders with simultaneous surface modification, solvent exchange and sodium ion removal from hydrogels [J]. Micropor. Mesopor. Mat., 2008, 112(1/2/3): 504-509.
[33]HILONGA A, KIM J K, SARAWADE P B. Titania-silica composites with less aggregated particles [J]. Powder Technol., 2009, 196(3): 286-291.
[34]ZHU J J, XIE J M, LU X M, et al. Synthesis and characterization of superhydrophobic silica and silica/titania aerogels by sol-gel method at ambient pressure [J]. Colloids and Surfaces A: Physicochem. Eng. Aspects, 2009, 342(1/2/3): 97-101.
[35]SHAO G N, ELINEEMA G, QUANG D V, et al. Two step synthesis of a mesoporous titania-silica composite from titanium oxychloride and sodium silicate [J]. Powder Technol., 2012, 217(2): 489-496.
[36]XU Q F, LIU Y, LIN F J, et al. Superhydrophobic TiO2-polymer nanocomposite surface with UV induced reversible wettability and self-cleaning properties [J]. ACS Appl. Mater. Inter., 2013, 5(18):8915-8924.
[37]TANG Q, WANG Y, ZHANG Q, et al. Preparation of metallic cobalt inside NaY zeolite with high catalytic in Fischer-Tropsch synthesis [J]. Catal. Commun., 2003, 4(5):253-258.
[38]WANG F, GUAN Y F, ZHANG S, et al. Hydrophilic modification of silica-titania mesoporous materials as restricted-access matrix adsorbents for enrichment of phosphopeptides [J]. J. Chromatogr. A, 2012, 1246(13): 76-83.
[39]ILKAEVA M, KRIVTSOV I, AVDIN V, et al. Comparative study of structural features and thermal behavior of mixed silica-titania xerogels prepared via the peroxo method and the conventional co-precipitation technique [J]. Colloids and Surfaces A: Physicochem. Eng. Aspects, 2014, 456: 120-128.
[40]RAO A V, GURAV A B, LATTHE S S, et al. Water repellent porous silica films by sol-gel dip coating method [J]. J. Colloid Interf. Sci., 2010, 352(1): 30-35.
Preparation and characterization of superhydrophobic rutile titania-silica nano complex oxides
HOU Leixin1, FANG Li1, YAN Guanghong2, WANG Yongkang2
(1School of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, Shanxi, China;2Shanxi Laslon Coating Company Limited, Jinzhong 030600, Shanxi, China)
Superhydrophobic titania-silica nano complex oxides were synthesized from tetraethylorthosilicate (TEOS) and titanium isopropoxide (TTIP) by an improved sol-gel method followed with high temperature calcination and modification with trimethylchlorosilane (TMCS). The obtained nano complex oxides were characterized by XRD, XPS, BET, SEM and FTIR, and water contact angle. Crystal polymorphism of the nano complex oxides was investigated to explore influence of titania-silica molar ratio as well as calcination temperature on crystal structure. The results showed that rutile crystal structure was achieved at titania-silica molar ratio of 5∶1 and calcination temperature of 1100℃. After TCMS surface modification, the superhydrophobic rutile TiO2-SiO2nano complex oxides exhibited large specific surface area (up to 348 m2·g−1) and excellent hydrophobicity (water contact angle of 154.7°), which could have a potential application for constructing micro-nano hierarchy-structured top coating of outside wall-decorating materials.
superhydrophobicity; sol-gel; titania-silica complex oxides; nanoparticles; preparation; sintering; rutile
Prof. FANG Li, fangli@sxu.edu.cn
O 648
:A
:0438—1157(2017)01—0444—08
10.11949/j.issn.0438-1157.20160782
2016-06-06收到初稿,2016-10-03收到修改稿。
联系人:方莉。
:侯磊鑫(1990—),男,硕士研究生。
国家科技支撑计划项目(2013BAC14B05);山西省自然科学基金重点项目(2014011003-1);山西省科技创新项目(2014101011)。
Received date: 2016-06-06.
Foundation item: supported by the National Key Technology Research and Development Program of the Ministry of Science and Technology of China (2013BAC14B05), the Key Project of the Natural Science Foundation of Shanxi Province (2014011003-1) and the Science and Technology Innovation Project of Shanxi Province (2014101011).
——以金红石为例

