硫铝酸钙的氧化铝溶出性能
楚维钦,张学政,马东东,孙会兰,王波
(河北科技大学材料科学与工程学院,河北省材料近净成形技术重点实验室,河北 石家庄 050018)
硫铝酸钙的氧化铝溶出性能
楚维钦,张学政,马东东,孙会兰,王波
(河北科技大学材料科学与工程学院,河北省材料近净成形技术重点实验室,河北 石家庄 050018)
使用分析纯CaCO3、Al2O3与CaSO4·2H2O配料,在1375℃、保温2 h的条件下合成了纯物相硫铝酸钙3CaO·3Al2O3·CaSO4(C4A3S),对其物相组成和微观形貌进行了表征。并探究了碳碱浓度、苛碱浓度、溶出温度、溶出时间、粒度等因素对C4A3S氧化铝溶出性能的影响。结果表明:C4A3S的氧化铝溶出性能随着碳碱与苛碱浓度的增加先提高,之后趋于稳定。粒度越小,溶出率越高。与七铝酸十二钙12CaO·7Al2O3(C12A7)相比,C4A3S的孔洞状结构使其氧化铝更易溶出,在10 min时氧化铝溶出率即达到98%以上,且溶出所需的碳碱浓度与溶出温度均低于C12A7。在最佳条件:碳碱80 g·L−1、苛碱10 g·L−1、溶出温度80℃、溶出时间10 min下,C4A3S的氧化铝溶出率为98.76%。
硫铝酸钙;氧化铝;溶出;高硫铝土矿
引 言
近年来,我国的氧化铝工业得到了快速的发展[1]。产量由2005年的859.22万吨增加到2014年的4777万吨,产能出现过剩现象,且产量将会继续上升[2]。与此同时,也出现了一系列的问题,如:铝土矿资源不足、矿石品位下降、生产成本增加等,因此开发可利用铝资源并实现资源的综合利用具有重要的意义[3-4]。并且当前以及今后的研究重点还应该包括高硫铝土矿的选矿脱硫技术研究[5]。国内外已开展了针对以粉煤灰、赤泥、铁铝共生矿、高硫铝土矿等为原料生产氧化铝的研究[6-11]。
处理中低品位矿主要采用石灰烧结法,该方法具有碱耗低、回收率高并可实现干法烧结等优点[12]。采用石灰烧结法从炉渣中提取氧化铝的研究中的主要含铝物相为 C12A7,研究发现其具有较好的氧化铝溶出性能,但存在钙铝配比较高、物料流量大、渣量大等问题[13-14]。在石灰烧结法处理粉煤灰的过程中发现熟料的氧化铝溶出率较高,但分析其含铝物相并非以C12A7的形式存在,而是以C4A3S的形式存在于熟料中。Goodboy[15]在其研究过程中也发现C4A3S会形成于烧结过程中,具有相对较好的氧化铝溶出性能。该工艺是基于石灰烧结法开展的,能够实现干法烧结,烧结过程仅添加石灰石即可,碳分母液只在湿法过程循环,不需要蒸发返回烧结配料;在脱硅工序中增加脱硫环节,以消除硫元素在母液中循环问题。科研工作者针对 C4A3S的形成机制及其热力学与动力学开展了一系列的工 作[16-18],确定了 C4A3S 的生成反应:但这些研究主要是应用于水泥方面,集中在C4A3S的固硫特性上[19],关于其氧化铝溶出性能方面的研究鲜见报道。另外,C4A3S取代C12A7作为主要含铝物相使C/A(CaO与Al2O3的物质的量之比)从1.71降到1.33,可以减少石灰配入量和渣量,实现低钙铝比下高氧化铝溶出。因此本文针对C4A3S在碱性溶液中的氧化铝溶出规律开展了系统的研究,以期为粉煤灰、含硫铝土矿等高硫矿物生产氧化铝提供理论依据。
1 实验材料和方法
1.1 原料
分析纯CaCO3、Al2O3、CaSO4·2H2O作为烧结原料,分析纯Na2CO3与NaOH配制的碱液作为溶出用调整液。
1.2 实验仪器
实验用仪器:KSL-1700X-A2箱式高温烧结炉、恒温水浴箱、SFM-1行星式球磨机、行星式混料机。分析用仪器:D/MAX-2500型 X射线分析仪(Rigaku),S-4800-I型扫描电子显微镜(HITACHI),MS2000激光粒度分析仪(Malvern)。
1.3 溶出样品处理
将分析纯CaCO3、Al2O3与CaSO4·2H2O按照C4A3S化学式中的摩尔比3:3:1称料,并用行星式混料机在130 r·min−1的转速下混匀2 h备用。将混匀的生料在1375℃下保温2 h进行烧结,待温度降至200℃后取出熟料。烧结后熟料一部分在SFM-1行星式球磨机下研磨至粒度74 μm以下,并进行XRD分析以及氧化铝溶出实验。
1.4 C4A3S的氧化铝溶出
本实验采用碱性溶出的方法。其溶出反应方程式为
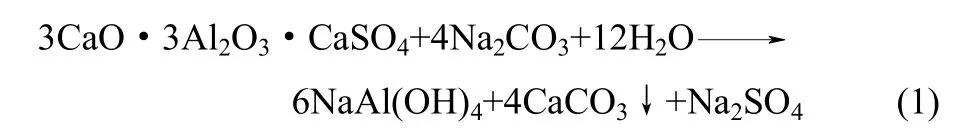
将烧结熟料在恒温水浴箱中进行溶出实验,采用三口烧瓶作为溶出容器,瓶口接有循环冷凝水。实验时先将调整液预热到相应的温度,加入烧结熟料,计时溶出。溶出条件:碳碱浓度(NC)为40~90 g·L−1,苛碱浓度(NK)为2.5~15 g·L−1,溶出温度为60~90℃,溶出时间为5~30 min,液固比(L/S)为10,转速400 r·min−1。用EDTA滴定法分析滤液中Al2O3的含量,按式(2)计算Al2O3溶出率

2 结果与讨论
2.1 C4A3S的合成
将烧结后熟料一部分研磨至 74 μm以下进行XRD分析,分析其物相组成,扫描范围10°~80°,扫描速度2(°)·min−1,结果如图1所示。另取一部分块状熟料进行打磨、腐蚀、喷金处理,并进行SEM分析,结果如图2所示。
由图1可知在1375℃,保温2 h条件下可合成纯物相C4A3S。由图2的SEM结果可知C4A3S的微观形貌上存在一定的沟壑与孔洞状结构,有利于与液体的充分接触,从而可提高液固的反应速率。
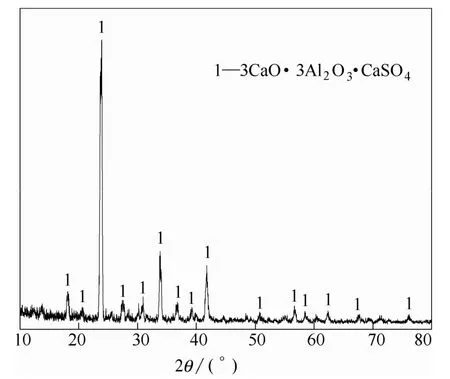
图1 1375℃保温2 h熟料XRD谱图Fig.1 XRD pattern of clinker at 1375℃ for 2 h

图2 C4A3S的SEM图Fig.2 SEM image of C4A3S
2.2 C4A3S的氧化铝溶出
2.2.1 溶出温度的影响 在NC为80 g·L−1,NK为10 g·L−1,L/S为10,转速400 r·min−1,溶出时间 30 min,溶出温度 60~90℃条件下,对 C4A3S进行氧化铝溶出实验,考察溶出温度对其氧化铝溶出性能的影响。
由图3可知随着溶出温度的增加,C4A3S的溶出率逐渐增大。在溶出温度80℃时,C4A3S的氧化铝溶出率达到98.7%,之后上升趋势变缓。在80℃同等溶出条件下 C12A7的氧化铝溶出率最高为93.30%[20]。由此可知,C4A3S与Na2CO3的反应性能优于C12A7。
2.2.2 碳碱浓度的影响 在溶出条件NC为40~90 g·L−1,NK为10 g·L−1,L/S为10,转速400 r·min−1,溶出时间30 min,溶出温度80℃条件下,考察碳碱浓度对C4A3S氧化铝溶出性能的影响,结果如图4所示。
根据反应方程式(1)计算得知,碳碱反应浓度为70 g·L−1时刚好足量,因此随着碳碱浓度的增加,C4A3S氧化铝溶出率先增加后趋于平稳。在碳碱浓度过量为80 g·L−1时,其氧化铝溶出率已基本达到最大值98.76%,而C12A7在80~120 g·L−1范围内才能达到平衡,且其在120 g·L−1时的氧化铝溶出率最大为92.46%[13]。

图3 溶出温度对C4A3S氧化铝溶出率的影响Fig.3 Effect of leaching temperature on alumina leaching ratio of C4A3S
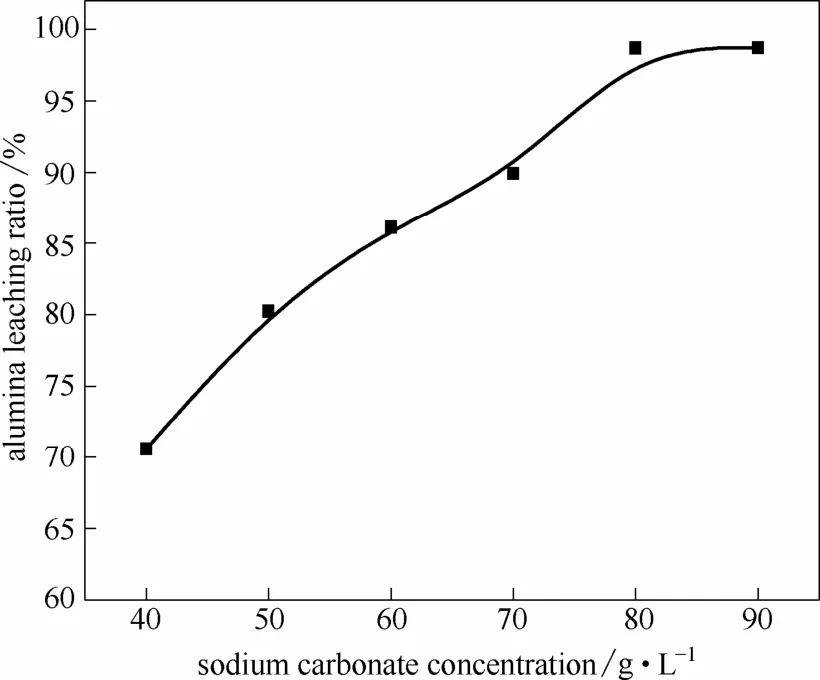
图4 碳碱浓度对C4A3S氧化铝溶出率的影响Fig.4 Effect of sodium carbonate concentration on alumina leaching ratio of C4A3S
2.2.3 苛碱浓度的影响 在NC为8 g·L−1,溶出温度为 80℃,溶出时间 30 min,搅拌速度 400 r·min−1,L/S为10的条件下考察苛碱浓度对C4A3S氧化铝溶出性能的影响,结果如图5所示。
由图5可知,不加苛碱时,C4A3S的氧化铝溶出率为71.63%,溶出率较低,加入苛碱后,溶出率迅速增加,提高到94%,继续增加苛碱浓度,氧化铝溶出率继续增加,但增幅减小,当苛碱浓度增加至10 g·L−1后,氧化铝溶出率已基本达到最佳值,继续增加,溶出率已基本无明显变化。对调整液中不加苛碱和加入苛碱后的溶出渣进行XRD分析,结果如图6与图7所示。

图5 苛碱浓度对C4A3S氧化铝溶出性能的影响Fig.5 Effect of alkali concentration on alumina leaching ratio of C4A3S

图6 NK=0 g·L−1的溶出渣XRD谱图Fig.6 XRD pattern of leaching residue (NK=0)
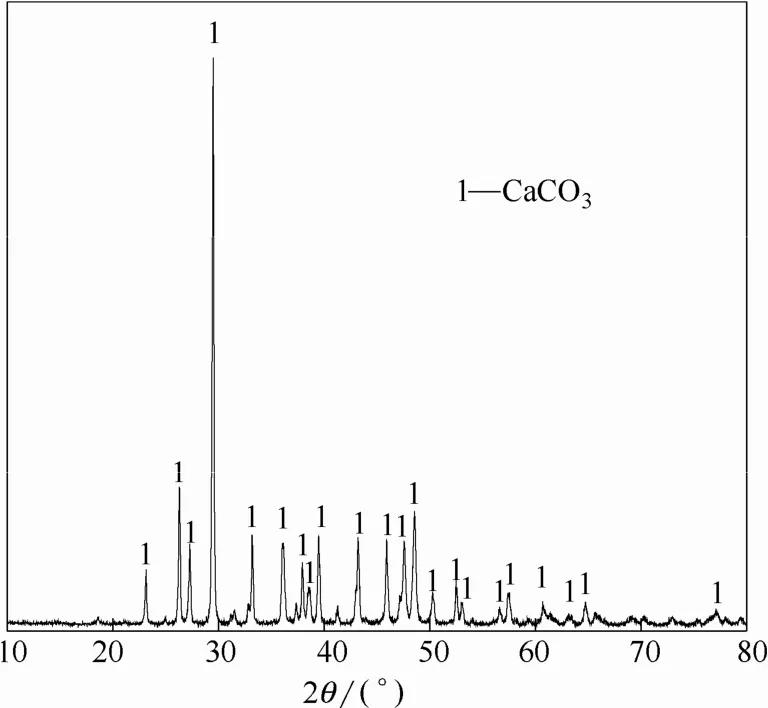
图7 NK=10 g·L−1的溶出渣XRD谱图Fig.7 XRD spectrum of leaching residue(NK=10 g·L−1)
对比图6、图7可知,不加苛碱时,溶出渣的主要成分为CaCO3与Al(OH)3,加入苛碱后溶出渣中则全部为CaCO3,由此可知,不加苛碱时铝酸钠溶液发生了分解,其分解反应方程式为
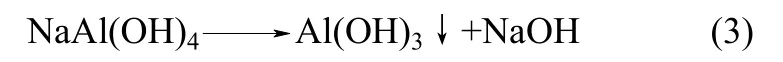
对不同苛碱浓度的αK(苛性钠与氧化铝的分子比)进行分析计算,结果如表1所示。使用苛碱浓度为10 g·L−1的调整液溶出后,对其溶出渣进行了化学成分分析,结果如表2所示。

表1 不同苛碱浓度下溶出液的分子比αKTable 1 Molecular ratio αKof solution with different concentration of alkali dissolution
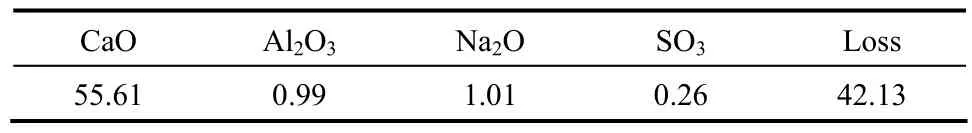
表2 溶出渣的化学成分Table 2 Chemical components of leaching residue/%
由表1可知随着调整液中苛碱浓度的增加,分子比αK逐渐增大。结合图5中C4A3S的氧化铝溶出率逐渐增加可知,随着αK的增大,生成的铝酸钠溶液越来越稳定。αK=1.0时,铝酸钠溶液不稳定极易分解;在NK=10 g·L−1时,αK=1.26,溶液稳定,氧化铝溶出率已基本不在改变。
根据图7知,渣中存在单一物相CaCO3,不存在 CaSO4,且根据硫酸钡重量法测定出溶出液中的浓度为0.047 mol·L−1,与理论计算得到的浓度0.048 mol·L−1极为接近,因此硫元素基本全部以的形式存在与溶出液中,仅有少量未反应的C4A3S中的硫残余在溶出渣中(表2)。符合1.4节中提出的C4A3S的氧化铝溶出反应方程式(1)。
2.2.4 溶出时间的影响 在NC为80 g·L−1,NK为10 g·L−1,溶出温度为80℃,搅拌速度400 r·min−1,L/S为10,考察了不同溶出时间的影响,结果如图8所示。
从图8中可看出,在10 min时C4A3S的氧化铝溶出率已达到98.41%,已基本达到最大值。随着溶出时间的继续延长,C4A3S的氧化铝溶出率已无明显变化。因此,可知C4A3S与Na2CO3的液固反应的表面化学反应过程迅速。结合图 2,C4A3S的微观形貌上存在一定的沟壑以及疏松的孔洞状结构,能够充分增加液固的接触面积,从而使反应速率加快,反应更充分。故C4A3S的氧化铝溶出反应在短时间即可完成。而对于C12A7而言,其在高碳碱溶液中,80℃、10 min条件下C12A7的氧化铝溶出率仅为 78%左右,并且其最佳溶出时间为 120 min[13,21]。故C4A3S相比于C12A7更易于和Na2CO3反应,更利于氧化铝的提取,并且起到了固硫的作用。

图8 溶出时间对C4A3S氧化铝溶出率的影响Fig.8 Effect of leaching time on alumina leachingratio of C4A3S
采用激光粒度仪分析了熟料和溶出时间为 10 min时溶出渣的粒度分布和比表面积。结果如表 3和图9所示。

表3 熟料与溶出渣的物性参数Table 3 Physical property parameters of clinker and residue
由粒度分析结果可知,熟料的粒度分布在10~90 μm之间,且主要集中在20~80 μm之间,中位径为34.14 μm。熟料溶出以后,得到的溶出渣粒度出现小幅的增大,比表面积降低,中位径增大到41.22 μm。
熟料的溶出反应为液固反应,反应过程中有不溶物CaCO3生成,并附着在颗粒表面,反应物内核不断收缩。在反应过程中,颗粒总体积的变化情况与反应物、产物的密度及化学计量系数有关。已知C4A3S的密度为2.61 g·cm−3,CaCO3密度为2.71 g·cm−3。反应时产物CaCO3和反应物C4A3S的体积变化为
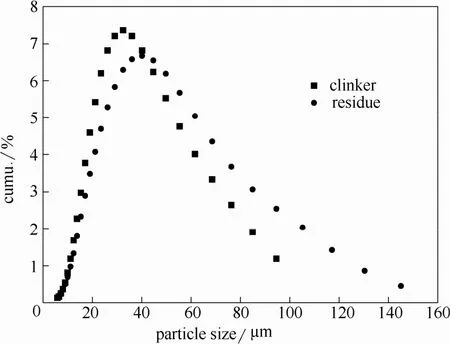
图9 熟料与溶出渣的粒度组成Fig.9 Particle size of clinker and leaching residue

因此,
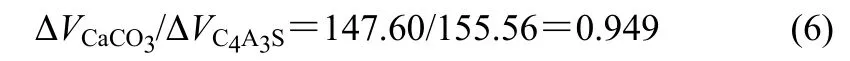
相应的半径变化之比为

可见,反应前后颗粒半径基本不变。溶出渣的粒度相对于熟料略有增加,主要是由于在反应过程中存在一定的团聚现象。
2.2.5 熟料粒度的影响 在NC为80 g·L−1,NK为10 g·L−1,溶出温度为80℃,溶出时间10 min,搅拌速度400 r·min−1,L/S为10,对熟料进行了粒度分级,并考察了反应物粒度对C4A3S氧化铝溶出性能的影响。结果如图10所示。

图10 反应物粒度对C4A3S氧化铝溶出率的影响Fig.10 Effect of particle size on alumina leaching ratio of C4A3S
由图10可知,粒度对C4A3S氧化铝溶出率影响较大,粒度越小,溶出率越高。熟料粒度达到148 μm后,溶出率即可达到91%以上。结合图2,C4A3S的形貌使其极易与碱液反应,在74 μm以下即可基本反应完全达到97.5%,继续减小粒度,熟料的氧化铝溶出率基本上不再变化。
3 结 论
(1)C4A3S的氧化铝溶出率随碳碱浓度与温度的升高先增加后稳定,且与C12A7相比,所需的碳碱量明显减少。
(2)调整液中不加苛碱时αK=1.0,溶液极易水解,在NK=10 g·L−1时,αK=1.26,溶液已基本稳定。
(3)C4A3S的疏松孔洞状结构增加了液固反应比表面积和反应活性,从而使得C4A3S的氧化铝在短时间内即可全部溶出,与C12A7相比大大缩短了溶出时间。
(4)C4A3S在最佳溶出条件NC80 g·L−1、NK10 g·L−1、溶出温度80℃、溶出时间10 min、粒度小于74 μm、液固比10时,氧化铝溶出率高达98.76%,高于C12A7的最佳溶出率93.30%。
符 号 说 明
m ——熟料的质量,g
V溶出液——溶出液体积,L
V调整液——溶出前调整液的体积,L
ηAl2O3——氧化铝溶出率,%
ρ溶出液——溶出液中Al2O3含量,g·L−1
ρ调整液——溶出前溶液中的Al2O3含量,g·L−1
ω ——熟料中Al2O3的含量(质量分数),%
[1]张佰永, 姜跃华, 郭沈, 等. 中国铝土矿资源变化对世界氧化铝工业格局的影响[J]. 轻金属, 2014, (7): 1-5. ZHANG B Y, JIANG Y H, GUO S, et al. The influence of bauxite resource change in China on layout of world alumina industry[J]. Light Metal, 2014, (7): 1-5.
[2]朱妍, 霍云波, 郭秋影. 氧化铝市场分析与展望[J]. 中国金属通报, 2013, (4): 27-29. ZHU Y, HUO Y B, GUO Q Y. Analysis and prospect of alumina market[J]. China Metal Bulletin, 2013, (4): 27-29.
[3]顾松青. 我国的铝土矿资源和高效低耗的氧化铝生产技术[J]. 中国有色金属学报, 2004, 14(S1): 91-97. GU S Q. Alumina production technology with high efficiency and low consumption from Chinese bauxite resource[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(S1): 91-97.
[4]杨静, 蒋周青, 马鸿文, 等. 中国铝资源与高铝粉煤灰提取氧化铝研究进展[J]. 地学前缘, 2014, 21(5): 313-324. YANG J, JIANG Z Q, MA H W, et al. The bauxite resource in China and advances in the techniques of extracting alumina from high-alumina coal fly ash[J]. Earth Science Frontiers, 2014, 21(5): 313-324.
[5]王祝堂. 浅析中国氧化铝工业技术发展方向[J]. 中国有色建设, 2013, (3): 40-41. WANG Z T. Analysis on the development trend of Chinese alumina industry[J]. China Nonferrous Construction, 2013, (3): 40-41.
[6]李来时, 翟玉春, 秦晋国, 等. 以粉煤灰为原料制备高纯氧化铝[J].化工学报, 2006, 57(9): 2189-2193. LI L S, ZHAI Y C, QIN J G, et al. Extracting high-purity alumina from fly ash[J]. Journal of Chemical Industry and Engineering(China), 2006, 57(9): 2189-2193.
[7]MOLDOVEANU G A, PAPANGELAKIS V G. Recovery of rare earth elements adsorbed on clay minerals(Ⅱ): Leaching with ammonium sulfate[J]. Hydrometallurgy, 2013, 131/132: 158-166.
[8]YAO Z T, XIA M S, SARKER P K, et al. A review of the alumina recovery from coal fly ash, with a focus in China[J]. Fuel, 2014, 120: 74-85.
[9]鲁桂林, 迟松江, 毕诗文. 赤泥中氧化铝和氧化铁的浸出[J]. 材料与冶金学报, 2010, 9(1): 31-34. LU G L, CHI S J, BI S W. Leachiing of alumina and iron oxide from red mud[J]. Journal of Materals and Metallurgy, 2010, 9(1): 31-34.
[10]王佳东, 翟玉春, 申晓毅. 碱石灰烧结法从脱硅粉煤灰中提取氧化铝[J]. 轻金属, 2009, (6): 14-16. WANG J D, ZHAI Y C, SHEN X Y. Extracting Al2O3from desiliconized fly ash with alkali lime sintering process[J]. Light Metal, 2009, (6): 14-16.
[11]张佰永, 周凤禄. 粉煤灰石灰石烧结法生产氧化铝的机理探讨[J].轻金属, 2007, (6): 17-18, 27. ZHANG B Y, ZHOU F L. The limestone sintering process to produce alumina with fly ash[J]. Light Metal, 2007, (6): 17-18, 27.
[12]李殷泰, 毕诗文, 段振瀛, 等. 关于广西贵港三水铝石型铝土矿综合利用工艺方案的探讨[J]. 轻金属, 1992, (9): 6-14. LI Y T, BI S W, DUAN Z Y, et al. Discussion on the comprehensive process of gibbsite bauxite in Guangxi[J]. Light Metal, 1992, (9): 6-14.
[13]孙会兰, 涂赣峰, 毕诗文, 等. 七铝十二钙的合成及其在高碳钠铝酸钠溶液中的溶出性能[J]. 轻金属, 2007, (11): 17-19. SUN H L, TU G F, BI S W, et al. Synthesizati on of C12A7and its leaching property in sodium aluminate solution with high-Na2OC[J]. Light Metal, 2007, (11): 17-19.
[14]王波, 宗书凤, 孙会兰, 等. 钙铝比对 11.3CaO·7Al2O3微观结构及其溶出性能的影响[J]. 化工学报, 2014, 65(10): 4183-4190. WANG B, ZONG S F, SUN H L, et al. Influence of calcium/aluminum ratio on microstructure and leaching of 11.3CaO·7Al2O3[J]. CIESC Journal, 2014, 65(10): 4183-4190.
[15]GOODBOY K P. Investigation of a sinter process for extraction of Al2O3from coal wastes[J]. Metallurgical and Materials Transactions B, 1976, 7(4): 716-718.
[16]马素花, 沈晓冬, 黄叶平, 等. 无水硫铝酸钙的合成及形成机制[J].硅酸盐学报, 2008, 36(1): 78-81. MA S H, SHEN X D, HUANG Y P, et al. Preparation and formation mechanism of calcium sulphoaluminate[J]. Journal of the ChineseCeramic Society, 2008, 36(1): 78-81.
[17]杨天华, 李润东, 周俊虎, 等. 高温固硫物相硫铝酸钙生成反应热力学研究[J]. 热力发电, 2006, (6): 6-9. YANG T H, LI R D, ZHOU J H, et al. Formation thermodynamics of high-temperature phase sulphoaluminate[J]. Thermal Power Generation, 2006, (6): 6-9.
[18]杨天华, 李润东, 周俊虎, 等. 高温固硫物相硫铝酸钙生成动力学[J]. 化工学报, 2006, 57(10): 2327-2331. YANG T H, LI R D, ZHOU J H, et al. Formation kinetics of high-temperature phase sulphoaluminate[J]. Journal of Chemical Industry and Engineering(China), 2006, 57(10): 2327-2331.
[19]王丽, 李金洪, 杨静. 高温固硫物相硫铝酸钙在不同气氛下的动力学实验研究[J]. 矿物岩石, 2009, 29(3): 23-28. WANG L, LI J H, YANG J. Study on the kinetics of high temperature solid phase calcium aluminate under different atmosphere[J]. Journal of Mineral and Petrology, 2009, 29(3): 23-28.
[20]于海燕, 王波, 潘晓林, 等. 12CaO·7Al2O3晶体结构及其氧化铝浸出性能[J]. 工程科学学报, 2015, 37(1): 30-34. YU H Y, WANG B, PAN X L, et al. Crystal structure and Al2O3leaching properties of 12CaO·7Al2O3[J]. Chinese Journal of Engineering, 2015, 37(1): 30-34.
[21]孙会兰, 于海燕, 王波, 等. 12CaO·7Al2O3溶出动力学[J]. 中国有色金属学报, 2008, 18(10): 1920-1925. SUN H L, YU H Y, WANG B, et al. Leaching dynamics of 12CaO·7Al2O3[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(10): 1920-1925.
Alumina leaching properties of calcium sulphoaluminate
CHU Weiqin, ZHANG Xuezheng, MA Dongdong, SUN Huilan, WANG Bo
(School of Material Science and Engineering, Hebei Key Laboratory of Material Near-Net Forming Technology, Hebei University of Science and Technology, Shijiazhuang 050018, Hebei, China)
Analytically pure carbonate calcium, alumina and dihydrate calcium sulfate were used to synthesize calcium sulphoaluminate (3CaO·3Al2O3·CaSO4, C4A3S) at 1375℃ for 2 h. The phase compositions and microstructure were characterized. The effects of carbon alkali concentration, alkali concentration, leaching temperature, leaching time and particle sizes on the alumina leaching properties of C4A3S were explored. The results show that the alumina leaching ratio of C4A3S increases with the increase of concentration of sodium carbonate and alkali, then trends to stable. The leaching ratio becomes higher when the particle size of clinker decreases. Compared with 12CaO·7Al2O3(C12A7), the alumina of C4A3S is easier to be dissolved because of its porous structure, and the alumina leaching ratio is up to 98% under 10 min leaching. The concentration of sodium carbonate and the dissolution temperature of C4A3S is lower than that of C12A7. The alumina leaching ratio of C4A3S could reach 98.76% under the optimum conditions: sodium carbonate 80 g·L−1, alkali 10 g·L−1, dissolution temperature 80℃ and dissolution time 10 min.
calcium sulphoaluminate; alumina; leaching; high-sulfur bauxite
WANG Bo, wangbo1996@gmail.com
TF 803.21
:A
:0438—1157(2017)01—0460—07
10.11949/j.issn.0438-1157.20160452
2016-04-07收到初稿,2016-10-22收到修改稿。
联系人:王波。
:楚维钦(1991—),女,硕士研究生。
国家自然科学基金项目(51104053);河北省自然科学基金项目(E2016208107);河北省高等学校科学技术研究项目(BJ2016023, QN2015002)。
Received date: 2016-04-07.
Foundation item: supported by the National Natural Science Foundation of China (51104053), the Natural Science Foundation of Hebei Province (E2016208107) and the Science Foundation of University of Hebei Province (BJ2016023, QN2015002).

