茉莉酸甲酯对重瓣玫瑰抗虫生理指标和双斑萤叶甲取食的影响1)
严俊鑫 许凌欣 宇佳 张永强 迟德富
(东北林业大学,哈尔滨,150040)
茉莉酸甲酯对重瓣玫瑰抗虫生理指标和双斑萤叶甲取食的影响1)
严俊鑫 许凌欣 宇佳 张永强 迟德富
(东北林业大学,哈尔滨,150040)
喷施不同浓度的茉莉酸甲酯(MeJA),研究其对重瓣玫瑰(Rosarugosa‘Plena’)抗虫生理指标和双斑萤叶甲(Monoleptahieroglyphica(Motschulsky))取食的影响。结果表明:不同浓度的MeJA处理对重瓣玫瑰过氧化物酶(POD)、多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)活性及缩合单宁、总酚质量分数影响明显,能不同程度减少双斑萤叶甲取食叶面积。0.5 mmol·L-1MeJA在第1、3、5、7天诱导的POD活性显著高于其他浓度诱导的;0.5 mmol·L-1MeJA诱导了较高的PPO活性,在第3、5天诱导的PPO活性显著高于其他浓度诱导的;1.0 mmol·L-1的MeJA诱导了较高的PAL活性,在第1、3、5、7、9天诱导的PAL活性显著高于其他浓度诱导的;1.0 mmol·L-1MeJA在第1、3、5、7、9天诱导的缩合单宁质量分数显著高于其他浓度诱导的;1.0 mmol·L-1MeJA诱导的总酚质量分数在第3、7、9天显著高于其他浓度诱导的。双斑萤叶甲取食0.5、1.0 mmol·L-1MeJA诱导的叶片面积在实验期间均极显著低于对照。MeJA诱导重瓣玫瑰抵御双斑萤叶甲取食的适宜浓度为0.5、1.0 mmol·L-1。
茉莉酸甲酯;重瓣玫瑰;抗虫;双斑萤叶甲
By sparying different concentrations of methyl jasmonate (MeJA) onRosarugosa‘Plena’, we investigated the effects of MeJA on the insect-resistant physiological indexes ofR.rugosa‘Plena’and the feeding ofMonoleptahieroglyphica. The activities of POD, PPO and PAL, the content of condensed tannins and total phenols were influenced obviously by MeJA inducing. After sparying MeJA, the area of leaves onR.rugosa‘Plena’ fed byM.hieroglyphica(Motschulsky) were significantly reduced. Compared with other concentrations, induced by 0.5 mmol/L of MeJA, the activities of POD were significantly higher at the 1 st, 3 rd, 5 th and 7 th day after treatment. Induced by 0.5 mmol/L of MeJA, the activities of PPO reached their maximal level, and the activities of PPO were significantly higher on the 3 rd, 5 th day than that treated by the other concentrations of MeJA. The activities of PAL reached their maximal level after inducing by 1 mmol/L of MeJA, and the activities of PAL were significantly higher than that treated by the other concentrations on 1 st, 3 rd, 5 th, 7 th and 9 th day after treating. Induced by 1 mmol/L of MeJA, the contents of condensed tannins were higher significantly at the 1 st, 3 rd, 5 th, 7 th and 9 th day. Induced by 1 mmol·L-1of MeJA, the contents of condensed tannins were significantly higher than other concentrations at the 1 st, 3 rd, 5 th, 7 th and 9 th day after treating. Induced by 1 mmol·L-1of MeJA, the contents of total phenols were significantly higher than that treated by the other concentrations at the 1 st, 3 rd, 7 th and 9 th day after treating. Compared with that of control, the area of leaves onR.rugosa‘Plena’ fed byM.hieroglyphica(Motschulsky) were significantly reduced after treating by 0.5 and 1 mmol/L of MeJA during the whole experiment time. The appropriate concentration of MeJA for treatingR.rugosa‘Plena’ to resist the feeding byM.hieroglyphica(Motschulsky) were 0.5 and 1 mmol/L.
重瓣玫瑰(Rosarugosa‘Plena’)是极具观赏价值和经济价值的园林植物,其花可食用,也是良好的中药材和芳香产品的重要原料[1-2]。生产中,玫瑰常受到虫害侵袭,近年来研究发现,双斑萤叶甲(Monoleptahieroglyphica(Motschulsky))成虫嗜食重瓣玫瑰叶片[3],严重影响植株的正常生长,而普通农药防治会污染环境,影响玫瑰花的药效和食用价值,迫切需求探索环境友好型的虫害防治方法。
植物的诱导抗性是植物在遭到外界损伤或外源特异物质诱导时才表现出来的一种防御反应,从而达到植物保护自身的目的。茉莉酸类化合物是植物内源生长激素,在植物抵御逆境条件和生长发育时起信号传递和激素调节作用[4-6]。有研究表明,茉莉酸类物质能够诱导植物产生防御反应,外源茉莉酸(JA)、茉莉酸甲酯(MeJA)可促使植物产生抗虫防御物质[7],诱导植物产生与虫害为害相似的反应,干扰害虫的行为或生理,抵御害虫为害[8-10]。
在马铃薯(SolanumtuberosumL.)[11]、烟草(NicotianatabacumL.)[12]、番茄(LycopersiconesculentumMill.)[13]等多种农作物中的研究结果表明,MeJA能够把创伤信息传递至植物体内的其他部位,从而激发和启动植物表达防御反应。MeJA能够诱导植株组织内源JA含量系统性和局部的增加,从而通过JA信号途径的应答,促使植物组织内多酚类物质等抗虫物质的含量升高[14-15]。
过氧化物酶(POD)、多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)作为植物次生代谢过程中的3种关键酶,在植物的抗虫防御中起着重要的保护作用[16]。这些酶的变化与植物的抗虫性密切相关,大麦(HordeumvulgareL.)中抗麦二叉蚜(Schizaphisgraminum(Rondani))品种的PAL活性高于感蚜品种[17-18],而植物多酚氧化酶的大量表达,能阻止和影响昆虫取食[19-20]。有研究表明,害虫为害能使植物的POD活性显著上升,表明POD与植物防御反应密切相关[21]。
单宁类化合物对昆虫有忌避防治的作用[22],高浓度的单宁酸甚至导致棉铃虫的死亡[23]。酚类物质是植物次生代谢产物的一个大家族,当植物遭遇外源伤害后在体内产生并积累,有研究表明酚类物质的积累对昆虫和病菌有抑制作用[24-26]。
笔者研究外源MeJA对重瓣玫瑰抗虫生理指标和双斑萤叶甲取食的影响,以期为植物诱导抗虫性研究提供参考。
1 材料与方法
植物材料及处理:以1年生重瓣玫瑰扦插苗为试验材料,于2012年4月将扦插苗栽植于盆中,提供良好的生长条件,恢复生长后,于7月选择健康、长势相似的植株用于试验。分别将0.01、0.10、0.50、1.00 mmol·L-1的MeJA均匀喷施在植株上,每株20 mL,每组40株,以清水喷施为对照。为避免交互效应,不同处理的植株分别放置,于喷药后的1、3、5、7、9、11 d采集叶片放入封口袋中,迅速放于冰箱中-40 ℃冷冻保存,用于生理指标的测定。
试虫虫源:双斑萤叶甲成虫采自黑龙江省哈尔滨市育林村苗圃,放到养虫笼中,置于光照培养箱内,以新鲜重瓣玫瑰叶片饲养,光照周期为16 h光照8 h黑暗,温度(25±0.5)℃,相对湿度为(70±5)%。选择大小一致、活力较好的成虫饥饿24 h后用于取食试验。
植物抗虫生理指标的测定:POD活性测定参照李合生等[27]164,[28]的方法;PPO活性测定参照严俊鑫[28]的方法;PAL活性测定参照李合生等[27]213,[28]的方法;缩合单宁的提取与测定参照袁红娥等[29]的香草醛盐酸法测定;总酚质量分数的测定参照林植芳等[30-31]的方法。
取食面积测定:植物材料喷施处理同前,在晴朗的天气进行取食试验。将双斑萤叶甲成虫(5头)用15 cm×20 cm细纱网罩在重瓣玫瑰植株中段叶片(健康、无损伤)处,用细绳收紧网口,待试虫取食1、3、5、7、9、11 d,用方格法计算取食叶片面积。3个重复。
数据分析:使用SPSS 11.5软件统计平均值和标准误差,用DPS 9.50进行单因素差异显著性检验。
2 结果与分析
2.1 MeJA对重瓣玫瑰抗虫生理指标的影响
2.1.1 对POD活性的影响
不同浓度MeJA诱导重瓣玫瑰叶片POD活性的变化如表1。0.01 mmol·L-1MeJA诱导后,重瓣玫瑰叶片POD活性在第5天是对照的1.19倍,与对照差异极显著(P<0.01),第1、3、7、9、11天与对照相比差异不显著。0.10 mmol·L-1MeJA诱导后,重瓣玫瑰叶片POD活性在第5天极显著高于对照(P<0.01),是对照的1.17倍;第3天POD活性与对照相比差异显著(P<0.05)。0.5 mmol·L-1MeJA诱导后,重瓣玫瑰叶片POD活性在各时间点均比对照有升高,是对照的1.05~1.68倍,其中第1~9天POD活性升高极显著(P<0.01)。1.0 mmol·L-1MeJA诱导后,重瓣玫瑰叶片POD活性在各时间点与对照相比都有升高,是对照的1.07~1.44倍,第1~7天POD活性极显著升高(P<0.01)。0.5、1.0 mmol·L-1MeJA诱导的POD活性较高,呈先升高后降低的趋势,0.5 mmol·L-1MeJA在第1、3、5、7天诱导的POD活性显著高于其他浓度诱导的(P<0.05)。
2.1.2 对PPO活性的影响
不同浓度MeJA诱导重瓣玫瑰叶片PPO活性变化如表1。0.01 mmol·L-1MeJA诱导后,重瓣玫瑰叶片在第1~11天PPO活性与对照相比差异均不显著。0.10 mmol·L-1MeJA诱导后,重瓣玫瑰叶片PPO活性在各时间点与对照相比差异均不显著。0.50 mmol·L-1MeJA诱导后,重瓣玫瑰叶片PPO活性在第1、3、5天极显著高于对照(P<0.01)。1.0 mmol·L-1MeJA诱导后,重瓣玫瑰叶片PPO活性是对照的1.03~1.38倍,其中第1、3、5天PPO活性极显著高于对照(P<0.01)。0.5 mmol·L-1的MeJA诱导了较高的PPO活性,在第3、5天诱导的PPO活性显著高于其他浓度诱导的(P<0.05)。
2.1.3 对PAL活性的影响
MeJA诱导重瓣玫瑰叶片的PAL活性变化如表1,呈先升高后降低趋势。0.01 mmol·L-1MeJA处理后,第5、7天诱导的重瓣玫瑰叶片PAL活性极显著高于对照(P<0.01)。0.1 mmol·L-1MeJA处理后,重瓣玫瑰叶片PAL活性是对照的1.02~1.47倍,第3~9天PAL活性极显著升高(P<0.01)。0.5 mmol·L-1MeJA处理后,重瓣玫瑰叶片PAL活性较对照升高了1.06~1.42倍,其中第1~9天PAL活性极显著升高(P<0.01)。1.0 mmol·L-1MeJA处理后,重瓣玫瑰叶片PAL活性是对照的1.09~1.89倍,第1~9天PAL活性与对照相比差异极显著(P<0.01),第11天酶活性与对照相比差异显著(P<0.05)。不同浓度的MeJA均能诱导重瓣玫瑰叶片PAL活性的升高,其中1.0 mmol·L-1MeJA诱导了较高的PAL活性,在第1、3、5、7、9天诱导的PAL活性显著高于其他浓度诱导的(P<0.05)。
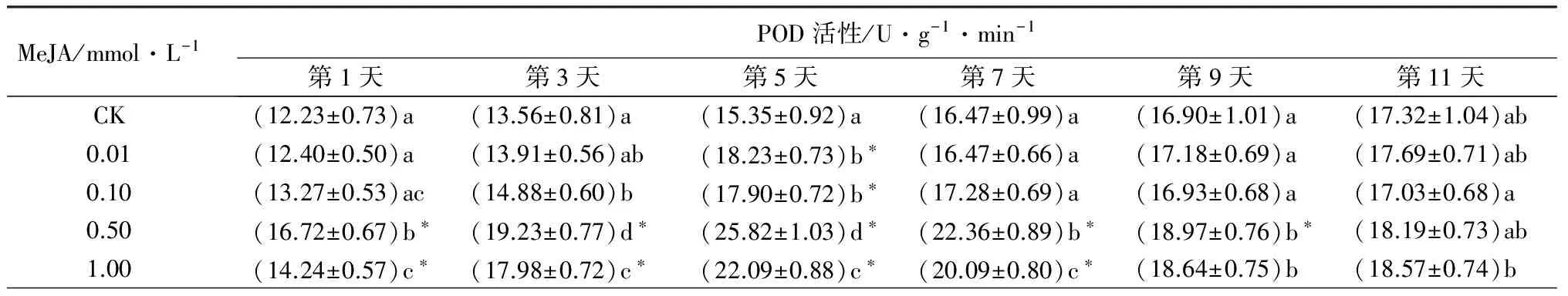
表1 MeJA对重瓣玫瑰抗虫生理指标及取食的影响
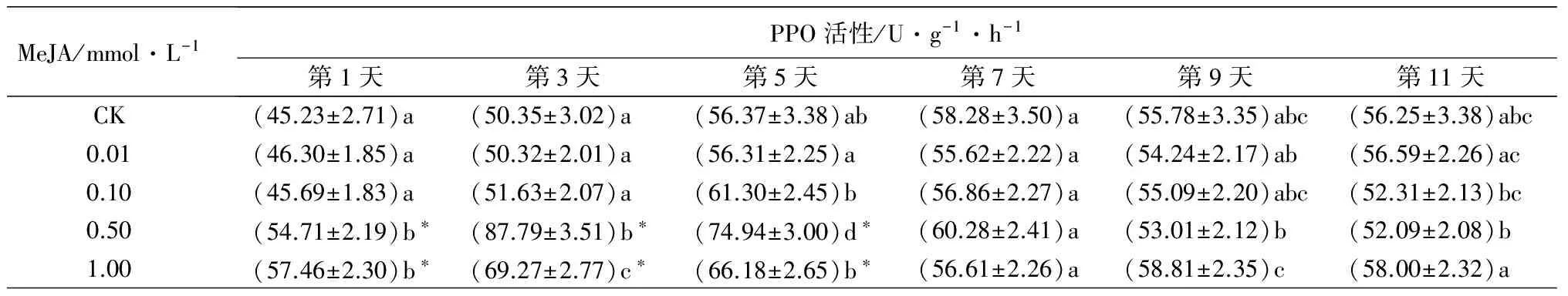
MeJA/mmol·L-1PPO活性/U·g-1·h-1第1天第3天第5天第7天第9天第11天CK(45.23±2.71)a (50.35±3.02)a (56.37±3.38)ab(58.28±3.50)a(55.78±3.35)abc(56.25±3.38)abc0.01(46.30±1.85)a(50.32±2.01)a(56.31±2.25)a(55.62±2.22)a(54.24±2.17)ab(56.59±2.26)ac0.10(45.69±1.83)a(51.63±2.07)a(61.30±2.45)b(56.86±2.27)a(55.09±2.20)abc(52.31±2.13)bc0.50(54.71±2.19)b∗(87.79±3.51)b∗(74.94±3.00)d∗(60.28±2.41)a(53.01±2.12)b(52.09±2.08)b1.00(57.46±2.30)b∗(69.27±2.77)c∗(66.18±2.65)b∗(56.61±2.26)a(58.81±2.35)c(58.00±2.32)a
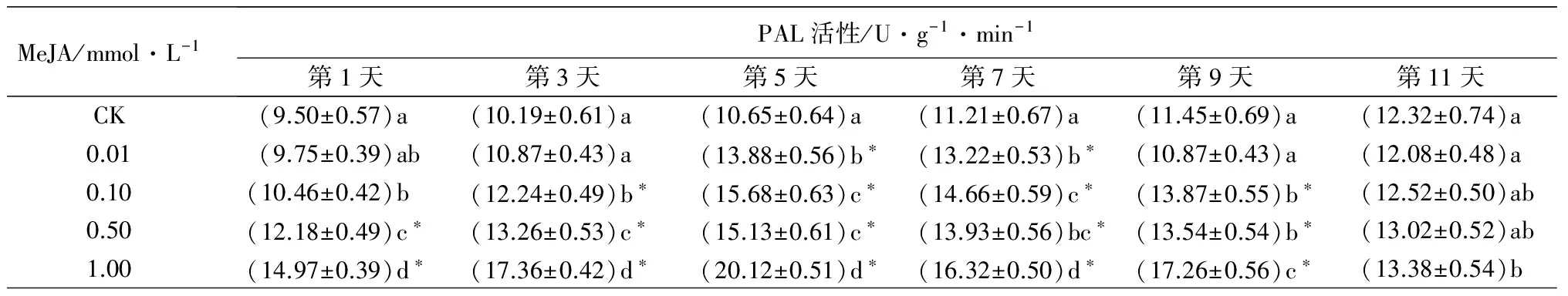
MeJA/mmol·L-1PAL活性/U·g-1·min-1第1天第3天第5天第7天第9天第11天CK(9.50±0.57)a (10.19±0.61)a (10.65±0.64)a(11.21±0.67)a(11.45±0.69)a(12.32±0.74)a0.01(9.75±0.39)ab(10.87±0.43)a(13.88±0.56)b∗(13.22±0.53)b∗(10.87±0.43)a(12.08±0.48)a0.10(10.46±0.42)b(12.24±0.49)b∗(15.68±0.63)c∗(14.66±0.59)c∗(13.87±0.55)b∗(12.52±0.50)ab0.50(12.18±0.49)c∗(13.26±0.53)c∗(15.13±0.61)c∗(13.93±0.56)bc∗(13.54±0.54)b∗(13.02±0.52)ab1.00(14.97±0.39)d∗(17.36±0.42)d∗(20.12±0.51)d∗(16.32±0.50)d∗(17.26±0.56)c∗(13.38±0.54)b
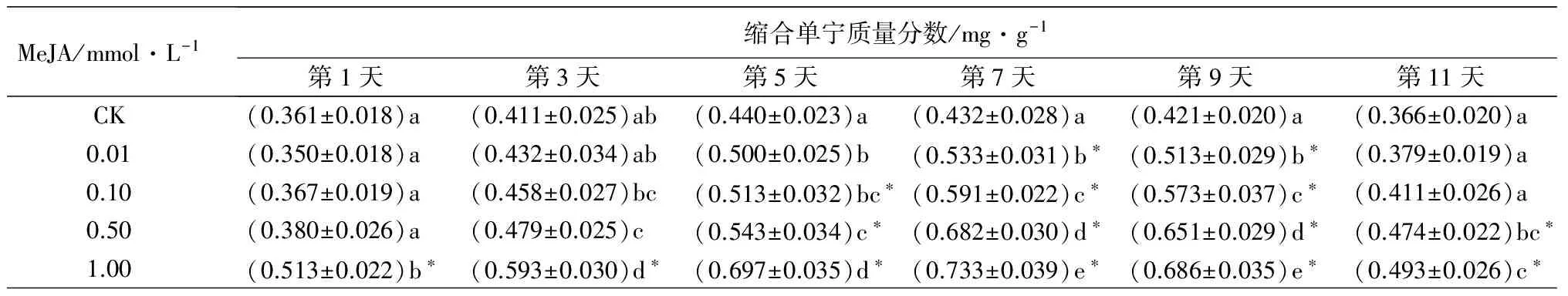
MeJA/mmol·L-1缩合单宁质量分数/mg·g-1第1天第3天第5天第7天第9天第11天CK(0.361±0.018)a (0.411±0.025)ab(0.440±0.023)a(0.432±0.028)a(0.421±0.020)a(0.366±0.020)a0.01(0.350±0.018)a(0.432±0.034)ab(0.500±0.025)b(0.533±0.031)b∗(0.513±0.029)b∗(0.379±0.019)a0.10(0.367±0.019)a(0.458±0.027)bc(0.513±0.032)bc∗(0.591±0.022)c∗(0.573±0.037)c∗(0.411±0.026)a0.50(0.380±0.026)a(0.479±0.025)c(0.543±0.034)c∗(0.682±0.030)d∗(0.651±0.029)d∗(0.474±0.022)bc∗1.00(0.513±0.022)b∗(0.593±0.030)d∗(0.697±0.035)d∗(0.733±0.039)e∗(0.686±0.035)e∗(0.493±0.026)c∗
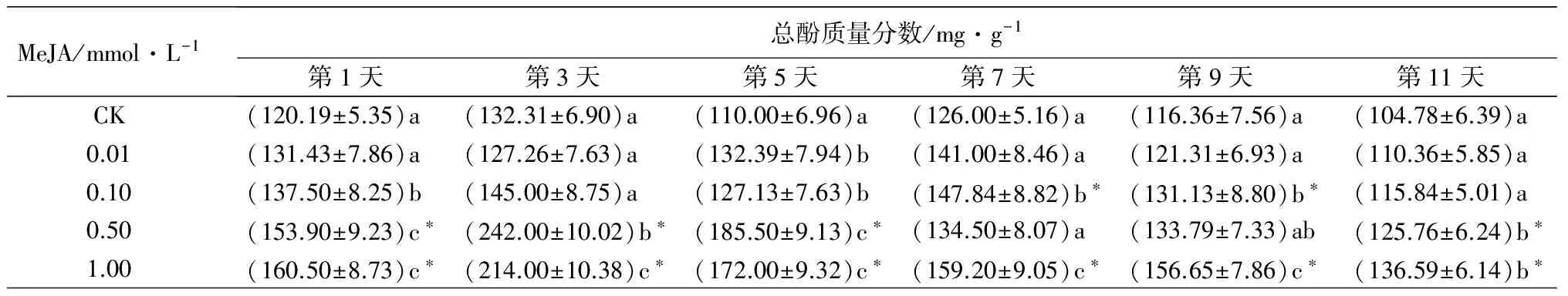
MeJA/mmol·L-1总酚质量分数/mg·g-1第1天第3天第5天第7天第9天第11天CK(120.19±5.35)a (132.31±6.90)a (110.00±6.96)a(126.00±5.16)a(116.36±7.56)a(104.78±6.39)a0.01(131.43±7.86)a(127.26±7.63)a(132.39±7.94)b(141.00±8.46)a(121.31±6.93)a(110.36±5.85)a0.10(137.50±8.25)b(145.00±8.75)a(127.13±7.63)b(147.84±8.82)b∗(131.13±8.80)b∗(115.84±5.01)a0.50(153.90±9.23)c∗(242.00±10.02)b∗(185.50±9.13)c∗(134.50±8.07)a(133.79±7.33)ab(125.76±6.24)b∗1.00(160.50±8.73)c∗(214.00±10.38)c∗(172.00±9.32)c∗(159.20±9.05)c∗(156.65±7.86)c∗(136.59±6.14)b∗

MeJA/mmol·L-1取食面积/cm2第1天第3天第5天第7天第9天第11天CK(0.93±0.06)a(2.43±0.10)a(3.72±0.15)a(4.96±0.19)a(6.24±0.28)a(7.47±0.32)a0.01(0.91±0.06)ab(2.23±0.08)ab(3.46±0.11)ab(4.53±0.12)b(5.78±0.16)b(6.89±0.21)b0.10(0.87±0.05)b(2.03±0.11)b∗(3.12±0.12)b∗(4.21±0.18)c∗(5.05±0.13)c∗(6.17±0.19)c∗0.50(0.83±0.06)bc∗(1.52±0.08)c∗(2.31±0.12)c∗(3.18±0.12)d∗(4.16±0.19)d∗(4.82±0.15)d∗1.00(0.78±0.04)c∗(1.45±0.07)c∗(2.14±0.10)d∗(3.11±0.12)d∗(4.07±0.14)d∗(4.76±0.19)d∗
注:*表示处理组与相应时段对照组的差异极显著(P<0.01);同一时间点不同字母表示各处理间的差异显著(P<0.05)。
2.1.4 对缩合单宁质量分数的影响
MeJA对重瓣玫瑰缩合单宁质量分数的影响如表1。不同浓度的MeJA诱导了重瓣玫瑰叶片缩合单宁质量分数呈现先升高后降低的趋势。0.01 mmol·L-1MeJA诱导的重瓣玫瑰叶片缩合单宁质量分数在第7、9天与对照差异极显著(P<0.01),第5天与对照差异显著(P<0.05)。0.1 mmol·L-1MeJA诱导的重瓣玫瑰叶片缩合单宁质量分数在第5、7、9天与对照差异极显著(P<0.01)。0.5 mmol·L-1MeJA诱导的重瓣玫瑰叶片缩合单宁质量分数是对照的1.05~1.58倍,第5、7、9、11天诱导的缩合单宁质量分数与对照差异极显著(P<0.01),第3天与对照差异显著(P<0.05)。1 mmol·L-1MeJA诱导的重瓣玫瑰叶片缩合单宁质量分数是对照的1.35~1.70倍,在各时间点均与对照差异极显著(P<0.01)。1 mmol·L-1MeJA诱导的缩合单宁质量分数较高,在第1、3、5、7、9天诱导的缩合单宁质量分数显著高于其他浓度诱导的(P<0.05)。
2.1.5 对总酚质量分数的影响
MeJA对重瓣玫瑰总酚质量分数的影响如表1。MeJA诱导了重瓣玫瑰叶片总酚质量分数的增加。0.01 mmol·L-1MeJA诱导的重瓣玫瑰叶片总酚质量分数在第5天与对照差异显著(P<0.05)。0.1 mmol·L-1MeJA诱导的重瓣玫瑰叶片总酚质量分数在第7、9天与对照差异极显著(P<0.01),第1、5天与对照差异显著(P<0.05)。0.5 mmol·L-1MeJA诱导的重瓣玫瑰叶片总酚质量分数是对照的1.07~1.83倍,第1、3、5、11天与对照差异极显著(P<0.01)。1 mmol·L-1MeJA诱导的重瓣玫瑰叶片总酚质量分数是对照的1.26~1.62倍,在各时间点均与对照差异极显著(P<0.01)。1 mmol·L-1MeJA诱导的总酚质量分数在第3、7、9天显著高于其他浓度诱导的。
2.2 MeJA对双斑萤叶甲取食的影响
由表1可见,不同浓度MeJA处理的重瓣玫瑰对双斑萤叶甲取食面积的影响。双斑萤叶甲取食0.01 mmol·L-1MeJA诱导的植株叶片面积在第7、9、11天与对照差异显著(P<0.05)。双斑萤叶甲取食0.1 mmol·L-1MeJA诱导的植株叶片面积在第3、5、7、9、11天与对照差异极显著(P<0.01),第1天与对照相比差异显著(P<0.05)。双斑萤叶甲取食0.5 mmol·L-1MeJA诱导的植株叶片面积在第1~11天均极显著低于对照(P<0.01)。双斑萤叶甲取食1.0 mmol·L-1MeJA诱导的植株叶片面积是对照的0.60~0.84倍,在各时间点均极显著低于对照(P<0.01)。不同处理均能使双斑萤叶甲取食面积与对照相比有不同程度的减少,取食0.5和1.0 mmol·L-1MeJA诱导的植株叶片面积在试验期间均与对照差异极显著。
3 结论与讨论
MeJA是植物体内一种具有应答外界刺激,传导逆境信号及启动抗逆基因的天然生理活性物质,在植物逆境胁迫响应和生长发育调节中有重要作用,是与植物抗性相关的信号分子。有研究表明,用MeJA熏蒸合作杨(Populussimonii×P.pyramidalis‘Opera 8277’),其叶片中POD、PPO和PAL的活性升高[32]。本试验结果表明,不同浓度的MeJA能诱导重瓣玫瑰叶片PAL、PPO、POD活性升高,基本呈先升高后降低趋势,这与胡增辉等[32]研究结果相似。张智慧等用外源MeJA可诱导水稻PAL、POD活性上升,诱导后的24h达到最高值[33]。本试验中1.0 mmol·L-1MeJA诱导了较高的PAL活性,在第5天达到最大值;0.5 mmol·L-1MeJA诱导了叶片内较高的PPO活性,在第3天达到最大值;0.5、1.0 mmol·L-1MeJA诱导了较高POD活性且最大值出现在第5天,这与张智慧等诱导酶活最大值的MeJA的浓度[33]不同,可能是不同植物对MeJA诱导的防御反应不同造成的。
单宁是植物中一类具有多抗性的酚类物质,能与蛋白质发生特异性结合从而影响昆虫的取食、生长发育、消化等,是植物关键防御物质之一[34]。0.5、1.0 mmol·L-1MeJA在5、7、9、11天诱导的缩合单宁质量分数极显著高于对照,其中1.0 mmol·L-1MeJA诱导的缩合单宁质量分数较高,并在试验时段内均极显著高于对照。
酚类物质是植物体内主要的次生代谢物质,也是植物体内重要的防御物质。农春莲等研究表明,水稻品种对稻瘿蚊中国Ⅳ型的抗性与稻叶总酚质量分数呈显著正相关[35]。吴莹莹等研究表明,MeJA诱导后水稻品种TN1、IR26、IR36对褐飞虱生物型Ⅱ的抗性与稻株总酚质量分数的升高关系密切,0.25 mmol·L-1的诱导浓度增加抗虫性的效果最为明显[36]。本试验结果表明,外源喷施MeJA能诱导重瓣玫瑰总酚质量分数的增加,这与吴莹莹等研究结果[36]相似,MeJA诱导可能启动了植物的防御反应。0.5、1.0 mmol·L-1MeJA诱导了较高的总酚质量分数,其中1.0 mmol·L-1MeJA诱导的总酚质量分数在试验时段内均极显著高于对照。
桂连友等研究表明,茶尺蠖(EctropisobliqueProut)1龄幼虫取食经MeJA处理的茶树(Camelliasinensis(L.) O. Ktze.)叶片5 d后,幼虫体质量增长和取食面积比对照低17.21%和21.59%[37]。本试验结果表明,不同浓度MeJA处理的重瓣玫瑰均能使试虫取食面积与对照相比有不同程度的减少,与桂连友等研究结果[37]类似,说明MeJA诱导能够启动重瓣玫瑰防御信号系统,起到防御外界伤害的作用,有一定的抗虫效果。试虫取食0.5、1.0 mmol·L-1MeJA诱导的叶片面积在试验期间均极显著低于对照,推测MeJA诱导重瓣玫瑰抵御双斑萤叶甲取食的适宜浓度为0.5、1.0 mmol·L-1。
[1] 李万英,王文中.我国玫瑰资源初探[J].园艺学报,1983,10(3):211-215.
[2] 郭峰,王桂芳,赵杰,等.玫瑰的生物学特性与生态环境[J],中国花卉园艺,2010(22):32-34.
[3] 张鑫乾,严俊鑫,杨洁莹,等.重瓣玫瑰诱导抗性对双斑萤叶甲成虫解毒酶的影响[J].东北林业大学学报,2014,42(5):125-128.
[4] 麻宝成,朱世江.苯并噻重氮和茉莉酸甲酯对采后香蕉果实抗病性及相关酶活性的影响[J].中国农业科学,2006,39(6):1220-1227.
[5] 王俊斌,王海凤,崔新仪,等.茉莉酸甲酯对烟草抵御棉铃虫的诱导作用[J].中国农学通报,2010,26(17):277-280.
[6] 宾金华,姜胜,黄胜琴,等.茉莉酸甲酯诱导烟草幼苗抗炭疽病与PAL活性及细胞壁物质的关系[J].植物生理学报,2000,26(1):1-6.
[7] 李新岗,刘惠霞,侯慧波,等.油松球果对外源茉莉酸甲酯和虫害诱导的生化反应[J].林业科学,2007,43(3):66-72.
[8] MORAES M C, BIRKETT M A, GORDON-WEEKS R, et al. Cis-jasmone induces accumulation of defence compounds in wheat,Triticumaestivum[J]. Phytochemistry,2008,69(1):9-17.
[9] PANIUTA O O, SHALII V A, BELAVA V N. Jasmonic acid and its participation in defence reactions of plant organism[J]. Ukrainskyi Biokhimichnyi Zhurnal,2009,81(2):14-26.
[10] MATTHES M C, BRUCE T J, TON J, et al. The transcriptome of cis-jasmone-induced resistance inArabidopsisthalianaand its role in indirect defence[J]. Planta,2010,232(5):1163-1180.
[11] COHEN Y, GISI U, NIDERMAN T. Local and systemic protection againstPhytophthorainfestansinduced in potato and tomato plants by jasmonic acid and jasmonic methyl ester[J]. Phytopathology,1993,83(10):1054-1062.
[12] BALDWIN I T, ZHANG Z P, DIAB N, et al. Quantification, correlations and manipulations of wound-induced changes in jasmonic acid and nicotine inNicotianasylvestris[J]. Planta,1997,201(4):397-404.
[14] CONSTABEL C P, RYAN C A. A survey of wound-and methyl jasmonate-induced leaf polyphenol oxidase in crop plants[J]. Phytochemistry,1998,47(4):507-511.
[15] BAILEY B A, STREM M D, BAE H, et al. Gene expression in leaves ofTheobromacacaoin response to mechanical wounding, ethylene, and/or methyl jasmonate[J]. Plant Science,2005,168(5):1247-1258.
[16] 毛红,陈瀚,刘小侠,等.绿盲蝽取食与机械损伤对棉花叶片内防御性酶活性的影响[J].应用昆虫学报,2011,48(5):1431-1436.
[17] CHAMAN M E, COPAJA S V, ARGANDOA V H. Relationships between salicylic acid content, phenylalanine ammonia-lyase (PAL) activity, and resistance of barley to aphid infestation[J]. Journal of Agricultural & Food Chemistry,2003,51(8):2227-2231.
[18] BITTNER S. When quinones meet amino acids: chemical, physical and biological consequences[J]. Amino Acids,2006,30(3):205-224.
[19] PINTO M S, SIQUEIRA F P, OLIVEIRA A E, et al. A wounding-induced PPO from cowpea (Vignaunguiculata) seedlings[J]. Phytochemistry,2008,69(12):2297-2302.
[20] 宗娜,王琛柱.三种夜蛾科昆虫对烟草烟碱的诱导及其与昆虫下唇腺葡萄糖氧化酶的关系[J].科学通报,2004,49(14):1380-1385.
[21] 周丹丹,刘长仲,姜生林,等.烟粉虱刺吸胁迫对棉花叶片生理的影响[J].甘肃农业大学学报,2009,44(1):107-110.
[22] 钦俊德.昆虫与植物的关系: 论昆虫与植物的相互作用及其演化[M].北京:科学出版社,1987:51-52.
[23] 陈凤菊,高希武,雷明庆,等.单宁酸对棉铃虫谷胱甘肽S-转移酶的影响[J].昆虫学报,2003,46(6):684-690.
[24] MATSUKI S, SANO Y, KOIKE T. Chemical and Physical defence in early and late leaves in three heterophyllous birch species native to northern Japan[J]. Annals of Botany,2004,93(2):141-147.
[25] 程智慧,佟飞,金瑞.大蒜秸秆水浸液的抑菌作用和抑菌成分初步分析[J].西北植物学报,2008,28(2):324-330.
[26] 关文强,李宁,段双科.真菌源激发子对采后葡萄果皮抗性产生的诱导[J].西北植物学报,2005,25(12):2408-2412.
[27] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[28] 严俊鑫,迟德富,张永强,等.JA、SA对重瓣玫瑰生长发育和防御酶活性的影响[J].北京林业大学学报,2013,35(3):128-136.
[29] 袁红娥,严善春,佟丽丽,等.剪叶损伤与昆虫取食对兴安落叶松(Larixgmelinii)针叶中缩合单宁诱导作用的差异[J].林业科学,2009,29(3):1415-1420.
[30] 林植芳,李双顺,张东林,等.采后荔枝果皮色素、总酚及有关酶活性的变化[J].植物学报,1988,30(1):40-45.
[31] 严俊鑫,迟德富,张永强,等.水杨酸诱导重瓣玫瑰对白粉病的抗性[J].东北林业大学学报,2013,41(8):95-101.
[32] 胡增辉,沈应柏,王宁宁,等.不同挥发物诱导的合作杨叶片中POD,PPO及PAL活性变化[J].林业科学,2009,45(10):44-48.
[33] 张智慧,聂燕芳,何磊,等.外源水杨酸诱导水稻相关防御酶活性及内源水杨酸含量的变化[J].华中农业大学学报,2010,29(5):541-545.
[34] 程红,严善春,隋祥,等.黑龙江省主栽杨树品系干部单宁含量与青杨脊虎天牛危害的关系[J].东北林业大学学报,2006,34(2):32-34.
[35] 农春莲,吴碧球,黄所生,等.水稻品种对稻瘿蚊中国Ⅳ型的抗性及其与总酚含量关系[J].西南农业学报,2011,24(6):2172-2177.
[36] 吴莹莹,吴碧球,陈燕,等.茉莉酸甲酯诱导水稻对褐飞虱抗性与植株总酚含量的关系研究[J].西南农业学报,2012,25(2):462-466.
[37] 桂连友.外源茉莉酸甲酯对茶树抗虫作用的诱导及其机理[D].杭州:浙江大学,2004.
Effects of MeJA on the Insect-resistant Physiological Indexes ofRosarugosa‘Plena’ and the Feeding ofMonoleptahieroglyphica//
Yan Junxin, Xu Lingxin,Yu Jia, Zhang Yongqiang, Chi Defu
(Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University,2017,45(1):77-81.
Methyl jasmonate (MeJA);Rosarugosa‘Plena’; Insect-resistant;Monoleptahieroglyphica(Motschulsky)
1)黑龙江省青年科学基金项目(QC2014C012);中央高校基本科研业务费专项资金(2572016CA11)。
严俊鑫,女,1981年7月生,东北林业大学园林学院,副教授。E-mail:yanjunxin@163.com。
迟德富,东北林业大学林学院,教授。E-mail:chidefu@126.com。
2016年10月25日。
S763.3;S685.12
责任编辑:程 红。

