BpAP1转基因白桦中开花相关基因的时序表达1)
黄海娇 李慧玉 姜静
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
BpAP1转基因白桦中开花相关基因的时序表达1)
黄海娇 李慧玉 姜静
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
为揭示白桦(Betulaplatyphylla×B.pendula)中BpAP1转录因子的调控机理,以BpAP1过表达、抑制表达转基因白桦以及非转基因对照白桦(NT)为试材,对前期获得的BpAP1转基因白桦中的6条开花相关基因(BpPI、BpMADS4、BpMADS5、FT、TFL1和LFY)进行了定量PCR分析,探讨了白桦BpAP1转录因子与这6条开花基因的表达调控关系以及它们对白桦提早开花的影响。结果表明:非转基因对照与BpAP1抑制表达转基因白桦叶片中BpAP1、BpPI、BpMADS4、BpMADS5、FT、TFL1和LFY的相对表达量在不同发育时期变化均不显著。BpAP1过表达转基因白桦叶片和雄花序中这7条基因的表达量在不同发育时期均显著高于NT和BpAP1抑制表达转基因白桦。在BpAP1过表达转基因白桦中,除BpAP1和TFL1外,其他5条基因在各个时期的雄花序中表达量均为最高,多数基因的表达高峰出现在6月15日;另外,BpAP1、BpMADS4、BpMADS5和BpPI在8月15日的雄花序中表达量也很高;TFL1的相对表达量在9月1日的叶片中显著上调;LFY基因在生长发育最旺盛的6、7月份的雄花序中达到了表达高峰。BpAP1与BpPI、BpMADS4、BpMADS5、FT、TFL1、LFY这6条开花相关基因之间均呈极显著的正相关。
白桦;BpAP1;开花相关基因;表达特性;定量PCR
We used quantitative real-time PCR (qRT-PCR) of several flowering related genes inBpAP1 transgenic birch to study the regulation relationship between BpAP1 transcription factor and other six flowering related genes for revealing regulation mechanism of BpAP1 transcription factor. By qRT-PCR,BpAP1 overexpression lines,BpAP1 suppression lines and non-transgenic line (NT) were used to analyze the expression ofBpAP1,BpPI,BpMADS4,BpMADS5,FT,TFL1 andLFYat the eight developmental stages, and the correlation analysis were employed to reveal the regulation relationship betweenBpAP1 and other six flowering genes for their effect on early flowering in birch. There was no significant change in expression ofBpAP1,BpPI,BpMADS4,BpMADS5,FT,TFL1 andLFYin leaves of NT andBpAP1 suppression lines at different developmental stages. However, expression of these seven genes in leaves and male inflorescences ofBpAP1 overexpression lines was significantly higher than that in NT andBpAP1 suppression lines at different developmental stages.BpMADS4,BpMADS5,FT,BpPIandLFYall ectopically expressed in male inflorescences at the eight developmental stages, and the expression peak of most of genes appeared in 15th June. The expression ofBpAP1,BpMADS4,BpMADS5 andBpPIwas dramatically increased in male inflorescences in 15th August. Relative expression ofTFL1 was significantly upregulated in leaves in 1st September. Expression ofLFYin male inflorescences appeared peak in June and July. There is a significant positive correlation betweenBpAP1 andBpPI,BpMADS4,BpMADS5,FT,TFL1,LFY.
开花是植物从营养生长到生殖生长的一个重要转折点,花的形成经历了一系列组织分化的过程,在这个过程中有诸多基因的参与,其中AP1基因编码一个MADS-box转录因子,该基因在控制植物花分生组织特性与花器官的形成过程中起着至关重要的作用,是调控植物花发育的热点基因之一[1-8]。人们最早研究MADS-box基因家族是通过拟南芥(Arabidopsisthaliana)、矮牵牛(Petuniahybrida)和金鱼草(Antirrihiummajus)等经典的模式植物进行的。根据MADS-box基因对花器官形成的调控作用,提出了著名的花器官发育ABC模型,后经补充发展成为ABCDE模型[9],AP1基因是其中的A类基因。自ap1突变体的获得和AP1基因的成功克隆以来[3,10],研究者们对该基因进行了20多年的研究,特别是近些年来,随着研究技术和研究手段的不断更新和丰富,人们对AP1基因的研究更为系统,逐渐形成了一个以AP1基因为中心的成花调控网络。
拟南芥中,AP1和LFY之间存在正反馈调节作用。在lfy突变体中,AP1的起始表达被推迟,说明LFY对AP1有正向调节作用,反过来,当AP1基因过量表达时,LFY基因的表达会提前,表明AP1基因能够正向调节LFY基因的表达[11-13]。另外,过量表达AP1基因能够降低TFL1基因的表达。LFY基因和AP1基因之间正反馈调节的促进作用和TFL1对这两条基因的抑制作用能够共同作用于植物的成花诱导[11]。
AP1能够正向调控PI和AP3的表达,以转录激活因子的方式决定花瓣特性[14-15],反过来,PI能与AP3一起,直接结合到AP1的启动子上,这表明AP1与PI之间的调控作用是直接的[16]。
欧洲白桦(Betulapendula)中有一些关于MADS-box基因的报道,BpMADS2,BpMADS4,BpMADS5和BpAP1同属于白桦中的MADS-box基因,其中BpMADS2是PI的同源基因,该基因在雄花序中表达明显,随着雄花序的发育,其表达逐渐增强;雌花序中表达微弱甚至检测不到[17]。BpMADS4、BpMADS5与拟南芥中的FUL基因序列相似,BpMADS4在花、芽和根中均有表达,其中花序分生组织起始的早期、顶端分生组织和幼嫩的苞片中均有很高的表达[18],BpMADS4和BpMADS5在烟草(Nicotianatabacum)中过量表达均能使转基因植株提前开花[19],BpMADS4基因在苹果(Maluspumila)中超量表达,也能使苹果提前开花[20]。
本研究团队前期获得了BpAP1过表达和抑制表达转基因白桦[21-22],对转基因白桦组培苗中BpAP1基因及开花相关基因的表达情况进行研究发现,过表达株系中BpAP1基因的表达量显著提高,且BpMADS4、BpMADS5和BpMADS8的表达量明显提高,而在抑制表达株系中,除了BpMADS8外其他开花基因的表达量均降低,其中BpMADS1、BpMADS5、BpMADS6和BpMADS7最为明显[23]。另外,对2年生过表达白桦和对照白桦中BpAP1基因的组织表达特异性进行分析发现,该基因在雄花序中的表达丰度显著高于其他组织部位[21]。本研究在此基础上,结合转录组测序结果从开花网络途径中选取了3条与AP1关系比较紧密的3条基因LFY、FT、TFL1和3条AP1的同族基因BpPI、BpMADS4和BpMADS5(图1),以BpAP1过表达、BpAP1抑制表达转基因白桦以及非转基因对照白桦为试材,对BpAP1基因和这6条开花相关基因在不同发育时期的表达情况进行了分析,探讨白桦BpAP1转录因子与上述基因的调控关系,为揭示白桦BpAP1转录因子的调控机理提供参考。
1 材料与方法
1.1 植物材料
2年生BpAP1过表达转基因白桦(A2、A5株系)、BpAP1抑制表达转基因白桦(FA10、FA11株系)以及非转基因对照白桦(NT)。
1.2 取材方法
于2012年6月至9月每月初和每月中旬(6月1日,6月15日,…,9月15日)分别取BpAP1过表达转基因白桦的叶片和雄花序、抑制表达白桦以及非转基因对照白桦的叶片为材料进行RNA的提取,叶片均为从植株顶端向下数第3或第4片叶,为刚刚完全展开的成熟叶片。

图1 开花调控网络[24]
1.3 实时荧光定量PCR
采用CTAB法分别提取各个时期BpAP1过表达、抑制表达白桦以及NT的总RNA[25],使用ReverTre Ace®qPCR RT Kit(Toyobo,Osaka,Japan)将提取的总RNA进行反转录。反转录体系为,RNA 0.5 g,65 ℃变性5 min;加入4×DNA Master Mix 2 L,37 ℃反应5 min;再加入5×RT Master Mix 2 L,使总体系为10 L。反应程序为,37 ℃,15 min;50 ℃,5 min;98 ℃,5 min。逆转录产物稀释10倍,用作定量PCR的模板,以18SrRNA和α-Tubulin为内参基因,对选取的开花基因进行定量验证。PCR反应体系为:2×SYBR Green Realtime PCR Master Mix 10 L(Toyobo,Osaka,Japan)、模板2 L、上游引物和下游引物(10 mol·L-1)各1 L、用去离子水补足体积20 L。反应程序为,94 ℃ 30 s,94 ℃ 12 s、60 ℃ 1 min,循环45次,温度由60 ℃开始至95 ℃终止,绘制熔解曲线。在ABI 7500实时定量PCR仪上完成qRT-PCR,重复3次,用2-ΔΔCt方法对定量结果进行分析[26],引物序列见表1。
1.4 表达量的相关性分析
采用SPSS16.0对BpAP1基因及其他6个开花相关基因的表达量进行相关性分析。
2 结果与分析
根据以往研究者们在拟南芥中建立的开花调控网络和转基因白桦的转录组测序结果,选取了BpPI、BpMADS4、BpMADS5、FT、TFL1、LFY这6条开花相关基因以及BpAP1基因进行了8个不同发育时期的表达分析。

表1 qRT-PCR引物序列
2.1 BpAP1和6条开花相关基因的时序表达特性
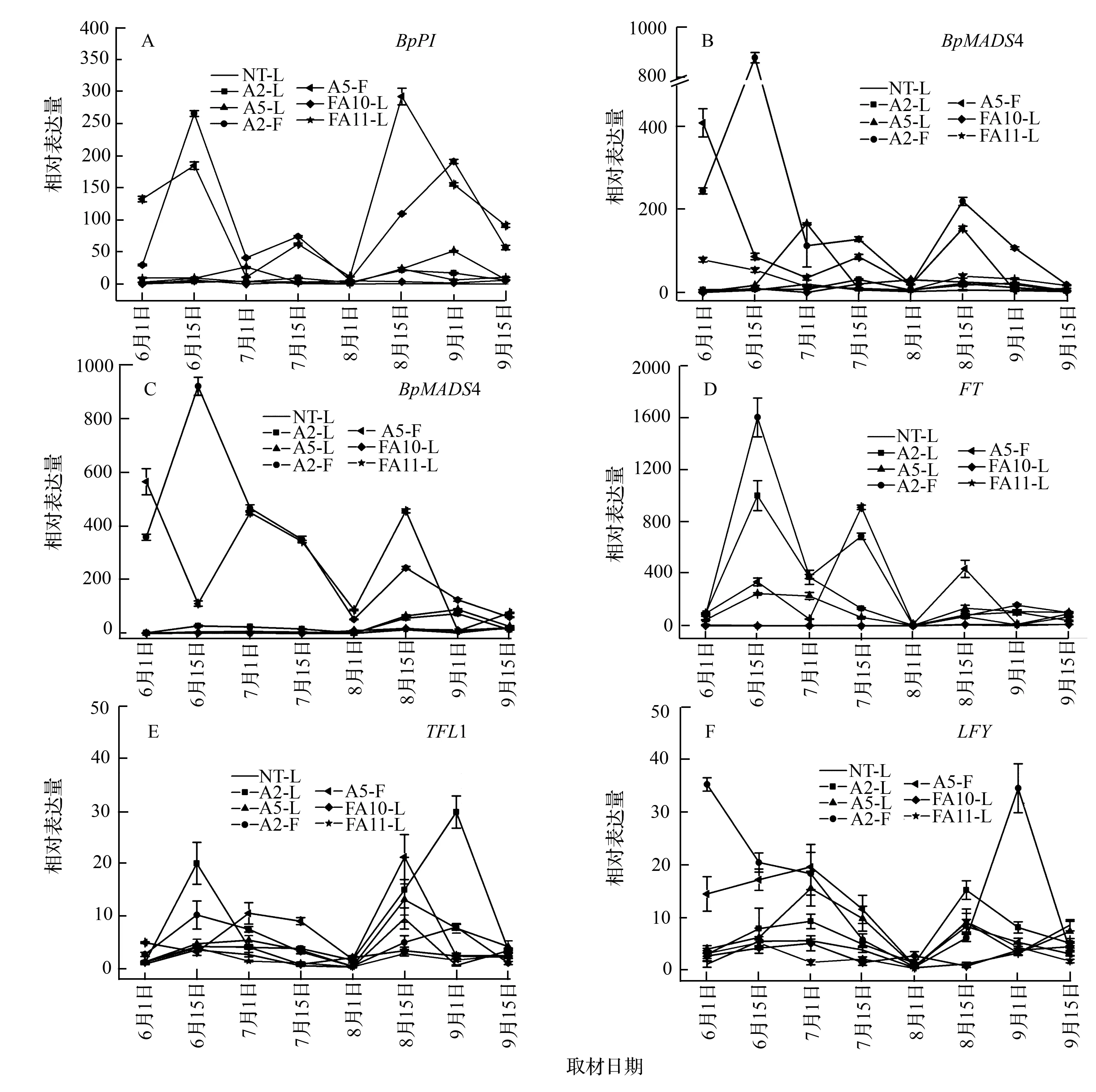
分别以ds1时期非转基因对照白桦(NT)叶片中BpAP1、BpPI、BpMADS4、BpMADS5、FT、TFL1和LFY基因的表达量为对照,对参试株系不同发育时期的叶片及雄花序中这7条基因的相对表达量进行比较。结果表明:NT与抑制表达白桦叶片中BpAP1基因的相对表达量在不同发育时期的变化不显著,BpAP1相对表达量为0.048~20.46;而BpAP1过表达白桦的2个株系则不同,其叶片及雄花序中BpAP1基因的表达量各时期均显著高于NT和BpAP1抑制表达白桦,并且该基因在不同发育时期的表达规律基本相同,其中A2株系的雄花序中BpAP1表达量在6月15日显著上调,分别是NT和BpAP1抑制表达株系的1 406.28、1 491.88倍(图2)。

NT.非转基因对照白桦;A2、A5.BpAP1过表达转基因白桦;FA10、FA11.BpAP1抑制表达转基因白桦;L.叶片;F.雄花序。
图2BpAP1基因在不同发育时期的表达量
BpPI、BpMADS4、BpMADS5与BpAP1同属于MADS-box基因家族中的成员,其中PI是开花ABC模型中的B类基因,主要控制花瓣和雄蕊的发育。从图3A中可以看出:不同发育时期的NT、BpAP1抑制表达白桦与BpAP1过表达白桦叶片中BpPI的相对表达量(0.36~52.30)变化不显著;而BpAP1过表达白桦雄花序中BpPI相对表达量各时期均显著高于NT、BpAP1抑制表达白桦和BpAP1过表达白桦叶片(7月1日和8月1日除外),并且BpAP1过表达白桦雄花序中BpPI的相对表达量在6月15日、8月15日和9月1日显著上调,分别是NT的79.05、186.98、204.35倍。
BpMADS4和BpMADS5这2条基因的表达模式趋于一致:8个发育时期中NT与BpAP1抑制表达白桦叶片中BpMADS4和BpMADS5基因的相对表达量变化不显著;而BpAP1过表达白桦雄花序中这2条基因的相对表达量均显著高于NT和BpAP1抑制表达白桦(8月1日和9月15日除外),且在6月15日,A2株系雄花序中这2条基因的相对表达量均达到最高,BpMADS4基因的表达量是NT的139.44倍;BpMADS5基因的表达量是NT的414.91倍(图3B、C)。
NT与BpAP1抑制表达白桦叶片中FT、TFL1和LFY基因的相对表达量在不同发育时期的变化均不显著,分别为0.69~69.79、0.46~9.70和0.33~15.51(图3D、E、F);而BpAP1过表达白桦叶片和雄花序中FT的相对表达量均显著高于NT和BpAP1抑制表达白桦(8月1日除外),并且在生长发育最旺盛的6月15日和7月15日出现表达高峰,在6月15日A2株系雄花序中FT的相对表达量最高,分别是NT和BpAP1抑制表达白桦中该基因表达量的630.51、617.71倍(图3D);A2株系叶片中TFL1的相对表达量在6月中旬和9月1日均显著高于NT和BpAP1抑制表达株系,9月1日最为明显,分别是NT和BpAP1抑制表达株系的39.67、13.78倍(图3E);BpAP1过表达白桦雄花序中LFY基因的相对表达量要高于NT和BpAP1抑制表达白桦(8月1日和9月15日除外),其中A2株系雄花序中LFY基因的表达量在6月1日和9月1日显著上调,分别是NT的32.53、10.71倍(图3F)。
2.2 开花相关基因的表达相关性
BpAP1基因的过量表达引起了白桦的提早开花(图4)[21],为了更好地了解BpAP1基因与其他6条开花相关基因之间的关系,对这7条基因的相对表达量进行相关性分析。结果发现:BpAP1与其他6条基因之间均呈极显著的正相关,其中与FT基因的相关性最高(r=0.611;P<0.01;n=168),说明BpAP1基因的过量表达提高了FT基因的表达量;另外,除BpMADS4与TFL1相关性不显著,BpMADS5与TFL1、FT与LFY、TFL1与BpPI以及BpPI与LFY之间呈显著的正相关以外,其他两两之间均呈极显著的正相关,说明这些开花基因不仅与AP1之间存在着紧密的联系,而且它们彼此之间也存在联系,这些基因共同影响了白桦的提早开花(表2)。
NT.非转基因对照白桦;A2、A5.BpAP1过表达转基因白桦;FA10、FA11.BpAP1抑制表达转基因白桦;L.叶片,F.雄花序。

A.转基因白桦组培瓶中开花;B.转基因白桦移栽2个月后开出雄花;C.转基因白桦的果穗;D.非转基因对照白桦。

开花相关基因BpAP1BpMADS4BpMADS5FTTFL1BpPILFYBpAP11.0000.594∗∗0.565∗∗0.611∗∗0.431∗∗0.399∗∗0.601∗∗BpMADS4─1.0000.844∗∗0.419∗∗0.1410.653∗∗0.448∗∗BpMADS5──1.0000.484∗∗0.264∗0.673∗∗0.547∗∗FT───1.0000.404∗∗0.378∗∗0.284∗TFL1────1.0000.271∗0.518∗∗BpPI─────1.0000.292∗LFY──────1.000
注:** 为0.01水平上极显著相关;*为0.05水平上显著相关。
3 结论与讨论
本研究通过对BpAP1以及BpPI、BpMADS4、BpMADS5、FT、TFL1、LFY基因在BpAP1过表达、抑制表达转基因白桦以及非转基因对照白桦中的表达情况进行分析,探讨了这几条基因之间的表达调控关系。结果发现,BpAP1过表达株系叶片和雄花序中这7条基因的表达量在不同发育时期均显著高于NT和BpAP1抑制表达转基因白桦,且BpAP1基因在各个时期过表达株系的叶片和雄花序中均处于高表达水平;除BpAP1和TFL1外,其他5条基因的表达高峰均出现在6月中旬的雄花序中;BpAP1基因与其他6条开花相关基因之间均呈极显著的正相关。总之,AP1基因的过量表达引起了白桦的提早开花,同时促使FT、PI、MADS4和MADS5基因的表达量在多数发育时期有着明显地上调表达。
花序分生组织和花分生组织特异基因在木本植物中的研究很少,其中AP1、TFL1、LFY在果树中有一些研究表明,AP1、LFY与开花呈正相关,而TFL1则与开花呈负相关[27-29]。本研究发现,过表达株系中AP1基因的表达量较NT有明显地提高;过表达株系中LFY基因的表达量在大部分时期要高于NT和BpAP1抑制表达株系;TFL1基因的表达量除在9月初较NT和BpAP1抑制表达株系上调之外,其他时期的表达量变化均不显著;因此认为这些基因表达量的变化可能对于白桦在生长发育旺盛的6月至9月起到了重要的作用。
有很多研究表明,FT是一个能直接从叶片运送到茎尖的长距离蛋白[30],它一般会通过与FD形成一个复合体在茎尖特异表达,同时也能激活下游的MADS-box基因,如AP1[31-32]。有研究表明,FT基因的过量表达能够促进拟南芥提早开花[33]。BpAP1过表达株系中FT基因的表达发生了明显的上调,而BpAP1抑制表达株系中FT的表达量则明显下降,这表明AP1虽然位于FT的下游,但该基因在白桦中的过量表达对于FT可能也会有影响,因此认为二者的高表达都可能缩短白桦的童期,引起早花现象。
PISTILLATA是ABC模型中的B类基因,在拟南芥中主要控制花瓣和雌蕊的发育;玉米中的PI基因在种子、叶片和根中均有表达[34];而葡萄中的PI基因在不同发育时期的花序中均有表达,但果实、根和叶片中检测不到该基因的表达,定量PCR结果发现葡萄花序中PI基因的表达量很高,是叶片和根中表达量的400倍[35];BpMADS2在欧洲白桦雄花序中表达明显,随着雄花序的发育,BpMADS2的表达逐渐增强,雌花序中表达很弱甚至检测不到[17]。本研究对BpPI基因进行表达分析发现,该基因在白桦生长发育的8个时期中雄花序中表达量均为最高(图2B);雌、雄花序发育的3个时期中,BpAP1过表达白桦中BpPI的表达量高于相应时期WT中该基因的表达量[22],这表明BpPI基因是花器官特征基因,能够控制白桦雄蕊的发育。
尽管人们对花的形态结构和建成有了相当的认识,但对植物由营养生长向生殖生长转变机理认识还很少,尤其是木本植物,开花过程中基因间的相互关系很多还仅仅基于遗传学的假设。本研究主要对BpAP1基因和BpPI、BpMADS4、BpMADS5、FT、TFL1、LFY这6条开花相关基因在不同发育时期的表达情况进行了分析,探讨白桦BpAP1转录因子与上述基因的调控关系,为揭示白桦BpAP1转录因子的调控机理提供参考。当然,植物生长发育过程中涉及到的代谢途径和基因之间的关系是极其复杂的,后续将采用CHIP技术和转录组测序技术对BpAP1转基因白桦进行研究,构建转录调控网络,进一步了解AP1基因的功能。
[1] KAUFMANN K, WELLMER F, MUIO J M, et al. Orchestration of floral initiation byAPETALA1[J]. Science,2010,328:85-89.
[2] IRISH V F, SUSSEX I M. Function of theapetala-1 gene duringArabidopsisfloral development[J]. Plant Cell,1990,2(8):741-753.
[3] MANDEL M A, GUSTAFSON-BROWN C, SAVIDGE B, et al. Molecular characterization of theArabidopsisfloral homeotic geneAPETALA1[J]. Nature,1992,360:273-277.
[4] MANDEL M A, YANOFSKY M F. A gene triggering flower formation inArabidopsis[J]. Nature,1995,377:522-524.
[5] PELAZ S, GUSTAFSON-BROWN C, KOHALMI S E, et al.APETALA1 andSEPALLATA3 interact to promote flower development[J]. The Plant Journal,2001,26(4):385-394.
[6] WELLMER F, ALVES-FERREIRA M, DUBOIS A, et al. Genome-wide analysis of gene expression during earlyArabidopsisflower development[J]. PLoS Genetics,2006,2(7):e117.DOI:10.1371/journal.pgen.0020117.eor.
[7] JAYA E S, CLEMENS J, SONG J, et al. Quantitative expression analysis of meristem identity genes inEucalyptusoccidentalis:AP1 is an expression marker for flowering[J]. Tree Physiology,2010,30(2):304-312.
[9] THEISSEN G, MELZER R. Molecular mechanisms underlying origin and diversification of the angiosperm flower[J]. Annals of Botany,2007,100(3):603-619.
[10] KOORNNEEF M, DELLAERT L W, VAN DER VEEN J H. EMS and radiation-induced mutation frequencies at individual loci inArabidopsisthaliana(L.) Heynh[J]. Mutat Res,1982,93(1):109-123.
[11] LILJEGREN S J, GUSTAFSON-BROWN C, PINYOPICH A, et al. Interactions amongAPETALA1,LEAFY, andTERMINALFLOWER1 specify meristem fate[J]. Plant Cell,1999,11(6):1007-1018.
[12] PARCY F, NILSSON O, BUSCH MA, et al. A genetic framework for floral patterning[J]. Nature,1998,395:561-566.
[13] WAGNER D, SABLOWSKI R W, MEYEROWITZ E M. Transcriptional activation ofAPETALA1 byLEAFY[J]. Science,1999,285:582-584.
[14] LAMB R S, IRISH V F. Functional divergence within theAPETALA3/PISTILLATAfloral homeotic gene lineages[J]. Proceedings of the National Academy of Sciences,2003,100(11):6558-6563.
[15] NG M, YANOFSKY M F. Activation of theArabidopsisB class homeotic genes byAPETALA1[J]. Plant Cell,2001,13(4):739-753.
[16] SUNDSTRÖM J F, NAKAYAMA N, GLIMELIUS K, et al. Direct regulation of the floral homeoticAPETALA1 gene byAPETALA3 andPISTILLATAinArabidopsis[J]. The Plant Journal,2006,46(4):593-600.
[18] ELO A, LEMMETYINEN J, NOVAK A, et al.BpMADS4 has a central role in inflorescence initiation in silver birch (Betulapendula)[J]. Physiologia Plantarum,2007,131(1):149-158.
[19] ELO A, LEMMETYINEN J, TURUNEN M L, et al. Three MADS-box genes similar toAPETALA1 andFRUITFULLfrom silver birch (Betulapendula)[J]. Physiologia Plantarum,2001,112(1):95-103.
[20] FLACHOWSKY H, PEIL A, SOPANEN T, et al. Overexpression ofBpMADS4 from silver birch (BetulapendulaRoth.) induces early-flowering in apple (Malus×domesticaBorkh.)[J]. Plant Breeding,2007,126(2):137-145.
[21] HUANG H, WANG S, JIANG J, et al. Overexpression ofBpAP1 induces early flowering and produces dwarfism inBetulaplatyphylla×Betulapendula[J]. Physiologia Plantarum,2014,151(4):495-506.
[22] HUANG H, CHEN S, LI H, et al. Next-generation transcriptome analysis in transgenic birch overexpressing and suppressing APETALA1 sheds lights in reproduction development and diterpenoid biosynthesis[J]. Plant Cell Reports,2015,34(9):1663-1680.
[23] 王姗.白桦BpAP1基因过表达和抑制表达研究[D].哈尔滨:东北林业大学,2011.
[24] ZHANG J Z, AI X Y, SUN L M, et al. Transcriptome profile analysis of flowering molecular processes of early flowering trifoliate orange mutant and the wild-type [Poncirustrifoliate(L.) Raf.] by massively parallel signature sequencing[J]. BMC Genomics,2011,12(1):63.
[25] CHANG S, PURYEAR J, CAIRNEY J. A simple and efficient method for isolating RNA from pine trees[J]. Plant Molecular Biology Reporter,1993,11(2):113-116.
[26] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtMethod[J]. Methods,2001,25(4):402-408.
[28] PILLITTERI L J, LOVATT C J, WALLING L L. Isolation and characterization of aTERMINALFLOWERhomolog and its correlation with juvenility in citrus[J]. Plant Physiology,2004,135(3):1540-1551.
[29] ESUMI T, TAO R, YONEMORI K. Relationship between floral development and transcription levels ofLEAFYandTERMINALFLOWER1 homologs in Japanese pear (PyruspyrifoliaNakai) and quince (CydoniaoblongaMill.)[J]. Journal of the Japanese Society for Horticultural Science,2007,76(4):294-304.
[30] TURCK F, FORNARA F, COUPLAND G. Regulation and identity of florigen:FLOWERINGLOCUSTmoves center stage[J]. Annu Rev Plant Biol,2008,59:573-594.
[31] ABE M, KOBAYASHI Y, YAMAMOTO S, et al. FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex[J]. Science,2005,309:1052-1056.
[32] WIGGE P A, KIM M C, JAEGER K E, et al. Integration of spatial and temporal information during floral induction inArabidopsis[J]. Science,2005,309:1056-1059.
[33] HSU C Y, LIU Y, LUTHE D S, et al. PoplarFT2 shortens the juvenile phase and promotes seasonal flowering[J]. Plant Cell,2006,18(8):1846-1861.
[34] 秦巧平,尹涛,陈俊伟,等.APETALA3/DEFICIENS和PISTILLATA/GLOBOSA基因与植物花发育[J].细胞生物学杂志,2006,28(4):571-576.
[35] POUPIN M J, FEDERICI F, MEDINA C, et al. Isolation of the three grape sub-lineages of B-class MADS-boxTM6,PISTILLATAandAPETALA3 genes which are differentially expressed during flower and fruit development[J]. Gene,2007,404(1/2):10-24.
Quantitative Expression Analysis of Several Flowering-related Genes inBpAP1 Transgenic Birch (Betulaplatyphylla×Betulapendula)//
Huang Haijiao, Li Huiyu, Jiang Jing
(State Key Laboratory of Tree Genetics and Breeding, Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University,2017,45(1):1-6.
Birch;BpAP1; Flowering-related genes; Expression pattern; qRT-PCR
1)国家自然科学基金项目(31570647)。
黄海娇,女,1985年10月生,林木遗传育种国家重点实验室(东北林业大学),工程师。E-mail:haijiao_sea@163.com。
姜静,林木遗传育种国家重点实验室(东北林业大学),教授。E-mail:jiangjing1960@126.com。
2016年11月3日。
S792.153;Q344+.13
责任编辑:程 红。
——植物学教材质疑(六)

