miRNA-1181抑制人胰腺癌细胞的增殖*
王 杰, 喻 超, 周显飞, 朱昌豪, 黄 巍, 江建新
(贵州医科大学附院 肝胆外科, 贵州 贵阳 550004)
·专题研究2·
miRNA-1181抑制人胰腺癌细胞的增殖*
王 杰, 喻 超, 周显飞, 朱昌豪, 黄 巍, 江建新**
(贵州医科大学附院 肝胆外科, 贵州 贵阳 550004)
目的: 探讨miRNA-1181(miR-1181)对人胰腺癌细胞增殖能力的影响。方法: 采用实时荧光定量聚合酶链反应(qRT-RCR)检测miR-1181在4株人胰腺癌细胞系及1株人正常胰腺上皮细胞系中的表达,选取miR-1181表达差异较明显的PANC-1和MIA PaCa-2细胞系进行后续实验;构建miR-1181过表达慢病毒载体(miR-1181U)以及空载慢病毒载体(NC),采用qRT-PCR检测感染效率;在体外采用CCK-8实验,平板克隆实验检测miR-1181对胰腺癌细胞增殖能力的影响;建立裸鼠皮下成瘤模型,用免疫组化实验检测miR-1181对胰腺癌细胞成瘤能力的影响。结果: qRT-PCR显示4株胰腺癌细胞系中miR-1181表达量低于正常胰腺上皮细胞(P<0.05);过表达miR-1181后PANC-1和MIA PaCa-2细胞增殖能力明显受到抑制(P<0.05),细胞集落形成数量明显减少(P<0.05);裸鼠皮下成瘤模型显示过表达miR-1181后肿瘤体积及免疫组化指标Ki67均明显低于对照组(P<0.05)。结论: 过表达的miR-1181能在体内体外抑制胰腺癌细胞的增殖,有望成为胰腺癌治疗的新靶点。
胰腺肿瘤; 细胞; 增殖; 慢病毒感染; 微小RNA; miR-1181
胰腺癌因其早期不易诊断,治疗效果差,预后不理想,被誉为致死性最高的消化道恶性肿瘤之一[1],因此早期精确的诊断以及新型的治疗手段对胰腺癌的诊治尤其重要[2]。miRNA是一类非编码的微小RNA,可以在转录后或者翻译水平与靶mRNA结合,使其降解并抑制基因的表达从而参与调控细胞的一系列生物行为[3]。本课题组前期研究表明miR-1181能抑制肿瘤干细胞成球形成率以及肿瘤干细胞标记物CD133的表达,并且能减少侧群细胞的形成[4];还有研究表明miR-1181可通过直接抑制SOX2和STAT3来抑制肿瘤干细胞的干扰[4],本研究主要探讨miR-1181对胰腺癌细胞增殖的影响。
1 材料和方法
1.1 材料
1.1.1 细胞株及试剂 人胰腺癌细胞株AsPC-1、BxPC-3、PANC-1、MIA PaCa-2以及人正常胰腺导管上皮细胞株HPDE由华中科技大学附属同济医院胆胰外科实验室馈赠,高糖DMEM培养基、RPMI 1640培养基、胎牛血清购自美国Gibco公司,慢病毒载体由上海吉凯公司负责包装和构建,CCK-8试剂盒购自日本同仁化学研究所,Ki67抗体购自美国CST公司。
1.1.2 动物 免疫缺陷小鼠(Balb/c nude mice)购于北京华阜康生物科技股份有限公司,雌性,4周龄,体质量14~15 g。
1.2 方法
1.2.1 细胞培养 人正常胰腺导管上皮细胞HPDE、人胰腺癌细胞AsPC-1、BxPC-3用RPMI 1640培养基(含10%FBS),置于37 ℃、5% CO2恒温培养箱培养,人胰腺癌细胞PANC-1和MIA PaCa-2用高糖DMEM培养基(含10%FBS),置于37 ℃、5% CO2恒温培养箱培养。
1.2.2 miR-1181在人胰腺癌及正常胰腺细胞中的表达 根据Trizol说明书提取各类细胞中总RNA,选取吸光度为1.8~2.0(A260/A280)的样本用于实验。再根据逆转录试剂盒说明书,以U6作为内参,分别逆转录为cDNA,逆转录反应为25 μL反应体系,反应条件为70 ℃ 10 min,42 ℃ 50 min,70 ℃ 10 min,4 ℃保存。以U6作为内参,实时荧光定量PCR(qRT-PCR)反应为25 μL反应体系,反应条件为95 ℃ 15 min,94 ℃ 15 s、55 ℃ 30 s、70 ℃ 30 s,45个循环。采用相对定量法(relative quantitative,RQ)表示miR-1181的表达量。
1.2.3 慢病毒感染及效率检测 根据PCR结果选取两株胰腺癌细胞系,待其贴壁生长至70%~80%融合时,用0.05%胰酶消化传代培养,按慢病毒感染手册感染胰腺癌细胞。实验分为过表达组(miR-1181U),阴性对照组(NC)和空白对照组(BC)3组,待其感染1周后采用RT-PCR检测感染效率。
1.2.4 CCK-8实验 制备细胞悬液,调整细胞密度为1×108个/L,接种到96孔板中,每孔约100 μL细胞悬液,每个样约5个副孔。分别于4、24、48、72、96 h加入含10% CCK8的培养液,培养3 h后测定波长为450 nm时每孔的吸光度。
1.2.5 平板克隆实验 收集对数生长期细胞,调整细胞悬液浓度为1×106个/L,于六孔板中种植2 000个细胞,37 ℃培养箱中培养7~8 d后,4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,计数每孔克隆形成数量并拍照记录。
1.2.6 裸鼠皮下成瘤模型 将6只裸鼠随机分成阴性对照组(NC组)和过表达组(miR-1181U组),分别收集对数生长期稳定表达的细胞,用PBS重悬后弃上清,再将PBS与Matrigel基质胶按1∶1体积混合,将混合液重悬并调整细胞浓度为1×1010个/L,于每只裸鼠的右后腿部皮下注射200 μL细胞悬液。在相同条件下(间断12 h光照与黑暗,自由进食等)饲养6周,每周观察1次裸鼠,记录裸鼠体质量及肿瘤大小。6周后采用颈部脱臼法处死裸鼠,解剖裸鼠取出肿瘤并拍照。
1.2.7 Ki67在裸鼠肿瘤中的表达 将解剖后的裸鼠肿瘤组织用4%多聚甲醛固定,石蜡包埋,HE染色;将细胞增殖相关蛋白Ki67按1∶400稀释后染色。每组肿瘤切片随机选取5张切片,每张切片随机选取3个视野,观察并拍照。
1.3 统计学处理

2 结果
2.1 miR-1181的表达
与正常胰腺导管上皮细胞HPDE相比,4株胰腺癌细胞miR-1181均为低表达,其中AsPC-1、PANC-1、MIA PaCa-2细胞株中miR-1181,显著低于HPDE细胞株,差异有统计学意义(P<0.05)。BxPC-3细胞株中miR-1181表达量与HPDE比较差异无统计学意义(P>0.05),见图1A。
2.2 miR-1181慢病毒在胰腺癌中的感染效率
根据细胞系表达情况,选取PANC-1和MIA PaCa-2作为实验所用细胞系,并感染慢病毒。PANC-1、MIA PaCa-2两株细胞miR-1181U组均比BC组和NC组显著升高(P<0.05),见图1B,1C。
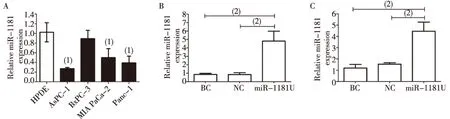
注:A为miR-1181在胰腺癌细胞系中低表达,B为PANC-1感染慢病毒后各组miR-1181的表达, C为MIA PaCa-2感染慢病毒后各组miR-1181的表达;(1)P<0.05,(2)P < 0.01图1 qRT-PCR检测miR-1181表达Fig.1 MiR-1181 expression evaluated by PCR
2.3 miR-1181对胰腺癌细胞增殖能力的影响
当PANC-1细胞培养72 h及96 h时,miR-1181U组吸光度值较NC组和BC组明显降低,差异有统计学意义(P<0.05,图2A);当MIA PaCa-2细胞培养96 h时,miR-1181组吸光度值较NC组和BC组明显降低,差异有统计学意义(P<0.05,图2B)。

注:A为PANC-1细胞系,B为MIA PaCa-2细胞系;(1)P<0.05图2 miR-1181U对胰腺癌细胞增殖能力的影响(CCK-8)Fig.2 The effect of miR-1181U on proliferation of pancreatic cancer cells
2.4 miR-1181对胰腺癌细胞集落形成的影响
平板克隆实验结果显示,miR-1181U组集落形成数量PANC-1为(334.7±16.48),MIA PaCa-2为 (153.7±8.51);NC组集落形成数量PANC-1为(917.0±37.58),MIA PaCa-2为(308.0±11.15);BC组集落形成数量PANC-1为(910.7±36.99),MIA PaCa-2为(316.7±13.16);miR-1181U组较NC组及BC组集落形成数量均明显减少,差异均有统计学意义(P<0.05,图3)。
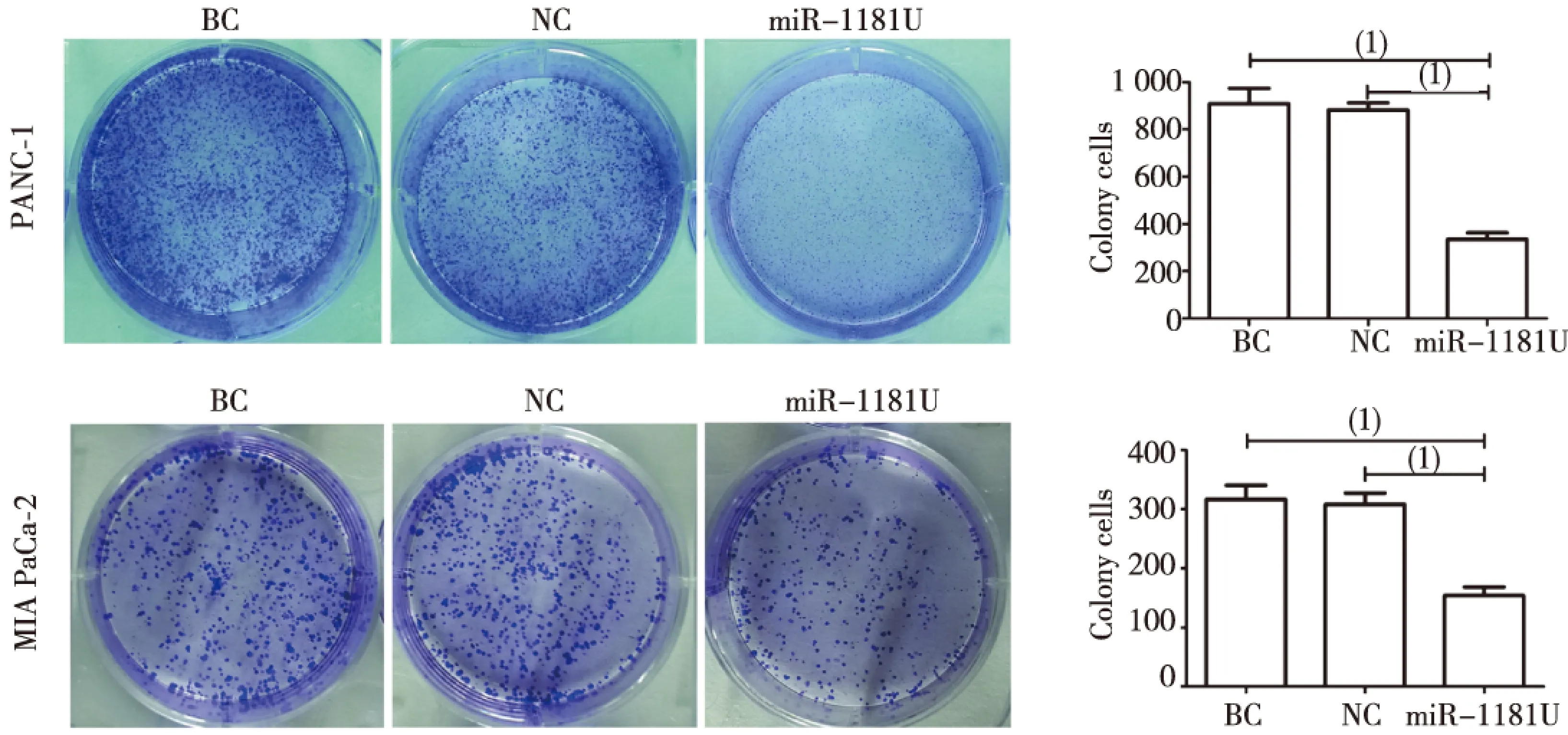
注:(1)P<0.05图3 miR-1181U对胰腺癌细胞克隆形成的影响(平板克隆)Fig.3 The effect of miR-1181U on colony forming of pancreative cancer cells
2.5 miR-1181对胰腺癌细胞体内成瘤的影响
裸鼠每组3只,注射细胞悬液后饲养6周,取出肿瘤,测定肿瘤体积volume(mm3),miR-1181U组(155.3±9.03)mm3,NC组(291.0±11.37)mm3,miR-1181U组较NC组肿瘤体积明显变小,差异有统计学意义(P<0.05,图4)。
2.6 miR-1181对肿瘤增殖膜指标Ki67的影响
免疫组化结果显示,Ki67的相对表达量miR-1181U组为(0.18±0.02),NC组为(0.55±0.03),miR-1181U组Ki67表达量明显低于NC组,差异有统计学意义(P<0.05,图5)。

(1)P<0.05图4 miR-1181裸鼠皮下成瘤能力Fig.4 Subcutaneous tumor formation in nude mice to detect subcutaneous tumor forming ability of miR-1181
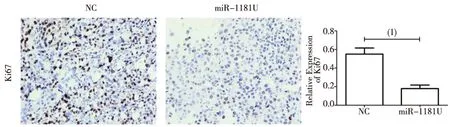
(1)P<0.05图5 miR-1181对增殖指标Ki67的影响(免疫组化,×400)Fig.5 The effect of miR-1181on Ki67 expression
3 讨论
近期研究显示,约30%的蛋白编码基因受miRNA所调控,每条miRNA都能特异性结合靶基因mRNA的3′-UTR序列,从而参与调控成千上万的基因表达[5]。miRNA作为一种转录后调控序列,参与机体的各种生理功能,如胚胎发育,细胞增殖以及细胞凋亡等。miRNA的异常表达在疾病发生、发展包括肿瘤形成过程中起到了显著的作用[6]。有研究表明,miRNA-330-5p在结肠癌中表达量明显低于癌旁组织,当过表达miR-330-5p后能显著抑制结肠癌细胞的增殖能力,并通过“双荧光素酶报告分析”确定人整合素5(ITGA5)是其直接作用靶基因[7]。Pei YF等[8]研究发现,miR-29a不仅能促进乳腺癌细胞的增殖,还能促进乳腺癌上皮细胞向间(充)质细胞转化进而获得迁徙能力。而在胰腺癌的报道中,Tanaka R等[9]研究发现miR-17-92能通过MEK-ERK信号通路影响胰腺癌细胞MIA PaCa-2的细胞周期,阻滞细胞从G1期进入到S期,进而影响增殖能力。Chang W等[10]通过癌症基因组图谱中发现miR-377在胰腺癌中呈低表达,并实验证实miR-377在组织及细胞中均呈低表达,进一步确定Pim-3为其直接作用靶点,miR-377通过抑制Pim-3的表达来抑制胰腺癌细胞的增殖。迄今为止,对miR-1181的研究甚少,只在卵巢癌和肝癌报道中有所提及[11-12]。本课题组前期研究只表明miR-1181能影响胰腺癌细胞干性[4],并未直接阐明miR-1181对胰腺癌细胞生物学效应的影响。另一方面,miR-1181的直接作用靶蛋白尚未明确,是否通过影响某些通路(如MAPK通路,PI3K/AKT通路和Hedgehog通路)进而影响细胞的增殖,均需进一步实验探究[13-15]。
本研究重点从体内体外两方面说明miR-1181对胰腺癌细胞的增殖有明显影响。体外采用CCK-8实验、平板克隆实验分别表明miR-1181能抑制胰腺癌细胞的增殖以及减少克隆集落的形成。体内建立裸鼠皮下成瘤模型证实miR-1181能抑制胰腺癌细胞的体内成瘤,且肿瘤免疫组化切片显示miR-1181能抑制Ki67的表达。故我们可以得出结论,miR-1181能抑制胰腺癌细胞的增殖。
综上,miR-1181在胰腺癌中是作为一种抑癌基因的形式而存在的,能显著抑制胰腺癌细胞体外增殖以及体内成瘤,为进一步研究其具体机制提供了一定的理论基础,miR-1181有望成为胰腺癌诊治的潜在靶点。
[1] Hidalgo M. Pancreatic cancer[J]. N Engl J Med, 2010(17): 1605-1617.
[2] Szafranska AE, Davison TS, John J, et al. MicroRNA expression alterations are linked to tumorigenesis and non-neoplastic processes in pancreatic ductal adenocarcinoma[J]. Oncogene, 2007(30): 4442-4452.
[3] Jiang B, Mu W, Wang J, et al. MicroRNA-138 functions as a tumor suppressor in osteosarcoma by targeting differentiated embryonic chondrocyte gene[J]. J Exp Clin Cancer Res, 2016 (1): 69.
[4] Jiang J, Li Z, Yu C, et al. MiR-1181 inhibits stem cell-like phenotypes and suppresses SOX2 and STAT3 in human pancreatic cancer[J]. Cancer Lett, 2015(2): 962-970.
[5] Schultz NA, Dehlendorff C, Jensen BV, et al. MicroRNA biomarkers in whole blood for detection of pancreatic cancer[J]. JAMA, 2014(4): 392-404.
[6] Ambros V. The functions of animal microRNAs[J]. Nature, 2004(7006): 350-355.
[7] Yoo HI, Kim BK, Yoon SK. MicroRNA-330-5p negatively regulates ITGA5 expression in human colorectal cancer[J]. Oncol Rep, 2016 (2):280.
[8] Pei YF, Lei Y, Liu XQ. MiR-29a promotes cell proliferation and EMT in breast cancer by targeting ten eleven translocation [J]. Biochim Biophys Acta, 2016(11): 2177-2185.
[9] Tanaka R, Tomosugi M, Sakai T, et al. MEK inhibitor suppresses expression of the miR-17-92 cluster with G1-phase arrest in HT-29 human colon cancer cells and MIA PaCa-2 pancreatic cancer cells[J]. Anticancer Res, 2016(9): 4537-4543.
[10]Chang W, Liu M, Xu J, et al. MiR-377 inhibits the proliferation of pancreatic cancer by targeting Pim-3[J]. Tumour Biol, 2016 (5):537-539.
[11]Zhang HY, Li JH, Li G. Activation of ARK5/miR-1181/HOXA10 axis promotes epithelial-mesenchymal transition in ovarian cancer[J]. Oncol Rep, 2015(3): 1193-1202.
[12]Liu X, Wang T, Wakita T, et al. Systematic identification of microRNA and messenger RNA profiles in hepatitis C virus-infected human hepatoma cells[J]. Virology, 2010(1): 57-67.
[13]Ji S, Qin Y, Shi S, et al. ERK kinase phosphorylates and destabilizes the tumor suppressor FBW7 in pancreatic cancer[J]. Cell Res, 2015(5): 561-573.
[14]Mao Y, Xi L, Li Q, et al. Regulation of cell apoptosis and proliferation in pancreatic cancer through PI3K/Akt pathway via Polo-like kinase [J]. Oncol Rep, 2016 (1): 49-56.
[15]Bai Y, Bai Y, Dong J, et al. Hedgehog signaling in pancreatic fibrosis and cancer[J]. Medicine (Baltimore), 2016(10): 2996.
(2016-10-06收稿,2016-11-28修回)
中文编辑: 刘 平; 英文编辑: 刘 华
The Inhibiting Effect of miRNA-1181 on Cell Proliferation of Pancreatic Cancer Cell
WANG Jie, YU Chao, ZHOU Xianfei, ZHU Changhao, HUANG Wei, JIANG Jianxin
(DepartmentofHepatic-Biliary-PancreaticSurgery,theAffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
Objective: To investigate the effect of microRNA-1181 on the proliferation of pancreatic cancer. Methods: Quantitative polymerase chain reaction (qRT-RCR) was adopted to detect the expression of miR-1181 in 4 human pancreatic cancer cell lines and 1 human normal pancreatic epithelial cell lines. The PANC-1 and MIA PaCa-2 cell lines with significantly different miR-1181 expression were selected for subsequent experiments. The miR-1181 over-expression lentiviral vector (miR-1181U) and the empty lentiviral vector vector (NC) were constructed and qRT-PCR was used to detect infection efficiency. The effect of miR-1181 on the proliferation of pancreatic cancer cells was detected by CCK-8 assay and Plate cloning experiment in vitro. The subcutaneous tumor model of nude mice was established, and the effect of miR-1181 on the ability of pancreatic cancer cells was detected by immunohistochemistry. Results: qRT-PCR showed that the expression of miR-1181 in 4 pancreatic cancer cell lines was significantly lower than that in normal pancreatic epithelial cells (P<0.05). The proliferation ability of PANC-1 and MIA PaCa-2 cells was significantly inhibited after over-expression of miR-1181 (P<0.05), and the number of colony formation was significantly decreased (P<0.05). Subcutaneous tumor model in nude mice showed that the tumor size and immunohistochemistry index Ki67 were significantly lower than those in the normal control group (P<0.05) after over-expression of miR-1181. Conclusion: Over-expression of miR-1181 can inhibit the proliferation of pancreatic cancer cells in vitro and in vivo, and is expected to become a new target for the treatment of pancreatic cancer.
pancreatic neoplasms; cells; proliferation; lentivirus infections; micro RNA; miR-1181
国家国际科技合作专项资助(2014DFA31420); 国家自然科学基金(81160311,81572429,81660483)
时间:2016-12-15
http://www.cnki.net/kcms/detail/52.1164.R.20161215.1534.005.html
R735.9
A
1000-2707(2016)12-1382-05
10.19367/j.cnki.1000-2707.2016.12.004
**通信作者 E-mail:jjx731003@163.com

