氯离子通道蛋白-3对胶质瘤细胞增殖和侵袭的影响
张广宇, 贾世峰, 曹旭华, 张晓炜, 焦保华
(1.河北医科大学第二医院 神经外科, 河北 石家庄 050000; 2.华北理工大学附属医院 肿瘤科, 河北 唐山 063000)
氯离子通道蛋白-3对胶质瘤细胞增殖和侵袭的影响
张广宇1, 贾世峰2, 曹旭华1, 张晓炜1, 焦保华1
(1.河北医科大学第二医院 神经外科, 河北 石家庄 050000; 2.华北理工大学附属医院 肿瘤科, 河北 唐山 063000)
目的: 观察氯离子通道蛋白-3(ClC-3)对胶质瘤BT-235细胞增殖和侵袭的影响的子机制。方法: 采用siRNA技术构建ClC-3表达沉默的人胶质瘤BT-235细胞株,设为siClC-3组,并设置空白对照组和空载体组;采用Western bolting检测3组细胞中ClC-3的表达,CCK8法检测细胞增值活性,ranswell实验用于测定细胞侵袭能力,通过测量细胞容积检测细胞调控性容积下降率,流式细胞术用于测定细胞周期;采用Western bolting检测cyclin D1、MMP-2和MMP-9的表达。结果: 相对于空白对照组,siClC-3组ClC-3表达明显降低(P<0.01),细胞增殖活性明显降低(P<0.01),细胞迁移率明显降低(P<0.01);空白对照组细胞调控性容积下降率为(79.35±2.31)%,而siClC组仅为(19.46±1.76)%,差异有统计学意义(P<0.01);培养48 h的空白对照组BT-235细胞G0/G1期占比率为(57.2±3.1)%,而siClC-3组G0/G1期占比率提升至 (71.3±4.0)%,产生明显的G0/G1期阻滞,差异有统计学意义(P<0.01);相对于空白对照组,siClC-3组G1期调控蛋白cyclin D1、侵袭相关蛋白MMP-2和MMP-9表达水平明显降低(P<0.01)。结论: ClC-3能明显增强胶质瘤BT-235细胞增殖和侵袭能力,其作用机制与增加细胞调控性容积下降率,诱导cyclin D1、MMP-2和MMP-9表达有关。
氯离子通道蛋白-3; 神经胶质瘤; 增殖; 侵袭
胶质瘤是最常见的脑部恶性肿瘤,具有高度的异型性、较强的侵袭能力及对放化疗抵抗的特点,是中枢神经系统致死率最高的恶性肿瘤,中位存活时间低于1.5年[1]。胶质瘤细胞过度增殖和广泛的组织浸润是胶质瘤治疗困难的主要原因,寻找有效的阻断胶质瘤细胞恶性增殖和侵袭的分子靶点是其研究的热点[2]。氯离子通道蛋白3(chloride channel-3,ClC-3)是电压依赖氯通道(chloridechannel of the CLCgene family,CLC)家族的一员,参与细胞调节性容量变化,与细胞增殖、分化、凋亡等细胞周期事件有密切的关系[3]。ClC-3在胸部肿瘤[4]、脑部肿瘤[5]和结直肠癌[6]等多种恶性肿瘤中呈现高表达,并且ClC-3在脑部肿瘤的高表达与其侵袭能力和恶性程度呈正相关关系,这种高表达的生物学意义和机制值得深入研究。本研究使用siRNA技术建立ClC-3表达敲除的脑胶质瘤细胞,拟探究ClC-3对脑胶质瘤细胞增殖和侵袭影响及其分子机制。
1 材料与方法
1.1 实验细胞及试剂
胶质瘤细胞株BT-325购自中科院上海细胞库,由本室保存。胎牛血清和DMEM高糖培养基购自美国Gibco公司,胰蛋白酶、青霉素和链霉素购自美国Sigma公司,CCK-8(cell counting kit-8)试剂盒购自上海铭睿生物科技有限公司,siRNA引物和pLKO.1-Puro质粒购自南京建成生物技术有限公司,ClC-1和cyclin D1抗体购自南京凯基生物科技公司,MMP-2和MMP-9抗体购自北京索莱宝生物科技公司。
1.2 方法
1.2.1 分组 采用siRNA技术构建ClC-3表达沉默的人胶质瘤BT-235细胞株,设为siClC-3组,并设置空白对照组和空载体组。
1.2.2 胶质瘤BT-325 培养 胶质瘤BT-325细胞培养于25 cm2细胞培养瓶中,每瓶加5 mL 10%热灭活的胎牛血清、25 mg/L-1青霉素和25.000 U/L链霉素的DMEM高糖培养基,在37 ℃、5% CO2和100%饱和湿度的CO2培养箱中培养。当细胞融合达到80%以上,胰蛋白酶消化传代。
1.2.3 siRNA靶序列设计及细胞筛选 根据PubMed的GeneBank数据库中ClC-3基因的序列以及siRNA的设计原则,设计人ClC-3 cDNA不同区域的RNAi,由Invitrogen公司设计合成,其序列为: 5′-AUAAUAGCUAACCUCCUCCAAACUA-3′,化学合成siClC-3克隆入pLKO.1-Puro质粒中,交由上海生工公司鉴定。预先培养于75 cm2细胞培养瓶中,待80%细胞融合时,经利用脂质体lipofectAMINE2000瞬时转染胶质瘤细胞。转染48 h后使用潮霉素筛选阳性克隆,阳性克隆即ClC-3基因表达沉默的BT-325细胞,并扩大培养。
1.2.4 CCK8法测定药物敏感性 收集对数期BT-325细胞,以2×108/L密度接种于96孔板,经过上述技术路线处理方法处理后,按照操作说明,加入CCK8试剂10 μL,放置于5% CO2培养箱中孵育2 h,于酶联免疫仪器上用波长450 nm处测定光密度值,OD值的大小反映活细胞的线粒体活性,细胞的线粒体活性=处理组的OD值/空白组的OD值×100%。
1.2.5 细胞容积测量 对数生长期的BT-325细胞用胰蛋白酶消化后,接种于含10%胎牛血清的DMEM培养基的24孔板中,置37 °C、5% CO2孵箱中培养3~4 h;置于等渗溶液中3 min,然后置于低渗液中25 min,最后重新回到等渗液中5 min;在倒置显微镜下连续拍照,每60 s/次,获取的细胞图像采用Imageproplus分析软件进行分析,测量细胞容积方程:V = 4/3×S×(S/π)1/2,S指细胞面积,计算调控性细胞容积下降率[调控性细胞容积下降率(%)=Vmax-Vmin/Vmax-V0×100% ]。
1.2.6 流式细胞术观察细胞周期 用PI染色区分细胞周期的变化。胶质瘤细胞,细胞消化后600 g离心5 min,冰冷PBS漂洗2次,离心后弃上清。用体积分数为70%冰乙醇制备成单细胞悬液,4 ℃固定24 h,PBS离心洗去乙醇加PI染液(含50 mg/L PI,10 mg/L RNAseA,0.1% TritonX-100,1%柠檬酸钠和0.5% NaCl),室温下避光染色30 min,用EPICS XL型流式细胞仪收集20 000个细胞,记录激发波长488 nm处红色荧光强度,分析DNA周期,计算出细胞各期比例。
1.2.7 细胞侵袭实验 用无血清培养基调细胞密度为2×108/L,在transwell小室(transwell chamber)上槽腔内加入100 μL无血清含0.2% BSA的2×104个胶质瘤细胞或者2×104个ClC-3敲除胶质瘤细胞,transwell小室下槽腔内加入600 μL含10% FBS的培养基,在37 ℃、5% CO2培养箱中培养12 h。用棉签小心擦除transwell小室上槽腔内细胞,90%酒精固定30 min,0.1%结晶紫染色10 min,用PBS漂洗3次,每次10 min。倒置显微镜下随机拍照,计算紫色细胞个数。
1.2.8 Western bloting检测蛋白表达水平 取对数生长期3组细胞,收集蛋白样品,加入等体积上样缓冲液和10% DTT,95 ℃加热变性5 min,8% SDS-PAGE电泳后,电转移至PVDF膜上。5%脱脂牛奶室温封闭2 h, 按照1∶1 000比例加入人ClC-3多克隆抗体及β-actin单克隆抗体,4 ℃孵育过夜,TBST洗涤30 min,每10 min换液1次。分别加入1∶2 000稀释辣根过氧化物酶标记的二级抗体,室温孵育1 h(或37 ℃ 30 min),TBST洗涤30 min,每10 min换液1次。在暗室中压X片,完成结合信号显影,凝胶成像系统分析实验结果。
1.3 统计学分析

2 结果
2.1 siClC-3对胶质瘤BT-325细胞增殖的影响
Western bloting结果显示,经siClC-3转染后,BT-325细胞中ClC-3蛋白表达被明显抑制,siClC-3组细胞ClC-3蛋白表达明显低于空白对照组和空载体组(P<0.01),见图1。CCK-8法显示,以空白对照组24 h细胞存活率为100%,经siClC-3转染后,siClC组细胞24 h细胞存活率仅为5%,差异具有统计学意义(P<0.01)。

注:A为空白对照组,B为空载体组,C为siClC-3组图1 siClC-3转染对BT-325细胞中 ClC-3蛋白表达的影响Fig.1 Influence of siCIC-3 transfection on CIC-3 protein in BT-325 cell
2.2 siClC-3对胶质瘤BT-325细胞调控性容积的影响
细胞容积测量结果显示,经siClC-3转染后,siClC-3组细胞调控性容积下降率明显降低,差异有统计学意义(P<0.01),见表1。

表1 siDNA-PKcs对胶质瘤BT-325细胞 耐药的逆转作用±s)Tab.1 Conversing effect of siDNA-PKcs on glioma U251 cell resistance
(1)与空白对照组比较,P<0.05
2.3 siClC-3对胶质瘤BT-325细胞侵袭的影响
细胞侵袭结果显示,经siClC-3转染后,siClC-3组细胞迁移能力明显低于对照组(P<0.01),见图2和表2。
2.4 siClC-3对胶质瘤BT-325细胞周期的影响
流式细胞术结果显示,培养48 h的空白对照组BT-325细胞G0/G1期占比率为(57.2±3.1)%,S期细胞占比为(31.8±1.8)%,G2/M期细胞所占为(11.2±1.5)%;空载体组细胞G0/G1期占比率为(57.3±2.9)%,S期细胞占比为(31.5±2.1)%,G2/M期细胞所占为(l1.7±1.4)%,两者间差异无统计学意义(P>0.05)。而siClC-3组G0/G1期占比率提升至 (71.3±4.0)%,S期细胞占比下降至(24.1±2.1)%,G2/M期细胞占比降低至(6.2±1.1)%,相对于空白对照组均差异有统计学意义(P<0.05)。这提示ClC-3蛋白表达沉默可使细胞周期停滞在G0/G1期。

注:A为空白对照组,B为空载体组,C为siClC-3组图2 siClC-3转染对BT-325细胞迁移能力的影响Fig.2 Influence of siCIC-3 transfection on BT-325 cell migration表2 siClC-3转染对BT-325细胞 迁移能力的影响±s)Tab.2 Influence of siCIC-3 transfection on BT-325 cell migration

迁移细胞比率(%)空白对照组100±631空载体组9733±896siClC⁃3组1568±423(1)
(1)与空白对照组比较,P<0.05
2.5 siClC-3抑制胶质瘤BT-325细胞cyclin D1蛋白表达的影响
Western bloting检测结果显示,siClC-3转染后,cyclin D1蛋白表达被明显抑制,siClC-3组细胞ClC-3蛋白表达明显低于空白对照组和空载体组(P<0.01),见图3。
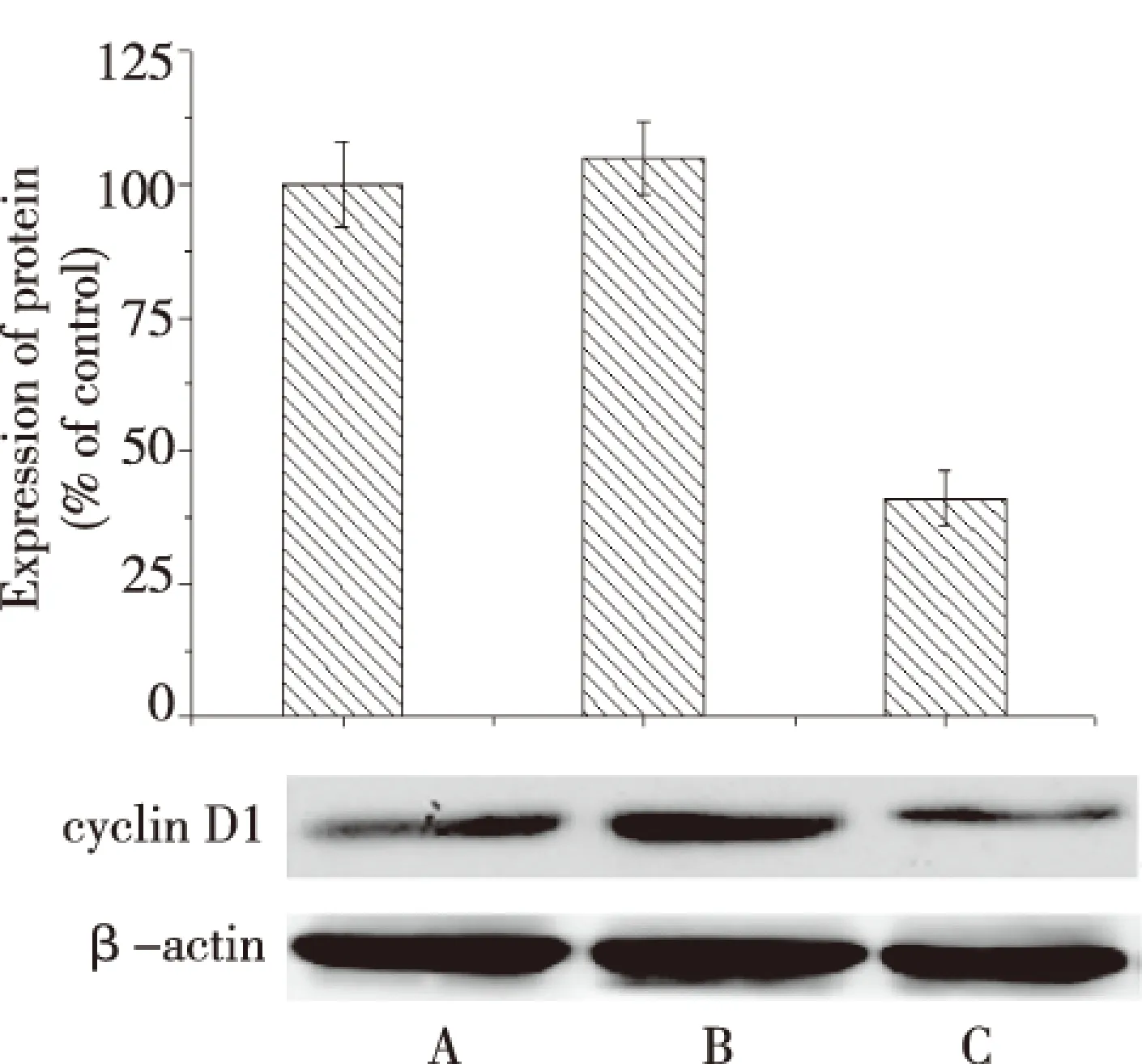
注:A为空白对照组,B为空载体组,C为siClC-3组图3 siClC-3转染对BT-325细胞cyclin D1 蛋白表达的影响Fig.3 Influence of siCIC-3 transfection on BT-325 cell cyclin D1 protein expression
2.6 siClC-3对胶质瘤BT-325细胞迁移相关蛋白表达的影响
Western bloting检测结果显示,siClC-3转染后,siClC-3组MMP-2和MMP-9蛋白表达被明显抑制,明显低于空白对照组和空载体组(P<0.01),见图4。

注:A为空白对照组,B为空载体组,C为siClC-3组图4 siClC-3转染对BT-325细胞迁移 相关蛋白表达的影响Fig.4 Influence of siCIC-3 transfection on BT-325 cell migration related protein expression
3 讨论
胶质瘤是高度的异型性、侵袭能力和放化疗抵抗较强的恶性肿瘤,迄今为止,其发病机制尚不明确,高增值和高转移是其重要的特征。在肿瘤的转移过程中,细胞形态变化是维持细胞进行迁移的物质基础[7]。肿瘤细胞增殖则有赖于细胞是否进入分裂周期以及分裂周期能否完成,G1/S和G2/M转换在其中发挥关键作用[8]。近年来研究人员发现,容积调节性氯通道参与调控细胞容积的变化,可能在细胞增殖中起重要作用;且其活性随细胞周期进程改变而变化,当细胞静止在G0期时活性较低,进入细胞周期G1后开始升高,G1/S转换时其活性最高[9]。ClC-3是电压依赖氯通道家族的一员,可表达在细胞膜上,从而可发挥氯离子通道功能,参与细胞调节性容量变化[10]。本研究通过siClC-3转染敲除了脑胶质瘤细胞BT-325的ClC-3表达,发现ClC-3的表达沉默导致BT-325细胞调控性容积下降率的降低。ClC-3通过容积调节性氯通道参与调控细胞容积的变化,这表明ClC-3表达缺失导致BT-325细胞形变能力的缺失。而对细胞增殖和侵袭的研究发现,ClC-3的缺失导致BT-235细胞细胞增殖活性下降,并且细胞迁移能力同样降低。
Ganapathi等[11]研究发现,当ClC-3高表达时,平滑肌细胞周期从G0/G1期向S期转换加快,DNA合成增加;而siRNA沉默ClC-3则阻止细胞从G0/G1期进入S期,认为ClC-3参与与细胞周期G1/S转换。在本研究中,ClC-3的缺失导致BT-235细胞阻滞于G0/G1期,提示ClC-3在胶质瘤细胞G1/S转换发挥关键作用。对细胞周期相关蛋白的检测发现,ClC-3的缺失导致cyclin D1表达下调。Cyclin D1是调控Gl期的重要的细胞周期蛋白,可以促进Gl/S期转换而加速细胞周期过程,在包括胶质瘤在内的多种肿瘤中过表达[12]。Rohrbough等[13]的研究报道,鼻咽癌CNZ-2Z细胞中ClC-3的表达沉默抑制cyclin D1, cyclin E的表达,增加p27Kip1,p21Waf1表达。这些结果提示ClC-3蛋白可在信号通路较上游位置作为细胞周期促进因子调节细胞G1/S转换。MMP-2 和 MMP-9,是基质金属蛋白酶家族的成员,两者可作为胶质瘤患者肿瘤转移中的重要参与者。Larrouture等[14]研究报道,应用特异性抑制剂 IAA94 阻断 ClC-1 通道可以抑制结肠癌细胞DLD-1的容积调节氯通道活性和氯通道电流,进一步western bloting分析显示DLD-1细胞MMP-2 和 MMP-9表达下调。本研究对细胞迁移相关蛋白的检测发现,ClC-3的表达缺失导致MMP-2 和 MMP-9表达下调,提示ClC-3对胶质瘤BT-235细胞的侵袭能力增强不仅涉及到细胞调控性容积下降率的增大,也与MMP-2 、MMP-9等侵袭相关蛋白上调相关。
综上所述,本研究证实ClC-3通过调节细胞增殖而影响胶质瘤生长,为从氯通道角度为开发防治胶质瘤的药物提供实验依据;并且可为探索胶质瘤的防治提供一条新的思路,将有良好的临床应用前景,对患者治疗对策的制定和预后的判断将起到积极的指导作用。
[1] Liang J, Piao Y, Holmes L, et al. Neutrophils promote the malignant glioma phenotype through S100A4[J]. Clinical Cancer Research, 2014(1): 187-198.
[2] Reardon DA, Groves MD, Wen PY, et al. A phase I/II trial of pazopanib in combination with lapatinib in adult patients with relapsed malignant glioma[J]. Clinical Cancer Research, 2013(4): 900-908.
[3] Cuddapah VA, Turner KL, Seifert S, et al. Bradykinin-induced chemotaxis of human gliomas requires the activation of KCa3. 1 and ClC-3[J]. The Journal of Neuroscience, 2013(4): 1427-1440.
[4] Qin C, He B, Dai W, et al. Inhibition of metastatic tumor growth and metastasis via targeting metastatic breast cancer by chlorotoxin-modified liposomes[J]. Molecular pharmaceutics, 2014(10): 3233-3241.
[5] 邹丽莉, 叶东, 吕瑞玲, 等. 敲低 IK1 钾通道抑制 ClC-3 氯通道的表达和功能[J]. 中国病理生理杂志, 2015(12): 2113-2119.
[6]王艳萍, 姬林松, 樊宏伟, 等. 阻断 CLC-3 氯通道对结直肠癌细胞株生存率和侵袭转移能力的影响及其分子机制[J]. 中国肿瘤临床, 2016(9): 361-365.
[7] Hubbi ME, Semenza GL. An essential role for chaperone-mediated autophagy in cell cycle progression[J]. Autophagy, 2015(5): 850-851.
[8] Tang HY, Beer LA, Tanyi JL, et al. Protein isoform-specific validation defines multiple chloride intracellular channel and tropomyosin isoforms as serological biomarkers of ovarian cancer[J]. Journal of proteomics, 2013(1): 165-178.
[9] Chiang PC, Chou RH, Chien HF, et al. Chloride intracellular channel 4 involves in the reduced invasiveness of cancer cells treated by photodynamic therapy[J]. Lasers in surgery and medicine, 2013(1): 38-47.
[10]Kim KH, Choi BK, Song KM, et al. CRIg signals induce anti-intracellular bacterial phagosome activity in a chloride intracellular channel 3-dependent manner[J]. European journal of immunology, 2013(3): 667-678.
[11]Ganapathi SB, Wei SG, Zaremba A, et al. Functional regulation of ClC-3 in the migration of vascular smooth muscle cells[J]. Hypertension, 2013(1): 174-179.
[12]Zhang J, Liu J, Liao YJ, et al. ClC-3 is Involved in NPPB-Induced Apoptosis in DU145 Prostate Cancer Cells[J]. J MolBiomarkDiagn S, 2016(2): 245.
[13]Rohrbough J, Lamb FS, Nguyen HN. Regulation of ClC-3 Cl-/H+ Transport and “Gating” Transients by Chloride Pathway Residues and External Protons[J]. Biophysical Journal, 2015(2): 440-441.
[14]Larrouture QC, Nelson DJ, Robinson LJ, et al. Chloride-hydrogen antiportersClC-3 and ClC-5 drive osteoblast mineralization and regulate fine‐structure bone patterning in vitro[J]. Physiological reports, 2015(11): e12607.
(2016-09-12收稿,2016-11-26修回)
中文编辑: 刘 平; 英文编辑: 赵 毅
The Molecular Mechanism of ClC-3 in the Proliferation and Invasion of Malignant Glioma Cells
ZHANG Guangyu1, JIA Shifeng2, CAO Xuhua1, ZHANG Xiaowei1, JIAO Baohua1
(1.DepartmentofNeurology,SecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,Hebei,China; 2.DepartmentofOncology,AffiliatedHospitalofNorthChinaUniversityofScienceandTechnology,Tangshan063000,Hebei,China)
Objective: To observe the effects of ClC-3 on the proliferation and invasion of malignant glioma cells, and to explore its molecular mechanism. Methods: ClC-3 knockdown human gliomaBT-235 cell line was constructed by siRNA, and assigned as siCIC-3 group, blank control group and empty vector group were also established; Western blotting was used to detect the expressions of ClC-3; CCK8 method was used to detect the cell proliferation activity; transwell method was used to detect invasive ability; the measure of cell volume was used to detect the decrease of regulatory volume; flow cytometry was used to detected cell cycle; Western blotting was used to detect the expressions of cyclin D1, MMP-2 and MMP-9. Results: Compared with the blank control group, the expression of ClC-3 in siClC-3 group was significantly decreased (P<0.01), the cell proliferation activity was significantly decreased (P<0.01), the cell migration rate was decreased (P<0.01). The regulatory volume decrease rate in normal control group were (79.35±2.31)%, while in siClC-3 group were (19.46±1.76)%, the difference was statistically significant (P<0.01). The percentage of G0/G1 phase in the blank control group were (57.2±3.1)%, but siClC-3 group increased into (71.3±4.0)%, the difference was statistically significant (P<0.01). Compared with the blank control group, the expression of cyclin D1, MMP-2 and MMP-9 were significantly decreased in siClC-3group (P<0.01). Conclusion: ClC-3 could significantly enhance the proliferation and invasion of glioma BT-235 cells, and the underlying mechanism is related to the increasing of cell-regulated volume decrease rate and the up-regulation of cyclin D1, MMP-2 and MMP-9.
chloride channel-3; glioma; proliferation; invasion
时间:2016-12-15
http://www.cnki.net/kcms/detail/52.1164.R.20161215.1534.018.html
R739.4
A
1000-2707(2016)12-1419-05
10.19367/j.cnki.1000-2707.2016.12.012

