miRNA-1181通过抑制STAT3影响人胰腺癌细胞的侵袭转移能力*
王 杰, 喻 超, 周显飞, 蔡 坤, 何志伟, 江建新
(贵州医科大学附院 肝胆外科, 贵州 贵阳 550004)
miRNA-1181通过抑制STAT3影响人胰腺癌细胞的侵袭转移能力*
王 杰, 喻 超, 周显飞, 蔡 坤, 何志伟, 江建新**
(贵州医科大学附院 肝胆外科, 贵州 贵阳 550004)
目的: 探讨miRNA-1181(miR-1181)对人胰腺癌细胞侵袭转移能力的影响以及机制。方法: 选取胰腺癌细胞系PANC-1和MIA PaCa-2进行实验并构建miR-1181过表达慢病毒载体(miR-1181U),低表达慢病毒载体(miR-1181D)以及空载慢病毒载体(NC),采用实时荧光定量聚合酶链反应(qRT-PCR)检测感染效率;Transwell实验以及划痕实验检测miR-1181对胰腺癌细胞侵袭转移能力的影响,免疫荧光检测miR-1181对细胞骨架的影响,Western bolt检测STAT3的表达;构建si-STAT3并转染miR-1181低表达组(miR-1181D),重复transwell实验验证STAT3是其靶基因。结果: qRT-PCR显示3条不同序列的si-STAT3均能显著下调STAT3的表达;Transwell实验及划痕实验显示上调miR-1181后能显著抑制胰腺癌细胞的侵袭转移(P<0.05),下调miR-1181后能显著促进胰腺癌的侵袭转移(P<0.05);Western blot显示miR-1181U能抑制STAT3的表达,miR-1181D能促进STAT3的表达;免疫荧光显示在PANC-1细胞中过表达miR-1181后,F-肌动蛋白(F-actin)被剪切,呈现低表达,导致其运动结构和极性的缺失,从而迁移能力变弱;si-STAT3以后能减弱miR-1181D组对侵袭转移的促进作用。结论: miR-1181可能通过抑制STAT3来抑制人胰腺癌细胞的侵袭转移能力,有望成为胰腺癌治疗的潜在靶点。
胰腺肿瘤; miR-1181; 肿瘤侵袭; 肿瘤转移; STAT3
胰腺癌是全球致死性排名第四的恶性肿瘤[1],预计到2030年排名有望上升至第2位[2]。肿瘤细胞早期的恶性侵袭及远处转移是其治疗效果差,预后不良的主要原因之一[3]。微小RNA(miRNAs)在人类多种疾病特别是肿瘤的发生、发展过程中扮演了关键的角色,通过对靶基因转录后调控进而影响肿瘤细胞的增殖、侵袭转移以及凋亡等进程[4]。本研究前期实验结果已经证实miR-1181在胰腺癌中呈低表达,并已成功构建上调组慢病毒(miR-1181U)、阴性对照组慢病毒(NC)以及下调组慢病毒(miR-1181D),证实miR-1181能通过调控STAT3影响胰腺癌干细胞的干性[5],本文主要探究miR-1181对胰腺癌侵袭转移的影响及机制。
1 材料和方法
1.1 细胞株和制剂
人胰腺癌细胞株PANC-1、MIA PaCa-2由华中科技大学附属同济医院胆胰外科实验室馈赠,高糖DMEM培养基、RPMI 1640培养基、胎牛血清购自美国Gibco公司,慢病毒载体由上海吉凯公司负责包装和构建,Transwell小室购自美国Corning公司,STAT3(1∶500)抗体以及P-STAT3(1∶500)抗体购自美国CST公司,siSTAT3购自上海生工,鬼笔环肽、β-tubulin以及DAPI购自美国Sigma公司。
1.2 方法
1.2.1 细胞培养及分组 将前期研究已感染慢病毒的胰腺癌细胞PANC-1和MIA PaCa-2置于高糖DMEM培养基(含10%FBS),37 ℃、5% CO2恒温培养箱培养,细胞分为上调组(miR-1181U)、下调组(miR-1181D)、阴性对照组(NC)以及空白对照组(BC)。
1.2.2 siRNA转染 分别制备PANC-1和MIA PaCa-2细胞悬液,密度为2×105个/mL,并分别接种于六孔板中,待其融合度达到50%,分别将3条序列不同的si-STAT3和si-NC与lipofectamine 3 000混合孵育20 min后加入每孔中,24 h后细胞换液,96 h后采用qRT-PCR验证转染效率,选取转染效果最好的一条si-STAT3用于后续实验。
1.2.3 transwell小室细胞迁移实验 分别制备PANC-1和MIA PaCa-2细胞悬液(用不含血清(FBS)的培养基重悬),密度为1×105个/mL,取200 μL细胞悬液于transwell小室的上室面,下室面放入含10% FBS的600 μL培养基中,置于恒温培养箱中培养24 h后用PBS洗2遍,4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,用棉签擦去上室面细胞,晾干,拍照。
1.2.4 Matrigel 细胞侵袭实验 用无血清培养基和基质胶按1∶8稀释,每孔加入60 μL,于37 ℃恒温培养箱中放置4 h,待胶凝固后进行实验。实验步骤同上述迁移实验。
1.2.5 细胞划痕实验 用0.25%胰蛋白酶分别消化PANC-1和MIA PaCa-2细胞,于六孔板中每孔接种5×105个细胞,待孔内细胞长满时,用200 μL枪头垂直划几条直线,并在0、24 h分别在倒置显微镜下观察。
1.2.6 细胞骨架免疫荧光 制备PANC-1和MIA PaCa-2细胞爬片,密度为1×105个/mL,待其贴壁后4%多聚甲醛固定。观察当天取出PBS洗涤2遍,再用0.1%Triton X-100的PBS洗涤3~5 min,于1%BSA中封闭1 h。分别制备1∶50以及1∶100的荧光素鬼笔环肽及β-tubulin置于玻片上染色2 h,PBS再次洗涤2次,DAPI染色10 min,最后PBS洗涤后封片剂封片,于共聚焦激光显微镜下观察。
1.2.7 GAPDH、STAT3及p-STATS表达 收集细胞提取蛋白,采用BCA法测蛋白浓度后按50 ng上样量计算出上样体积,SDS-凝胶电泳,孵育GAPDH(1∶1 000)、STAT3(1∶500)、p-STAT3(1∶500)一抗4度摇床过夜,室温孵育二抗2 h后用ECL化学发光试剂曝光,Western bolt检测GAPDH、STAT3及p-STAT3的蛋白表达。
1.3 统计学处理

2 结果
2.1 qRT-PCR验证转染效率
分别转染3条不同序列si-STAT3于PANC-1和MIA PaCa-2细胞后,STAT3的基因表达量明显低于NC组,差异有统计学意义(P<0.05),图1。
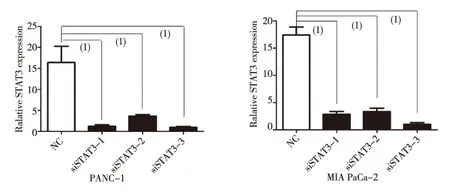
(1)P<0.05图1 转染siSTAT3后STAT3的表达Fig.1 The expression of STAT3 after transfected siSTAT3
2.2 miR-1181抑制胰腺癌细胞的侵袭和转移
Transwell小室实验显示,PANC-1和MIA PaCa-2细胞的miR-1181U组侵袭转移能力均明显受到抑制,细胞侵袭转移数量明显少于NC组,差异具有统计学意义(P<0.05,图2)。相反,PANC-1和MIA PaCa-2细胞的miR-1181D组侵袭转移能力均明显增强,细胞侵袭转移数量明显多于NC组,而miR-1181D+si-STAT3组则侵袭转移能力变弱,细胞侵袭转移数量明显少于miR-1181D组,差异均有统计学意义(P<0.05,图3)。细胞划痕实验结果显示,miR-1181U组细胞迁移的距离明显短于NC及BC组,差异具有统计学意义(P<0.05,图4)。
2.3 miR-1181对细胞骨架的影响
在PANC-1细胞中过表达miR-1181后,F-肌动蛋白(F-actin)被剪切,呈现低表达,导致其运动结构和极性的缺失,从而迁移能力变弱。BC组和NC组中,F-actin不被剪切,大量聚集形成伪足和极性,为间充质移动方式向阿米巴样移动方式的转变过程提供所必须的运动结构和极性,故迁移能力强(图5)。
2.4 STAT3及P-STAT3的蛋白表达
Western bolt结果显示,上调miR-1181后能抑制STAT3以及磷酸化STAT3的表达,而下调miR-1181后则促进STAT3以及磷酸化STAT3的表达(图6)。
3 讨论
MicroRNA(miRNA)是一组由19~22个核苷酸组成的内源性非编码小RNA,它能通过与靶mRNA的3’UTR特异性结合,在转录后水平调控基因的表达[6]。大量研究表明,这些单链RNA在细胞的正常生命周期中发挥至关重要的作用[7-9]。Zhang B等[10]研究表明miR-489在胃癌之中扮演了抑癌基因的角色,通过直接作用于PROX1蛋白抑制胃癌的侵袭转移转移能力。Wang C等[11]研究发现MiR-323-3p能在胰腺癌中抑制肿瘤细胞的增殖以及侵袭转移,且通过直接抑制靶蛋白SMAD2以及SMAD3实现抑制胰腺癌的发生、发展。STAT3(信号传导及转录激活因子3)在一系列细胞过程中扮演了重要的角色,如细胞增殖、凋亡以及免疫抑制等[12]。JAK-STAT信号通路最初是发现于干扰素α,干扰素γ以及白介素6共同参与调控的下游信号通路[12]。STAT3在信号传导及
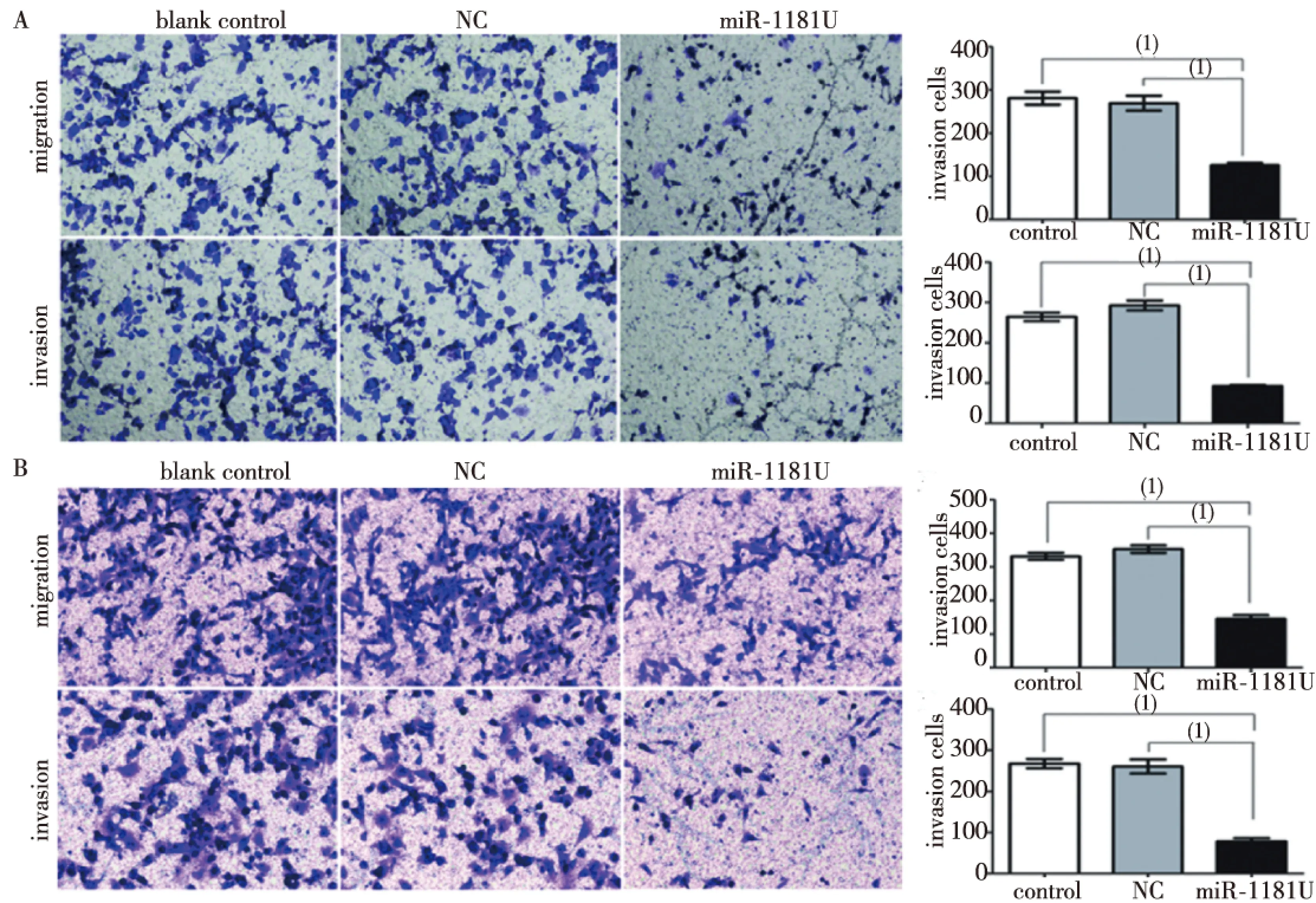
注:A为PANC-1,B为MIA PaCa-2;(1)P<0.05图2 miR-1181对胰腺癌细胞侵袭转移能力的影响(transwell)Fig.2 Transwell assay detected the effect of miR-1181 on migration and invasion of pancreatic cancer
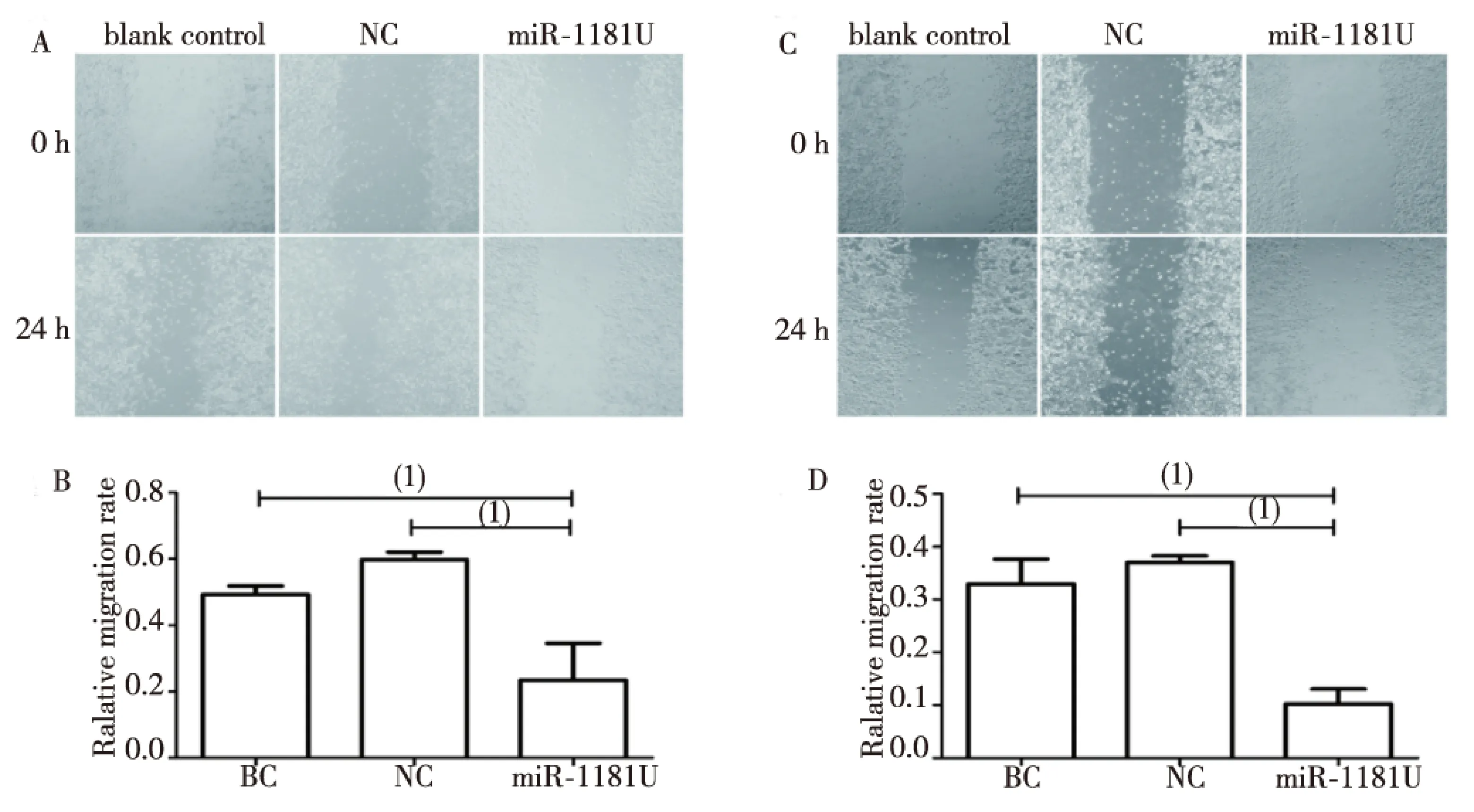
注:A、B为PANC-1,C、D为MIA PaCa-2;(1)P<0.05图4 miR-1181对胰腺癌细胞迁移能力的影响(划痕实验)Fig.4 Wound healing assay detected the effect of miR-1181 on invasion of pancreatic cancer
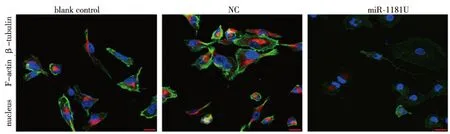
图5 免疫荧光检测miR-1181对细胞骨架的影响(600×)Fig.5 Immunofluorescence detected the influence of miR-1181 on cytoskeleton
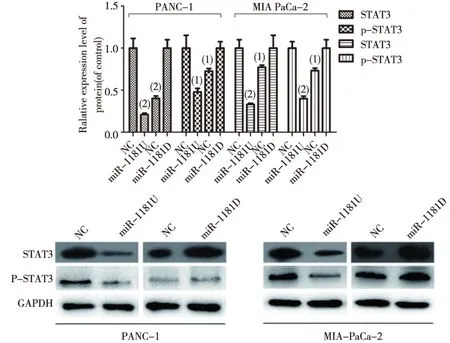
图6 miR-1181对STAT3及p-STAT3表达的影响(Western bolt)Fig.6 Western bolt detected the effect of miR-1181 on STAT3 and p-STAT3
转录激活上发挥了关键性的作用[13]。目前已发现STAT家族有6个成员,STAT3是家族中最普遍存在的,当接受细胞因子或者生长因子刺激后,STAT3作用于细胞核内以二聚体的形式特异性结合DNA片段,调控目的基因的转录。如果通路持续激活,将导致细胞的恶性增殖以及周边侵袭[13]。STAT3能通过各种靶基因促进肿瘤的发生、发展,包括细胞周期调控因子,血管生成因子以及抗凋亡基因等[14]。
本研究通过transwell实验,细胞划痕实验初步验证了miR-1181能抑制胰腺癌的侵袭转移能力。并通过western bolt观察了miR-1181对靶蛋白STAT3的影响,即过表达miR-1181能抑制STAT3的表达,低表达miR-1181能促进STAT3的表达。进一步我们人为干扰了STAT3的表达后,发现miR-1181D组的促进作用被抑制。免疫荧光实验结果显示,在PANC-1细胞中过表达miR-1181后,F-肌动蛋白(F-actin)被剪切,呈现低表达,导致其运动结构和极性的缺失,从而迁移能力变弱。miR-1181U组F-肌动蛋白和β-微管蛋白较NC及BC组明显减少,BC组和NC组中,F-actin不被剪切,大量聚集形成伪足和极性,为间充质移动方式向阿米巴样移动方式的转变过程提供所必须的运动结构和极性,故迁移能力强。综上我们可以得出结论,miR-1181能通过抑制STAT3的表达来影响胰腺癌细胞的侵袭转移能力。
总之,miR-1181在胰腺癌中作为一种抑癌基因,能抑制胰腺癌细胞的侵袭转移,有望成为治疗胰腺癌的新靶点。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2013(1): 11-30.
[2] Erratum for PMID 21180585[J]. Therap Adv Gastroenterol, 2012(5): 371.
[3] Hidalgo M. Pancreatic cancer[J]. N Engl J Med, 2010(17): 1605-1617.
[4] Ambros V. The functions of animal microRNAs[J]. Nature, 2004(6): 350-355.
[5] Jiang J, Li Z, Yu C, et al. MiR-1181 inhibits stem cell-like phenotypes and suppresses SOX2 and STAT3 in human pancreatic cancer[J]. Cancer Lett, 2015(2): 962-970.
[6] Humeau M, Torrisani J, Cordelier P. miRNA in clinical practice: pancreatic cancer[J]. Clin Biochem, 2013(10): 933-936.
[7] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism and function[J]. Cell, 2004(2): 281-297.
[8] He L, Hannon GJ. MicroRNAs: small RNAs with a big role in gene regulation[J]. Nat Rev Genet, 2004(7): 522-531.
[9] Szafranska AE, Davison TS, John J, et al. MicroRNA expression alterations are linked to tumorigenesis and non-neoplastic processes in pancreatic ductal adenocarcinoma[J]. Oncogene, 2007(30): 4442-4452.
[10]Zhang B, Ji S, Ma F, et al. miR-489 acts as a tumor suppressor in human gastric cancer by targeting PROX1[J]. Am J Cancer Res, 2016(9): 2021-2030.
[11]Wang C, Liu P, Wu H, et al. MicroRNA-323-3p inhibits cell invasion and metastasis in pancreatic ductal adenocarcinoma via direct suppression of SMAD2 and SMAD3[J]. Oncotarget, 2016(12): 14912-14924.
[12]Zhao C, Li H, Lin HJ, et al. Feedback Activation of STAT3 as a Cancer Drug-Resistance Mechanism[J]. Trends Pharmacol Sci, 2016(1): 47-61.
[13]Niit M, Hoskin V, Carefoot E, et al. Cell-cell and cell-matrix adhesion in survival and metastasis: Stat3 versus Akt[J]. Biomol Concepts, 2015(5): 383-399.
[14]Wake MS, Watson CJ. STAT3 the oncogene-still eluding therapy[J]. FEBS J, 2015(14): 2600-2611.
(2016-09-16收稿,2016-11-13修回)
中文编辑: 刘 平; 英文编辑: 苏晓庆
Capacity of miRNA to Influence the Migration and Invasion of Pancreatic Cancer through Inhibiting STAT3
WANG Jie, YU Chao, ZHOU Xianfei, CAI Kun, HE Zhiwei, JIANG Jianxin
(DepartmentofHepatic-Biliary-PancreaticSurgery,theAffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,GuizhouChina)
Objective: To investigate the effect of microRNA-1181 on the migration and invasion of pancreatic cancer and its potential mechanism. Methods: Lentiviral vectors of miR-1181 including overexpression (miR-1181U), knockdown (miR-1181D) and a negative control (NC) were constructed, and were transfected into human pancreatic cancer cell lines PANC-1 and MIA-PaCa-2 respectively. The expressions of miR-1181 were detected by real-time PCR. Transwell assay and wound healing assay were employed to detect cell invasion ability. The influence of miR-1181 on cytoskeleton was detected with immunofluorescence technique, and the expression of STAT3 detected by Western bolt. siRNA for STAT3 was constructed and transfected into miR-1181D, and then transwell assay was repeated to ensure that STAT3 was the miR-1181's target. Results: qRT-PCR results showed that 3 different si-STAT3 decreased expression of STAT3. Transwell assay and wound healing assay showed that miR-1181U inhibited cell migration and invasion (P<0.05), and miR-1181D promoted cell migration and invasion (P<0.05) significantly. Furthermore, miR-1181U inhibited the expression of STAT3 while miR-1181D up-regulated the expression of STAT3. Immunofluorescence test showed that when miR-1181 overexpressed in PANC-1 cells, F-actin was cut, and its expression was low. As the results, cells lost movement structure and polarity, and their migration capability was weakened. si-STAT3 can decrease the promotion effect of miR-1181 on migration and invasion in pancreatic cancer. Conclusion: miR-1181 may inhibit cell migration and invasion of pancreatic cancer by suppressing STAT3, which suggests it might be a potential new therapeutic agent for pancreatic cancer.
pancreatic neoplasms; miR-1181; tumor migration; tumor invasion; STAT3
国家国际科技合作专项资助(2014DFA31420); 国家自然科学基金(81160311,81572429,81660483)
时间:2016-12-15
http://www.cnki.net/kcms/detail/52.1164.R.20161215.1534.014.html
R735.9
A
1000-2707(2016)12-1387-06
10.19367/j.cnki.1000-2707.2016.12.005
**通信作者 E-mail:jjx731003@163.com

