miR-675调控低氧诱导肺动脉平滑肌细胞的增殖
王贝诺 刘雪萍 张君国 贺斌峰
·论著·
miR-675调控低氧诱导肺动脉平滑肌细胞的增殖
王贝诺1刘雪萍2张君国3贺斌峰1
目的探讨miR-675对低氧诱导大鼠肺动脉平滑肌细胞(PASMCs)增殖的调控作用及相关机制。方法低氧(1% O2)处理PASMCs 48 h,利用Real time-PCR检测0、6、12、24和48 h时各个时相点miR-675的表达水平,应用Western blot检测低氧处理PASMCs 48 h 后靶基因REPS2蛋白的表达情况。先合成miR-675抑制剂(inhibitor)再将其和阴性对照(NC)转染PASMCs细胞,24 h后再进行低氧处理从0h至48 h,应用MTT法检测0、12、24、48 h时细胞的活力,并检测REPS2蛋白的表达状况。构建野生型和突变型REPS2 3′UTR 插入pMIR-REPORTTMluciferase vector载体,并将其与pRL-TK质粒共转染PASMCs细胞,之后将miR-675 inhibitor和NC分别转染PASMCs细胞,利用双荧光素酶报告基因检测活性。在常氧下先分别转染miR-675 inhibitor或模拟物(minic)48 h,再检测PASMCs中REPS2的表达水平。结果随着低氧处理时间的延长,miR-675 在PASMCs细胞中的表达水平逐渐增高(P<0.05)。而与对照组比较,REPS2蛋白在低氧处理的PASMCs细胞中表达显著下调(P<0.05)。miR-675 inhibitor组在24 h和48 h的细胞活力显著低于对照组和miR-NC组(P<0.01)。荧光素酶报告基因结果说明REPS2是miR-675的靶基因。在常氧环境上调miR-675可显著下调REPS2蛋白表达,而在常氧和低氧环境下抑制miR-675的水平可明显升高REPS2蛋白表达。结论miR-675通过下游靶基因REPS2调控低氧诱导的PASMCs的异常增殖,可能是低氧肺动脉高压、肺源性心脏病等疾病治疗的潜在靶点。
miR-675; 低氧; 肺动脉平滑肌; 肺血管重构; REPS2; 增殖
低氧肺血管重构(hypoxia pulmonary vascular remodeling, HPR)及肺动脉高压是慢性阻塞性肺疾病(chronic obstructive pulmonary diseases, COPD)发展为肺源性心脏病和呼吸衰竭的关键病理学基础[1]。在我国COPD、慢性肺源性心脏病、高原肺水肿、高原心脏病等多种与肺血管重构关系密切的重要疾病已成为社会的主要负担和临床诊治的难点。目前认为肺血管重构的主要特征之一是在各种刺激因素下(包括低氧)肺动脉平滑肌异常增生导致的血管结构重塑[2]。因此,探索阻止和逆转肺动脉平滑肌细胞的异常增殖依然是防治肺血管重构的重点。
普遍存在于各种细胞内的microRNAs (miRNA)是一种非编码RNA,一般长度仅有18-25bp。研究表明miRNA或miRNA与其他非编码RNA协同参与了各种生理、病理生命现象的调控,其主要的调控机制是通过与靶基因mRNA的3′UTR完全/不完全互补结合,起到抑制mRNA的翻译或介导mRNA的降解,从而抑制靶蛋白的表达及其功能[3]。最近的miRNA的研究表明,miRNA在低氧诱导肺动脉高压、慢阻肺中发挥着重要的作用[4-5]。既往研究表明,miR-675在低肌力和低非脂肪量指数(Fat-free mass idex, FFMI) 的COPD患者血浆中呈高表达[6],而低肌力和低FFMI意味着高死亡率[7],提示miR-675的高表达与COPD患者预后较差关系密切。其他研究还表明,上调miR-675可促进多种肿瘤的增殖、转移和侵袭[8-10]。但目前miR-675在低氧肺血管重构中的表达及其作用尚不清楚。本研究主要检测miR-675在低氧诱导的肺动脉平滑肌细胞中的表达,并探索其在增殖中的作用及其可能的机制,为低氧肺血管重构、慢阻肺及肺心病的治疗提供新的靶点。
材料与方法
一、主要材料
DMEM培养基GIBCO公司,胎牛血清购自PAN公司,TRIzol regent 购自sigma公司,lipofectamine 2000购自Invirogen公司;阴性对照(Negative control, NC)、miR-675 minic和miR-675 inhibitor均购自上海生工;逆转录试剂盒、T4连接酶、HindⅢ和Spe I限制性内切酶购自Fermentas 公司;实时定量试剂盒购自Roche公司;REPS2抗体购自abcam公司,蛋白裂解液和GAPDH单克隆抗体购自上海梦至生物科技有限公司;CKK-8试剂盒购自江苏碧云天;pMIR-REPORTTMluciferase和pRL-TK 质粒载体购自clonetech生物技术公司;荧光素酶报告基因检测试剂盒购自peromega公司。
二、研究方法
1. 大鼠肺动脉平滑肌细胞(pulmonary artery smooth muscle cells, PASMCs)的培养: PASMCs细胞用含有10%胎牛血清的DMEM培养基进行培养,取对数生长期的细胞进行实验。
2. PASMCs的低氧处理:将PASMCs原有培养基弃去,加入1%胎牛血清的DMEM培养基中培养12 h进行同步化,然后弃去培养基加入10%胎牛血清的DMEM培养基,将细胞放入低氧培养箱中以1% O2下进行低氧处理。
3. miR-675表达的检测: 按照TRIzol Regent说明书提取细胞的总RNA。应用颈环法检测miR-675的表达。miR-675的特异逆转录引物为5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAG
ACTGAGCG-3′,内参U6的逆转录引物为5′-CAAAATATGGAACGCTTC-3′,逆转录条件为42 ℃ 60 min,72 ℃ 5 min。 逆转录获得的cDNA进行实时荧光定量PCR检测miR-675的表达,以U6作为内参,序列见表1。每个待测基因设2个复孔。数据通过BIO-RAD CFX96系统进行处理,按照公式RQ=2-△△CT计算各组间的关系。
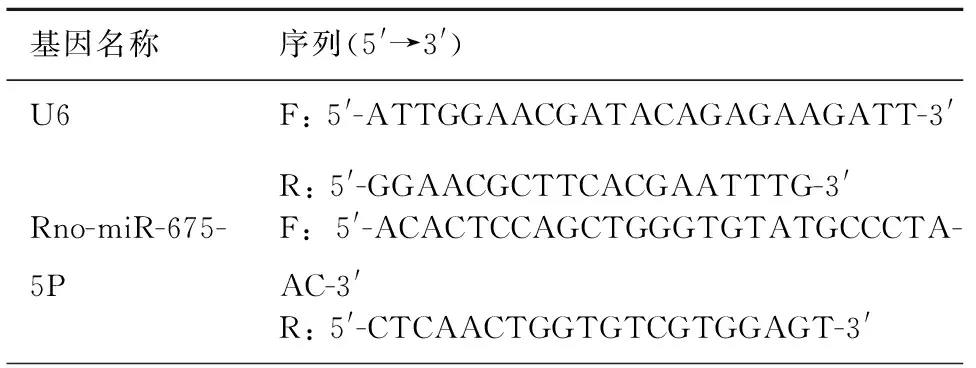
表1 基因引物序列
4. miR-675 模拟物(minic)、miR-675抑制物(inhibitor)及NC转染PASMCs : 将miR-675 minic、miR-675 inhibitor及NC干粉用125 μl RNase-free H2O 配制成20μmol/L的储存液。miR-675 minic转染PASMCs细胞的步骤如下:① 将PASMCs消化后,在24孔板中接种约2×105个/孔的细胞;②过夜培养后,弃去培养基,每孔加入40 μl的opti-MEM培养基;③将2.5 μl浓度为20μM 的miR-675 minic加入到47.5l opti-MEM中,轻轻混匀,室温孵育5 min,将另外一支装有48μl opti-MEM中EP管中加入2 μl转染试剂lipofectamine 2000,轻轻吹打混匀,室温孵育5 min;④将lipofectamine 2000吸入装有miR-675 minic的EP管中,轻轻混匀,室温孵育20 min;⑤将100μl混合试剂加入24孔板中,充分混匀;⑥细胞培养48 h后进行PCR和Western blot等检测。miR-675 inhibitor及NC的转染同miR-675 minic转染步骤。
5. MTT检测细胞增殖:取对数生长期的PASMCs细胞消化后制成细胞悬液,将细胞浓度调整到1×104/孔,接种于96孔板。过夜培养后进行低氧或转染处理,处理完成后继续培养48 h后换液,每孔加入10 μl(5 mg/ml)的MTT溶液。37 ℃孵育4 h后,每孔加入150 μl Formanzan溶液,继续孵育15 min可观察到Formanzan全部溶解。用酶标仪在570 nm处检测各孔吸光度(OD值),空白孔调零。
6. 荧光素酶报告基因检测:构建野生型和突变型REPS2 3′UTR pMIR-REPORTTMluciferase vector载体;并将上述载体分别与pRL-TK质粒共转染PASMCs细胞。培养24 h后分别将等量的miR-675 minic和NC转染PASMCs;转染48 h后,检测萤火虫和海肾荧光素酶活性。
7. Western blot检测REPS2蛋白的表达:在培养皿中加入200 μl蛋白裂解液,置于冰上裂解10 min,然后将其收集,于4 ℃、以离心半径8 cm、12 000 r/min离心20 min,取上清液。蛋白变性后进行SDS-PAGE电泳。蛋白转印后,将PVDF膜室温封闭1 h,然后将膜放入含有REPS2抗体 (1︰1 000)及GAPDH抗体(1︰20 000)的抗体稀释液中,4 ℃过夜。TBST洗3次后孵育二抗,用ECL化学发光法检测REPS2和GAPDH蛋白的表达水平, GAPDH作为内参来校正各自目的蛋白。
三、统计学方法
结 果
一、低氧干预PASMCs后miR-675的表达水平
利用qPCR检测了miR-675在低氧处理后PASMCs 中的表达。发现在低氧处理PASMCs的6、12、24和48 h时相点miR-675的表达分别是0 h的1.21±0.03、1.81±0.11、2.59±0.14和3.13±0.07倍(P<0.05),miR-675在低氧处理后PASMCs 中表达呈时间依赖性,见图1。

图1 qPCR检测miR-675在低氧处理的PASMCs细胞中的表达;注:*与0 h,P<0.05;**与0 h,P<0.05
二、转染miR-675 inhibitor对 低氧处理下PASMCs细胞活力的影响
分别将miR-675 inhibitor和NC 转染PASMCs细胞24 h后,将细胞置于1% O2的低氧环境下处理48 h,利用qPCR检测PASMCs细胞中的miR-675表达水平,发现miR-675 inhibitor和NC组中miR-675的相对表达量分别是对照组的(50.00±6.01)%和(99.67±2.00)%,miR-675 inhibitor组中miR-675的表达显著低于NC组和单纯低氧组(P<0.05) ,见图2A。我们发现低氧处理24 h、48 h后,Hypoxia组、Hypoxia+NC组和Hypoxia+miR-675 inhibitor组细活力均显著高于低氧处理0 h和12 h这三组的细胞活力(P<0.05) ,并且在低氧处理24 h、48 h时Hypoxia+miR-675 inhibitor组细胞活力显著低于Hypoxia组和Hypoxia+NC组(P<0.05)。在各个时相点Hypoxia组和Hypoxia+NC组细胞活力无显著差异(P<0.05),见图2B。上述研究说明下调miR-675的表达可显著抑制低氧诱导PASMCs异常增殖。
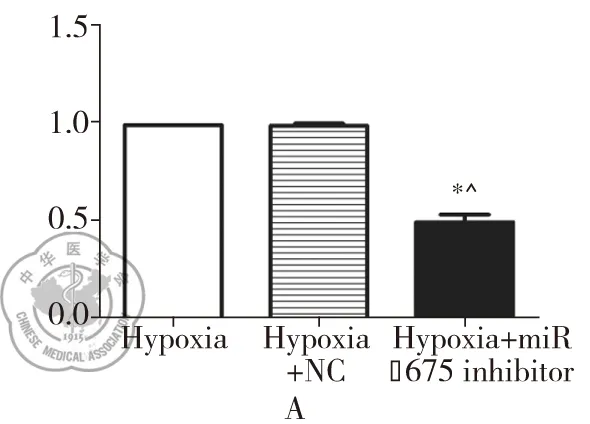
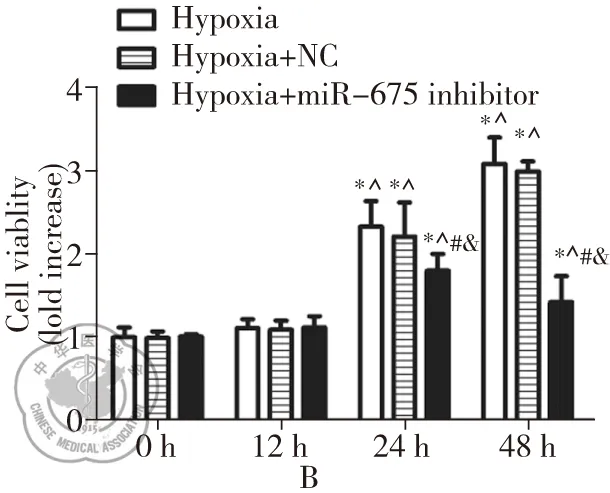
图2 下调miR-675对PASMCs细胞活力的影响;注:A:qPCR检测PASMCs转染miR-675 inhibitor和NC后的miR-675的表达;*与Hypoxia组比较,P<0.01;^与Hypoxia+NC组比较,P<0.01;B:MTT检测PASMCs细胞转染miR-675 inhibitor和NC后,其对低氧诱导PASMCs的细胞活力影响。*与0 h比较,P<0.01;^与12 h组比较,P<0.01;#与Hypoxia组比较,P<0.01;&与Hypoxia+NC组比较,P<0.01
三、REPS2是miR-675作用的下游直接靶点
通过生物信息学分析,认为REPS2可能是为miR-675的靶基因。分别构建REPS2野生型和突变型3′UTR质粒荧光素酶报告载体,见图3A。上述载体与pRL-TK质粒、miR-675 minic或NC一起共转染PASMCs细胞,然后检测荧光素酶活性。结果显示野生型REPS2 3′UTR质粒和miR-675 minic共转染组的荧光素酶活性低于野生型REPS2 3′UTR质粒和NC共转染组(P<0.01)。miR-675 minic和突变型REPS2 3′UTR质粒共转染组与突变型REPS2 3′UTR质粒和NC共转染组相比较,两组荧光素酶活性无显著差异(P>0.05)。上述研究结果证实REPS2是miR-675的作用靶点,见图3B。此外,我们还发现miR-675 minic转染PASMCs细胞后,其REPS2蛋白的表达较NC组可显著降低(P<0.05),见图3C。而用miR-675 inhibitor抑制PASMCs中miR-675的表达,REPS2蛋白的表达水平较NC组明显升高(P<0.05),见图3D。进一步说明REPS2是miR-675的直接靶点。
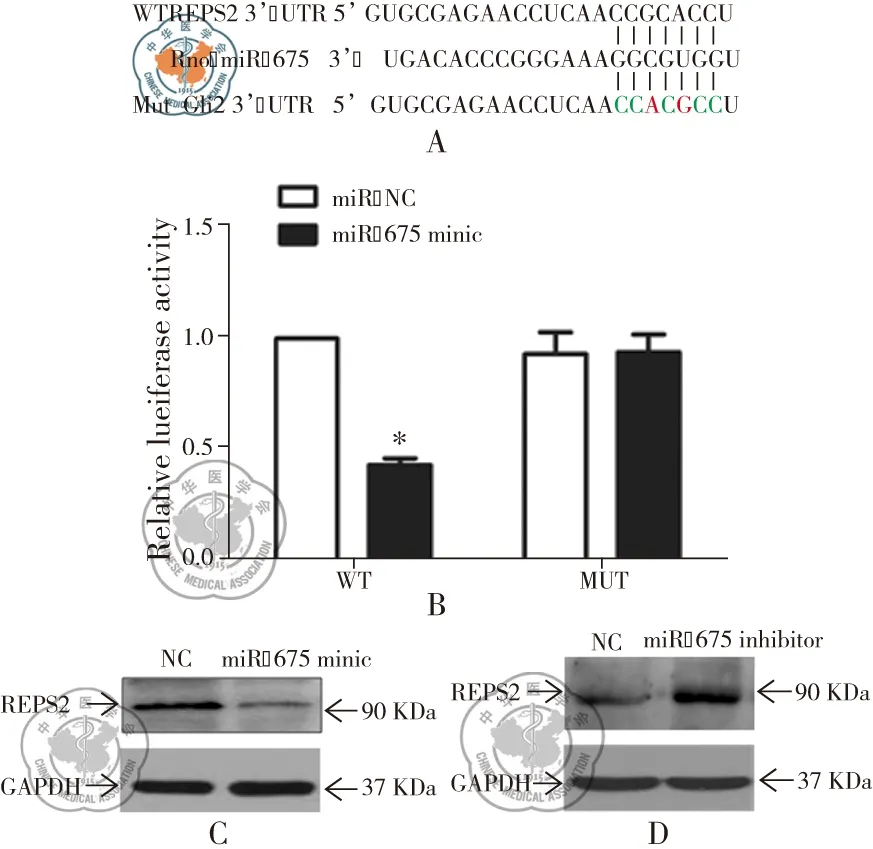
图3 REPS2是miR-675的靶点;注:A:miR-675与野生型和突变型REPS2 3′UTR端的示意图;B:荧光素酶报告基因检测miR-675与REPS2 3′UTR端的结合情况;*与野生型REPS2 3′UTR质粒和miR-675 minic共转染组,P<0.01;C和D:转染miR-675 minic/miR-675 inhibitor与NC 48 h后,western blot检测PASMCs细胞中REPS2蛋白的表达情况
四、下调miR-675促进低氧处理PASMCs中REPS2的表达
前面的研究发现低氧处理后PASMCs中miR-675的表达显著升高,但其靶点REPS2的表达并不清楚。因此,我们检测低氧处理PASMCs 48 h后REPS2蛋白的表达情况,见图4A。发现低氧处理后REPS2较常氧组显著下调。转染miR-675 inhibitor、NC后继续低氧处理48 h后,见图4B。检测发现miR-675 inhibitor组和NC组REPS2的表达显著高于低氧处理组,并且REPS2蛋白在miR-675 inhibitor组的表达明显高于NC组。

图4 下调miR-675促进低氧处理PASMCs中REPS2的表达;注:A:REPS2蛋白在低氧和常氧下PASMCs中的表达;B:转染miR-675 inhibitor和NC后,PASMCs继续低氧处理后REPS2蛋白的表达水平
讨 论
本研究发现miR-675在PASMCs中随低氧处理时间的延长而表达逐渐升高。利用miR-675 inhibitor可有效抑制低氧诱导的PASMCs异常增殖。此外,还发现增殖相关负性调节因子REPS2是miR-675的直接靶点。因此,我们推测miR-675通过调控REPS2,进而发挥调控PASMCs增殖的作用。
最近研究的表明,miRNA的紊乱在低氧肺血管重构的发生和发展中发挥着重要作用[11]。血清中循环的miRNA,如miR-20, miR-28-3p, miR-34c-5p and miR-100 and miR-7可作为评估、监测COPD进展的生物标志物[12]。Courboulin 等[13-15]指出miR-204在肺动脉平滑肌中的异常上调激活NFAT,下调BMPR2,促进IL-6的生产,导致肺动脉平滑肌细胞的异常增殖和凋亡的抵抗。同样,miR-21在低氧暴露的人PASMCs中也显著升高[16],其可能通过下调PDCD4、SPRY2和PPARα,进而发挥促进PASMCs增殖、抵抗凋亡的作用[17]。本实验发现,低氧上调PASMCs细胞中miR-675的表达。本研究应用miR-675 inhibitor下调PASMCs细胞中miR-675的表达,结果显示下调miR-675能抑制低氧诱导的PASMCs的增殖。此外,其他研究表明下调miR-675也可抑制肝癌、食管癌的增殖[18-19],但具体的作用机制尚不清楚。
本研究在PASMCs中验证了REPS2 (RALBP1 associated Eps domain containing 2)是miR-675的靶基因。REPS2也被叫做POB1,其可编码蛋白复合物的一部分,从而发挥调节生长因子内吞的作用。进一步研究发现REPS2通过作用于小G蛋白Ral的GTPase活性蛋白,进而负性调节生长因子受体的内化和抑制生长因子相关信号通路[20]。最近的研究发现REPS2在前列腺癌中的表达显著降低,并且其可作为评估乳腺癌和前列腺癌进展的潜在分子标志物[21]。本研究发现REPS2是miR-675的靶点,并且调节miR-675的表达可影响REPS2蛋白的表达[19]。本研究还发现低氧下REPS2显著下调,而此时PASMCs细胞由于处于合成期,增殖能力显著升高[22]。在PASMCs处于低氧情况下时,miR-675表达受到抑制可上调REPS2的表达,并且下调的miR-675可抑制低氧诱导的PASMCs异常增殖。上述研究提示miR-675通过REPS2进而调控 PASMCs的增殖。但是REPS2调控细胞增殖的具体机制仍不清楚。Tomassi 等[23]的研究指出REPS2蛋白含有中心脯氨酸富集域(central proline rich domain),其负性调节激活的EGFR受体的内化过程,进而影响细胞的增殖。因此,我们推测在PASMCs中REPS2也可能通过上述机制调控细胞的增殖。
本研究尚存在一些不足:①研究在体外证实了miR-675通过REPS2调控PASMCs细胞增殖,但在体内miR-675是否依然具有抑制PASMCs增殖和阻止低氧肺血管重构的作用尚不清楚;②尽管我们发现REPS2可以调控低氧诱导的PASMCs的增殖,但是具体机制依然不明确。
综上所述,下调miR-675通过促进靶基因REPS2的表达,进而发挥抑制低氧诱导的PASMCs细胞异常增殖的作用。上述研究提示miR-675可成为治疗低氧肺动脉高压、慢阻肺、肺心病的潜在靶点。
1 Wells JM, Washko GR, Han MK, et al. Pulmonary arterial enlargement and acute exacerbations of COPD[J]. N Engl J Med, 2012, 367(10): 913-921.
2 Long L, Ormiston ML, Yang X, et al. Selective enhancement of endothelial BMPR-Ⅱ with BMP9 reverses pulmonary arterial hypertension[J]. Nat Med, 2015, 21(7): 777-785.
3 Guo H, Ingolia NT, Weissman JS, et al. Mammalian microRNAs predominantly act to decrease target mRNA levels[J]. Nature, 2010, 466(7308): 835-840.
4 Mohsenin V. The emerging role of microRNAs in hypoxia-induced pulmonary hypertension[J]. Sleep Breath, 2016, 20(3): 1059-1067.
5 Szymczak I, Wieczfinska J, Pawliczak R. Molecular Background of miRNA Role in Asthma and COPD: An Updated Insight[J]. Biomed Res Int, 2016, 2016: 7802521.
6 Lewis A, Lee JY, Donaldson AV, et al. Increased expression of H19/miR-675 is associated with a low fat-free mass index in patients with COPD[J]. J Cachexia Sarcopenia Muscle, 2016, 7(3): 330-344.
7 Genton L, Graf CE, Karsegard VL, et al. Low fat-free mass as a marker of mortality in community-dwelling healthy elderly subjects[J]. Age Ageing, 2013, 42(1): 33-39.
8 Matouk I J, Halle D, Raveh E, et al. The role of the oncofetal H19 lncRNA in tumor metastasis: orchestrating the EMT-MET decision[J]. Oncotarget, 2016, 7(4): 3748-3765.
9 Vennin C, Spruyt N, Dahmani F, et al. H19 non coding RNA-derived miR-675 enhances tumorigenesis and metastasis of breast cancer cells by downregulating c-Cbl and Cbl-b[J]. Oncotarget, 2015, 6(30): 29209-29223.
10 Li H, Yu B, Li J, et al. Overexpression of lncRNA H19 enhances carcinogenesis and metastasis of gastric cancer[J]. Oncotarget, 2014, 5(8): 2318-2329.
11 Mohsenin V. The emerging role of microRNAs in hypoxia-induced pulmonary hypertension[J]. Sleep Breath, 2016, 20(3): 1059-1067.
12 Akbas F, Coskunpinar E, Aynaci E, et al. Analysis of serum micro-RNAs as potential biomarker in chronic obstructive pulmonary disease[J]. Exp Lung Res, 2012, 38(6): 286-294.
13 Courboulin A, Paulin R, Giguere NJ, et al. Role for miR-204 in human pulmonary arterial hypertension[J]. J Exp Med, 2011, 208(3): 535-548.
14 Cotroneo E, Ashek A, Wang L, et al. Iron homeostasis and pulmonary hypertension: iron deficiency leads to pulmonary vascular remodeling in the rat[J]. Circ Res, 2015, 116(10): 1680-1690.
15 Bonta PI, Bogaard HJ, van den Berk I, et al. Pulmonary endarterectomy for calcified amorphous tumour-related pulmonary hypertension[J]. Thorax, 2016, doi: 10.1136/thoraxjnl-2016-208939.
16 Sarkar J, Gou D, Turaka P, et al. MicroRNA-21 plays a role in hypoxia-mediated pulmonary artery smooth muscle cell proliferation and migration[J]. Am J Physiol Lung Cell Mol Physiol, 2010, 299(6): L861-L871.
17 Cheng Y, Zhu P, Yang J, et al. Ischaemic preconditioning-regulated miR-21 protects heart against ischaemia/reperfusion injury via anti-apoptosis through its target PDCD4[J]. Cardiovasc Res, 2010, 87(3): 431-439.
18 Yu YQ, Weng J, Li SQ, et al. MiR-675 Promotes the Growth of Hepatocellular Carcinoma Cells Through the Cdc25A Pathway[J]. Asian Pac J Cancer Prev, 2016, 17(8): 3881-3885.
19 Zhou YW, Zhang H, Duan CJ, et al. miR-675-5p enhances tumorigenesis and metastasis of esophageal squamous cell carcinoma by targeting REPS2[J]. Oncotarget, 2016, 7(21): 30730-30747.
20 Nakashima S, Morinaka K, Koyama S, et al. Small G protein Ral and its downstream molecules regulate endocytosis of EGF and insulin receptors[J]. EMBO J, 1999, 18(13): 3629-3642.
21 Badway JA, Baleja JD. Reps2: a cellular signaling and molecular trafficking nexus[J]. Int J Biochem Cell Biol, 2011, 43(12): 1660-1663.
22 You Z, Qian H, Wang C, et al. Regulation of vascular smooth muscle cell autophagy by DNA nanotube-conjugated mTOR siRNA[J]. Biomaterials, 2015, 67: 137-150.
23 Tomassi L, Costantini A, Corallino S, et al. The central proline rich region of POB1/REPS2 plays a regulatory role in epidermal growth factor receptor endocytosis by binding to 14-3-3 and SH3 domain-containing proteins[J]. BMC Biochem, 2008, 9: 21.
(本文编辑:王亚南)
王贝诺,刘雪萍,张君国,等. miR-675调控低氧诱导肺动脉平滑肌细胞的增殖[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(6): 625-630.
miR-675 modulates hypoxia-induced proliferation of pulmonary artery smooth muscle cell by targeting REPS2
WangBeinuo1,LiuXueping2,ZhangJunguo3,HeBinfeng1.
1DepartmentofRespiratoryDiseases,theSecondAffiliatedHospitaloftheThirdMilitaryMedicalUniversity,Chongqing400037,PRChina.2DepartmentofThoracicSurgery,theSecondAffiliatedHospitaloftheThirdMilitaryMedicalUniversity,Chongqing400037,PRChina;3EmergencyDepartment,Fengducountypeople′shospital,Chongqing400037,PRChina
HeBinfeng,Email:ldhbf@tmmu.edu.cn
Objective To explore the mechanism and effect of miR-675 regulation hypoxia induced proliferation of pulmonary artery smooth muscle cells (PASMCs). Method The relative expression of miR-675 have been detected by real time-PCR while PASMCs were under 1% O2hypoxia for 0, 6, 12, 24 and 48 h. The protein expression of REPS2 was measured by western blot when PASMC have been exposed at hypoxia for 48 h. The sequence of miR-675 inhibitor and NC were synthesized. They were transfected into PASMCs for 24 h, and then PASMCs were treated by hypoxia for 48 h. The cell viability and REPS2 protein levels of PASMCs was evaluated at 12, 24 and 48 h by MTT and western blot. The wild-type and mutation of REPS2 3′UTR was inserted into the plasmid of pMIR-REPORTTMluciferase vector, which was co-transfected into PASMCs with pRL-TK plasmid. miR-675 minic and NC was transfected into these cells, which had been transfected pMIR-REPORTTMluciferase vector and pRL-TK plasmid. Firefly and Renilla reniformis luciferase activities were measured 48 h later. Additional, the protein expression of REPS2 was detected when PASMCs was treated with miR-675 inhibitor or minic for 48 h. Result The miR-675 levels was time-depended manner while PASMCs were under hypoxia exposed (P<0.05). The expression of REPS2 protein was significant lower in hypoxia group, compared to normoxia group (P<0.05). The cell viability of PASMCs were makeable decreased under hypoxia 24 and 48 h after PASMCs had been transfected miR-675 inhibitor, compared to NC group(P<0.01). Luciferase assay showed REPS2 was a direct target gene of miR-675. Up-regulation of miR-675 was significant decreased the expression of REPS2 while miR-675 minic was transfected into PASMCs in normoxia. On the contrary, down-regulation miR-675 by miR-675 inhibitor was remarkable elevated REPS2 protein level both normoxia and hypoxia. Conclusion miR-675 regulated the hypoxia induced PASMCs proliferation by target gene REPS2, and it maybe consider as a novel treatment target for hypoxia PAH and cor pulmonary.
miR-675; Hypoxia; Pulmonary vascular remodeling; REPS2; Proliferation
10.3877/cma.j.issn.1674-6902.2016.06.010
国家自然科学基金面上项目(81670047)
400037 重庆,第三军医大学新桥医院呼吸内科1、胸外科2408200 重庆市丰都县人民医院急诊科3
贺斌峰,Email: ldhbf@tmmu.edu.cn
R563
A
2016-11-02)

