植物乳杆菌发酵牛乳挥发性风味物质的解析
明庭红,苏秀榕,周君,司开学,张红燕,韩姣姣,崔晨茜,董丽莎,王朝阳,裘迪红
1(宁波大学 海洋学院,浙江 宁波,315211) 2(杭州医学院,浙江 杭州,310053)
植物乳杆菌发酵牛乳挥发性风味物质的解析
明庭红1,苏秀榕1,周君1,司开学1,张红燕1,韩姣姣1,崔晨茜1,董丽莎1,王朝阳1,裘迪红2*
1(宁波大学 海洋学院,浙江 宁波,315211) 2(杭州医学院,浙江 杭州,310053)
利用电子鼻和顶空固相微萃取-气质联用仪(headspace solid-phase microextraction-gas chromatograph-mass spectrometry,HS-SPME-GC-MS)研究了发酵牛乳挥发性风味物质的变化和组成。测定牛乳发酵过程中的pH值,确定发酵时间。结果表明,电子鼻能够灵敏地检测到牛乳发酵过程中气味的变化,主成分分析(principal component analysis,PCA)显示各个样品间差异明显。通过GC-MS在新鲜牛乳和发酵0、2、4、6、8、10、12、14、16 h的牛乳中分别检测出36和34、41、36、45、34、34、31、30、29种化合物,主要为烃类、醇类、醛类、酮类、酯类、酸类及其他化合物,其中醛类和酮类化合物的总峰面积和总浓度均较高,是发酵牛乳主要的挥发性风味成分。
植物乳杆菌;发酵牛乳;电子鼻;顶空固相微萃取-气质联用仪(HS-SPME-GC-MS);挥发性风味成分
植物乳杆菌(Lactobacillusplantarum)属于乳杆菌科中的乳杆菌属,革兰氏阳性菌,它是人体胃肠道的益生菌群,它能通过与病原菌对限制性营养素的能力竞争,来抑制病原菌的生长,调节肠道微生态的组成,形成生物学屏障。同时,植物乳杆菌代谢可以产生有机酸、细菌素、过氧化氢、双乙酰等多种天然的抑菌物质,具有维持肠道内菌群平衡,降低胆固醇水平,提高机体免疫力,促进营养物质吸收,缓解乳糖不耐症及抑制肿瘤细胞形成等多种功能[1]。有报道称,益生菌发酵乳制品如牛奶、酸乳和乳酪在体内模型中具有显著的降血脂功能[2],而且临床实验证明,植物乳杆菌具有有效地调节血清中脂质的作用[3]。现代乳品工业中常用嗜热链球菌和保加利亚乳杆菌发酵牛乳制备酸奶,而由于植物乳杆菌不仅能增进发酵食品的营养价值,改善口感和风味,同时能产生抗菌物质,延长发酵食品的保存时间,因此在功能性酸乳发酵中得到广泛应用[4]。
植物乳杆菌在牛乳发酵过程中能促进牛乳的酸化和成形,并通过乳糖和氨基酸代谢等代谢途径生成各种风味化合物,这些风味物质的来源大体有3种主要途径[5]:原料中的成分,即新鲜牛乳中特有的奶香气味等;加工过程中发生的变化,包括还原糖与氨基酸等水溶性物质间发生的美拉德反应,牛乳乳脂中的β-酮酸受热产生甲基酮类的化合物,含氧酸产生的内酯类化合物,以及各种裂解反应等;微生物代谢,包括乳酸菌对牛乳中营养成分的分解和利用这些营养物质进行生物合成作用。电子鼻由于具有检测快速、操作简便、灵敏度高、重现性好等优点而被用于乳制品气味的测定[6],再结合气相色谱-质谱联用技术就能够较好地对乳制品中风味化合物进行定性和定量分析[7]。
本实验以植物乳杆菌为牛乳发酵剂,通过电子鼻和顶空固相微萃取结合气质联用(headspace solid-phase microextraction-gas chromatograph-mass spectrometry,HS-SPME-GC-MS)技术,以各挥发性风味物质的峰面积、内标物的峰面积和浓度为基础参数,对挥发性化合物进行定量分析,量化评价不同挥发性物质对发酵牛乳总体风味的贡献程度。
1 材料与方法
1.1 材料与试剂
伊利全脂奶粉(100 g奶粉含蛋白质23.8 g,脂肪28.5 g,碳水化合物41.6 g,钠520 mg)。
植物乳杆菌属1株,高产蛋白酶,从泡菜中分离鉴定获得,鉴定号为JX025073.1[8]。
1.2 仪器与设备
丁酸甲酯,标准品(0.898 g/mL,25 ℃),上海沃凯化学试剂有限公司;MRS肉汤培养基,杭州微生物试剂有限公司;电子鼻,德国AIRSENSE公司PEN3型;50/30μm DVB/CAR/PDMS萃取头,65 μm PDMS,美国SUPELCO公司;气相色谱-质谱联用仪,7890/M7-80EI,美国Agilent公司、北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 种子发酵液的制备
取适量已活化的保存于液体培养基中的植物乳杆菌于MRS肉汤培养基中,35 ℃摇床培养至菌体浓度约为107~108CFU/mL(OD600nm值约为2.0)。
1.3.2 样品制备
将全脂奶粉加去离子水调配成12%的还原全脂牛乳,分装到150 mL(100 mL/瓶)的三角瓶中,用透气的微孔滤膜封口后,105 ℃,灭菌10 min[9]。取出放在无菌超净台中冷却至 35~40 ℃,在无菌条件下,按体积分数为1%的接种量接入已活化的种子发酵液,于35 ℃的恒温培养箱中静置培养至pH为4.5左右终止发酵[10]。
在无菌条件下分别取未接菌的原料乳和发酵时间为0、2、4、6、8、10、12、14、16 h的牛乳100 μL于15 mL的样品瓶中密封,每个样品重复取样5组,用于电子鼻的检测。
取100 μL标准品丁酸甲酯(0.898 g/mL),用超纯水稀释4×104倍后,取10 μL稀释的丁酸甲酯加入到15 mL 的SPME顶空瓶中。在无菌条件下分别取未接菌的原料乳和发酵时间为0、2、4、6、8、10、12、14、16 h的牛乳990 μL于含内标的样品瓶(内标含量为224.5 μg/mL)中混匀后,将经过老化处理过的50/30 μm DVB/CAR/PDMS萃取头插入顶空瓶中,于60 ℃水浴顶空微萃取30 min后,立即将萃取头置于气质联用仪进样口解吸2 min,进行GC-MS分析。
1.3.3 电子鼻检测
样品进样流量为300 mL/min,载气流量为300 mL/min,测试时间为200 s,传感器清洗时间为200~1 000 s。
1.3.4 GC-MS分析鉴定
色谱条件:VOCOL毛细管色谱柱(60 m×0.32 mm×1.8 μm);程序升温为35 ℃保持2 min,以3 ℃/min升至40 ℃,保持1 min,然后以5 ℃/min升至210 ℃,保持25 min;采用不分流进样模式,载气为He,流速为1.00 mL/min,不分流进样。
质谱条件:离子源温度230 ℃,电离方式EI,电子能量70 eV,接口温度250 ℃,扫描质量范围45~1 000 u,扫描时间63 min。
1.3.5 数据分析
电子鼻数据信号采集时间为200 s,取稳定后的第199~200 s进行主成分分析(principal component analysis,PCA)。
气质所得数据采用计算机检索谱库WILEY及NIST 08处理,并参考有关文献来确定检出成分,所得结果与谱库中化合物相似度低于80(最大值100)的组分视为未鉴定出,并通过面积归一化法确定各挥发性物质的样品峰面积[11],采用内标法确定发酵牛乳中挥发性化合物的浓度。
2 结果与讨论
2.1 发酵牛乳pH的测定
用酸度计(FE20-FiveEasy型)分别测定未接菌的牛乳和发酵0、2、4、6、8、10、12、14、16 h的牛乳的pH值。测得新鲜牛乳的pH值为6.66,接入植物乳杆菌后,发酵牛乳的pH值从0 h的6.50下降至发酵6 h的6.02,此阶段的牛乳pH值下降缓慢。发酵6 h后牛乳的pH值下降较快,此时的牛乳开始出现凝块,到发酵16 h时牛乳的pH值降为4.38,牛乳凝成块状,有较强的、酸酸的奶香味(图1)。
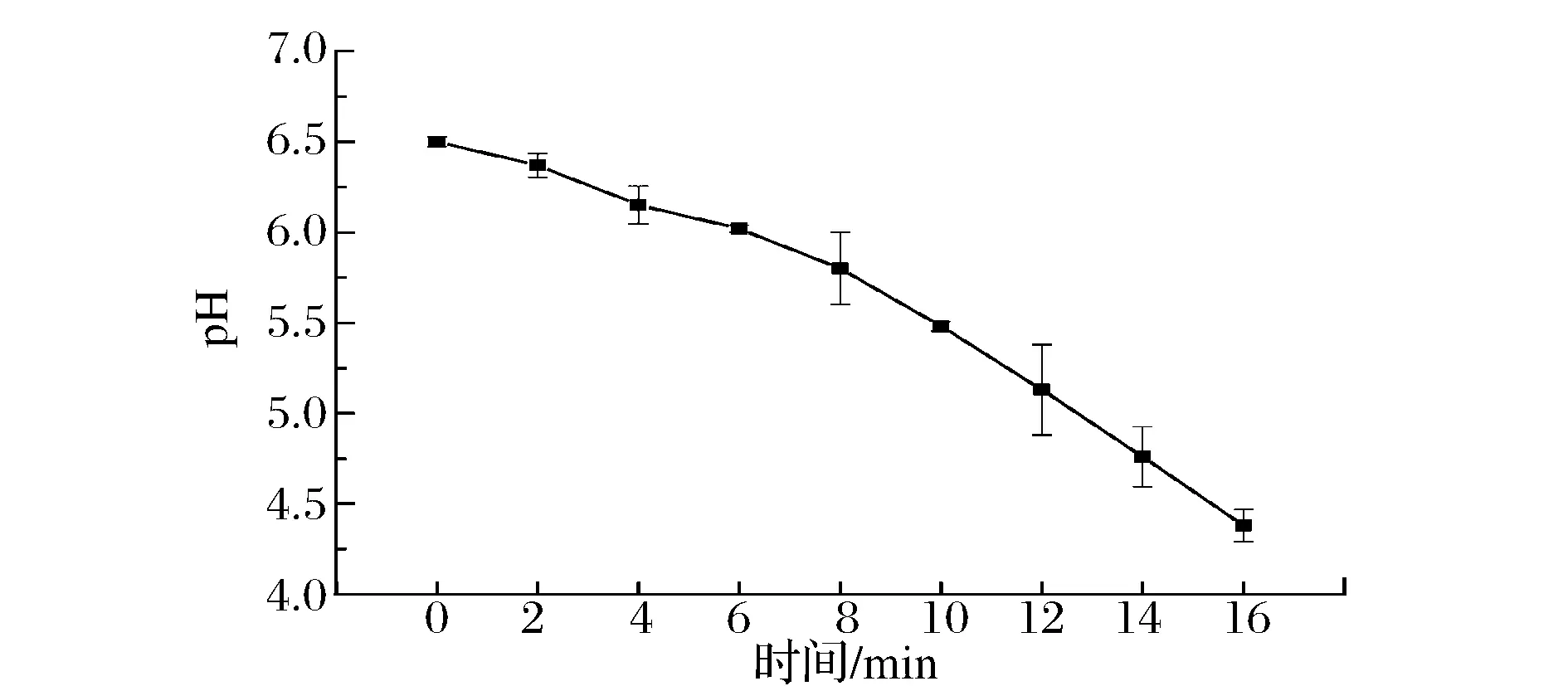
图1 牛乳发酵不同阶段的pH值变化情况Fig.1 Changes of pH in the different stages during the fermentation of milk
2.2 电子鼻检测
从牛乳发酵不同阶段的PCA分析图(图2)中可知,第一主成分PC1的贡献率为75.90%,第二主成分PC2的贡献率为18.76%,总贡献率为94.66%,表明PC1和PC2可以反映牛乳发酵不同阶段的主要信息特征。从图2可以看出,电子鼻能够较好地区分不同发酵时间牛乳气味的差异,新鲜原料乳和发酵0、2、4和6 h的牛乳挥发性主成分距离较近,气味特征相近,说明在此阶段发酵乳的气味差别不大,这与图1中牛乳pH值变化较小相一致,原因可能是发酵乳中接入的植物乳杆菌生长速度缓慢,代谢产物较少。发酵8~16 h,牛乳气味差异较大,且此阶段的发酵乳pH值变化较大,其原因是植物乳杆菌在牛乳中接种6 h后开始进入对数生长期,在此阶段牛乳中的碳水化合物和蛋白质被大量分解产生各种挥发性化合物。据此可以说明电子鼻能够准确地区分不同发酵阶段的牛乳。
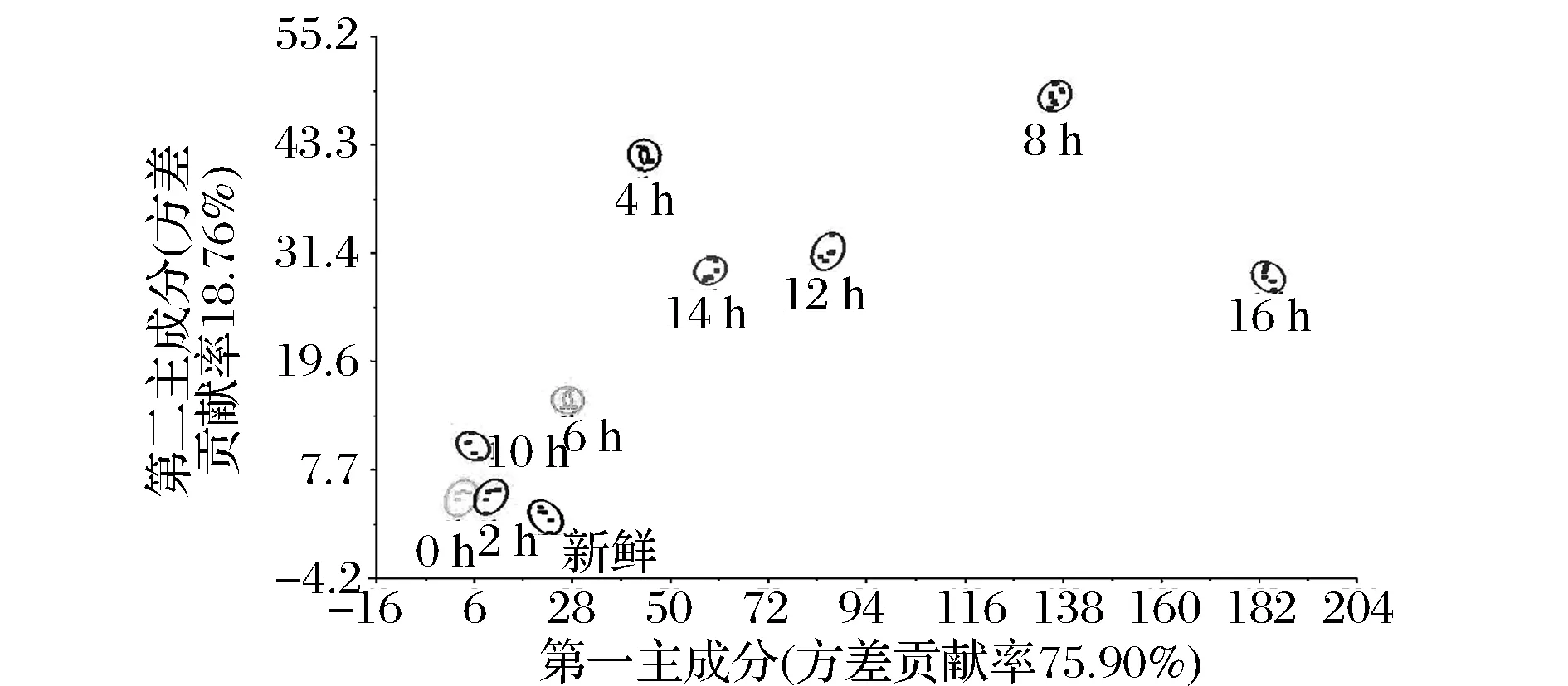
图2 牛乳发酵不同阶段的PCA分析Fig.2 PCA analysis during the fermentation of milk
2.3 HS-SPME-GC-MS测定结果
实验选用丁酸甲酯标准品为内标物,其保留时间为19.114 min,图3为待测组分GC-MS总离子流色谱图。

图3 GC-MS总离子流色谱图Fig.3 GC-MS of the TIC chromatogram
利用顶空固相微萃取和气质联用技术对不同发酵时间段的牛乳挥发性物质进行分析,共鉴定出68种挥发性物质,包括烃类16种、醇类8种、醛类7种、酮类19种、酯类9种和其他化合物9种(见表1)。
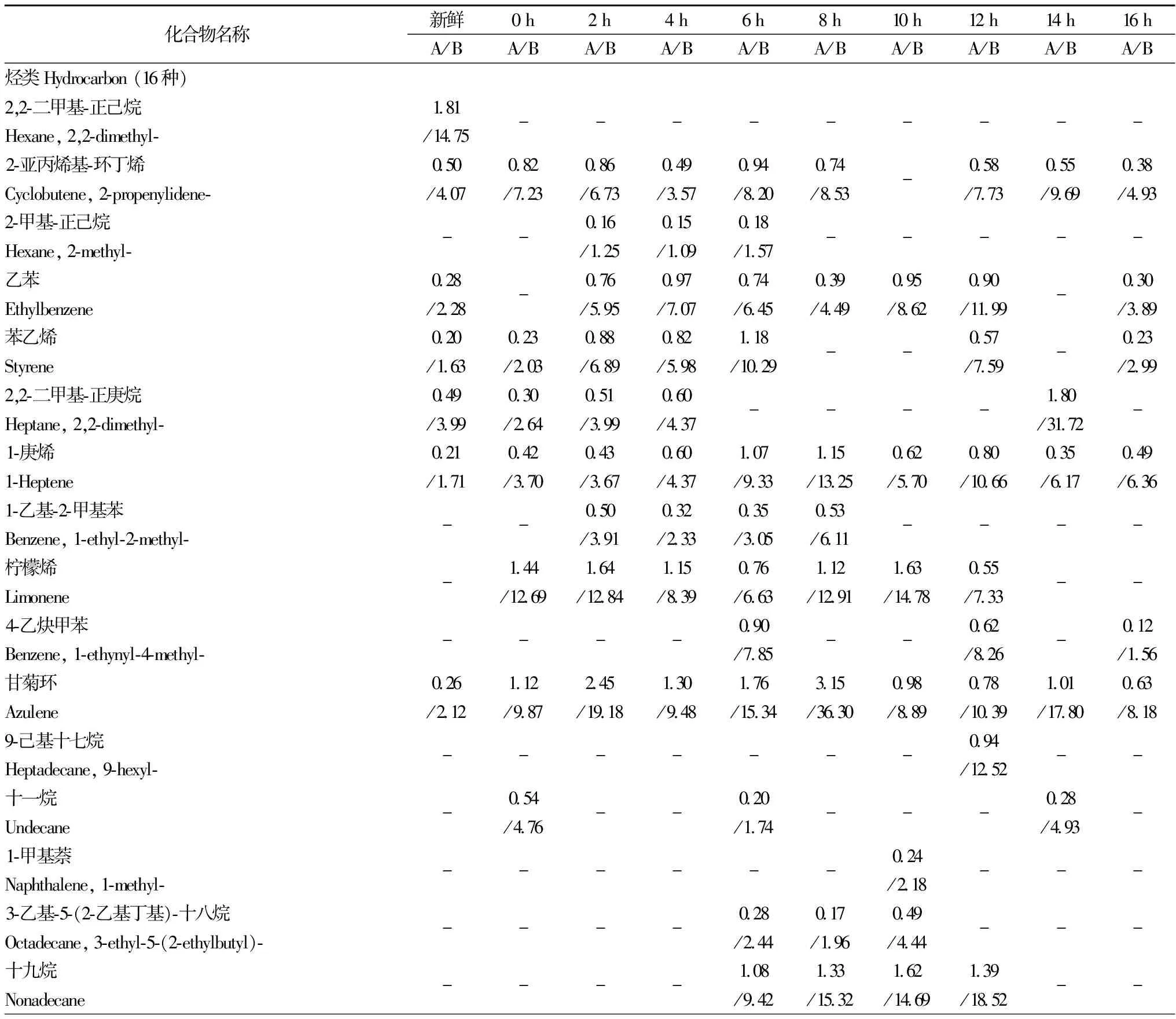
表1 发酵牛乳不同阶段各种挥发性物质的面积和浓度 单位:%,μg/L
续表1
续表1
化合物名称新鲜0h2h4h6h8h10h12h14h16hA/BA/BA/BA/BA/BA/BA/BA/BA/BA/B2,4⁃二甲基⁃3⁃己酮3⁃Hexanone,2,4⁃dimethyl⁃030/244-051/399055/401--192/1741310/4130387/6661419/54402⁃羟基⁃2⁃环戊烯⁃1⁃酮2⁃Cyclopenten⁃1⁃one,2⁃hydroxy⁃------036/326-068/1198-2,3⁃辛二酮2,3⁃Octanedione051/416043/379053/415-026/227-----5⁃甲基⁃2⁃己酮2⁃Heptanone,5⁃methyl⁃027/220034/300030/235033/241028/244025/288----6⁃甲基⁃5⁃庚烯⁃2⁃酮5⁃Hepten⁃2⁃one,6⁃methyl⁃-035/309029/227-019/166040/461040/363---3′⁃氨基⁃6⁃甲氧基橙酮3′⁃Amino⁃6⁃methoxyaurone026/212----024/277-036/799--2⁃壬酮2⁃Nonanone977/7961695/5809666/5213687/5009646/5632414/4771418/3790401/5343314/5533219/2844苯乙酮Acetophenone033/269072/635051/399052/379049/427119/1371078/707037/493085/1498034/4412,4,6⁃环庚三烯⁃1⁃酮2,4,6⁃Cycloheptatrien⁃1⁃one1020/8312590/5200386/3021824/6008345/30081508/17379762/6909499/6648556/9798498/6466二氢⁃4⁃羟基⁃2(3H)⁃呋喃酮2(3H)⁃Furanone,dihydro⁃4⁃hydroxy⁃--------267/4705-2⁃十一烷酮2⁃Undecanone479/3903400/3526332/2599323/2355285/2485250/2881198/1795175/2332103/1815130/1688四羟基⁃6⁃丙基⁃2H⁃吡喃⁃2⁃酮2H⁃Pyran⁃2⁃one,tetrahydro⁃6⁃propyl⁃025/204---021/183042/484047/426160/2132--2⁃十三烷酮2⁃Tridecanone190/1548228/2010146/1143161/1174141/1229151/1740169/1532143/1905090/1586068/8826⁃己基⁃四羟基⁃2H⁃吡喃⁃2⁃酮2H⁃Pyran⁃2⁃one,6⁃hexyltetrahydro⁃320/2608332/2926126/986201/1466180/1569221/2547290/2629273/3637141/2485-总计4590/374033728/379473007/295793410/309452931/390673525/585452964/411362890/773282570/972651951/61803酯类Esters(9种)乙酸正丁酯Aceticacid,butylester----191/1665--077/1026--2⁃丙炔⁃1⁃醇丁酯2⁃Propyn⁃1⁃ol,acetate--------086/1515-4⁃乙基苯甲酸环戊基酯4⁃Ethylbenzoicacid,cyclopentylester046/375058/511047/368063/459-043/496----草酸异壬酯Oxalicacid,isobutylnonylester--053/415-042/366---065/1145-螺内酯Spironolactone---078/569052/453089/1026----2⁃氧代⁃硬脂酸甲基酯Octadecanoicacid,2⁃oxo⁃,methylester-043/379031/243045/328034/296053/611057/517--022/2862⁃戊基亚硫酸十八烷酯Sulfurousacid,octadecyl2⁃pentylester--187/681-------2⁃甲基⁃3⁃羟基⁃2,4,4⁃三甲基丙酸戊酯Propanoicacid,2⁃methyl⁃,3⁃hydroxy⁃2,4,4⁃trimethylpentylester-------143/1905--4⁃十三烷基己酸酯Hexanoicacid,4⁃tridecylester--111/869-057/497-085/771-139/2449044/571总计046/357101/890429/2576186/1356185/3277185/2133142/1288143/2931204/5109066/857
续表1
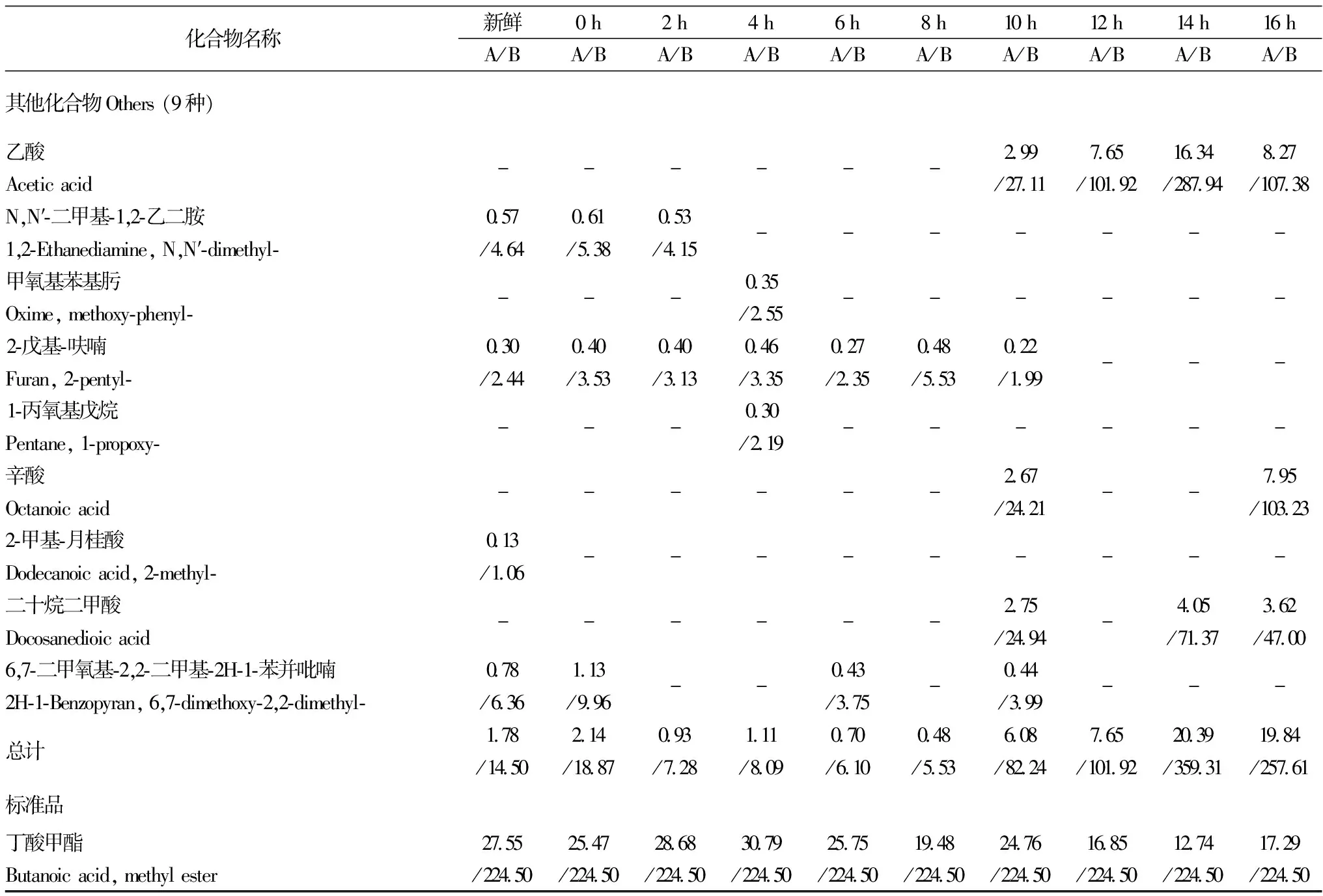
化合物名称新鲜0h2h4h6h8h10h12h14h16hA/BA/BA/BA/BA/BA/BA/BA/BA/BA/B其他化合物Others(9种)乙酸Aceticacid------299/2711765/101921634/28794827/10738N,N′⁃二甲基⁃1,2⁃乙二胺1,2⁃Ethanediamine,N,N′⁃dimethyl⁃057/464061/538053/415-------甲氧基苯基肟Oxime,methoxy⁃phenyl⁃---035/255------2⁃戊基⁃呋喃Furan,2⁃pentyl⁃030/244040/353040/313046/335027/235048/553022/199---1⁃丙氧基戊烷Pentane,1⁃propoxy⁃---030/219------辛酸Octanoicacid------267/2421--795/103232⁃甲基⁃月桂酸Dodecanoicacid,2⁃methyl⁃013/106---------二十烷二甲酸Docosanedioicacid------275/2494-405/7137362/47006,7⁃二甲氧基⁃2,2⁃二甲基⁃2H⁃1⁃苯并吡喃2H⁃1⁃Benzopyran,6,7⁃dimethoxy⁃2,2⁃dimethyl⁃078/636113/996--043/375-044/399---总计178/1450214/1887093/728111/809070/610048/553608/8224765/101922039/359311984/25761标准品丁酸甲酯Butanoicacid,methylester2755/224502547/224502868/224503079/224502575/224501948/224502476/224501685/224501274/224501729/22450
注:“A”表示样品峰面积,单位为“%”;“B”表示化合物含量,单位为“μg/L”;“-”表示未检出。
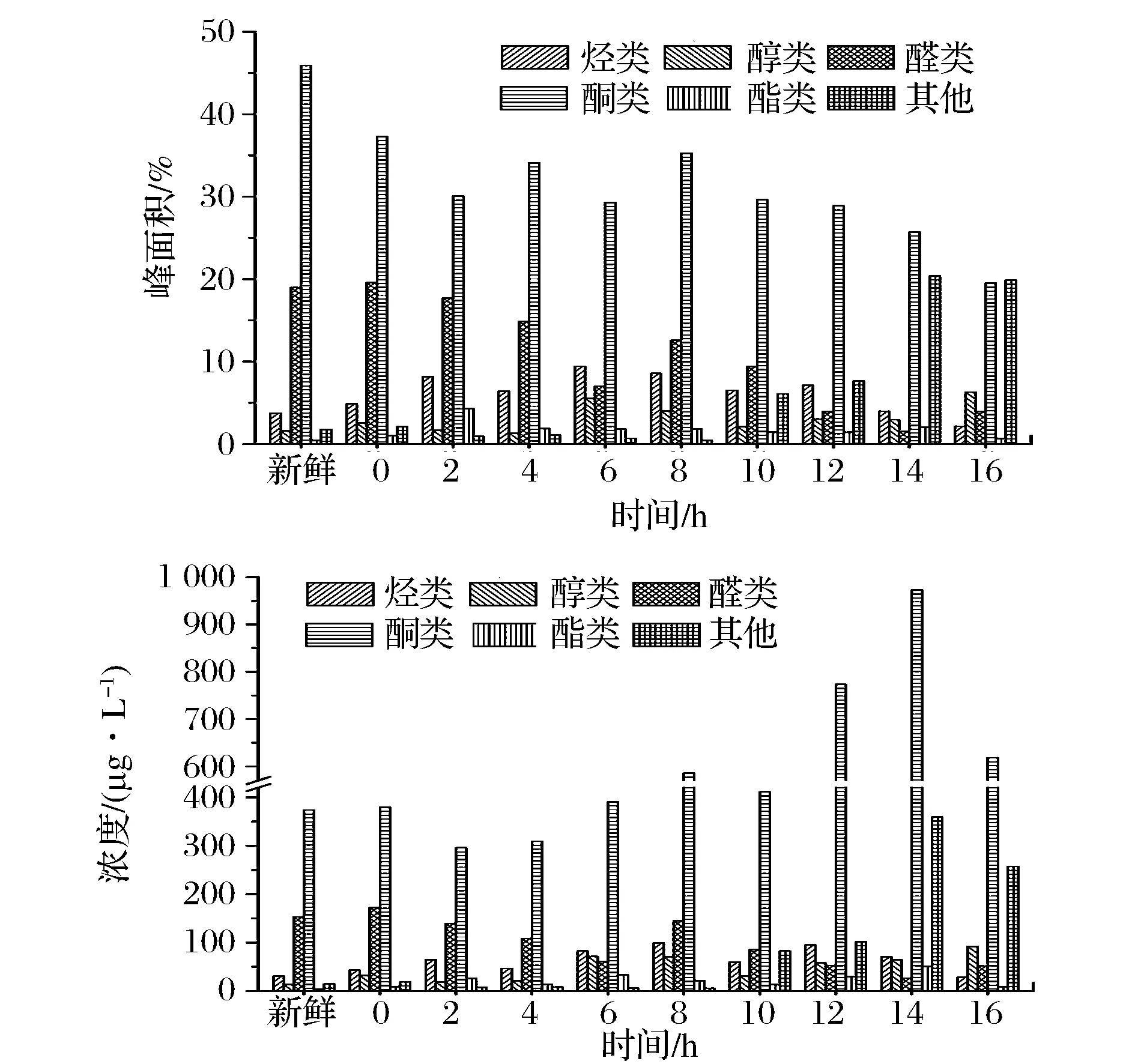
图4 发酵不同阶段牛乳中各类挥发性成分的峰面积和浓度Fig.4 The peak area and concentration of volatile compounds in milk during the different stages of fermentation
2.3.1 烃类化合物
从原料乳和发酵牛乳中共鉴定出16种烃类化合物,主要为烷烃类、烯烃类以及一些芳香族类化合物,牛乳中的烃类化合物所占比例均小于10%,总浓度均小于100 μg/L。牛乳发酵6 h时总峰面积达到最大为9.44%,此时浓度为82.31 μg/L,而总浓度最大出现在发酵8 h,为98.87 μg/L(表1和图4)。烃类化合物主要来自烷基自由基的脂肪酸自氧化过程,大部分烃类化合物具有较高的阈值,对发酵牛乳的风味贡献不大[12]。柠檬烯具有类似柠檬的香味,主要出现在发酵前期,对酸奶发酵前期风味物质的形成有一定的影响。
2.3.2 醇类化合物
牛乳发酵过程中共鉴定出8种醇类化合物,发酵初期醇类化合物的总峰面积和总浓度均较低,发酵中期有所增加,发酵16 h时达到最大为6.32%和91.86 μg/L。由于醇类化合物大多都具有较高的感觉阈值[13],且在牛乳发酵过程中各种醇类化合物的峰面积和浓度均较低,所以可以推测它们对发酵牛乳的风味贡献不大(表1和图4)。
2.3.3 醛类化合物
牛乳发酵阶段共产生7种醛类化合物,它们的总峰面积和总浓度随发酵时间的延长呈递减趋势,其中发酵0 h牛乳中醛类化合物的总量最高为19.56%和172.40 μg/L,发酵12 h后的醛类化合物的种类和含量都有显著地减少,这可能与后期发酵乳pH的显著降低有关。有研究表明,乳脂肪经脂肪酶的作用降解为游离脂肪酸,其中的脂肪酶由2个途径产生[14]:牛乳中微生物代谢生成以及牛乳中本来含有,而发酵乳中的己醛、庚醛、辛醛、苯甲醛和壬醛多由乳脂中的脂肪酸及游离脂肪酸发生自动氧化及微生物代谢生成,这是发酵乳中醛类物质产生的重要原因[15]。新鲜牛乳中的己醛、庚醛和辛醛含量最高,其峰面积和浓度分别为5.57%(43.39 μg/L)、4.33%(35.28 μg/L)和4.80%(47.26 μg/L),己醛具有青草味[16],庚醛具有不愉快的脂肪味,而辛醛具有很强的水果香味[17],它们是复原乳中主要的挥发性风味成分之一。发酵16 h牛乳中醛类化合物总峰面积和总浓度下降至3.96%和51.41 μg/L,此时仅有辛醛和2-羟基-苯甲醛两种醛类化合物检出,它们的含量分别为1.50%(19.47 μg/L)和2.46%(31.94 μg/L),2-羟基-苯甲醛具有焦灼味及杏仁气味,这两种醛类对牛乳发酵后期酸奶的风味形成具有重要作用(表1和图4)。
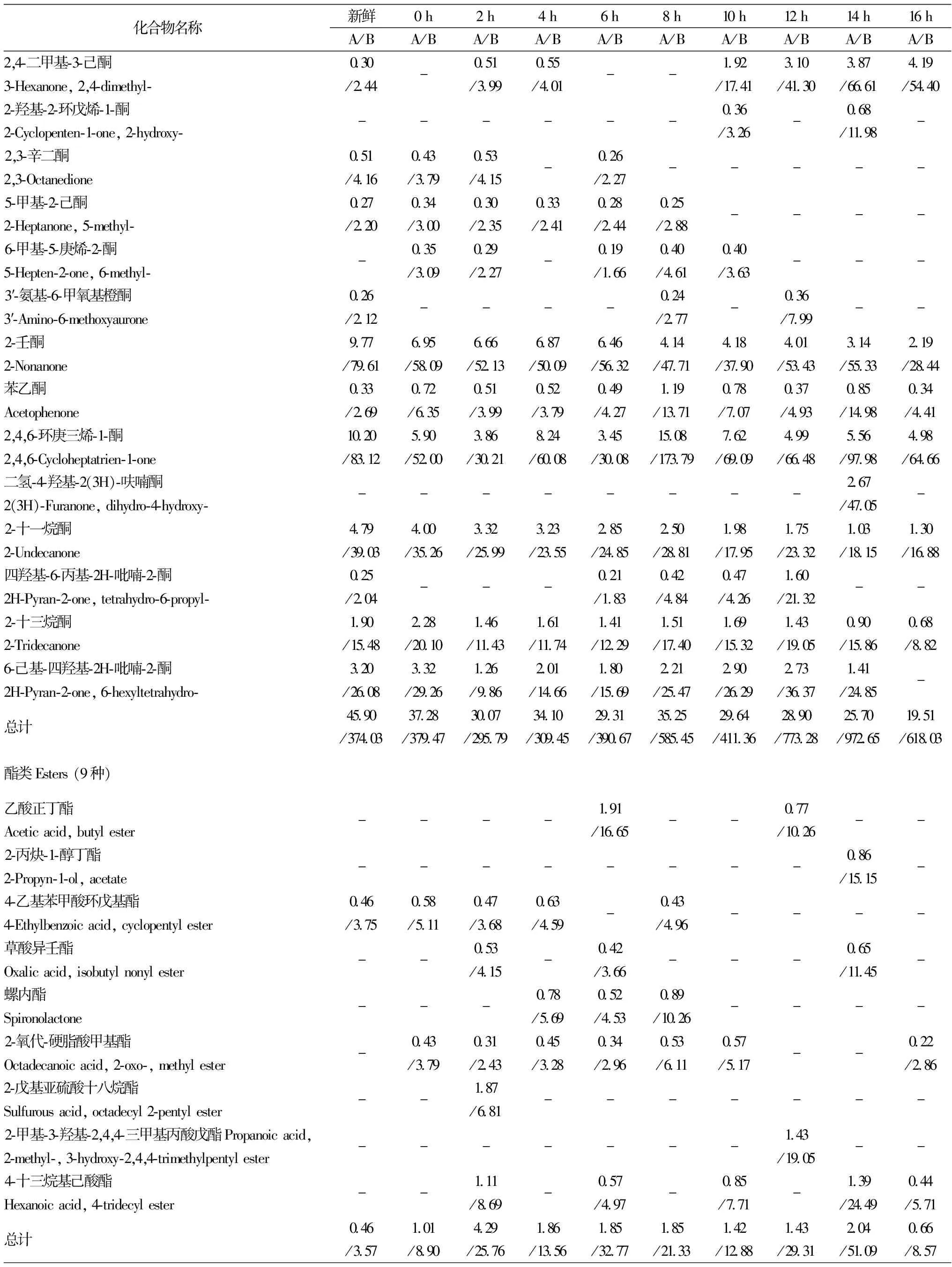
2.3.4 酮类化合物
酮类化合物可能是由于多不饱和脂肪酸的氧化、热降解、氨基酸降解或微生物代谢产生的[18]。酮类化合物是牛乳发酵过程产生的最主要风味化合物之一,它们的感觉阈值相对较低,对发酵乳的风味贡献较大。酮类化合物的总峰面积随发酵时间的延长而呈递减趋势,其总浓度呈现先增加后减少的趋势,新鲜牛乳中酮类化合物的总峰面积最大为45.90%(374.03 μg/L),在发酵14 h时其浓度达到最大为972.65 μg/L(25.70%)。新鲜原料乳中主要的酮类化合物有2-庚酮(14.12%,115.06 μg/L,水果香[19])、2-壬酮(9.77%,79.61 μg/L,果香、奶油香[19])、2,4,6-环庚三烯-1-酮(10.20%,83.12 μg/L)和2-十一烷酮(4.79%,39.03 μg/L,脂香、奶油浓香、干酪香[19]),2-十三烷酮(1.90%,15.48 μg/L,果香、乳品香)和6-己基-四羟基-2H-吡喃-2-酮(3.20%,26.08 μg/L),这些酮类化合物共同构成了新鲜牛乳特有的香味。发酵16 h的牛乳中主要的酮类化合物有2,3-丁二酮(12.65%,164.25 μg/L)、乙偶姻(15.09%,195.93 μg/L)、2-庚酮(5.83%,75.70 μg/L)、2,4-二甲基-3-己酮(4.19%,54.40 μg/L)、2-壬酮(2.19%,28.44 μg/L)、2,4,6-环庚三烯-1-酮(4.98%,64.66 μg/L)和2-十一烷酮(1.30%,16.88 μg/L)(表1和图4)。其中,2,3-丁二酮又名双乙酰,是一种具有强烈奶油香味的重要香料,它是乳酸菌通过葡萄糖代谢途径生成的重要中间代谢产物丙酮酸,再利用非酶自然氧化脱羧作用而产生的[20];而乙偶姻化学名为3-羟基-2-丁酮,具有令人愉悦的奶油香味,它是乳酸菌经糖酵解途径合成丙酮酸后再在α-乙酰乳酸合成酶的作用下生成乙酰乳酸和二氧化碳,随后乙酰乳酸经α-乙酰乳酸脱羧酶脱羧作用而产生的[21]。这2种酮类化合物是牛乳发酵过程中产生的重要的挥发性风味物质,其含量的多少对乳制品风味的形成具有重要影响。
2.3.5 酯类化合物
酯类物质一般是由发酵或脂质代谢生成的羧酸类和醇类酯化后的产物[22]。发酵牛乳中共检测出9种酯类化合物,它们在发酵乳中的含量较低,新鲜牛乳中仅检测出4-乙基苯甲酸环戊基酯一种酯类,其峰面积和浓度分别为0.46%和3.75 μg/L(表1和图4)。随着发酵时间的延长,酯类化合物的种类和含量都有所增加,发酵后期又呈现下降趋势,这可能是由于酯类化合物主要是通过脂肪酸水解以及微生物代谢生成,尤其是中短链脂肪酸水解产生的甲基酮和内酯直接会对发酵乳风味产生影响[23],可以推测发酵牛乳中的酯类化合物对后期牛乳发酵风味的贡献不大。
2.3.6 其他化合物
发酵乳中还检出酸类、胺类、呋喃类和吡喃类等9种化合物,这些化合物在发酵初期所占比例较小,发酵10 h后化合物的种类和含量都有明显增加,发酵14 h时牛乳中的乙酸峰面积和浓度均达到最大,分别为16.34%和287.94 μg/L,此时植物乳杆菌正处于对数生长期中期,其代谢活动旺盛,牛乳的pH值也下降较快。当发酵至16 h时,发酵牛乳中仅检测出乙酸(8.27%,107.38 μg/L)、辛酸(7.95%,103.23 μg/L)和二十烷二甲酸(3.62%,47.00 μg/L)3类化合物,这些酸类化合物主要赋予发酵牛乳特有的酸味(表1和图4)。
3 讨论
基于原料乳成分、发酵条件、乳酸菌的种类及其代谢等因素的差异,不同条件下发酵牛乳所得到的牛乳风味物质的种类和含量也有所不同。乳酸菌发酵牛乳时所产生的胞内和胞外蛋白酶、肽酶对牛乳蛋白的降解及风味化合物的形成都具有重要作用[24]。GC-MS数据分析表明,牛乳发酵过程中的醛类和酮类化合物的种类多、含量高,对发酵乳的风味影响较大,而这些醛类和酮类化合物可能是由牛乳中的乳脂肪分解产生的,也可能是牛乳在加工过程中其内部的氨基酸发生美拉德反应而生成的[25],酮类化合物中的3-羟基-2-丁酮和2,3-丁二酮是发酵牛乳的特征性风味化合物,该结论已得到论证[26-27]。文献中报道的酸奶中常见的风味物质乙醛在本实验中并未检测到,可能与顶空固相微萃取所使用的萃取头和萃取温度等因素的不同有关,这与王伟军[28]用SDE-GC-MS法测定发酵乳中风味物质也未检测到乙醛的实验结论相似。目前,已有许多研究表明,牛奶中的风味前体物质主要是β-乳球蛋白[29],但关于牛乳中接种乳酸菌后,乳酸菌是如何利用β-乳球蛋白而形成挥发性风味化合物,以及这类蛋白质与挥发性风味成分的结合机理的研究比较少[30-31]。实验采用顶空固相微萃取技术来得到发酵牛乳中的挥发性化合物的,由于固相微萃取需要对样品进行加热处理且要保持一段时间,可能会对牛乳中热敏性风味成分有一定的影响,而有研究表明,利用溶剂辅助风味蒸发(SAFE)法结合GC-MS对酸牛奶的挥发性成分进行分析,避免了热敏性挥发性物质的损失[32],所以今后可以有针对地选择合适的萃取方法,同时也可以结合嗅觉检测技术(GC/O)进一步确定这些风味化合物的气味类型和强度,为乳品风味物质的研究提供更好的检测平台。通过对植物乳杆菌发酵牛乳的挥发性风味物质进行研究发现,利用电子鼻和顶空固相微萃取-气质联用仪(HS-SPME-GC-MS)技术可以检测发酵牛乳挥发性风味物质的变化和组成。因此,以本实验结果为基础结合嗅觉检测技术(GC/O)可以建立一个完善的发酵牛乳风味评价体系,为今后改善酸奶风味和提高酸奶品质等方面提供理论参考。
4 结论
新鲜牛乳中主要的挥发性风味化合物有醛类(43.39 μg/L己醛、35.28 μg/L庚醛、47.26 μg/L辛醛和15.24 μg/L 2-羟基-苯甲醛)和酮类(115.06 μg/L 2-庚酮、79.61 μg/L 2-壬酮、83.12 μg/L 2,4,6-环庚三烯-1-酮、39.03 μg/L 2-十一烷酮、15.48 μg/L 2-十三烷酮和26.08 μg/L 6-己基-四羟基-2H-吡喃-2-酮);而牛乳经植物乳杆菌发酵后,其在不同发酵阶段的挥发性化合物的种类和含量都不同,发酵后期(16 h)主要的挥发性风味化合物有醛类(19.47 μg/L辛醛、31.94 μg/L 2-羟基-苯甲醛)、酮类(164.25 μg/L 2,3-丁二酮、195.93 μg/L乙偶姻、75.70 μg/L 2-庚酮、54.40 μg/L 2,4-二甲基-3-己酮、28.44 μg/L 2-壬酮、64.66 μg/L 2,4,6-环庚三烯-1-酮、16.88 μg/L 2-十一烷酮)和酸类(107.38 μg/L乙酸、103.23 μg/L辛酸和47.00 μg/L二十烷二甲酸)。
[1] 王水泉, 包艳, 董喜梅, 等. 植物乳杆菌的生理功能及应用[J]. 中国农业科技导报, 2010, 12(4): 49-55.
[2] STANTON C, GARDINER G, MEEHAN H, et al. Market potential for probiotics[J]. American Journal of Clinical Nutrition, 2001, 73(2): S476-S483.
[3] 王俊国, 孟和毕力格, 包秋华,等. 植物乳杆菌LIP-1对高脂血症大鼠血脂的调节作用[J]. 中国食品学报, 2013, 13(2): 6-12.
[4] 马千里, 刘冬, 顾瑞霞. 植物乳杆菌的益生特性及其在乳制品中的应用[J]. 中国奶牛, 2014, 1(1): 36-40.
[5] 王伟君, 李延华, 张兰威, 等. 发酵乳风味及风味物质成分分析[J]. 通化师范学院学报, 2007, 28(8): 49-51.
[6] 兰会会, 胡志和. 电子鼻技术在乳品生产与质量控制中的应用[J]. 食品科学, 2010, 31(17): 467-471.
[7] 梁琪, 张卫兵, 张炎. 百合酸奶的挥发性风味物质成分分析[J]. 食品工业科技, 2012, 33(16): 99-107.
[8] 胡玲萍, 裘迪红, 王鑫钰. 泡菜中高产蛋白酶乳酸菌的筛选鉴定及其酶学特性初步研究[J].食品与发酵工业, 2015, 41(6): 35-40.
[9] 张中义, 晁文, 刘萍, 等. 植物乳杆菌发酵脱脂牛乳生成共轭亚油酸过程的研究[J].中国食品学报, 2005, 5(2): 12-16.
[10] 王辑, 张雪, 李盛钰, 等. 植物乳杆菌K25发酵乳降低小鼠血清胆固醇的作用研究[J]. 食品科学, 2012, 33(7): 256-260.
[11] 蔺佳良, 繆芳芳, 苏秀榕, 等. 中华绒螯蟹不同部位挥发性物质的研究[J]. 核农学报, 2014, 28(2): 259-269.
[12] 孙静, 黄健, 苏秀榕, 等. 顶空固相微萃取-气质联用分析大眼金枪鱼肉的挥发性成分[J]. 食品科学, 2011, 32(22): 230-233.
[13] 刘登勇, 周光宏, 徐幸莲. 确定食品关键风味化合物的一种新方法: “ROAV”法[J]. 食品科学, 2008, 29(7): 370-374.
[14] NING L, FU-PING Z, HAI-TAO C, et al. Identification of volatile components in Chinese Sinkiang fermented camel milk using SAFE, SDE, and HS-SPME-GC/MS[J]. Food Chemistry, 2011, 129(3): 1 242-1 252.
[15] 贺红军, 邹慧, 孙宁, 等. 紫薯酸奶和普通酸奶挥发性风味物质差异性研究[J]. 现代食品科技, 2014, 30(8): 225-230.
[16] 孙宝国. 食用调香术[M]. 北京: 化学工业出版社, 2003: 25-32, 123.
[17] 卢春霞, 翁丽萍, 王宏海, 等. 3种网箱养殖鱼类的主体风味成分分析[J]. 食品与发酵工业, 2010, 36(10): 163-169.
[18] ALCARROLL, SH DESAI, S ATSUMI. Microbial production of scent and flavor compounds[J]. Current Opinion in Biotechnology, 2015, 37(1): 8-15.
[19] NING L, FU-PING Z, HAI-TAO C, et al. Identification of volatile components in Chinese Sinkiang fermented camel milk using SAFE, SDE, and HS-SPME-GC/MS[J]. Food Chemistry, 2011, 129(3): 1 242-1 252.
[20] 练敏, 纪晓俊, 黄和, 等. 香料2,3-丁二酮的合成现状及展望[J]. 现代化工, 2008, 28(8): 29-34.
[21] 陈元元, 吴岩, 刘晓光. 乙偶姻生物合成代谢调控及其应用[J]. 生物学杂志, 2014, 31(5): 76-84.
[22] CHEN D, ZHANG M. Analysis of volatile compounds in Chinese mitten crab[J]. Journal of Food and Drug Analysis, 2010, 14(3): 297-300.
[23] MURGA ML, CABRERA GM, DE VALDEZ, et al. Influence of growth temperature on cryotolerance and lipid composition of Lactobacillus acidophilus[J]. Journal of Applied Microbiology, 2000, 88(2): 342-348.
[24] 马玲, 郝教敏, 杨华, 等. 辐照对低脂Mozzarella 干酪成熟过程中挥发性风味物质的影响[J]. 核农学报, 2014, 28(1): 77-84.
[25] DD PAN, Z WU, T PENG, et al. Volatile organic compounds profile during milk fermentation by Lactobacillus pentosus and correlations between volatiles flavor and carbohydrate metabolism[J]. Journal of Dairy Science, 2014, 97(2): 624-631.
[26] DM BESHKOVA, ED SIMOVA, GI FRENGOVA, et al. Production of volatile aroma compounds by kefir starter cultures[J]. International Dairy Journal, 2003, 13(7): 529-535.
[27] A OTT, J GERMOND, M BAUMGARTNER, et al. Aroma comparisons of traditional and mild yogurts: headspace gas chromatography quantification of volatiles and origin of α-diketones[J]. Journal of Agricultural and Food Chemistry, 1999, 47(6): 2 379-2 385.
[28] 王伟君, 李延华, 张兰威, 等. SDE-GC-MS法测定发酵乳中风味物质[J]. 食品科学, 2008, 29(6): 332-334.
[29] 林晓姿, 魏巍, 何志刚, 等. 植物乳杆菌R23发酵枇杷果汁的挥发性风味物质解析[J]. 核农学报, 2015, 29(7): 1 329-1 336.
[30] S KHEM, D M SMALL, AND BK MAY. The behaviour of whey protein isolate in protecting Lactobacillus plantarum[J]. Food chemistry, 2016, 190(1): 717-723.
[31] 蒋娅婷, 曹锦轩, 张玉林, 等. 蛋白质与挥发性风味成分相互作用研究进展[J]. 核农学报, 2014, 28(2): 285-291.
[32] 刘楠楠, 郑福平, 张玉玉, 等. SAFE-GC-MS分析酸牛奶挥发性成分[J].食品科学, 2014, 35(22): 150-153.
Analysis on volatile compounds in milk fermented byLactobacillusplantarum
MING Ting-hong1, SU Xiu-rong1, ZHOU Jun1, SI Kai-xue1, ZHANG Hong-yan1, HAN Jiao-jiao1, CUI Chen-xi, DONG Li-sha,QIU Di-hong2*
1(Shool of marine sciences, Ningbo University, Ningbo 315211, China) 2(Hangzhou Medical College, Hangzhou 310053, China)
The goal of this study was to discuss the change of the volatile substances in milk by fermentedLactobacillusplantarumduring fermentation, which provided a reference for the research on flavor materials in fermented milk. Electronic nose and headspace solid-phase microextraction-gas chromatography-mass spectrometry (HS-SPME-GC-MS) were used to study the changes and compositions of the volatile substances in fermented milk. And the pH values of fresh milk and fermented milk during fermentation were measured to determine the optimal fermentation time. The results showed that the electronic nose could sensitively detect the changes of volatile flavor from milk during fermentation processing. PCA results revealed that there were obviously differences among samples. Then the GC-MS analysis indicated that 36, 34, 41, 36, 45, 34, 34, 31, 30, 29 kinds of volatile composition were respectively presented in the milk fermented for 0 h, 2 h, 4 h, 6 h, 8 h, 10 h, 12 h, 14 h and 16 h, which mainly included hydrocarbons, alcohols, aldehydes, ketones, esters, acids and other compounds. Among them, aldehydes and ketones accounted for a higher proportion in total peak area and total concentration, and were the main volatile compounds in fermented milk.
Lactobacillusplantarum;fermented milk;electronic nose;headspace solid-phase microextraction-gas chromatography-mass spectrometry(HS-SPME-GC-MS);volatile flavor components
10.13995/j.cnki.11-1802/ts.201612029
硕士研究生(裘迪红教授为通讯作者,E-mail:qiudihong@nbu.edu.cn)。
浙江省高等专科学校科研基金项目(2015B05)
2016-05-27,改回日期:2016-07-13

