老年Her-2阳性型乳腺癌患者使用赫赛汀的安全性观察
石 林 钱志英 徐 霞 沈 波
※为通讯作者
老年Her-2阳性型乳腺癌患者使用赫赛汀的安全性观察
石 林 钱志英 徐 霞 沈 波※
目的 评估年龄等于或大于65岁的老年Her-2阳性型乳腺癌患者接受赫赛汀治疗的安全性。方法 观察22例使用赫赛汀患者的治疗计划完成率并统计原因;分析不同年龄、合并心脏基础疾病、其他合并症及化疗方案含有蒽环类药物等因素是否影响治疗计划的完成;通过心脏彩超计算自赫赛汀使用时每隔3月左心射血分数(LVEF),分析在0月、3月、6月、9月、12月不同时间点LVEF数据的差异,观察赫赛汀心脏毒性的发生并随访其转归。结果 22例患者中15例(68.12%)完成治疗计划,7例(31.81%)未完成计划的患者中有3例(42.86%)因心脏毒性,其他因经济原因、患者拒绝及其他化疗毒性各1例。合并有心血管疾病的患者治疗完成率明显下降,具有统计学意义(P<0.05)。LVEF在赫赛汀使用后第9月及第12月明显下降,具有统计学差异(P<0.05);3例LVEF下降超过16%的患者暂停赫赛汀治疗后2月内LVEF恢复至基础水平。结论 多数接受赫赛汀治疗的老年Her-2阳性的乳腺癌患者能完成治疗计划,具有心血管基础疾病是发生心脏毒性导致未完成治疗计划的重要原因。赫赛汀导致的LVEF下降停药后可逆,赫赛汀选择性应用于老年患者安全可行。
赫赛汀 Her-2阳性 乳腺癌 安全性
在每年全球新发乳腺癌患者中大于65岁的老年患者约占30%,并随着老年化的趋势比例逐渐升高,老年患者中约25%为HER-2阳性型[1]。赫赛汀能降低Her-2阳性型的乳腺患者50%的复发风险,因此早在2005年赫赛汀就被批准成为Her-2阳性乳腺癌患者的标准治疗药物,且与患者年龄无关。赫赛汀的总体安全性良好,不良反应主要为心脏毒性,NCCN指南提出,对于年龄大且合并有心脏病的Her-2阳性的乳腺癌患者应谨慎使用赫赛汀。此结论源自多个大型临床试验结果,但实际老年患者在试验中是排除在入组标准之外的。因此,使用赫赛汀治疗的Her-2阳性老年乳腺癌患者发生心脏毒性的情况知之甚少。本研究通过对2011~2015年本院经治的病例进行回顾性研究,观察其心脏毒性的发生及转归,评估老年患者使用赫赛汀的安全性。
1.材料与方法
1.1 材料 选取2011年1月至2015年9月使用赫赛汀治疗的Her-2阳性患者22例,Her-2阳性诊断标准为:免疫组化显示Her-2(+++)或荧光原位杂交法显示Her-2基因扩增。女性21例,男性1例;年龄为65岁或以上,其中65~70岁15例,70岁以上为7例,具体分期为Ⅱ期7例、Ⅲ期6例、Ⅳ期9例。其中术后辅助治疗为12例,晚期一线治疗为6例,晚期二线及以上为4例。病理类型:浸润性导管癌21例,浸润性小叶癌1例。化疗方案:单药赫赛汀1例,EC-TH 5例,TCH6例,赫赛汀+紫杉醇3例,赫赛汀+长春瑞滨+顺铂2例,赫赛汀+希罗达1例,赫赛汀+吉西他滨+卡铂1例,拉帕替尼+赫赛汀+希罗达1例,帕妥珠单抗+赫赛汀+希罗达1例,赫赛汀+来曲唑1例。
1.2 赫赛汀使用方法 赫赛汀首次使用8mg/kg静滴90分钟,后以6mg/kg静滴,每3周1次,化疗前一天使用。
1.3 心脏毒性的评估和处置 每周期化疗前行心电图检查,观察心律变化及心脏缺血性改变情况。赫赛汀首次使用前应用二维心脏彩超进行LVEF基线评估,随后整个赫赛汀使用期间,每间隔3个月采集LVEF数据。遵循我国Her-2阳性乳腺癌治疗专家共识[2]:如出现LVEF较基线下降达到16%及以上,或低于50%且LVEF较治疗前下降10%,应停止曲妥珠单抗体治疗至少4周,并每4周检测1次LVEF,患者在4~8周内LVEF回升至正常范围或LVEF较治疗前绝对数值下降15%,可恢复使用曲妥珠单抗,LVEF持续下降超过8周,或者3次以上因心脏毒性而停止曲妥珠单抗治疗,应永久停止使用曲妥珠单抗。
1.4 完成治疗计划的定义 辅助化疗的患者完成使用赫赛汀1年或晚期乳腺癌患者赫赛汀使用至疾病进展,以上两种情况定义为完成治疗计划。
1.5 统计学方法 应用SPSS 16.0统计软件包进行统计学分析不同时间点的LVEF值与基线水平的比较采用配对t检验。分析完成治疗计划与年龄、心脏基础疾病、其他合并症及是否使用蒽环类药物各个因素之间的关系,采用FISH精确概率检验,P<0.05为差异有统计学意义。
2.结果
2.1 未完成赫赛汀治疗计划的原因分析 22例患者中15例(68.12%)完成治疗计划;在12例辅助治疗患者中9例(75%)完成了赫赛汀一年的计划,3例未完成患者具体原因:心脏毒性的2例(左心射血分数较基线下降大于15%),病情进展1例;10例晚期患者中完成治疗计划的有6例,4例未完成患者中1例因心脏毒性中止(左心射血分数较基线下降20%);因经济原因、化疗药物毒性及患者拒绝各1例。见表1。

表1 未完成赫赛汀治疗计划的原因分析
2.2 治疗计划的完成与年龄、心脏基础疾病、其他合并症及是否联合蒽环类药物的关系 患者年龄大于70岁、合并其他合并症及治疗方案联合蒽环类药物的患者完成治疗计划下降但无统计学意义(P>0.05)。合并有心脏基础疾病则明显降低了患者治疗计划的完成,差异具有差异(P<0.05)。见表2。
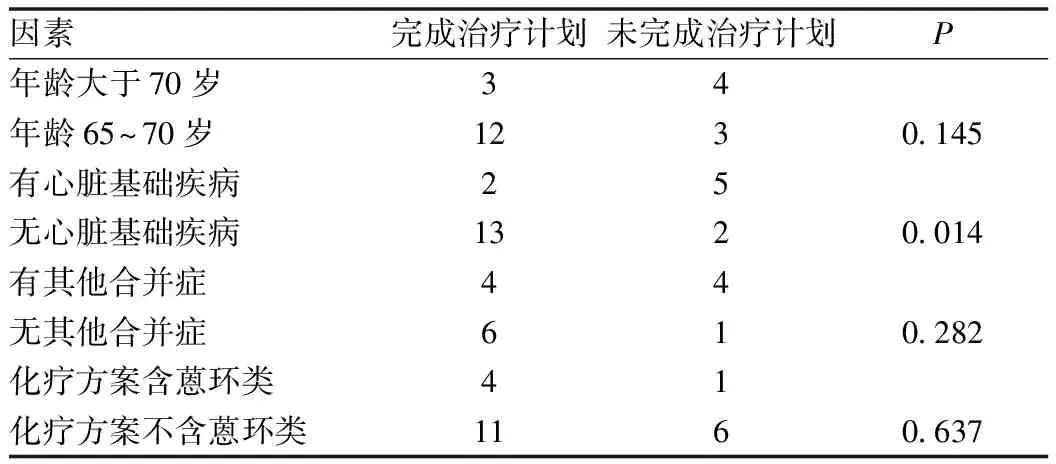
表2 多项因素与完成治疗计划的关系
2.3 左心射血分数的变化 本组患者接受赫赛汀的中位月数为22月(3月~43月),其中2例在总结时仍在进行赫赛汀治疗,最长使用时间为43月。总体上使用赫赛汀后LVEF值均基线水平有所下降,其中第9个月和第12个月LVEF由68.81±3.25分别降至64.54±3.47分和61.64±1.91分,具有统计学意义(P<0.05或P<0.01)。见表3。

表3 赫赛汀治疗过程中LVEF的变化
2.4 心脏其他事件的发生 除观察到LVEF下降外,每周期赫赛汀使用前心电图的检查中,有2例患者新发S-T段改变、有1例窦性心动过速、2例房性早搏及1例室性早搏。在整个临床研究中,无患者发生心力衰竭事件。
2.5 心脏事件处理与转归 赫赛汀使用中发生LVEF下降超过16%的患者2例,仅予以停止使用赫赛汀,随访中分别于第4周和第8周即恢复到基线水平,但因患者拒绝再次使用赫赛汀,未观察到重新使用后心脏毒性发生的情况。心电图上出现S-T段改变的患者,于心血管科就诊建议密切随访,在继续使用赫赛汀的情况下未演变为心血管不良事件。房性早搏及室性早搏的患者,因无症状,赫赛汀继续使用,随后的观察中室性早搏消失。窦性心动过速考虑与病情进展出现胸腔积液相关。
3.讨论
Her-2阳性的乳腺癌占所有乳腺癌的25%,因具有更高的恶性行为特征,相对更差的预后[1]。赫赛汀为第一个应用于临床的抗Her-2治疗的靶向药物,能显著改善Her-2阳性型乳腺癌患者的预后和转归,并成为Her-2阳性的乳腺癌患者的标准治疗药物[3]。尽管赫赛汀的耐受性良好,但在多组临床试验中观察到心脏的毒性,包括左心射血分数的下降以及心力衰竭[4]。特别是年龄大或者有基础心脏疾患的患者发生心脏毒性的风险更高[5]。NCCN因此指出,对于这部分年龄大且合并有心脏病的乳腺癌患者使用时需谨慎[6]。本研究选取经治的年龄大于65岁的Her-2阳性乳腺癌患者作为研究对象,从完成治疗计划的情况、终止赫赛汀治疗原因分析、发生心脏不良事件情况以及心脏事件发生的干预措施与转归等方面予以分析,观察老年患者对赫赛汀的耐受情况。
本次随访过去五年在治疗方案中包含赫赛汀的Her-2阳性的老年患者仅只有22例符合标准,如此小的样本量原因可能有:①患者及家属普遍对老年恶性肿瘤患者的生存预期较低,进而选择高投入的意愿小[7];②目前老年患者使用赫赛汀的安全资料不足,临床医生在对该人群的治疗上首先考虑的是安全性,因此方案选择相对保守;③经济原因。但同时观察到从2011年使用仅仅1例患者增加到2015年使用了7例,越来越多的老年患者选择使用赫赛汀,表现出的趋势与国外报道相似[7]。
在所有选择赫赛汀的患者中,完成既定治疗计划患者有15例(68.18%);而中断治疗的患者有7例(31.82%),在其中因为发生心脏毒性终止治疗的有3例(42.86%),因化疗药物毒性的1例(14.29%),因其他原因(如患者拒绝、经济原因及辅助治疗中出现病情进展)的3例。国外大组的临床试验以所有使用赫赛汀进行辅助治疗的乳腺癌患者为研究对象,分析指出其中有31.4%的患者因为心脏毒性没有能完成赫赛汀的治疗,非心脏毒性的有7%,患者拒绝和经济原因占到26%,病情进展仅仅只有6%[8]。本次观察中因心脏毒性而中断治疗的情况与国外报道相近,心脏毒性仍然是老年乳腺癌患者中赫赛汀治疗终止的重要原因。此外,国内患者及家属拒绝及经济原因中断继续使用赫赛汀的比例高于国外,很大程度上与国内对老年乳腺癌患者的生存预期不够及相对落后经济原因相关。
患者在赫赛汀使用过程观察到左心射血分数的情况,LVEF下降最明显出现在使用赫赛汀的第9月和12月,与基线相比具有统计学差异,此与Dannis Salmon观察到的情况一致[9]。并且由于LVEF下降超过16%,导致2例患者停止使用赫赛汀。此外通过心电图还观察到S-T的异常、房早及室早的发生。所有出现心脏毒性的患者都未进行药物干预,在随访中,2例LVEF下降的患者在停止赫赛汀治疗后2个月内恢复到基线水平;S-T段改变的患者未进一步演变为冠心病或心梗;无症状的房性早搏患者未见恶化,而发生室性早搏的患者后续复查心电图恢复正常。在所有患者中无发生心力衰竭的情况,也没有因心脏毒性而导致额外的住院治疗。Molinaro认为赫赛汀的心脏毒性真正的心脏毒性机制仍不明了,现在较为接受的说法是心肌细胞上HER-2常与HER-4形成二聚体,并通过与神经调节蛋白-1结合,发挥引导心肌细胞的自我调节功能。而赫赛汀与HER-2结合后阻断了该通道,导致心肌细胞功能损害[10]。Tocchetti研究发现赫赛汀的心脏毒性无法预见且通常被视为瞬态,因为它不发生或只仅仅有轻微的组织学改变,并且经过相关治疗后通常能完全恢复正常[11]。赫赛汀引起的心脏毒性在临床上观察到停用赫赛汀后大部分患者的心脏功能可以恢复,并且在心脏相关药物的治疗下,再次使用赫赛汀仍然是安全的[12]。本组出现LVEF的患者后续随访心脏功能基本恢复正常,室性早搏的患者随访中恢复正常与该观点基本一致,但因患者出于安全性考虑,拒绝重新使用赫赛汀,故未能观察到重新使用赫赛汀是否再次出现心脏毒性的情况。
本组研究中发现,7例年龄大于70岁的患者中,完成治疗计划的仅3例(42.86%),而在65~70岁之间的15例患者有80%完成治疗计划,有明显的升高,但差异无统计学意义。7例合并有心脏基础疾病的患者中,有5例未能完成治疗计划,其中由于LVEF明显下降的为3例(60%)。相对应的在无心脏基础疾病的15例患者中13例(86.67%)完成治疗计划,无患者因心脏毒性而终止治疗,两组之间的差异具有统计学意义。在合并其他合并症如:糖尿病、类风湿及COPD等慢性疾病的患者共有8例,其中50%的患者完成治疗计划,而无合并症的7例患者中6例(85.71%)完成治疗计划,虽然完成比例明显升高,但无统计学意义。5例治疗方案中联合使用蒽环类药物的患者都为术后辅助治,使用EC-TH方案序贯使用了表柔比星和赫赛汀,其中4例(80%)完成赫赛汀治疗1年的计划,剩下1例(20%)患者因心脏毒性未完成赫赛汀的维持治疗。随后分析联合蒽环类药物与治疗计划完成的差异之间的关系时,未见统计学意义。有报道未完成赫赛汀治疗计划与心脏基础疾病相关,与具有心脏基础病的患者发生心脏毒性的可能性更高有关[13],本次观察与该观点相符。Peter Dalla等研究发现年龄大于70岁,合并有其他合并症以及使用蒽环类药物可能增加心脏毒性的风险[14]。而本次研究中,大于70岁的患者病例数过少,并且在老年患者使用赫赛汀时,医师制定的方案都尽可能避免选择蒽环类,而选择其他的等效方案如TCH方案,造成亚组的样本量过小,未能达到统计学差异。
总之,本研究中发现使用赫赛汀治疗的Her-2阳性型的老年乳腺癌患者大部分都能完成治疗计划,但观察到心脏不良事件的发生是终止治疗的最重要原因,合并有心脏基础疾病是发生心脏毒性的高危因素。老年Her-2阳性型乳腺癌患者使用赫赛汀的安全性需进一步扩大样本量的随机对照研究,进一步筛选适用人群。
1 Aapro M,Monfardini S,Jirillo A,et al.Management of primary and advanced breast cancer in older unfit patients (medical treatment)[J].Cancer Treat Rev,2009,35(6):503-508.
2 中国抗癌协会乳腺癌专业委员会.Her-2阳性乳腺癌临床诊疗专家共识[J].中国癌症杂志,2012,22(4):314-318.
3 Piccart-Gebhart MJ,Procter M,Leyland-Jones B,et al.Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer[J].N Engl J Med,2005,353(16):1659-1672.
4 Balduzzi S,Mantarro S,Guarneri V,et al.Trastuzumab containing regimens for early breast cancer[J].Cochrane Database Syst Rev,2012(6):CD006242.
5 Romond EH,Jeong JH,Rastogi P,et al.Seven-year follow-up assessment of cardiac function in NSABP B-31,a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel (ACP) with ACP plus trastuzumab as adjuvant therapy for patients with node-positive,human epidermal growth factor receptor 2-positive breast cancer[J].J Clin Oncol,2012,30(31):3792-3799.
6 Freedman RA,Hughes ME,Ottesen RA,et al.Use of adjuvant trastuzumab in women with human epidermal growth factor receptor 2 (HER2)-positive breast cancer by race/ethnicity and education within the National Comprehensive Cancer Network[J].Cancer,2013,119(4):839-846.
7 Vaz-Luis I,Keating NL,Lin NU,et al.Duration and toxicity of adjuvant trastuzumab in older patients with early-stage breast cancer:a population-based study[J].J Clin Oncol,2014,32(9):927-934.
8 Romond EH,Perez EA,Bryant J,et al.Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer[J].N Engl J Med,2005,353(16):1673-1684.
9 Slamon D,Eiermann W,Robert N,et al.Adjuvant trastuzumab in HER2-positive breast cancer[J].N Engl J Med,2011,365(14):1273-1283.
10 Molinaro M,Ameri P,Marone G,et al.Recent Advances on Pathophysiology,Diagnostic and Therapeutic Insights in Cardiac Dysfunction Induced by Antineoplastic Drugs[J].BioMed Research International,2015,2015:1-14.
11 Tocchetti CG,Ragone G,Coppola C,et al.Detection,monitoring,and management of trastuzumab-induced left ventricular dysfunction:an actual challenge[J].Eur J Heart Fail,2012,14(2):130-137.
12 Suter TM,Cook-Bruns N,Barton C.Cardiotoxicity associated with trastuzumab (Herceptin) therapy in the treatment of metastatic breast cancer[J].Breast,2004,13(3):173-183.
13 Denegri A,Moccetti T,Moccetti M,et al.Cardiac toxicity of trastuzumab in elderly patients with breast cancer[J].J Geriatr Cardiol,2016,13(4):355-363.
14 Dall P,Lenzen G,G?hler T,et al.Trastuzumab in the treatment of elderly patients with early breast cancer:Results from an observational study in Germany[J].J Geriatr Oncol,2015,6(6):462-469.
Observation on safety of Herceptin in treatment of elderly patients with Her-2-positive breast cancer
(SHI Lin, QIAN Zhiying, XU Xia, SHEN Bo.
Department of Oncology, Jiangsu Cancer Hospital Affiliated to Nanjing Medical University, Nanjing 210009, China.)
Objectives To evaluate the safety of Herceptin in the treatment of eldely patients with Her-2-positive breast cancer who aged ≥65 years old.Methods The completion rate of therapeutic plan of the 22 patients using Herceptin was observed and the causes were recorded.Whether the factors,like different ages,complication of cardiac basic diseases,other complications,and whether the chemotherapy contained anthracyclines,had influence on the completion of therapeutic plan was analyzed.Cardiac color ultrasound was used to calculate the left ventricular ejection fraction (LVEF) once every 3 months since the application of Herceptin,so as to analyze the difference of LVEF data at different time points after 0,3,6,9 and 12 months.The occurrence of cardiac toxicity of Herceptin and clinical outcomes after follow up were observed.Results Of the 22 patients,15 (68.12%) completed the therapeutic plan.Of the 7 (31.81%) patients who did not finish the plan,3 (42.86%) had cardiac toxicity,1 had financial cause,1 refused to continue the treatment and 1 had other chemotherapeutic toxicity.The completion rate of patients complicated with cardiovascular diseases decreased notably,and there was significant difference (P<0.05).LVEF level decreased prominently after 9- and 12- month treatment with Herceptin,and there were significant differences when compared with treatment before (P<0.05).The level of LVEF decreasing >16% in 3 patients was recovered to basal level after drug withdrawal within two months.Conclusions Most elderly patients with Her-2-positive breast cancer who received Herceptin can finish the therapeutic plan,and cardiovascular basal diseases are important caused for the incompletion of therapeutic plan due to cardiac toxicity.Herceptin-induced LVEF decrease is reversible after drug withdrawal,and selective application of Herceptin is safe and feasible in the treatment of elderly patients.
Herceptin, Her-2 positive, breast cancer, safety
南京医科大学附属江苏省肿瘤医院 肿瘤内科 21009
吴阶平基金(N0.320.6750.14193),江苏省卫计委中医药管理局课题(LZ13232)
10.3969/j.issn.1672-4860.2016.06.010
2016-11-01

