心肌细胞中微小核糖核酸 let-7c对肌营养素基因表达的调控作用
王玉瑶,王玉璇,翟翔,刘铭,解军
心肌细胞中微小核糖核酸 let-7c对肌营养素基因表达的调控作用
王玉瑶,王玉璇,翟翔,刘铭,解军
目的:探讨心肌细胞中微小核糖核酸(miR)let-7c(miR-let-7c)对肌营养素基因表达是否具有调控作用以及可能的作用机制。
微小核糖核酸;肌营养素;核转录因子-κB
(Chinese Circulation Journal, 2016,31:1215.)
微小核糖核酸(miR)通过降解靶mRNA或抑制靶mRNA的翻译来调控基因表达[1]。最近研究发现miR-let-7家族在心脏组织中高表达,参与许多重要的心脏功能调控[2],miR-let-7c可能在心肌肥厚中发挥重要作用,但其具体作用靶标和机制仍不清楚[3]。肌营养素(myotrophin, MTPN)是从原发性高血压大鼠的心脏中分离得到的低分子量蛋白,经研究证实肌营养素参与心脏肥厚的起始环节,并在心脏肥厚向心力衰竭的发展过程中发挥重要作用[4-7]。生物信息学分析表明,肌营养素mRNA 的3'非编码区(3'-UTR)可能受miR-let-7c调控,但尚少有切实实验证据的支持。我们拟构建携带有肌营养素mRNA 3'-UTR的重组质粒载体,与miR-let-7c前体共同转入Hela细胞,采用双荧光素酶报告系统分析miR-let-7c对肌营养素表达的调控作用。进一步通过转染大鼠心肌细胞H9c2,研究miR-let-7c上调后对肌营养素基因在心肌细胞中表达的影响,以及对肥厚关键信号分子核转录因子-κB(NF-κB)活性的调控作用,研究结果有助于阐明miR-let-7c在心肌肥厚中的作用机制。
1 材料和方法
实验材料和试剂:胰蛋白酶购自Sigma公司(美国);胎牛血清、达尔伯克改良伊格尔培养基(DMEM)、转染试剂Lipofectamine 2000购自Invitrogen公司(美国);miR-let-7c前体及抑制剂、pMIRREPORTTMmiRNA表达报告载体购自Ambion公司(美国);Taqman 实时定量聚合酶链式反应(PCR)相关试剂购自ABI公司(美国);肌营养素抗体、NF-κB p65抗体购自Santa Cruz公司(美国)。
构建荧光素酶报告系统:合成含肌营养素3'-UTR关键区域的核酸片段,序列为: 5'-TATTAAGACCAAG TCATGCAATAATTGAATGTACCTCAAATTTTTA-3', 经PCR,HindⅢ和SpeⅠ双酶切,将上述序列克隆入pMIR-REPORT荧光素酶报告基因表达载体,重组载体经测序验证后命名为重组荧光素酶报告基因表达载体(pMIR-MTPN)。Hela细胞培养在含10% 胎牛血清的DMEM培养液中,转染前1天给细胞换液至无胎牛血清的DMEM培养液中,每孔接种1×105细胞于24孔细胞培养板中,每孔200 ng 重组载体DNA pMIR-MTPN和miR-let-7c前体或者阴性对照(终浓度为50 nmol/L)与Lipofectamine 2000试剂混合后分别对Hela细胞进行共转染,分为3个实验组(n=3):(1)pMIR-MTPN单纯载体组;(2)pMIR-MTPN +miR前体阴性对照组;(3)pMIRMTPN + miR-let-7c前体组。各组细胞培养48 h后,用磷酸盐(PBS)缓冲液洗涤三遍,加入被动裂解缓冲液(PLB),细胞裂解液检测并计算标准荧光素酶活性(荧光素酶活性检测仪,美国Turner 公司)。
miR转染大鼠H9c2心肌细胞:大鼠H9c2细胞株购自中国科学院细胞库,于含10%胎牛血清DMEM培养液,5% 二氧化碳(CO2),37℃条件下培养。转染实验前,将终浓度为50 nM miR-let-7c前体或抑制剂100 μl DMEM与加入5 μl Lipofectamine 2000试剂100 μl DMEM配成混合液体,H9c2细胞的6孔板中的细胞中加入1.8 ml无血清DMEM培养液后,加入该混合液体,37℃孵育6 h,去掉转染液,换2.5 ml DMEM培养48 h,进行后续实验。实验分为4个组(n=3):(1)miR阴性对照组;(2)miR-let-7c前体组;(3)抑制物阴性对照组;(4) miR-let-7c抑制物组。
实时定量PCR:提取转染后的H9c2细胞总RNA,每份标保本取10 ng RNA进行逆转录,逆转录产物稀释至30 μl后进行实时定量PCR检测,反应体系:0.75 μl 20×探针,2 μl稀释后逆转录产物,7.5 μl 2×Taqman Universal PCR Master Mix Ⅱ,4.75 μl无核酸酶水。反应条件:95℃,10 min;95℃,15 s,60℃,60 s,40个循环。使用U6作为内参基因。采用2-ΔΔCt方法计算分析各组miR-let-7c mRNA的相对表达量。
蛋白质提取及Western blot:裂解液裂解转染后的H9c2细胞,提取细胞总蛋白或分离提取细胞核蛋白,BCA法[8]测定样品蛋白浓度。等量(50 μg)蛋白经十二烷基硫酸钠(SDS)-聚丙稀酰胺凝胶电泳转印至硝酸纤维素膜,分别加入肌营养素一抗(稀释倍数1:1 000)、NF-κB p65以及β-微管蛋白或β-肌动蛋白内参一抗(稀释倍数1:1 000),于4℃孵育过夜,洗膜后,加辣根过氧化物酶标记二抗(稀释倍数1:5 000),室温孵育2 h。X光片显色。使用ImageJ软件分析各条带与内参条带的吸光度值之比。
统计学方法:所有实验均至少重复三次,结果取平均值,数据表达为均数±标准差,多组间比较采用单因素方差分析,两组间比较采用Student’s t检验,统计学处理使用SPSS 13.0软件进行,P<0.05为差异有统计学意义(双侧)。
2 结果
2.1miR-let-7c作用于肌营养素mRNA 靶向关系验证
双荧光素酶报告系统实验结果表明(图1),在Hela细胞中,与pMIR-MTPN+miR前体阴性对照组相比,pMIR-MTPN+ miR-let-7c前体组荧光素酶活性显著降低,下降了41%[(59.30±9.90)% vs(98.10±15.10)%,P<0.05],表明miR-let-7c能够直接作用于肌营养素mRNA 3'-UTR区域。
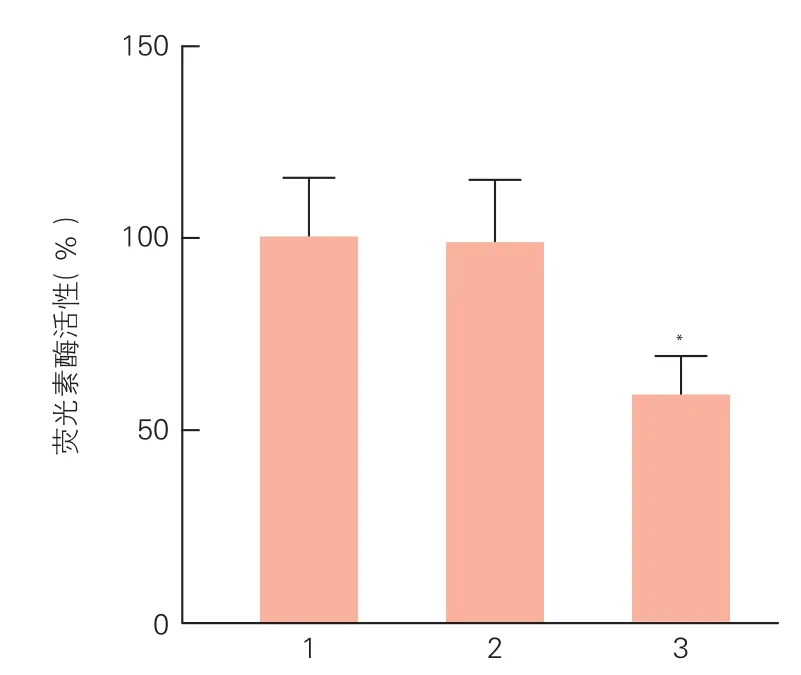
图1 荧光素酶活性检测miR-let-7c与肌营养素mRNA 3'-UTR区域相互作用(n=3)
2.2miR-let-7c转染大鼠H9c2心肌细胞效果
采用Taqman实时定量PCR法检测 miR转染效果,结果表明(图2),miR-let-7c前体转染H9c2心肌细胞后,与miR阴性对照组相比,miR-let-7c前体组miR-let-7c表达水平显著升高;而miR-let-7c抑制物转染后,与抑制物阴性对照组相比,miR-let-7c抑制物组miR-let-7c表达水平则显著降低(0.42±0.11) 倍。差异均有统计学意义(P<0.05)。

图2 Taqman实时定量PCR法检测miR-let-7c前体及抑制物转染H9c2心肌细胞后miR-let-7c表达水平(n=3)
2.3miR-let-7c对肌营养素蛋白表达具有抑制作用
Western blot法检测miR-let-7c转染H9c2心肌细胞后肌营养素蛋白表达,结果表明(图3),miR-let-7c前体组与miR阴性对照组相比,肌营养素蛋白表达水平显著降低(0.28±0.05 vs 0.90±0.09);而miR-let-7c抑制物转染H9c2心肌细胞后,miR-let-7c抑制物组与抑制物阴性对照组比较肌营养素蛋白表达水平显著升高(1.14±0.09 vs 0.44±0.09)。差异均有统计学意义(P<0.05)。
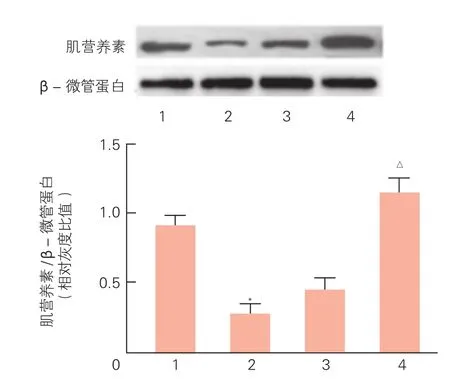
图3 蛋白免疫印迹法检测miR-let-7c对大鼠心肌细胞中肌营养素蛋白表达水平的影响(n=3)
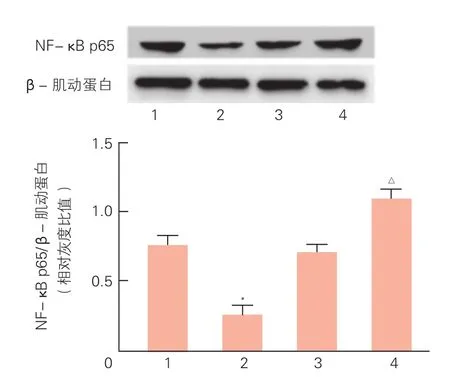
图4 蛋白免疫印迹法检测miR-let-7c对大鼠心肌细胞核中NF-κB p65蛋白表达的影响(n=3)
2.4miR-let-7c 转染心肌细胞后NF-κB蛋白水平变化
Western blot法检测miR-let-7c转染H9c2心肌细胞后细胞核内NF-κB p65蛋白表达,结果表明(图4),miR-let-7c前体组与miR阴性对照组相比,NF-κB p65蛋白表达水平显著降低(0.25±0.06 vs 0.75±0.07);而miR-let-7c抑制物组与抑制物阴性对照组比较,NF-κB p65蛋白表达水平显著升高(1.09±0.05 vs 0.71±0.06)。差异均有统计学意义(P<0.05)。
3 讨论
心肌肥厚是影响心血管疾病发病率和病死率的独立危险因素。心肌肥厚过程受到多种因素刺激和多种信号通路调控,寻找参与调控心肌肥厚的关键因子,揭示心肌肥厚的分子机制一直以来都是研究热点[9]。近年来,随着对miR功能研究的不断深入,人们已经明确证实了一些miR参与心肌肥厚的调控通路[10-12],但仍有许多miR在心肌肥厚中的调控机制尚待揭示。miR-let-7是最早被发现的miR之一,在各物种间高度保守。之前大量研究多关注于miR-let-7在肿瘤抑制方面的作用[1,13]。近年来,一系列研究表明,miR-let-7家族还参与心血管系统分化、发育、疾病等诸多生理病理学过程的调控,其中miR-let-7c可能参与了心肌肥厚过程,但其靶标及具体作用机制目前仍不清楚[2,3]。
miR的5’端第2~7或2~8个核苷酸序列称为“种子序列”,这一区域具有高度的保守性,与之互补的靶序列在不同物种中通常也具有高度的保守性,种子序列对于miR识别特异性的靶序列是必需的[14]。肌营养素是蛋白分子量为12 kD的锚定重复序列蛋白,在哺乳动物的组织中广泛表达[15]。一系列基础及临床实验研究均表明,肌营养素是心肌肥厚和心力衰竭的起始因子[4-7]。我们前期通过文献调研和生物信息学分析,发现肌营养素基因3'-UTR区域存在与miR-let-7c种子序列识别和结合的靶序列,克隆该段序列,并进一步通过分子及细胞生物学实验对miR-let-7c能否调控肌营养素基因表达进行了研究,荧光素酶报告系统实验结果证实了miR-let-7c能够直接作用于肌营养素基因3'-UTR相应序列,从而对肌营养素基因表达产生抑制作用。进一步通过在心肌细胞中过表达miR-let-7c前体,发现miR-let-7c能够降低肌营养素在心肌细胞中的蛋白表达水平,从而证实了肌营养素是miR-let-7c在心肌肥厚过程中的调控靶蛋白之一。此外,研究表明,NF-κB信号通路是肌营养素发挥心肌肥厚调控的关键分子通路[5],NF-κB通路活化时,NF-κB p65转入细胞核内,从而行使一系列调控作用。本研究结果表明,miR-let-7c上调后NF-κB蛋白水平降低,这可能是其参与心肌肥厚的重要分子机制之一。
综上所述,本研究在分子、细胞水平上对miR-let-7c与肌营养素基因3'-UTR位点的相互作用以及肥厚关键分子NF-κB的影响进行了验证,结果表明,miR-let-7c可能通过调节肌营养素基因参与心肌肥厚过程,且该过程涉及NF-κB信号通路,这一结果有助于阐明miR-let-7c在心肌肥厚中的具体分子机制。
[1] Roush S, Slack FJ. The let-7 family of microRNAs. Trends Cell Biol, 2008, 18: 505-516.
[2] Bao MH, Feng X, Zhang YW, et al. Let-7 in cardiovascular diseases, heart development and cardiovascular differentiation from stem cells. Int J Mol Sci, 2013, 14: 23086-23102.
[3] Sayed D, Hong C, Chen IY, et al. MicroRNAs play an essential role in the development of cardiac hypertrophy. Circ Res, 2007, 100: 416-424.
[4] 王玉瑶, 惠汝太. 肌侵蛋白起始心脏肥厚机制的研究进展. 中国分子心脏病学杂志, 2010, 10: 314-316.
[5] Gupta S, Purcell NH, Lin A, et al. Activation of nuclear factor-kappaB is necessary for myotrophin-induced cardiac hypertrophy. J Cell Biol, 2002, 159: 1019-1028.
[6] Gupta S, Maitra R, Young D, et al. Silencing the myotrophin gene by RNA interference leads to the regression of cardiac hypertrophy. Am J Physiol Heart Circ Physiol, 2009, 297: H627-636.
[7] Das B, Young D, Vasanji A, et al. Influence of p53 in the transition of myotrophin-induced cardiac hypertrophy to heart failure. Cardiovasc Res, 2010, 87: 524-534.
[8] Brown RE, Jarvis KL, Hyland KJ. Protein measurement using bicinchoninic acid: elimination of interfering substances. Anal Biochem, 1989, 180: 136-139.
[9] Rohini A, Agrawal N, Koyani CN, et al. Molecular targets and regulators of cardiac hypertrophy. Pharmacol Res, 2010, 61: 269-280. [10] Callis TE, Pandya K, Seok HY, et al. MicroRNA-208a is a regulator of cardiac hypertrophy and conduction in mice. J Clin Invest, 2009, 119:2772-2786.
[11] da CMPA, Salic K, Gladka MM, et al. MicroRNA-199b targets the nuclear kinase Dyrk1a in an auto-amplification loop promoting calcineurin/NFAT signalling. Nat Cell Biol, 2010, 12: 1220-1227.
[12] Yang Y, Del RDP, Nakano N, et al. miR-206 mediates YAP-induced cardiac hypertrophy and survival. Circ Res, 2015, 117: 891-904.
[13] Shi XB, Tepper CG, deVere WRW. Cancerous miRNAs and their regulation. Cell Cycle, 2008, 7: 1529-1538.
[14] Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets. Cell, 2005, 120: 15-20.
[15] Sivasubramanian N, Adhikary G, Sil PC, et al. Cardiac myotrophin exhibits rel/NF-kappa B interacting activity in vitro. J Biol Chem, 1996, 271: 2812-2816.
Regulative Effect of microRNA let-7c on Myotrophin Gene Expression in Rat’s H9c2 Cardiac Myocytes
WANG Yu-yao, WANG Yu-xuan, ZHAI Xiang, LIU Ming, XIE Jun.
Department of Biochemistry and Molecular Biology, Shanxi Medical University, Taiyuan (030001), Shanxi, China
XIE Jun, Email: xiejun1968@126.com
Objective: To explore weather microRNA let-7c (miR-let-7c) could regulate myotrophin gene expression in rat’s H9c2 cardiac myocytes with possible mechanisms.Methods: Recombinant plasmid carrying 3′ untranslated region (3′-UTR) of myotrophin and miRNA precursor of let-7c was co-transfected into Hela cells to construct the luciferase reporter system in order to measure luciferase activity. Rat’s H9c2 cardiac myocytes were cultured. The let-7c gene expression was detected by Taqman probe-based real-time PCR after let-7c miRNA precursor or let-7c miRNA inhibitor transfection respectively; protein expressions of myotrophin and nuclear factorκB (NF-κB) were examined by Western blot analysis.Results: Luciferase activity examination indicated that compared with recombinant luciferase gene expression carrier (pMIR-MTPN)+miR precursor negative control group, pMIR-MTPN+miR-let-7c miRNA precursor group showed reduced luciferase activity (59.30±9.90) % vs (98.10±15.10) %. Western blot analysis presented that compared with miR negative control group, miR-let-7c precursor group had decreased protein expressions of myotrophin (0.28±0.05) vs (0.90±0.09) and NF-κB (0.25±0.06) vs (0.75±0.07); in contrast, compared with Negative inhibitor group, miR-let-7c inhibitor group had increased protein expressions of myotrophin (1.14±0.09) vs (0.44±0.09) and NF-κB (1.09±0.05) vs (0.71±0.06), all P<0.05.Conclusion: miR-let-7c could inhibit myotrophin expression via acting on its 3′-UTR domain and may also infuence NF-κB signaling pathway in rat’s H9c2 cardiac myocytes.
microRNA; Myotrophin; Nuclear factor-κB
2016-06-20)
(编辑;曹洪红)
国家自然科学基金(81500364);山西省基础研究项目(2015021187);山西省高等学校科技创新项目(2015149)
030001 山西省太原市,山西医科大学基础医学院 生物化学与分子生物学教研室
王玉瑶 讲师 博士 主要从事心血管疾病相关基因功能研究 Email:wyybio@163.com 通讯作者:解军 Email: xiejun1968@126.com.
R541
A
1000-3614(2016)12-1215-04
10.3969/j.issn.1000-3614.2016. 12.015
方法:首先构建携带肌营养素基因3'非编码区(3'-UTR)片段的荧光素酶报告基因载体,与miR-let-7c前体共转染Hela细胞,双荧光素酶报告基因系统检测荧光素酶活性以验证miR-let-7c与肌营养素基因的靶向调控关系。进而培养大鼠心肌细胞H9c2,Taqman实时定量聚合酶链式反应(PCR)法检测miR转染效果,蛋白免疫印迹(Western blot)法检测miR-let-7c及miR-let-7c抑制物转染心肌细胞后肌营养素蛋白表达,以及心肌肥厚相关信号通路分子核转录因子-κB(NF-κB)的活性变化。
结果:荧光素酶活性实验结果表明,与重组荧光素酶报告基因表达载体(pMIR-MTPN)+ miR前体阴性对照组相比,pMIR-MTPN+ miR-let-7c前体组荧光素酶活性显著降低[(59.30±9.90)% vs ( 98.10±15.10)%]。Western blot结果表明,miR-let-7c前体组与miR阴性对照组相比,肌营养素蛋白表达水平显著降低[(0.28±0.05) vs (0.90±0.09)],此外,NF-κB蛋白水平显著降低[(0.25±0.06) vs ( 0.75±0.07)];相反,miR-let-7c抑制物组与抑制物阴性对照组相比,肌营养素蛋白表达水平显著升高[(1.14±0.09) vs(0.44±0.09)],同时,NF-κB蛋白水平也显著升高[(1.09±0.05)vs(0.71±0.06)],差异均有统计学意义(P < 0.05)。
结论:miR-let-7c能够通过作用于3'UTR区域,抑制肌营养素基因表达,并影响心肌肥厚关键信号通路分子NF-κB的活性。

