高位胸段硬膜外阻滞对心房颤动自主神经重构的影响
曹勇,田晓燕,张苒,代玉川,赵家琦,安毅
高位胸段硬膜外阻滞对心房颤动自主神经重构的影响
曹勇*,田晓燕,张苒,代玉川,赵家琦,安毅
目的:观察高位胸段硬膜外阻滞(HTEB)对长期右心耳快速起搏诱发心房颤动(房颤)犬心房自主神经重构的影响,并探讨心房肌神经生长因子(NGF)在心房自主神经重构中的作用。
心房颤动;自主神经重构;注射,硬膜外;利多卡因
Methods: AF model was established by consistent rapid atrial pacing for 6 weeks. 18 experimental dogs were randomly divided into 3 groups: Sham group, the dogs had no pacing while received normal saline injection; Control group, the dogs had pacing and normal saline injection; HTEB group, the dogs had pacing and 0.5% lidocaine injection for HTEB. n=6 in each group. Atrial myocardium collagen volume fraction (CVF) was examined by Masson staining; sprouting of NGF related protein 43 (GAP43) and tyrosine hydroxylase (TH) were assessed by immunohistochemistry; protein expressions of NGF, GAP43 and TH were measured by Western blot analysis.
Results: Compared with Sham group, HTEB group showed decreased CVF and sprouting of GAP43, TH, P<0.05; reduced protein expressions of NGF, GAP43 and TH, P<0.05-0.01. Compared with Sham group, HTEB group presented increased CVF and sprouting of GAP43, TH, P<0.05-0.01; elevated protein expressions of NGF, GAP43 and TH, P<0.05.
Conclusion: Long-term rapid atrial pacing induced AF dog had inhomogeneous sprouting of atrial myocardial nerve which may cause autonomic nerve remodeling; NGF played the important role in such process. HTEB could effectively inhibit NGF up-regulation and suppress the autonomic nerve remodeling in experimental dogs.
Key wordsAtrial fbrillation; Autonomic nerve remodeling; Injection, epidural; Lidocaine
(Chinese Circulation Journal, 2016,31:1219.)
心房颤动(房颤)的发生机制至今仍未明确,目前认为房颤是多种机制共同作用的结果。心房重构作为房颤的发生机制之一已经获得公认,房颤时心房重构主要包括:电重构、结构重构和收缩功能重构。新近研究表明,除上述三种重构外,房颤时心房还存在“自主神经重构”,主要表现为自主神经纤维的显著萌出及其不均一性分布[1]。“自主神经重构”可通过多种机制触发并维持房颤。因而,有人提出房颤发生的“自主神经机制”。另外,研究发现[2],高位胸段硬膜外阻滞(HTEB)可通过抑制交感神经系统、血管紧张素系统过度激活,抑制凋亡和氧化应激,可用于治疗顽固性心绞痛和扩张型心肌病,提示HTEB可能通过多种途径影响房颤“自主神经重构”,抑制房颤的发生和维持。本研究旨在观察HTEB对房颤犬心房“自主神经重构”的影响,并探讨心房肌神经生长因子(NGF)在心房自主神经重构中的作用。
1 材料与方法
实验动物:2014-06至2015-06将18只成年健康杂种犬,雌雄不限,体重20~25 kg,由哈尔滨医科大学附属第一临床医学院动物实验室提供。犬随机分入假手术组(n=6)、对照组(n=6)和HTEB组(n=6)。
实验动物准备[3]及取材:主要包括麻醉、开胸手术、硬膜外腔置管术,在术后恢复一周行心房快速起搏6周建立房颤犬模型。起搏6周后快速取出心脏、生理盐水冲洗,切取左、右心房侧壁心肌组织,固定包埋液氮速冻后-80℃存放。
实验方法:(1)分组:假手术组:不起搏、硬膜外腔注射生理盐水4 ml/次;对照组:起搏、硬膜外腔注射生理盐水4 ml/次;HTEB组:起搏、硬膜外腔注射0.5%利多卡因4 ml/次。(2)各组犬心房肌纤维化程度测定:取各组犬心房肌石蜡组织切片、脱蜡后,固定于Bouin氏液,常规脱水包埋,行Masson胶原染色。用计算机图像分析系统(Motic Images Advanced 3.0)进行胶原半定量分析。(3)免疫组化方法检测心房肌自主神经萌出:选取各组石蜡包埋的左、右房心肌组织行5 μm连续切片脱蜡、水化,3%过氧化氢孵育10 min阻断内源性过氧化物酶。滴加兔抗酪氨酸羟化酶(TH)多克隆抗体(1:600,英国Abcam公司)和兔抗神经生长相关蛋白43(GAP43)多克隆抗体(1:600,英国Abcam公司),磷酸盐缓冲液(PBS,pH 7.4,0.01 mol/L)阴性对照,4℃孵育过夜,PBS冲洗后滴加羊抗兔-HRP二抗(北京中杉生物公司提供),37℃孵育20 min,二氨基联苯胺显色[4]。酪氨酸羟化酶(TH)标志心脏交感神经分布,神经生长相关蛋白43(GAP43)标志再生神经纤维。(4) 蛋白免疫印迹法测定犬心房肌神经生长因子 (NGF)、酪氨酸羟化酶(TH)及GAP43蛋白表达:取液氮冻存心房肌组织500 mg,加入裂解液,冰浴匀浆,115g离心40 min。在生物分光光度计上比色分析对上清液进行蛋白测定。取蛋白质行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,湿转膜,BSA封闭后磷酸盐吐温缓冲液(PBST,pH 7.4,PBS液中加入0.05% Tween20)漂洗。加入兔抗NGF多克隆抗体(1:200 美国Santa Cruz公司)、兔抗TH多克隆抗体(1:200,英国Abcam公司)、兔抗GAP43多克隆抗体(1:400,英国Abcam公司)、小鼠抗GAPDH多克隆抗体(1:10000,上海康成生物公司)一抗,4℃过夜。TBST(pH 7.4,Tris缓冲液中加入0.05% Tween20)漂洗后,分别与碱性磷酸酶标记的羊抗兔IgG及马抗小鼠IgG(1:1000,北京中杉生物公司)二抗进行杂交,37℃平摇1 h。将滤膜用TBST摇动洗涤3次。NBT/BICP(四唑氮蓝/5-溴-4-氯-3-吲哚磷酸盐)显色,应用凝胶成像系统进行蛋白条带光密度扫描分析。
统计学方法:数据以均数±标准差表示,所有数据采用SPSS19.0统计软件分析,计量资料组间比较采用方差分析。 P<0.05为差异有统计学意义。
2 结果
2.1各组犬心房肌纤维化程度(表1,图1)
HTEB组及假手术组犬左、右心房肌CVF值较对照组犬明显降低(P<0.05~0.01)。且假手术组低于HTEB组(P<0.05),差异均有统计学意义。各组犬左、右心房肌CVF值无差异(P>0.05),假手术组心肌间质中可见极少量胶原纤维散在分布,排列整齐,细胞形态规整;对照组胶原纤维弥漫性增生分布,胶原明显增粗,肌丝排列紊乱松散,间质明显纤维化;HTEB组胶原纤维少量增生,胶原有所增粗,肌丝排列不规整,间质可见部分纤维化。
表1 Masson胶原染色三组犬左、右心房肌胶原容积分数(CVF值)比较(%,n=6,

表1 Masson胶原染色三组犬左、右心房肌胶原容积分数(CVF值)比较(%,n=6,
注:HTEB:高位胸段硬膜外阻滞。与对照组比较*P<0.05**P<0.01;与假手术组比较△P<0.05
部位 对照组 HTEB组 假手术组右心房 6.016±0.273 5.580±0.265* 3.422±0.256**△左心房 5.818±0.303 5.328±0.399* 3.262±0.169**△

图1 各组犬心房肌Masson胶原染色(×400)
2.2各组犬心房肌神经纤维萌出情况
各组犬心房肌GAP43免疫组化染色 (图2,图3):与对照组犬相比,HTEB组和假手术组犬左、右心房肌GAP43阳性纤维密度显著降低(P<0.01),且假手术组低于HTEB组,差异均有统计学意义(P<0.01)。假手术组左、右心房肌GAP43阳性纤维分布规整;对照组左、右心房肌GAP43阳性纤维显著增生,排列明显紊乱,呈高度不均一性分布,右心房较左心房GAP43阳性纤维增生更明显(P<0.05); HTEB组左、右心房肌GAP43阳性纤维少量增生,呈不均一性分布,右心房GAP43阳性纤维增生更明显(P<0.05)。
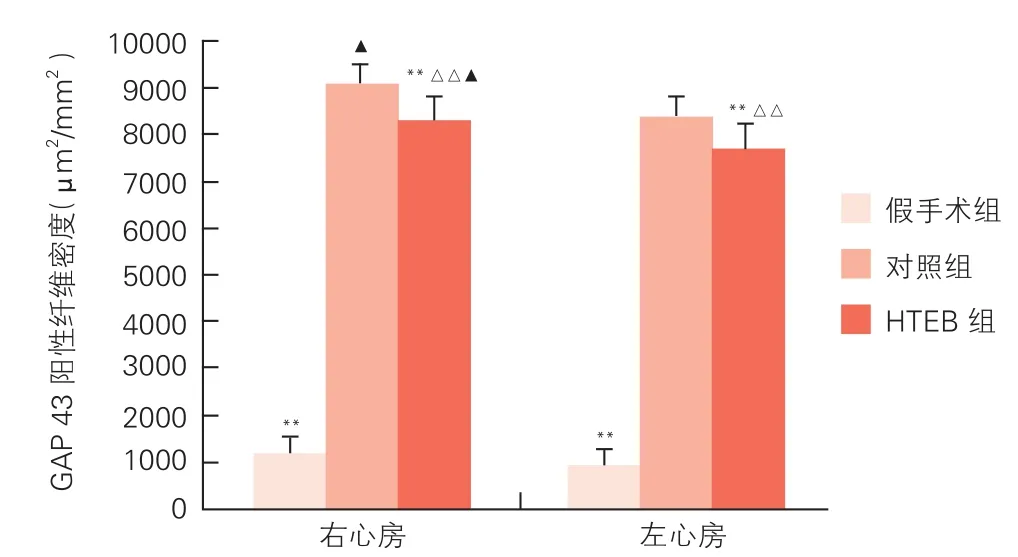
图2 免疫组化染色分析各组犬心房肌神经生长相关蛋白43(GAP43)阳性纤维密度

图3 各组犬心房肌神经生长相关蛋白43(GAP43) 免疫组化染色
各组犬心房肌TH免疫组化染色(表2): 与对照组犬相比,假手术组犬左、右心房肌TH阳性纤维密度显著降低(P<0.01),对照组犬左心房间TH阳性纤维密度显著低于右心房(P<0.05);HTEB组犬左、右心房肌TH阳性纤维密度明显低于对照组(P<0.05),但仍显著高于假手术组(P<0.01);差异均有统计学意义。
表2 免疫组化染色分析各组犬心房肌酪氨酸羟化酶(TH)阳性纤维密度(μm2/mm2 ,n, ±s)

表2 免疫组化染色分析各组犬心房肌酪氨酸羟化酶(TH)阳性纤维密度(μm2/mm2 ,n, ±s)
注:HTEB:高位胸段硬膜外阻滞。与对照组比较*P<0.05**P<0.01;与假手术组比较△△P<0.01;与同组右心房比较▲P<0.05
部位 对照组 HTEB组 假手术组右心房 4514.2±293.7 4164.0±184.3*△△ 684.4±26.1**左心房 4166.8±339.3▲ 3928.1±143.4*△△ 651.0±38.2**
各组犬心房肌NGF,GAP43和TH蛋白表达情况(表3):与对照组犬相比,假手术组犬左、右心房肌NGF 蛋白表达降低(P<0.01);对照组犬左心房心房肌NGF 蛋白表达较右心房降低(P<0.05);HTEB组犬左、右心房肌NGF蛋白表达较对照组降低(P<0.05),但仍高于假手术组(P<0.05);差异均有统计学意义。与对照组犬相比,假手术组犬左、右心房肌GAP43蛋白表达降低(P<0.01);对照组犬左心房心房肌GAP43 蛋白表达较右心房降低(P<0.05);HTEB组犬左、右心房肌GAP43 蛋白表达较对照组降低(P<0.05),但仍高于假手术组(P<0.05);差异均有统计学意义。与对照组犬相比,假手术组犬左、右心房肌TH蛋白表达降低(P<0.01);对照组犬左心房心房肌TH 蛋白表达较右心房降低(P<0.05);HTEB组犬左、右心房肌TH蛋白表达较对照组降低(P<0.05),但仍高于假手术组(P<0.01);差异均有统计学意义。
表3 半定量分析各组犬心房肌蛋白含量(NGF/GAPDH光密度比值)(n=6,)
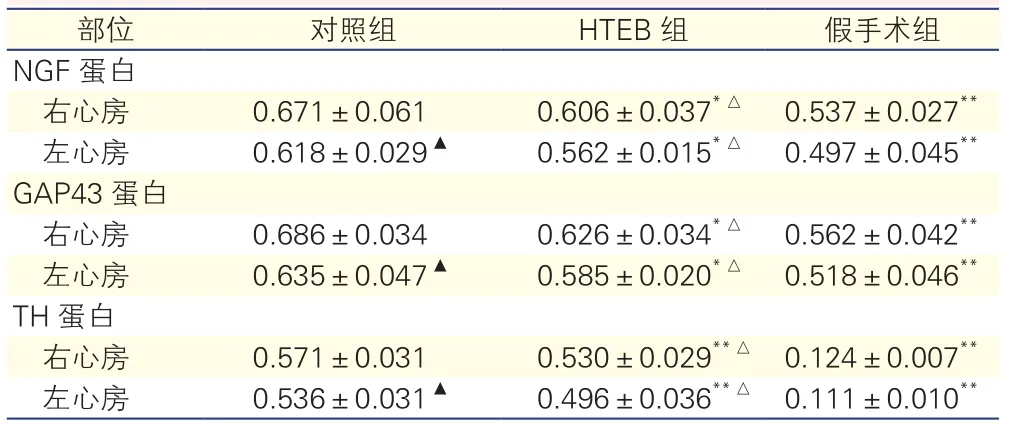
表3 半定量分析各组犬心房肌蛋白含量(NGF/GAPDH光密度比值)(n=6,)
注:GAPDH:甘油醛-3-磷酸脱氢酶;NGF:神经生长因子;GAP43:神经生长相关蛋白43;TH:酪氨酸羟化酶。与对照组比较*P<0.05**P<0.01;与假手术组比较△P<0.05;与同组右心房比较▲P<0.05
部位 对照组 HTEB组 假手术组NGF蛋白右心房 0.671±0.061 0.606±0.037*△ 0.537±0.027**左心房 0.618±0.029▲ 0.562±0.015*△ 0.497±0.045**GAP43蛋白右心房 0.686±0.034 0.626±0.034*△ 0.562±0.042**左心房 0.635±0.047▲ 0.585±0.020*△ 0.518±0.046**TH蛋白右心房 0.571±0.031 0.530±0.029**△ 0.124±0.007**左心房 0.536±0.031▲ 0.496±0.036**△ 0.111±0.010**
3 讨论
本研究发现长期快速右心耳起搏建立的房颤犬模型,其心房肌NGF蛋白表达明显增加,TH及GAP43蛋白表达明显增加;心房肌存在显著神经纤维萌出,右心房神经纤维萌出量显著多于左心房,且萌出神经纤维呈高度不均一性分布。HTEB可显著降低房颤犬心房肌NGF蛋白表达上调,抑制TH及GAP43蛋白表达上调;显著抑制心房肌神经萌出及不均一性分布,阻止心房自主神经重构[5,6]。同时,房颤犬心房肌GAP43阳性纤维密度较TH 阳性纤维密度高[6],而TH阳性纤维密度未有显著差别,提示房颤犬心房肌萌出神经并非都是交感神经,可能也存在迷走神经萌出。
房颤时心房肌自主神经萌出与NGF、TH、GAP43蛋白表达相关。研究发现,NGF在心室神经重构过程中发挥重要作用,能够触发神经纤维再生[7,8]。NGF通过高亲和力酪氨酸激酶受体(TrKs,主要为TrKA)和低亲和力受体P75NTR对神经元的生长、分化和损伤后修复进行调节。TrKs转导的一般是“正性”信号,如维持神经元的存活、生长;而P75NTR多表现抑制神经生长作用。在衰竭心肌中存在去交感神经支配,这与心室肌神经细胞中TrKA表达的减少密切相关[9]。另外,Zhou等[7]研究发现心肌梗死犬左侧星状神经节NGF蛋白表达明显增加,因此局部梗死的心室肌诱导NGF表达增加,通过轴浆运输被逆转运至左侧星状神经节,触发心脏神经萌出。GAP43作用于神经元触发神经末梢萌发[10]。在转基因小鼠中GAP43过度表达将导致新的突触形成及神经萌处[11,12]。因此,可通过检测心房肌NGF、TH、GAP43蛋白表达评估神经纤维萌出情况。
房颤时心房发生电、结构、功能重构导致局部神经损伤。Gould等[12]的研究表明,慢性持续房颤患者心房肌交感神经存在不均一性增加。然而,Gould等[12]研究并未发现NGF mRNA水平增加,可能是mRNA水平并不能代表蛋白表达情况。此外,本研究发现房颤心房肌GAP43及TH蛋白表达明显增加,且右心房蛋白表达较左心房高。GAP43蛋白表达同NGF蛋白表达存在高度相关性,NGF在GAP43表达减少时不能诱发神经萌出[13]。因此我们推测NGF可能通过上调GAP43表达来诱发心脏神经萌出。然而,房颤心房肌神经萌出的作用机制仍不清楚,需进一步研究来证实。
HTEB可改善房颤时心房肌自主神经重构。HTEB通过将麻醉平面控制在胸1-5脊髓阶段,抑制心脏交感神经节前纤维,致心交感张力减弱,副交感张力相对增强,减少心脏节律障碍发生[14]。因此,HTEB能减少肾上腺素诱发心律失常的发生,这与HTEB能够延长心肌细胞动作电位时程(APD)、延长有效不应期(AERP)密切相关[15]。研究发现,局部血管紧张素II含量增加可促进组织NGF表达,促进神经萌出。HTEA可抑制机体肾素-血管紧张素系统的激活[16],间接抑制NGF表达上调。本研究证实,HTEB组TH 、GAP43免疫组化染色阳性纤维密度较对照组明显减少,但仍较假手术组增加,提示HTEB可显著抑制房颤心房肌神经萌出。同时,HTEB组NGF蛋白表达较对照组明显减少,但仍较假手术组增加;HTEB组GAP43及TH蛋白表达较对照组明显减少,但仍较假手术组增加。我们认为可能通过抑制房颤心肌NGF表达上调,抑制心脏神经萌出及不均一分布。HTEB防治房颤发生的具体机制至今仍未明确,仍有待进一步研究[17]。
本研究局限性:本研究只探讨了房颤犬心房肌自主神经重构中交感神经重构的情况及其机制,未对房颤时心房肌迷走神经重构情况作研究分析。此外,心力衰竭可导致心房、心室自主神经功能失调和自主神经重构[18],因此,研究中需注意排除合并心力衰竭的动物模型,减少心力衰竭对自主神经重构的干扰。
[1] 易茜, 马瑞彦. 心房结构重构在心房颤动的发生及维护中的作用.中国循环杂志, 2015, 30: 813-816.
[2] Jakobsen CJ. High thoracic epidural in cardiac anesthesia: a review. Semin Cardiothorac Vasc Anesth, 2015, 19: 38-48.
[3] Goldberg A, Kusunose K, Qamruddin S, et al. Left atrial size and function in a canine model of chronic atrial fibrillation and heart failure. PLoS One, 2016, 11: e0147015.
[4] Chang CM, Wu TJ, Zhou S, et al. Nerve sprouting and sympathetic hyperinnervation in a canine model of atrial fibrillation produced by prolonged right atrial pacing. Circulation, 2001, 103: 22-25.
[5] Jayachandran JV, Sih HJ, Winkle W, et al. Atrial fibrillation produced by prolonged rapid atrial pacing is associated with heterogeneous changes in atrial sympathetic innervation. Circulation, 2000, 101:1185-1191.
[6] Hamabe A, Chang CM, Zhou S, et al. Induction of atrial fibrillation and nerve sprouting by prolonged left atrial pacing in dogs. Pacing Clin Electrophysiol, 2003, 26: 2247-2252.
[7] Zhou S, Chen LS, Miyauchi Y, et al. Mechanisms of cardiac nerve sprouting after myocardial infarction in dogs. Circ Res, 2004, 95: 76-83.
[8] 辛林伟, 王梨明, 唐际存, 等. 外源性神经生长因子对雪旺细胞中NF- κ B mRNA表达的影响. 山东医药, 2014, 54: 24- 26.
[9] Kreusser MM, Buss SJ, Krebs J, et al. Differential expression of cardiac neurotrophic factors and sympathetic nerve ending abnormalities within the failing heart. J Mol Cell Cardiol, 2008, 44: 380-387.
[10] Chen MM, Yin ZQ, Zhang LY, et al. Quercetin promotes neurite growth through enhancing intracellular cAMP level and GAP-43 expression . Chin J Nat Med, 2015, 13: 667-672.
[11] Ceber M, Sener U, Mihmanli A, et al. The relationship between changes in the expression of growth associated protein-43 and functional recovery of the injured inferior alveolar nerve following transection without repair in adult rats. J Craniomaxillofac Surg, 2015, 43: 1906-1913.
[12] Gould PA, Yii M, McLean C, et al. Evidence for increased atrial sympathetic innervation in persistent human atrial fibrillation. Pacing Clin Electrophysiol, 2006, 29: 821-829.
[13] Huang R, Zhao J, Ju L, et al. The influence of GAP-43 on orientation of cell division through G proteins. Int J Dev Neurosci, 2015, 47: 333-339.
[14] Pedroviejo Sáez V. Nonanalgesic effects of thoracic epidural anesthesia. Rev Esp Anestesiol Reanim, 2011, 58: 499-507.
[15] Meissner A, Eckardt L, Kirchhof P, et al. Effects of thoracic epidural anesthesia with and without autonomic nervous system blockade on cardiac monophasic action potentials and effective refractoriness in awake dogs. Anesthesiology, 2001, 95: 132-138.
[16] Nader A, Kendall MC, Chrisman H, et al. Greater cephalad extent of thoracic epidural sensory anesthesia after lidocaine and epinephrine test dose correlates with analgesic consumption and pain burden after uterine fibroid artery embolization. Reg Anesth Pain Med, 2016, 41:56-64.
[17] 黄欣淼, 曲秀芬. 心房颤动与自主神经的相关性研究进展. 中国循环杂志, 2015, 30: 1027-1029.
[18] Sun J, Lu Y, Huang Y, el al. Vnilateral vagus nerve stimulation improves ventricular autonomic nerve distribution and functional imbalance in a canine heart failure model. Int J Clin Exp Med, 2015, 8:9334-9340.
Impact of High Thoracic Epidural Blockade on Autonomic Nerve Remodeling in Experimental Dogs With Atrial Fibrillation
CAO Yong**, TIAN Xiao-yan, ZHANG Ran, DAI Yu-chuan, ZHAO Jia-qi, AN Yi.
Qingdao University Medical College, Qingdao (266000), Shandong, China Corresponding Author: AN Yi, Email: anyiqingdao@126.com
Objective: To observe the impact of high thoracic epidural blockade (HTEB) on atrial autonomic nerve remodeling in dogs with atrial fbrillation (AF) induced by long-term rapid right atrial appendage pacing and to explore the efect of nerve growth factor (NGF) on atrial autonomic nerve remodeling.
2016-03-08)
(编辑:汪碧蓉)
266000 山东省青岛市,青岛大学医学院 心内科 (曹勇,安毅);济宁医学院附属医院 健康管理与社区服务中心(田晓燕),心内科(张苒、代玉川、赵家琦)
曹勇 主治医师 博士 主要从事心房颤动等心血管相关疾病诊治*现在山东省济宁市,济宁医学院附属医院 心内科工作**Now Working in Department of Cardiology, Affiliated Hospital of Jining Medical College, Email:caoyong0419@163.com 通讯作者:安毅 Email:anyiqingdao@126.com
R541
A
1000-3614(2016)12-1219-05
10.3969/j.issn.1000-3614.2016.12.016
方法:18只犬随机分为假手术组、对照组和HTEB组。对照组和HTEB组犬给予持续快速心房起搏建立房颤模型,HTEB组给予硬膜外腔注射0.5%利多卡因行高位胸段硬膜外阻滞。通过Masson染色检测犬心房肌胶原容积分数(CVF)改变,免疫组化法测定犬心房肌神经生长相关蛋白43(GAP43)及酪氨酸羟化酶(TH)表达,蛋白免疫印迹法检测犬心房肌NGF、GAP43及TH蛋白表达情况。
结果:与对照组相比,右心耳快速起搏6周后,HTEB组犬心房肌CVF值显著降低; GAP43及TH神经萌出量显著减少(P<0.05); NGF、GAP43及TH蛋白表达量显著减少(P<0.05~0.01)。与假手术组比较,HTEB组犬心房肌CVF值显著增加;GAP43及TH神经萌出量显著增加(P<0.05~0.01); NGF、GAP43及TH蛋白表达量显著增加(P<0.05)。
结论:长期右心耳快速起搏诱发犬房颤致心房肌神经不均一萌出,诱发自主神经重构,而NGF在其中发挥重要作用。HTEB可有效阻止房颤犬心房肌NGF表达上调,减轻自主神经重构。

