苯肾上腺素对大鼠心肌纤维化的调节及其与转化生长因子-β1、果蝇母性DPP同源蛋白3及结缔组织生长因子信号通路的关系
曹慧,庞晓,王硕,唐燕
基础与实验研究
苯肾上腺素对大鼠心肌纤维化的调节及其与转化生长因子-β1、果蝇母性DPP同源蛋白3及结缔组织生长因子信号通路的关系
曹慧,庞晓,王硕,唐燕
目的:观察苯肾上腺素对压力超负荷介导的大鼠心肌纤维化(MF)的调节及其与转化生长因子-β1(TGF-β1)、果蝇母性DPP同源蛋白3(Smad3)及结缔组织生长因子(CTGF)信号通路的关系。
苯肾上腺素;心肌纤维化;转化生长因子-β1
(Chinese Circulation Journal, 2016,31:1205.)
心肌纤维化(MF)是指在正常的心肌组织结构中胶原纤维过量积聚、胶原浓度显著升高或胶原成分发生改变。这种病理变化存在于多种心血管疾病,与心律失常、心功能障碍甚至心原性猝死密切相关,而交感神经系统(SNS)的活性变化在MF的发生发展中有着重要作用[1-3],但大多数研究都聚焦在β-肾上腺素能受体(β-AR),有关α1-肾上腺素能受体(α1-AR)的报道较少。近年来已有基础实验发现,α1-AR可激活心脏适应性肥厚、抑制心肌细胞凋亡、增强心肌收缩力而产生心脏保护功能[4-6],但具体机制尚不十分清楚,对MF是否有调节作用亦少见报道。
1 材料与方法
1.1动物与主要试剂
雄性健康SD大鼠28只,5~7周龄,体重220~260 g,由新疆医科大学第一附属医院实验动物中心提供[动物合格证号:SCXK(新)2011-0003] 。苯肾上腺素(07140501,上海禾丰),哌唑嗪(56140401,上海信宜),水合氯醛(XK13-011-00017,天津巴斯夫);二喹啉甲酸(BCA)蛋白定量分析试剂盒(赛默飞世尔科技);α-平滑肌肌动蛋白(α-SMA),兔抗鼠多克隆抗体(bs-0189R,北京博奥森),转化生长因子-β1(TGF-β1)兔抗鼠多克隆抗体(bs-0086R,北京博奥森),果蝇母性DPP同源蛋白3(Smad3)兔抗鼠单克隆抗体(BA4559,武汉博士德),结缔组织生长因子(CTGF)兔抗鼠多克隆抗体(bs-0743R,北京博奥森),甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体(TA-08,北京中杉)。
1.2动物模型的建立与分组
SD大鼠28只随机分为4组,对照组、腹主动脉缩窄(AAC)组、AAC+苯肾上腺素组和AAC+哌唑嗪组,每组7只。AAC组大鼠10%水合氯醛溶液3 ml/kg腹腔注射麻醉后,在左肾动脉分支上方分离大鼠腹主动脉,用7号注射针头紧贴腹主动脉结扎,抽出注射器针头,逐层缝合手术切口。对照组仅分离腹主动脉而不结扎。术后8周,AAC+苯肾上腺素组给予苯肾上腺素 0.65 mg/(kg·d) 腹腔注射,AAC+哌唑嗪组给予哌唑嗪 5 mg/(kg·d)灌胃,AAC组和对照组给予等量生理盐水灌胃持续4周。
1.3心肌胶原形态学观察及定量分析
处死大鼠取心脏,剪取部分左心室游离壁心肌组织,固定于4%多聚甲醛液中,石蜡包埋心肌组织,4 μm厚切片,用苦味酸酸性复红法胶原纤维染色法(VG染色),光镜下可见:心肌细胞呈黄色,胶原呈红色。然后用Image-Pro5.1图像分析软件行图像处理,测量左心室心肌的胶原容积分数(CVF),CVF =左心室胶原面积/所测视野面积。随机取6个视野,以均值作为该心脏的CVF。剩余心肌组织部分冻存于液氮中,待用。
1.4免疫组化法检测α-SMA、TGF-β1、Smad3和CTGF表达
石蜡切片,常规脱蜡,3 ml/L过氧化氢灭活过氧化物酶,热修复抗原后,滴加α-SMA、TGF-β1、Smad3、CTGF一抗,4℃过夜;滴加生物素标记的二抗,37℃孵育30 min;滴加辣根酶标记的链霉卵白素工作液;双花扁豆凝集素(DBA)显色,封片。应用Image-Pro5.1图像分析软件对α-SMA、TGF-β1、Smad3、CTGF表达进行图像分析(细胞之中棕褐色颗粒为阳性),每张切片取5个连续阳性表达视野,测定积分光密度(IOD),IOD值越高,则蛋白表达量越多,进行半定量分析。
1.5蛋白免疫印迹(Western blot) 法检测α-SMA表达
提取心肌组织蛋白,二喹啉甲酸试剂盒检测蛋白浓度[7,8],聚丙烯酰胺凝胶电泳凝胶电泳后转聚偏二氟乙烯膜,脱脂牛奶室温封膜,加入α-SMA抗体,4℃过夜。0.5% TBST洗膜,加入二抗孵育1 h,洗膜后化学发光法按时曝光拍照,用Image J图像分析软件对结果进项定量分析,目的蛋白表达量以其与内参照条带的灰度比值表示。
1.6统计学方法
采用SPSS17.0统计软件进行数据分析,资料数据用均数±标准差表示,组间比较在方差齐时用单因素方差分析,组间两两比较应用LSD。P<0.05为差异有统计学意义。
2 结果
2.1心肌胶原形态学观察及定量分析结果(图1)
光学显微镜下发现对照组心肌仅有血管周围存在少量胶原纤维,胶原纤维呈红色,心肌组织被染成黄色,分布均匀,排列呈条索状。与对照组比较,AAC组、AAC+苯肾上腺素组及AAC+哌唑嗪组心肌组织中均有胶原沉积,分布不规则,心肌细胞排列紊乱,其CVF均明显升高[P<0.01,CVF对照组(3.38±0.33)%,AAC组(12.81±0.37)%,AAC+苯肾上腺素组(7.86±0.19)%,AAC+哌唑嗪组(12.31±0.60)%]。与AAC组比,AAC+苯肾上腺素组CVF显著降低(P<0.01),AAC+哌唑嗪组CVF差异无统计学意义(P>0.05)。
2.2免疫组化法检测α-SMA、TGF-β1、Smad3和CTGF表达结果(表1,图2)
与对照组比,AAC组心肌组织中可见α-SMA、TGF-β1、Smad3及CTGF表达均明显增加,着色深,其IOD值均显著升高(P<0.01)。与AAC组比,AAC+苯肾上腺素组可见α-SMA、TGF-β1、Smad3及 CTGF表达均明显减少,着色变浅,其IOD值均显著降低(P均<0.01)。AAC+哌唑嗪组与AAC组比,α-SMA、TGF-β1、Smad3及CTGF表达差异均无统计学意义(P均>0.05)。
2.3Western blot法检测α-SMA表达结果
与对照组(0.88±0.06)比,AAC组(2.21±0.24)、AAC+苯肾上腺素组(1.22±0.15)和AAC+哌唑嗪组(1.94±0.09)的α-SMA表达均上调(P均<0.05);与AAC组比,AAC+苯肾上腺素组的α-SMA表达降低(P<0.01);而AAC+哌唑嗪组与AAC组比,α-SMA的表达差异无统计学意义(P>0.05)。
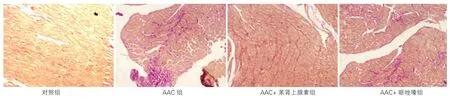
图1 各组大鼠苦味酸酸性复红法胶原纤维染色胶原形态学观察(×100,n=7)
表1 各组大鼠心肌α-SMA、TGF-β1、Smad3及CTGF的积分光密度值比较(n=7,
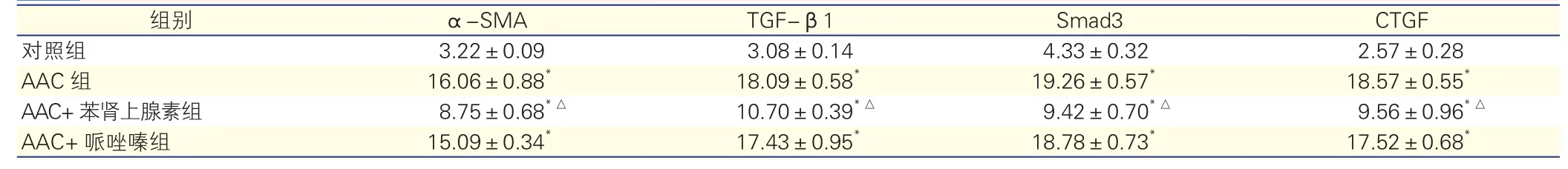
表1 各组大鼠心肌α-SMA、TGF-β1、Smad3及CTGF的积分光密度值比较(n=7,
注:α-SMA:平滑肌肌动蛋白;TGF-β1:转化生长因子-β1;Smad3:果蝇母性DPP同源蛋白3;CTGF:结缔组织生长因子;AAC:腹主动脉缩窄。与对照组比*P<0.01;与AAC组比△P<0.01
组别 α-SMA TGF-β1 Smad3 CTGF对照组 3.22±0.09 3.08±0.14 4.33±0.32 2.57±0.28 AAC组 16.06±0.88* 18.09±0.58* 19.26±0.57* 18.57±0.55*AAC+苯肾上腺素组 8.75±0.68*△ 10.70±0.39*△ 9.42±0.70*△ 9.56±0.96*△AAC+哌唑嗪组 15.09±0.34* 17.43±0.95* 18.78±0.73* 17.52±0.68*
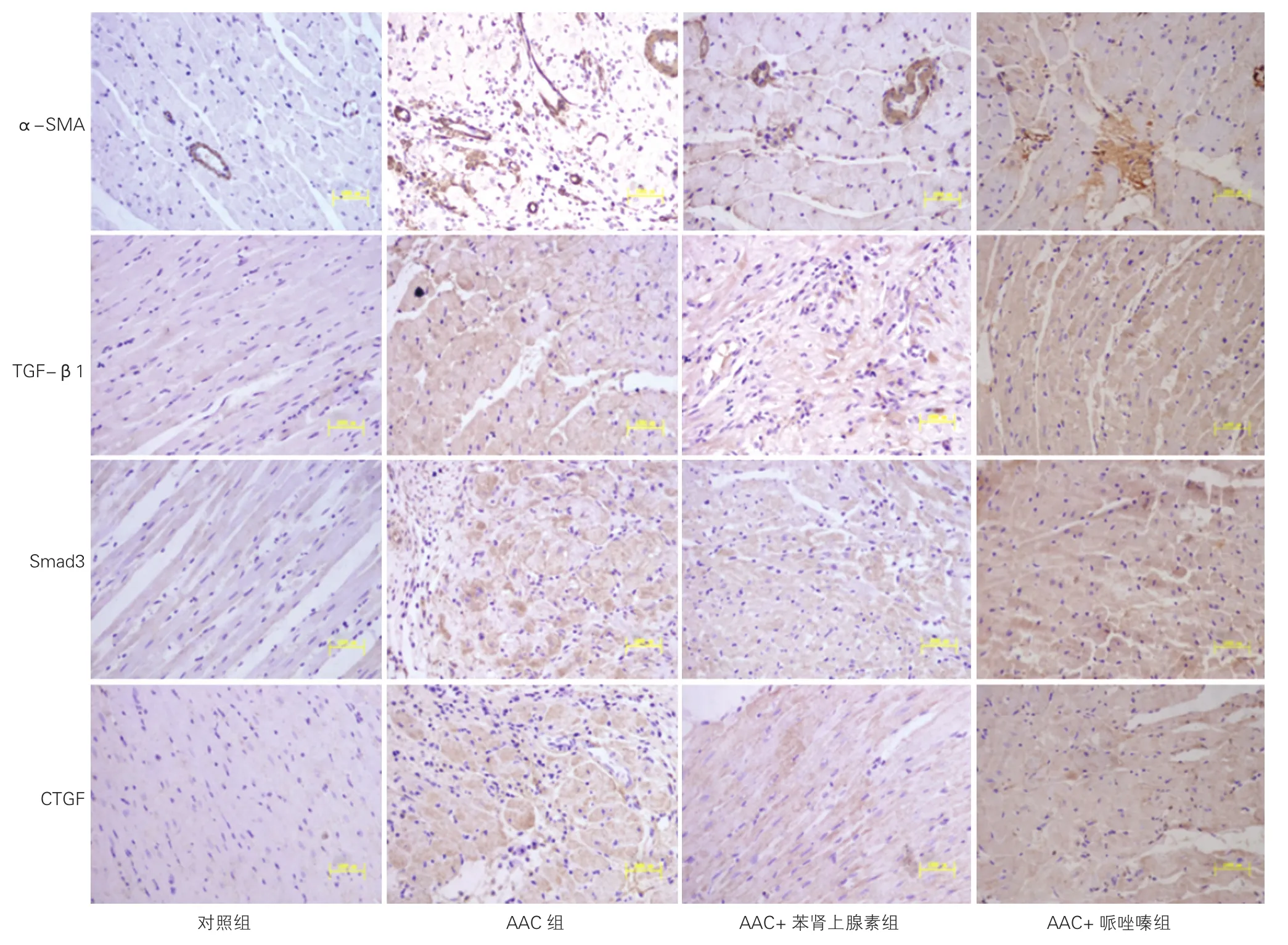
图2 免疫组化分析各组大鼠心肌α-SMA、TGF-β1、Smad3及CTGF表达(×200,n=7)
3 讨论
α1-AR是一种Gq蛋白耦连受体,约占心脏总AR的10%。既往观点认为交感神经系统激活释放的儿茶酚胺通过经典的“Gαq/PLCβ1-IP3/PKC”信号转导模式调节心脏病理性重构和纤维化[2],但近年研究发现α1-AR尤其是α1A亚型能够以核受体模式激活生存信号,刺激心肌细胞适应性肥大,抑制心肌细胞凋亡,具有防止病理性重塑的心脏保护作用[9]。MF作为心脏病理性重构的重要特征之一,其发生发展能否被α1-AR所调节尚不清楚。
本研究在腹主动脉缩窄诱导SD大鼠广泛MF的动物模型上观察到,AAC术后12周心肌组织发生纤维化,心肌总胶原增多(VG染色),α-SMA表达增强,这与咸瑛琳等[10]研究结果一致。有学者报道[4,11]主动脉缩窄术后,α1ABKO小鼠模型较野生型小鼠心肌细胞凋亡及纤维化增加,从而导致心脏衰竭,最终50%死亡。心肌梗死的大鼠模型在给予苯肾上腺素后,非梗死区心肌I、III型CVF降低[12]。Dash等[13]发现低于升压剂量的α1-AR特异性兴奋剂,可以逆转阿霉素诱导的心脏细胞凋亡和病理性重构。本研究显示,用α1-AR兴奋剂苯肾上腺素干预模型大鼠4周后,心肌组织α-SMA表达明显减少,MF程度改善,而AAC+哌唑嗪组未观察到上述反应提示α1-AR兴奋剂苯肾上腺素可改善压力超负荷导致的心脏重构和纤维化。
MF的发生与发展与多种生长因子和细胞因子有关,其中TGF-β1被认为是诱导MF的关键因子[14],它主要通过TGF-β/Smads信号来发挥生物学作用,如调节心肌成纤维细胞增殖分化、胶原蛋白和纤维连接蛋白的生成与降解以及诱导细胞外基质过度积聚等[15]。有研究表明,大鼠压力超负荷模型中,TGF-β均明显上调,并观察到胶原蛋白的持续表达[16]。本研究结果显示AAC组心肌组织TGF-β1、Smad3蛋白的表达明显高于对照组,这与多数研究中在心脏等器官组织纤维化过程中,TGF-β1表达增多且促进下游Smad2、Smad3信号的结论一致[17]。Delella等[18]研究发现成年大鼠给予α1-AR抑制剂多沙唑嗪后,前列腺组织中TGF-βmRNA表达水平持续升高。在H9C2心肌母细胞中,TGF-β1持续能够促进多沙唑嗪诱导的p38促分裂素原活化蛋白激酶的磷酸化,提示TGF-β相关信号通路参与了多沙唑嗪诱导的细胞凋亡[19]。本研究显示,给予α1-AR抑制剂哌唑嗪处理4周后,心肌组织的TGF-β1、Smad3蛋白的表达较AAC组比无明显变化,而α1-AR兴奋剂苯肾上腺素干预后,大鼠心肌组织中TGF-β1、 Smad3蛋白的表达明显减少,提示在心肌组织中抑制α1-AR不能改善纤维化。
CTGF是一种促成纤维细胞分裂、增生和表型转化,增加胶原沉积的细胞因子是MF的生物标记物之一[20],其表达主要受TGF-β/Smad信号通路调控[21]。本研究中AAC组心肌组织CTGF蛋白的表达明显高于对照组,与蒋洪强等[22]报道相似,给予苯肾上腺素干预后CTGF表达明显减少,而AAC+哌唑嗪组无明显变化,与心肌组织TGF-β1/Smad3变化趋势相同,这可能与CTGF启动子上存在功能性的TGF-β反应原件和Smad结合原件,CTGF受到Smad3的直接调控有关[21,23],由此推测苯肾上腺素改善MF的作用机制之一可能与抑制TGF-β1/ Smads 信号通路并调节其下游CTGF表达相关。MF的发生机制复杂,其中心肌成纤维细胞活化是驱动纤维化应答的重要细胞活动,苯肾上腺素对心肌成纤维细胞活化是否也具有调节作用以及调节机制如何尚不清楚,有待进一步研究。
综上所述,在压力超负荷诱导的MF大鼠模型中,抑制α1-AR不能逆转MF的发生发展,而α1-AR兴奋剂苯肾上腺素可部分抑制促纤维化TGF-β1/Smads信号通路并下调CTGF从而改善MF,进一步深入研究可为逆转MF,延缓心力衰竭发展进程提供新思路。
[1] Puhl SL, Kazakov A, Müller A, et al. A1 receptor activation attenuates cardiac hypertrophy and fibrosis in response to α1-adrenergic stimulation in vivo. Br J Pharmacol, 2016, 173: 88-102.
[2] Yin YG, Wang RZ, Ruan ZB, et al. Effect of phentolamine on myocardial extracellular matrix of cardiac remodeling in rats. Asian Pac J Trop Med, 2014, 7: 645-649.
[3] Lu H, Tian A, Wu J, et al. Danshensu inhibits β-adrenergic receptors-mediated cardiac fibrosis by ROS/p38 MAPK axis. Biol Pharm Bull, 2014, 37: 961-967.
[4] O'Connell TD, Swigart PM, Rodrigo MC, et al. Alpha1-adrenergic receptors prevent a maladaptive cardiac response to pressure overload. J Clin Invest, 2006, 116: 1005-1015.
[5] Huang Y, Wright CD, Kobayashi S, et al. GATA4 is a survival factor in adult cardiac myocytes but is not required for {alpha}1A-adrenergic receptor survival signaling. Am J Physiol, 2008, 295: H699-H707.
[6] Cowley PM, Wang G, Chang AN, et al. The α1A-adrenergic receptor subtype mediates increased contraction of failing right ventricular myocardium. Am J Physiol Heart Circ Physiol, 2015, 309: H888-896.
[7] Wiechelman KJ, Braun RD, Fitzpatrick JD. Investigation of the bicinchoninic acid protein assay: identification of the groups responsible for color formation. Anal Biochem, 1988, 175: 231-237.
[8] Adilakshmi T, Laine RO. Ribosomal protein S25 mRNA partners with MTF-1 and La to provide a p53-mediated mechanism for survival or death. J Biol Chem, 2002, 277: 4147-4151.
[9] O'Connell TD, Jensen BC, Baker AJ, et al. Cardiac alpha1-adrenergic receptors: novel aspects of expression, signaling mechanisms, physiologic function, and clinical importance. Pharmacol Rev, 2014, 66: 308-333.
[10] 咸瑛琳, 张晶, 王绿娅, 等. 补体5a受体在阿霉素致急性心力衰竭心肌损伤的早期研究. 心肺血管病杂志, 2012, 31: 209-213.
[11] O’Connell TD, Ishizaka S, Nakamura A, et al. The alpha(1A/C)-and alpha(1B)-adrenergic receptors are required for physiological cardiac hypertrophy in the double-knockout mouse. J Clin Invest, 2003, 111: 1783-1791.
[12] 牟杨, 李刚, 张灿晶, 等. 大鼠非梗死区心肌C3G蛋白的表达及苯肾上腺素对其的干预. 基础与实验, 2010, 25: 391-394.
[13] Dash R, Chung J, Chan T, et al. A molecular MRI probe to detect treatment of cardiac apoptosis in vivo. Magn Reson Med, 2011, 66:1152-1162.
[14] Kamato D, Burch ML, Piva TJ, et al. Transforming growth factor-β signaling: Role and consequences of Smad linker region phosphorylation. Cell Signal, 2013, 25: 2017-2024.
[15] 程显禄, 黄琦磊, 张建成. 转化生长因子-β1和阿托伐他汀对人心房成纤维细胞Ⅰ型胶原和Smads蛋白表达的影响. 中国循环杂志, 2015, 30: 562-566.
[16] Kuwahara F, Kai H, Tokuda K, et al. Transforming growth factor-beta function blocking prevents myocardial fibrosis and diastolic dysfunction in pressure-overloaded rats. Circulation, 2002, 106: 130-135.
[17] Tran CM, Markova D, Smith HE, et al. Regulation of ccn2/ctgf expression in the nucleus pulosus of the intervertebral disc: role of smad and aplsignaling. Arthritis Rheum, 2010, 62: 1983-1992.
[18] Delella FK, Lacorte LM, Almeida FL, et al. Fibrosis-related gene expression in the prostate is modulated by doxazosin treatment. Life Sci, 2012, 91: 1281-1287.
[19] Yang YF, Wu CC, Chen WP, et al. Transforming growth factor-beta type I receptor/ALK5 contributes to doxazosin-induced apoptosis in H9C2 cells. Naunyn Schmiedebergs Arch Pharmacol, 2009, 380: 561-567.
[20] Koshman YE, Patel N, Chu M, et al. Regulation of connective tissue growth factor gene expression and fibrosis in human heart failure. J Card Fail, 2013, 19: 283-294.
[21] Phanish MK, Wahab NA, Colville-Nash P, et al. The differential role of Smad2 and Smad3 in the regulation of pro-fibrotic TGFbetal responses in human proximal-tubule epithelial cells. Biochem J, 2006, 393: 601-607.
[22] 蒋洪强, 张金国, 谭洪勇, 等. 黄芪甲苷对慢性心力衰竭大鼠MF和结缔组织生长因子表达的影响. 中国循环杂志, 2016, 31: 165-169.
[23] Chung AC, Zhang H, Kong YZ, et al. Advanced glycation end-products induce tubular CTGF via TGF-beta-independent Smad3 signaling. J Am Soc Nephrol, 2010, 21: 249-260.
Effect of Phenylephrine on Myocardial Fibrosis Regulation With its Relevance to TGF-β/smads/CTGF Signal Pathway in Experimental Rats
CAO Hui, PANG Xiao, WANG Shuo, TANG Yan.
Department of Cardiology, First Afliated Hospital of Shihezi University Medical College, Shihezi (832002), Xinjiang, China Corresponding Author: PANG Xiao, Email: px0993@163.com
Objective: To observe the efect of phenylephrine (PE) on pressure overload induced myocardial fbrosis (MF) with its relevance to transforming growth factor-β1 (TGF-β1), drosophila mothers against decapentaplegic protein 3 (smad3) and connective tissue growth factor (CTGF) signal pathway in experimental rats.Methods: A total of 28 male SD rats were randomly divided into 4 groups: Control group, AAC (abdominal aorta coarctation) group, AAC+PE group and AAC+prazosin group. n=7 in each group. Collagen volume fraction (CVF) of left ventricle was observed by myocardial collagen morphology, left ventricular myocardial tissue protein expressions of α-smooth muscle actin (α-SMA), TGF-β1, smad3 and CTGF were measured by immunohistochemistry, protein expression of α-SMA was also examined by Western blot analysis.Results:① Myocardial collagen morphology presented that compared with Control group, AAC, AAC+PE and AAC+prazosin groups had increased CVF, all P<0.01; compared with AAC group, AAC+PE group had decreased CVF, P<0.01.②Immunohistochemistry demonstrated that compared with Control group, AAC, AAC+PE and AAC+prazosin groups had up-regulated protein expressions of α-SMA, TGF-β1, smad3 and CTGF, all P<0.01; compared with AAC group, AAC+PE group had down-regulated protein expressions of α-SMA, TGF-β1, smad3 and CTGF, all P<0.01.③ Western blot analysis indicated that compared with Control group, AAC, AAC+PE and AAC+prazosin groups had the higher α-SMA expression, all P<0.05; compared with AAC group, AAC+PE group had the lower α-SMA expression, P<0.01.Conclusion: Phenylephrine could improve pressure overload induced MF in experimental rats which might be related to TGF-β1/smads signal pathway inhibition and CTGF down-regulation.
Phenylephrine; Myocardial fbrosis; Transforming growth factor-β1
2016-03-18)
(编辑:王宝茹)
国家重点专科资助
832002 新疆维吾尔自治区石河子市,石河子大学医学院第一附属医院 心内科
曹慧 硕士研究生 主要从事心血管病的基础与临床研究 Email:Tuffycaohui@163.com 通迅作者:庞晓 Email:px0993@163.com
R54
A
1000-3614(2016)12-1205-05
10.3969/j.issn.1000-3614.2016.12.013
方法:将雄性SD大鼠28只随机分为对照组、腹主动脉缩窄(AAC)组、AAC+苯肾上腺素组和AAC+哌唑嗪组,每组7只。通过心肌胶原形态学测定左心室组织胶原容积分数(CVF)观察大鼠MF的变化,应用免疫组化法检测各组大鼠左心室组织α-平滑肌肌动蛋白(α-SMA)、TGF-β1、Smad3及CTGF表达,用蛋白免疫印迹(Western blot)法测定左心室组织α-SMA表达。
结果:(1)心肌胶原形态学显示:与对照组比,AAC组、AAC+苯肾上腺素组和AAC+哌唑嗪组的CVF均明显升高(P均<0.01);与AAC组比,AAC+苯肾上腺素组的CVF显著减少(P<0.01)。(2)免疫组化法显示:与对照组比,AAC组、AAC+苯肾上腺素组和AAC+哌唑嗪组的α-SMA、TGF-β1、Smad3及CTGF表达均上调(P均<0.01);与AAC组比,AAC+苯肾上腺素组的α-SMA、TGF-β1、Smad3及CTGF表达均降低(P均<0.01)。(3)Western blot法显示:与对照组比,AAC组、AAC+苯肾上腺素组和AAC+哌唑嗪组的α-SMA表达均上调(P均<0.05);与AAC组比,AAC+苯肾上腺素组的α-SMA表达降低(P<0.01)。
结论:苯肾上腺素可以改善压力超负荷诱导的大鼠MF,该作用可能与抑制TGF-β1/Smads信号通路及下调CTGF有关。

