血管损伤对新生内膜增生的影响
袁吉祥,张亮,魏述军
血管损伤对新生内膜增生的影响
袁吉祥,张亮,魏述军
目的:研究血管损伤对新生内膜增生及核转录因子κb (NF-κb)、组织因子(TF)、内皮素-1(ET-1)、基质金属蛋白酶3(MMP-3)的影响。
血管损伤;新生内膜;增生
(Chinese Circulation Journal, 2016,31:1210.)
尽管药物洗脱支架的出现减少了支架内再狭窄(ISR)的发生,但ISR仍高达10%~15%。ISR是影响冠状动脉介入手术效果的重要因素,极大地限制了经皮冠状动脉介入治疗(PCI)的获益,特别是糖尿病或多支病变的冠心病患者[1]。从病理生理学角度看,ISR是机体对血管损伤的病理性修复反应,介入过程所导致的血管损伤和结构破坏导致新生内膜增生,新生内膜过度增生导致ISR。但是,目前血管损伤导致新生内膜增生的病理生理机制还不明确,内弹力膜在血管损伤中的作用还未揭示。本研究通过球囊扩张并拉伤兔子腹主动脉建立血管损伤模型,分析血管损伤对新生内膜增生及核转录因子κb (NF-κb)、组织因子(TF)、内皮素-1(ET-1)、基质金属蛋白酶3(MMP-3)影响,探讨血管损伤导致新生内膜增生的病理生理机制,为防治ISR提供生物学靶点。
1 材料与方法
实验动物: 4~6个月龄雄性新西兰大耳白兔32只,体重2.0~2.5 kg,由宁夏医科大学实验动物中心提供。
血管损伤模型的建立:分离右侧股动脉,直视下穿刺并置入5F鞘管,经导丝引入后扩张球囊(3.5 mm×15 mm),以12 atm(1 atm=101.325 kPa)的压力扩张并拉伤腹主动脉建立血管损伤模型[2]。
病理学切片的制作:术后28 d用注射空气法处死兔子,开腹暴露腹主动脉,剥离拉伤的血管段,生理盐水冲洗后固定于10%甲醛溶液。24 h后血管段常规石蜡包埋,间隔相同距离于血管段25%、50%、75%分位切片3次(切片厚度4 μm),行苏木素伊红(HE)染色,NF-κb免疫组化染色后光镜下观察。切片经铅、铀染色后透射电镜下观察。使用计算机图像分析软件测量血管标本新生内膜厚度,分析确定血管壁损伤积分。
根据内弹力膜损伤的情况血管壁损伤分级标准如下:1级,内皮损伤,内弹力膜无明显损伤;2级,内弹力膜轻度损伤;3级,内弹力膜明显损伤,未累及中膜;4级,内弹力膜破损,累及中膜;5级,内弹力膜破损,累及中膜、外弹力膜及外膜[3]。
血清检验:损伤术后1 min经股动脉鞘管采血,4周后经心脏采血,存放于-20℃冰箱。用酶联免疫吸附法(ELISA)测定血清TF、ET-1和MMP-3含量。
统计分析:采用SPSS17.0统计软件,正态分布计量资料用描述,相关性分析采用Pearson法,P<0.05为差异有统计学意义。
2 结果
兔腹主动脉损伤情况(图1):术后4周,32只兔中30只顺利完成实验,共获得30条受损血管段及相应切片。受损血管直径为(3.40±0.16)mm,球囊/血管直径比为1.12±0.06。光镜下观察内弹力膜,正常时为一条平缓的波浪线,损伤后表现为锯齿状的曲线,损伤越严重,锯齿越密集且不规则。
透射电镜下观察新生内膜(图2):可见新生内膜显著增厚,损伤的内弹力膜呈现迂曲的波浪状,平滑肌细胞穿过内弹力膜微孔及断裂口向新生内膜迁移,新生内膜增生,线粒体、内质网、高尔基体以及溶酶体等细胞器显著增多。
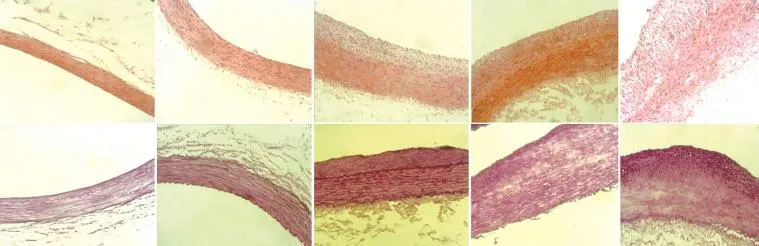
图1 血管壁损伤分级情况(×100)
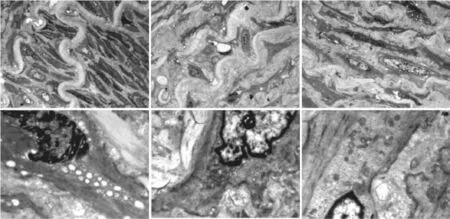
图2 透射电镜下观察新生内膜(上排图×500,下排图×3000)
NF-κb免疫组化显示(图3):NF-κb主要在新生内膜中表达,血管损伤积分与NF-κb阳性细胞百分率呈正相关,Pearson相关系数为0.916(P<0.05)。
血管损伤积分与新生内膜厚度、TF、ET-1及MMP-3的相关性分析(图4): 血管损伤积分与新生内膜厚度之间的最优拟合曲线是“S”形的三次曲线,曲线中间的部分增幅较大,它对应的横坐标是3,也就是内弹力膜明显损伤的部分。相关分析结果显示:血管损伤积分与术后1 min TF,术后1 min和4周 后 的ET-1,术后1 min和4周后的MMP-3均呈正相关,Pearson相关系数分别为0.925、0.957、0.947、0.914和0.940( P均<0.05)。
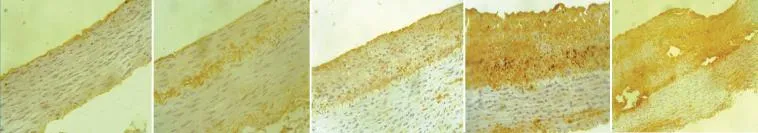
图3 核转录因子-κb 免疫组化二甲基联苯胺染色(DAB染色,×200)
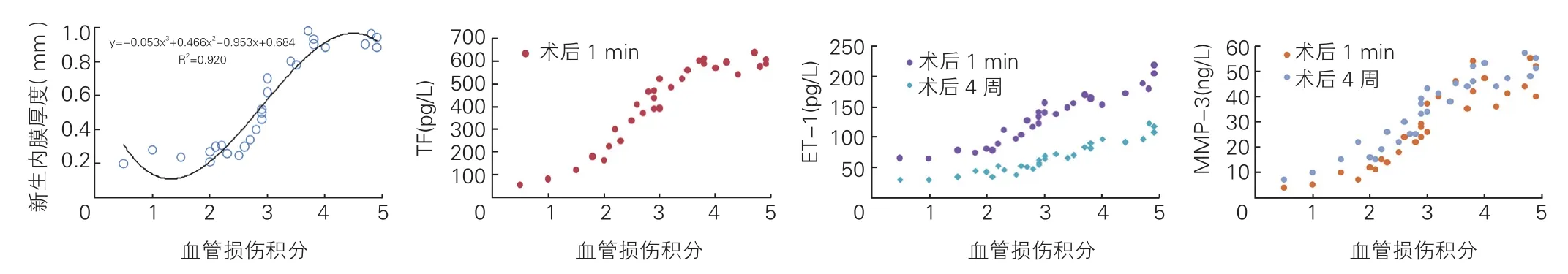
图4 血管损伤积分与新生内膜厚度、TF、ET-1、MMP-3的相关性分析
3 讨论
新生内膜形成和增生导致ISR是冠状动脉支架置入后一个重要的病理生理事件,血管损伤或者结构破坏是导致新生内膜增生的重要原因[3]。但是PCI术中血管损伤是不可避免的,因为随着膨胀的球囊或者支架把动脉粥样硬化斑块向外挤压,内膜可能会撕裂,内弹力膜张力会不断增大,当张力超过其代偿范围时内弹力膜就会损伤甚至断裂,从而导致血管弹性降低。内弹力膜是由交叉排列的、密集的弹力纤维组成的,损伤或者断裂后无法修复。为了维持正常的血管张力,机体会通过新生内膜增生来代偿。在血管伴有钙化、支架口径偏大、扩张压力过大等情况下,更容易出现内弹力膜的损伤。本实验采用了曲线拟合的方法来体现血管损伤与新生内膜厚度之间的关系,最优拟合曲线是“S”形的三次曲线,表明血管壁各结构中内弹力膜是反映血管损伤的关键结构。
目前认为,血管损伤后新生内膜增生的机制主要是:内皮下组织暴露于血液后导致血小板在损伤局部的黏附、聚积,炎性细胞浸润并释放趋化、黏附、生长因子,刺激血管平滑肌细胞(VSMCs)通过内弹力膜迁移至内皮下,转型为新生内膜并不断增生,导致血管负性重构[4]。内弹力膜是阻碍上述过程发生的唯一屏障。内弹力膜损伤后,变形扩大的内弹力膜微孔或者断裂的内弹力膜使VSMCs移行相对容易,因而加速了新生内膜的增厚。
TF是一种脂蛋白复合物,含有大量磷脂,是导致凝血系统激活的重要因素。在正常情况下TF不存在于循环中或不与循环血液接触,只有当血管壁的完整性遭到破坏时,中膜胶原纤维暴露于血液,TF才会被组织细胞释放于循环血液,通过外源性凝血途径启动凝血反应[5]。凝血反应导致血小板聚集和炎症细胞浸润并释放趋化、黏附、生长因子,刺激中膜血管平滑肌细胞迁移至内皮下转型为新生内膜。可见TF是血管损伤后导致新生内膜增生的始动因子。本实验4周后血清TF未能检测到,提示暴露的中膜胶原纤维已经被新生内膜所封闭。经皮冠状动脉介入治疗时球囊或支架扩张挤压可引起内膜损伤或者撕裂,内皮下组织暴露,血管及血液细胞立即释放TF,引起局部急性血栓形成,血栓可能被纤溶酶溶解或者逐渐被新生内膜机化。支架贴壁不良也容易导致血栓形成。血栓如果未造成急性缺血症状,可能会因为晚期机化而造成ISR。因此,支架内再狭窄也可能是支架内血栓机化的结果[6]。
NF-κb是一类特殊的蛋白质,具有和基因启动子区的固定核苷酸序列结合而启动基因转录的功能,参与调控许多与动脉粥样硬化有关的靶基因的表达,在细胞增殖、分化中起重要作用[7]。本研究中免疫组化提示NF-κb主要在新生内膜中表达,提示血管损伤后细胞增生主要发生在新生内膜,另一方面提示内弹力膜的屏障作用。本实验中血管损伤积分与新生内膜NF-κb阳性细胞率正相关提示血管损伤可激活新生内膜NF-κb途径,继而引发损伤修复相关靶基因的表达和活性因子的释放,因而刺激新生内膜不断增生。
ET-1是一种由21个氨基酸残基组成的活性多肽,不仅存在于血管内皮,也广泛存在于各种组织和细胞中,是一种内源性长效血管收缩调节因子,同时也是一种强效持久的促有丝分裂剂,可促进细胞增殖[8]。本研究血管损伤术后1 min ET-1释放可能与内皮受到挤压损伤有关,4周后ET-1持续表达可能与新生内膜不断增生有关。血管损伤当时,由于内皮细胞受到挤压刺激,立即释放内皮素产生强烈的缩血管反应,同时NF-κb被激活与靶基因结合持续表达内皮素。随着内皮细胞的坏死和剥脱,VSMC逐渐迁移至内皮下转型为新生内膜。新生内膜持续表达内皮素可能是导致新生内膜增生的原因之一。
MMPs主要存在于溶酶体中,几乎能降解细胞外基质中的各种蛋白成分。MMP-3属于基质分解素,其作用底物广泛,包括层粘连蛋白、纤连蛋白、弹性蛋白、蛋白聚糖等[9]。血管损伤后,胶原纤维暴露导致凝血系统激活,后者引发纤溶酶系统激活,继而引起MMP-3释放。MMP-3降解细胞外基质,从而有利于VSMC的迁移和新生内膜的增生,最后导致血管负性重构。本实验通过透射电镜观察到血管损伤后新生内膜内溶酶体增多,可能是NF-κb活性增高导致MMP-3转录合成增多的表现。
总之,本实验发现血管损伤可以通过激活NF-κb途径,促进ET-1和MMP-3表达,从而促使新生内膜不断增生,导致血管负性重构。TF是血管损伤后导致新生内膜增生的始动因子。内弹力膜是反映血管损伤的关键结构,是阻碍新生内膜增生的惟一屏障。因此内弹力膜损伤可以作为预测ISR的一项指标[10]。减少ISR的关键是PCI操作需细致谨慎,减少血管损伤,同时要求支架大小合适、紧密贴壁。血管内超声或者光学相干断层扫描有助于判断血管直径和支架贴壁情况,从而有助于减少ISR[11]。另外,本研究为防治ISR提供了生物学靶点,下调NF-κb 的活性、拮抗或者阻断ET-1和MMP-3可能是防治ISR的新途径。
本研究的不足之处:首先本研究结果是从兔腹主动脉血管损伤中获得的,因此可能与人冠状动脉的实际病理改变存在差别;第二,本研究中血管损伤模型是在非病变血管基础上建立的,与PCI术中的血管损伤存在一定差距。
致谢:感谢宁夏医科大学实验中心的王洁、张琰老师,宁夏医科大学总医院病理科的马爱玲、郭雅琪老师。
[1] 张文广, 裴汉军, 吴永健, 等. 药物洗脱支架治疗糖尿病合并冠状动脉支架内再狭窄远期疗效及安全性观察. 中国循环杂志, 2013, 28: 96-99.
[2] 王勇, 袁吉祥, 王磊. 牛磺酸抑制高脂合并高同型半胱氨酸血症致兔动脉粥样硬化的病理学改变. 中国老年学杂志, 2013, 33: 6227-6229.
[3] Swier VJ, Tang L, Krueger KD, et al. Coronary injury score correlates with proliferating cells and alpha-smooth muscle actin expression in stented porcine coronary arteries. PLoS One, 2015, 10: e0138539.
[4] Kashima Y, Takahashi M, Shiba Y, et al. Crucial role of hyaluronan in neointimal formation after vascular injury. PLoS One, 2013, 8: e58760.
[5] 黎娜, 李宪伦. 组织因子和组织因子途径抑制物与心肌无复流. 中国循环杂志, 2011, 26: 317-319.
[6] Risheen R, Lotfi AS. Prevention of stent thrombosis: challenges and solutions. Vasc Health Risk Manag, 2015, 11: 93-106.
[7] Yoshida T, Yamashita M, Horimai C, et al. Smooth muscle-selective inhibition of nuclear factor-κb attenuates smooth muscle phenotypic switching and neointima formation following vascular injury. J Am Heart Assoc, 2013, 2: e000230.
[8] Kawanabe Y, Takahashi M, Jin X, et al. Cilostazol prevents endothelin-induced smooth muscle constriction and proliferation. PLoS One, 2012, 7: e44476.
[9] 黄捷, 冯艳, 韩凌, 等. 核糖核酸干扰基质金属蛋白酶-3 基因对大鼠血管平滑肌细胞增殖的影响. 中国循环杂志, 2015, 30: 159-163.
[10] 李少君, 李宁, 李志韬, 等. 猪冠状动脉内弹力板损伤对介入术后再狭窄的影响. 中国介入心脏病学杂志, 2010, 18: 340-344.
[11] 罗明华, 王贺, 关怀敏. 支架内新生动脉粥样硬化研究进展. 中国循环杂志, 2014, 29: 848-851.
Impact of Vascular Injury on Neointimal Hyperplasia in Experimental Rabbit Model
YUAN Ji-Xiang, ZHANG Liang, WEI Shu-jun.
Department of Cardiology, People’s Hospital of Ningxia Hui Autonomous Region, Yinchuan (750001), Ningxia, China Corresponding Author: WEI Shu-jun, Email: weishujun1968@163.com
Objective: To study the impact of vascular injury on neointimal hyperplasia and the expressions of nuclear transcription factor-κb (NF-κb), tissue factor (TF), endothelin-1 (ET-1) and matrix metalloproteinase-3 (MMP-3) in experimental rabbit model.Methods:A total of 32 male New Zealand big-eared white rabbits were used to establish vascular injury model by femoral artery puncture, balloon was sent to abdominal aorta via the wire followed by balloon dilatation to strain abdominal aorta. Blood sample was taken from femoral artery sheath 1 minute after operation, and the rabbits were killed at 4 weeks after operation, meanwhile blood sample was taken from the heart. Injured arteries were isolated, fxed and embedded; slices were stained by HE, basic fuchsine and NF-κb immunohistochemical methods for light microscope observation; slices were also stained by lead and uranium for transmission electron microscope observation. Neointimal thickness was measured by computer analysis, vascular injury integral and NF-κb positive cell rate were determined, blood levels of TF, ET-1 and MMP-3 wereexamined by ELISA. The relationship between vascular injury integral and the contents of TF, ET-1, MMP-3 and NF-κb positive cell rate were analyzed by SPSS statistical software.Results: The optimal ftting curve between vascular injury integral and neointimal thickness was S-shaped cubic curve. NF-κb was mainly expressed in neointima, vascular injury integral was positively related to NF-κb positive cell percentage, Pearson correlation coefcient was 0.916, P<0.05. Vascular injury integral was positively related to the contents of 1 min post-operative TF; 1 min and 4 weeks post-operative ET-1; 1 min and 4 weeks post-operative MMP-3; Pearson correlation coefcients were 0.925, 0.957, 0.947, 0.914 and 0.940 respectively, all P<0.05.Conclusion: Vascular injury may activate NF-κb pathway, promote ET-1 and MMP-3 expression, therefore accelerating neointimal hyperplasia, leading negative vascular remodeling, TF was an initiating factor for neointimal hyperplasia. Internal elastic lamina was the key structure reflecting vascular injury, it is the only barrier hindering neointimal hyperplasia in experimental rabbit model.
Vascular injury; Neointima; Hyperplasia
2016-04-20)
(编辑:王宝茹)
宁夏自然科学基金(NZ14174)
750001 银川市,宁夏回族自治区人民医院(西北民族大学第一附属医院) 心内科
袁吉祥 副主任医师 硕士 研究方向为冠心病基础与介入技术 Email: 34232762@qq.com 通讯作者:魏述军Email:weishujun1968@163.com
R54
A
1000-3614(2016)12-1210-05
10.3969/j.issn.1000-3614.2016.12.014
方法:对32只雄性新西兰大耳白兔进行穿刺股动脉,经导丝送入球囊,球囊扩张并拉伤腹主动脉建立血管损伤模型。损伤术后1 min经股动脉鞘管采血,4周后经心脏采血,处死兔子,分离损伤血管,进行固定、包埋,切片行苏木素伊红(HE)染色、碱性品红染色及NF-κb免疫组化染色后光镜下观察。切片经铅、铀染色后透射电镜下观察。使用计算机图像分析软件测量新生内膜厚度,分析确定血管壁损伤积分及NF-κb阳性细胞率,采用酶联免疫吸附法(ELISA)测定血清TF、ET-1和MMP-3含量,利用SPSS统计软件对血管损伤积分与血清TF、ET-1、MMP-3含量及NF-κb阳性细胞率进行相关性分析。
结果:血管损伤积分与新生内膜厚度之间的最优拟合曲线是“S”形的三次曲线。NF-κb主要在新生内膜中表达,血管损伤积分与NF-κb阳性细胞百分率呈正相关,Pearson相关系数为0.916(P<0.05)。血管损伤积分与术后1 min TF,术后1 min及4周ET-1,术后1 min及4周MMP-3含量均呈正相关,Pearson相关系数分别为0.925、0.957、0.947、0.914和0.940(P均<0.05)。
结论:血管损伤可以通过激活NF-κb途径,促进ET-1和MMP-3表达,从而促使新生内膜不断增生,导致血管负性重构。TF是血管损伤后导致新生内膜增生的始动因子。内弹力膜是反映血管损伤的关键结构,是阻碍新生内膜增生的唯一屏障。

