岩藻黄质对黄颡鱼的生长、消化和抗氧化能力的影响
■陈 钱 张滕闲 张宝龙何建武 张 曼 曾小理 白东清
(1.天津农学院水产学院天津市水产生态及养殖重点实验室,天津 300384;2.天津现代晨辉科技集团有限公司天津市水族动物功能性饲料企业重点实验室,天津 301800)
黄颡鱼(Pelteobagrus fulvidraco),俗称黄姑、黄腊丁等,属鲶形目(Siluriformes)鲿科(Bagridae)黄颡鱼属(Pelteobagrus),为东亚特有种,是一种小型淡水经济鱼类[1]。黄颡鱼具有肉质细嫩、味道鲜美、营养丰富、刺少等优点,越来越受到东亚各国消费者的青睐[2]。随着养殖规模的扩大,爆发性疾病时有发生,经济损失惨重,为提高黄颡鱼健康,探究黄颡鱼的免疫能力成为当今研究者的热点问题。
岩藻黄质(Fucoxanthine),亦称褐藻素、岩藻黄素,为褐藻、硅藻、金藻及黄绿藻所含有的一种重要的类胡萝卜素,参与光合作用的光化学系统,在叶绿体的类囊体中参与光合作用,和叶绿素a一起参与某些蛋白质组成为岩藻黄质叶绿素a蛋白质复合体,起到光捕获和光传递的作用[3]。并且,岩藻黄质具有抗肿瘤、抗炎、抗氧化和减肥作用[4]。除此以外岩藻黄素还有抗痘、抗糖尿病、抗疟疾和抗血脂等方面的作用[5]。此外,学者们就岩藻黄质的稳定性[6-7]和毒性[8-10]进行了相应的研究,得出其无毒的结论,并提出了适宜的保存条件。基于此,本试验首次将不同水平岩藻黄质添加到黄颡鱼饲料中,进行养殖试验,通过测定各水平组该鱼生长指标、消化酶活力和部分抗氧化指标的变化情况,探讨岩藻黄质对黄颡鱼生长性能、消化能力和抗氧化能力的影响。旨在寻求岩藻黄质在饲料中适宜的添加水平,为黄颡鱼养殖过程岩藻黄质在饲料中的添加水平提供部分参考数据。
1 材料与方法
1.1 岩藻黄质
岩藻黄质购于河南郑州永尚化工产品有限公司,纯度为10%。
1.2 试验用鱼及其饲养管理
试验所用健康黄颡鱼雌鱼购自天津市蓝科水产有限公司,共720尾,初始体重为(13.17±0.68)g,初始体长为(11.86±0.53)cm,随机分为6组,每组3个重复,每个重复40尾鱼。分别投喂添加0、20、80、320、640、1 280 mg/kg岩藻黄质的试验饲料,分别标记为D1~D6。
试验用鱼培养容器为直径1.5 m,深度0.75 m的玻璃纤维缸,日投饲率为3%,早8:00,晚4:30各投一次,以20 min内吃尽为准,试验用水采用大水面池塘水与深井水混合的形式,水温保持(24±2)℃,每天持续充氧,2 d换水1/2。试验为60 d。
1.3 饲料配制
试验饲料主要原料为鱼粉、豆粕、花生粕、菜籽粕等,在天津市天祥水产有限责任公司用江苏牧羊集团牧羊MUZLM V4型饲料制粒机制成直径为2.00 mm的沉性颗粒饲料,置于阴凉处冷却干燥,冷却干燥后装袋,于阴凉干燥处保存待用。各组试验饲料的组成与营养水平见表1。
1.4 取样及指标测定
1.4.1 取样处理
投喂60 d后,进行取样,每个重复取15条鱼进行解剖,每5尾鱼的组织置于同一样品袋中,作为一个样本。取鳃、肝胰脏、脾脏、头肾、中肾、胃、前肠、中肠、后肠,用预冷0.85%生理盐水冲洗血渍并用滤纸吸干后称重,鳃、肝胰脏、脾脏、头肾、中肾按组织(g)∶0.85%生理盐水(ml)=1∶9的比例用台式均质乳化机冰水浴匀桨,制成10%的组织匀浆液,离心机4 000 r/min离心10 min,吸取上清液-80℃保存。胃、前、中、后肠均按组织(g)∶0.85%生理盐水=1∶4冰水浴匀桨,4 000 r/min离心10 min,取上清液,-80℃保存。
1.4.2 指标测定方法
1.4.2.1 生长指标测定
增重率(WG,%)=100×(Wt-W0)/W0;
饲料系数(FCR)=Id/(Wt-W0);
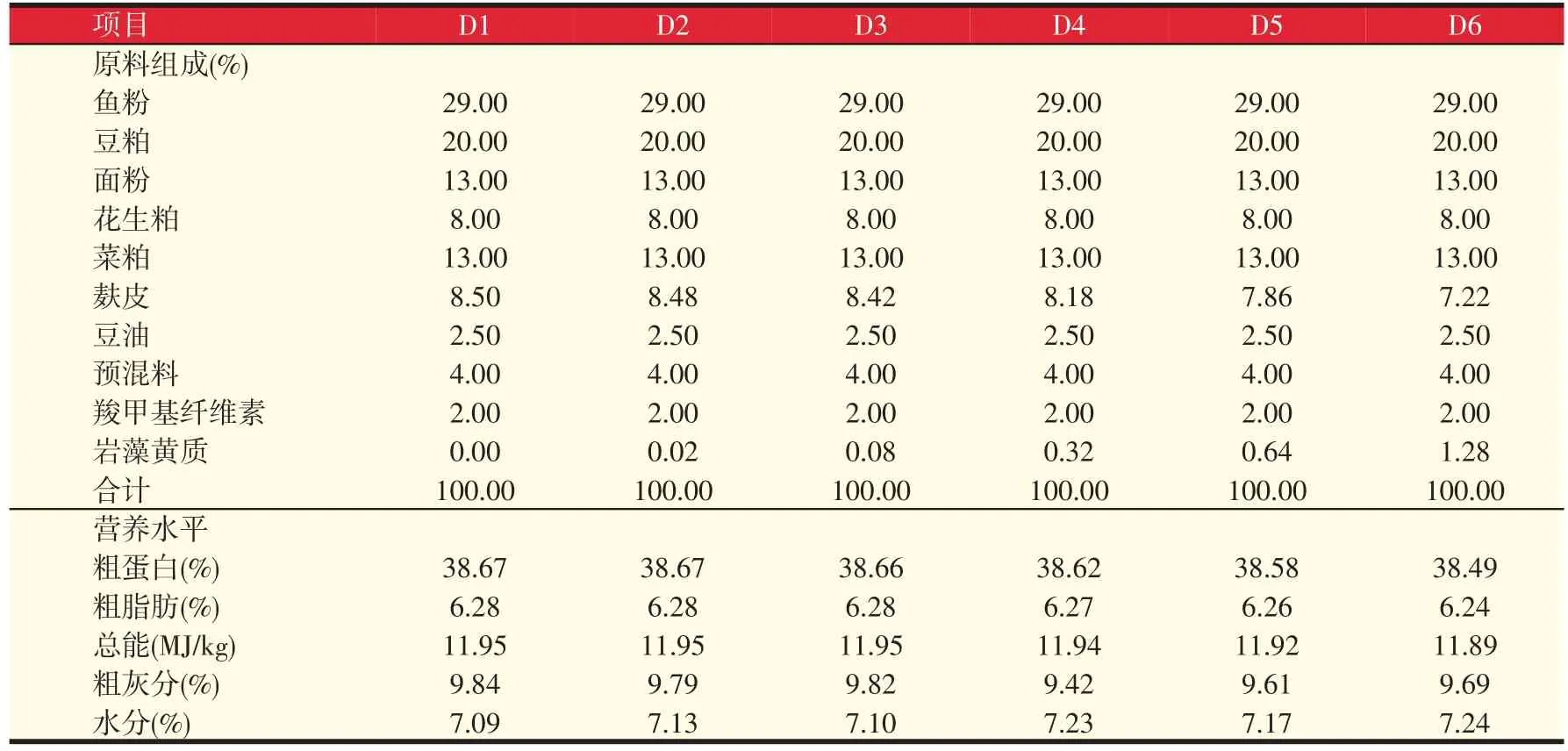
表1 试验饲料组成及营养水平(风干基础)
特定生长率(SGR,%/d)=(LnWt-LnW0)×100/t;
存活率(%)=100×Nt/N0;
蛋白质效率(PER)=(Wt-W0)/(Id×Pd);
肥满度(g/cm3)=100×Wt/L3。
式中:Wt和W0——鱼的终末体重和初始体重(g);
t——试验天数;
Nt、N0——分别为试验末期和初期的鱼体总数;
Pd——饲料中蛋白含量;
Id——摄食量的干重(g);
L——鱼末体长(cm)。
1.4.2.2 常规成分的测定
试验结束后,取饲料参照最新国标要求,测定其常规成分含量。
水分采用105℃常压恒温烘干法(GB/T5009.3—2010);粗蛋白采用杜马斯灼烧法(GB/T24318—2009)(ThermoFisher scientific FLASH2000全自动蛋白测定仪测定);粗脂肪采用索氏抽提法(GB/T5009.6—2010);粗灰分采用550℃高温灼烧法(GB/T5009.4—2010)。
1.4.2.3 非特异性免疫力指标
过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、丙二醛(MDA)、还原型谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)、蛋白酶、淀粉酶和脂肪酶活力测定试剂盒均购自南京建成生物工程研究所,具体测定方法参照所附说明书进行。
1.5 数据处理
数据均以“平均值±标准差(x±SD)”表示,数据分析采用SPSS16.0软件中的单因素方差分析(One-way ANOVA),若差异达到显著(P<0.05),则进行Ducan's法多重比较。
2 结果
2.1 岩藻黄质对黄颡鱼生长性能的影响(见表2)
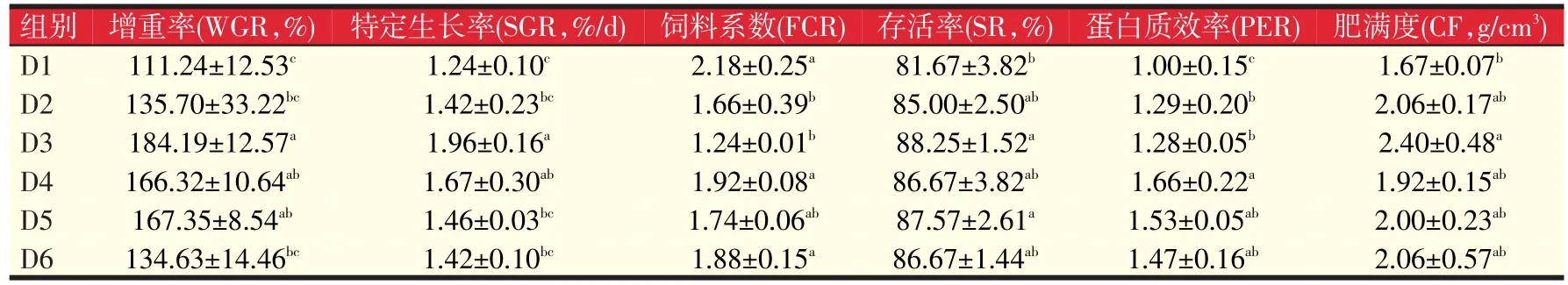
表2 不同水平岩藻黄质对黄颡鱼生长的影响
由表2可知,D3、D4、D5组鱼的增重率显著高于对照组65.58%、49.51%、50.44%(P<0.05),D2、D6组与对照组差别不大(P>0.05);D3、D4组特定生长率显著高于对照组58.06%、34.67%(P<0.05),D2、D5、D6组与对照组差异不明显(P>0.05);D2、D3组饲料系数显著低于对照组23.85%、43.12%(P<0.05),其它组与对照组无显著差异(P>0.05);D3、D5组存活率显著高于对照组8.06%、7.22%(P<0.05),其它组与对照组无显著差异(P>0.05)。对照组蛋白质效率显著低于各添加组(P<0.05),肥满度D3组显著高于对照组43.71%(P<0.05)。可见,从生长指标来分析,岩藻黄质添加适宜水平为80~320 mg/kg,其中80 mg/kg岩藻黄质促生长效果最好。
2.2 岩藻黄质对黄颡鱼消化能力的影响
养殖60 d后,通过测定各组黄颡鱼胃肠消化酶活力,研究岩藻黄质对黄颡鱼消化道消化能力的影响,结果见表3。从结果可以看出,前肠脂肪酶活力D3组是对照组的1.49倍;中肠脂肪酶活力D3组明显高于对照组74.30%(P<0.05),D3组脂肪酶活性分别是D1、D2、D5组的1.74倍、1.60倍和1.51倍;后肠脂肪酶活力D5组显著高于对照组43.22%(P<0.05)。可见,与对照组相比,D3组前肠、中肠脂肪酶活性最高,D5组后肠脂肪酶活性最高;胃中脂肪酶活力D4、D5、D6组比对照组提高5.96%、5.94%、8.68%(P<0.05)。总的来说,在D3组和D5组岩藻黄质水平能有效提高肠道脂肪酶活性。
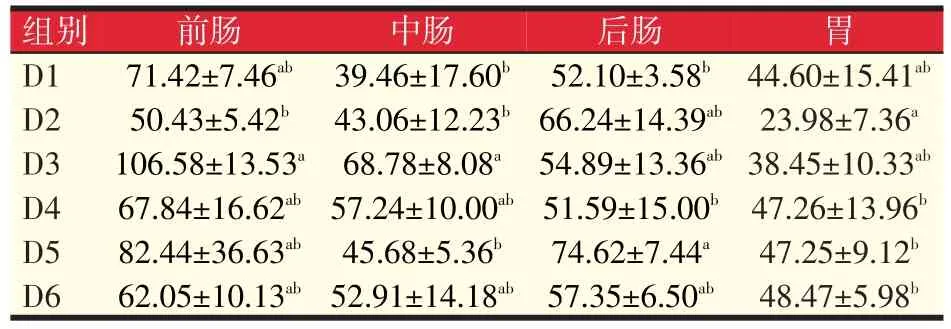
表3 岩藻黄质对黄颡鱼脂肪酶活力的影响(U/g prot)
由表4可以看出各组鱼前肠淀粉酶活力与对照组相比差异不显著(P>0.05);中肠的淀粉酶活力D5组显著高于其他各组(P<0.05);后肠淀粉酶活力D2、D5组分别是对照组的4.87倍、7.77倍(P<0.05)。可见,与对照组相比,试验组前肠淀粉酶活力无显著变化(P>0.05),D5组中肠、后肠淀粉酶活力最好。胃淀粉酶活力比对照组有所提高但不显著(P>0.05)。总的来说,D5组岩藻黄质水平(640 mg/kg)能有效提高肠道淀粉酶活力。
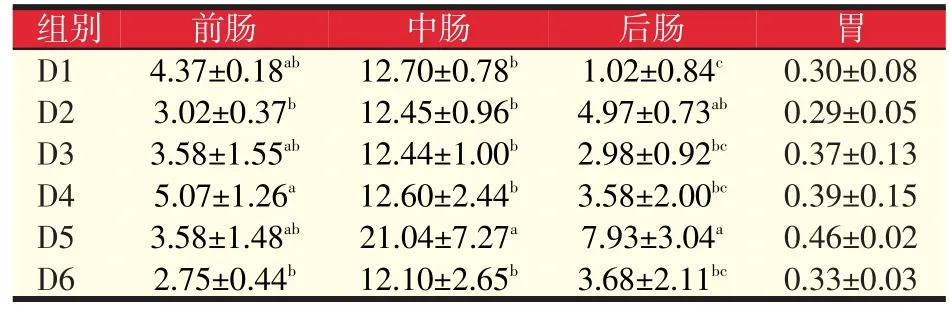
表4 岩藻黄质对黄颡鱼淀粉酶活力的影响(U/mg prot)
由表5可以看出前肠蛋白酶活力试验组与对照组均无显著差异(P>0.05);中肠蛋白酶活力D2组显著高于对照组75.68%(P<0.05);后肠蛋白酶活力D3组显著高于对照组28.53%(P<0.05);D3组前肠、后肠蛋白酶活力最好,D2组中肠蛋白酶活力最高,胃蛋白酶活力D5组显著低于对照组19.10%(P<0.05)。总的来说,D3组岩藻黄质水平(80 mg/kg)能有效提高肠道蛋白酶活力。
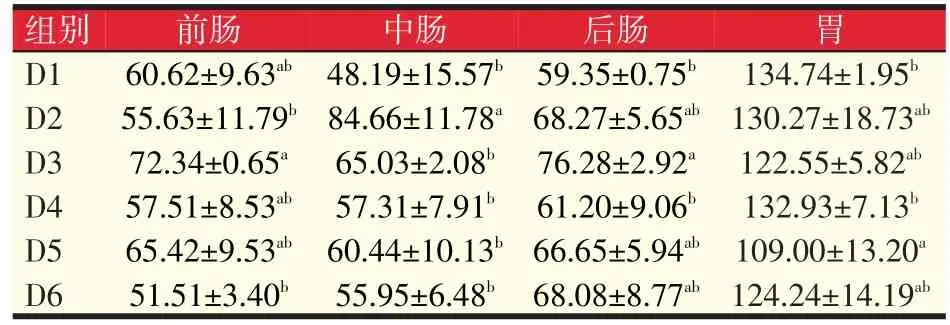
表5 岩藻黄质对黄颡鱼蛋白酶活力的影响(U/mg prot)
2.3 岩藻黄质对黄颡鱼抗氧化能力的影响
养殖结束后,测定了各组鱼肝胰脏、脾、头肾、中肾和鳃的CAT活力。由表6可以看出,与对照组相比,D2、D3组和D4组肝胰脏CAT活力显著提高了32.63%、38.88%和44.08%(P<0.05);D2、D3和D4组脾脏中CAT活力显著高于对照组39.81%、68.65%、39.56%(P<0.05);D5组头肾CAT活力显著高于对照组80.54%(P<0.05),其余差异不明显;D4组中肾和鳃中CAT活力分别提高72.18%和57.32%(P<0.05);可见D4、D5组(320~640 mg/kg)岩藻黄质水平有效提高了组织中的CAT活力。
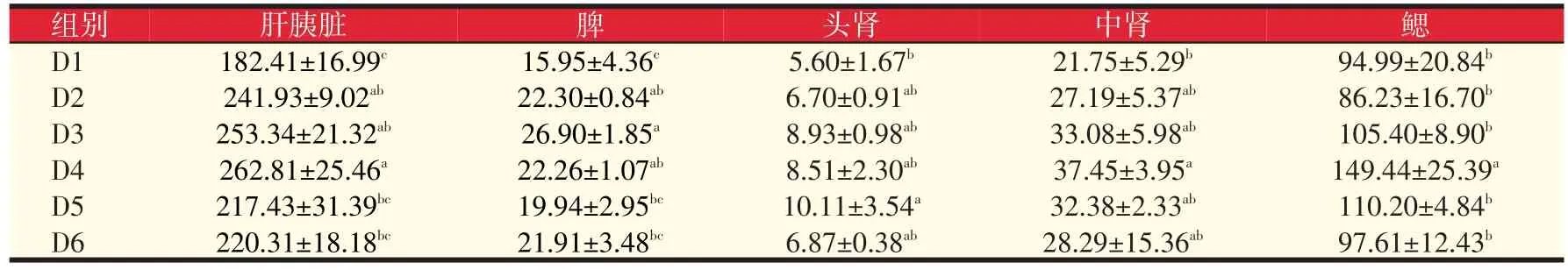
表6 岩藻黄质对黄颡鱼过氧化氢酶CAT活力的影响(U/mg prot)
由表7可以看出各组黄颡鱼肝胰脏中SOD活力随着岩藻黄质水平提高基本上呈现增加的趋势,但各组间差异不显著(P>0.05);各组脾脏中SOD活性较对照组均有提高但是都不显著;D4、D5、D6组头肾中SOD活性显著高于对照组71.48%、79.66%、31.82(P<0.05);D4组中肾中SOD活力显著高于对照组34.95%(P<0.05);D3组鳃中SOD活力显著高于对照组55.02%(P<0.05)。由此可以看出,D3、D4、D5组岩藻黄质添加水平(80~640 mg/kg)可以有效提高组织中SOD活力。
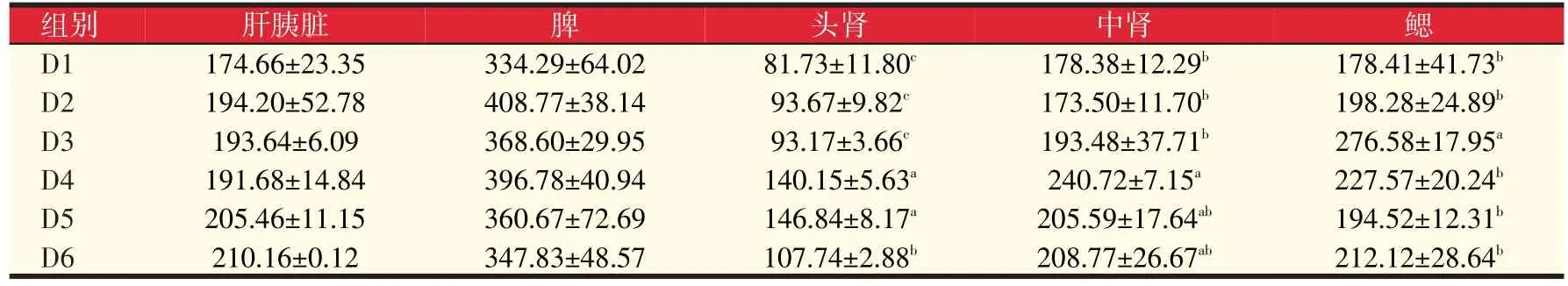
表7 岩藻黄质对黄颡鱼超氧化物歧化酶SOD活力的影响(U/mg prot)
由表8可见,与对照组相比,肝胰脏GSH含量D4、D5、D6组均显著提高了58.94%、124.88%、64.53%(P<0.05),其中D5组又显著高于D4、D6组(P<0.05);脾中GSH含量各组比对照组都有提高但均不显著(P>0.05);头肾中D3组显著高于对照组70.76%(P<0.05);中肾D4、D6组显著高于对照组100.72%、89.58%(P<0.05);D4 组鳃中显著高于对照组 64.00%(P<0.05)。因此可知添加岩藻黄质对提高各组织GSH的含量有一定的作用,其中添加量D4组(320 mg/kg)较为适宜。
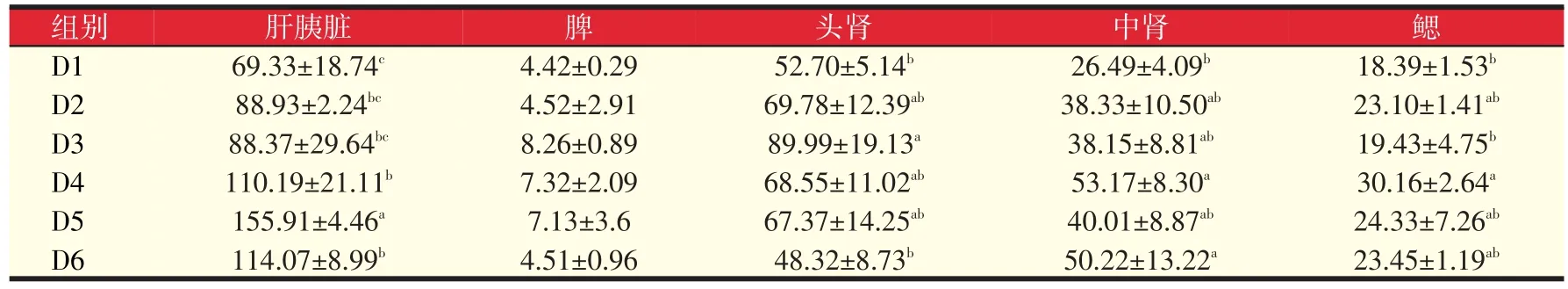
表8 岩藻黄质对黄颡鱼GSH含量的影响(μmol/g prot)
如表9可知,盐藻黄质添加水平对黄颡鱼肝胰脏和头肾中GSH-Px的活力影响不大;D3、D4组脾中GSHPx活力显著高于对照组46.04%、58.31%(P<0.05);D4、D5组和D6组中肾中GSH-Px活力显著高于对照组56.92%、30.94%、27.88%(P<0.05),其中D4组又显著高于D5组和D6组(P<0.05);D5组鳃中GSH-Px活力显著高于对照组110.70%(P<0.05)。由此可见,从GSH-Px角度来说,岩藻黄素适宜添加水平为320 mg/kg。
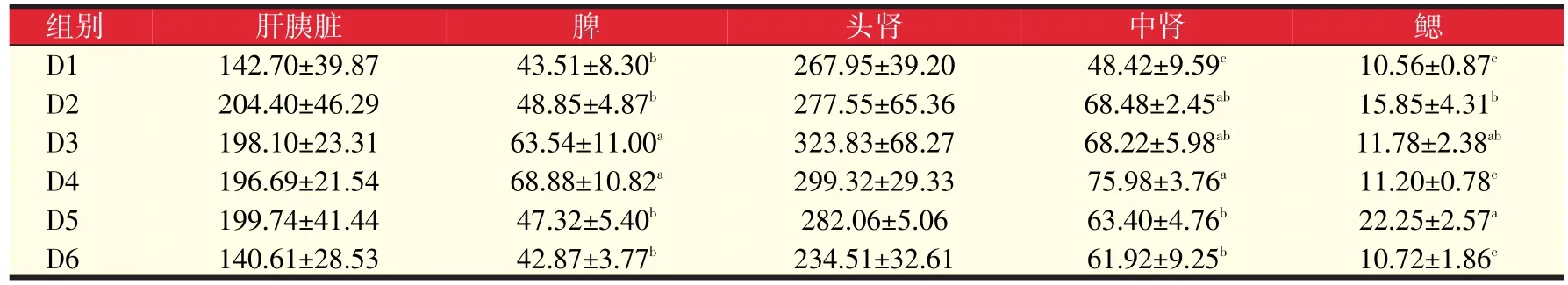
表9 岩藻黄质对黄颡鱼GSH-Px活力的影响(活力单位)
由表10可以看出,D4、D5组肝胰脏中MDA含量显著低于对照组28.57%、28.57%(P<0.05);D2、D3、D6组与对照组相比无明显变化(P>0.05);各组中肾中MDA含量均低于对照组,但只有D5组明显降低55.62%(P<0.05)。可见一定水平的岩藻黄质可有效降低中肾和肝胰脏中MDA含量。
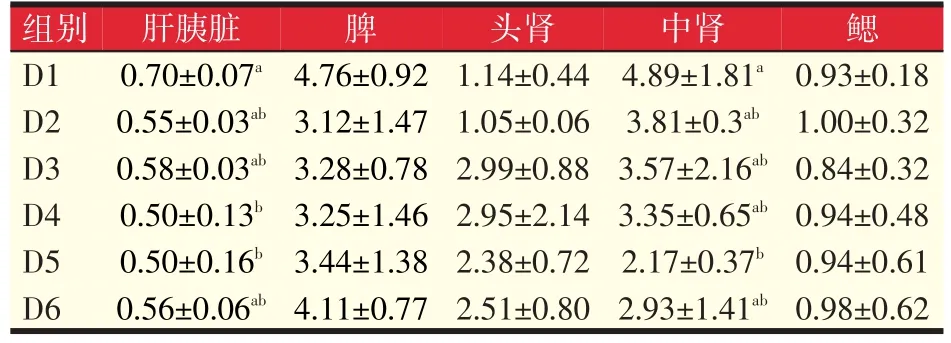
表10 岩藻黄质对黄颡鱼MDA含量的影响(nmol/mg prot)
3 讨论
3.1 岩藻黄质对黄颡鱼生长性能的影响
岩藻黄质作为营养物质在小鼠上进行过相应研究,其主要作用是具有降脂功效。Maeda H等[11]对小鼠投喂含有岩藻黄质的海藻,来减少其腹部的脂肪组织(WAT),该海藻中主要含有糖脂类海藻胡萝卜素和岩藻黄质,而在食用岩藻黄质的小鼠中,脂肪重量显著减少(P<0.05)。Tsukui T等[12]研究显示给C57BL/6J小鼠投喂含有岩藻黄质的食物,与对照组相比,小鼠肝脏中的DHA和AA的含量均高了1.3倍,又有研究发现脂肪酸可以作为能源物质为鱼类提供生长发育繁殖等各项活动所需的能量,另外脂肪酸有助于脂溶性维生素的吸收和体内运输,并且提供鱼类生长所需的必需脂肪酸[13]。Woo M N等[14]等研究岩藻黄素对高饮食C57BL/6N小鼠的脂肪代谢和血糖浓度的影响,发现岩藻黄素显著降低血浆中甘油三酯的浓度,进一步说明岩藻黄质对脂肪的代谢有着重要做用。本试验在黄颡鱼饲料中添加不同水平的岩藻黄质,结果表明鱼增重率、特定生长率、存活率、蛋白质效率与对照组相比均有不同程度的提高,而饲料系数降低。岩藻黄质在鱼类生长上的研究尚属首次,推测岩藻黄质可能通过促进鱼类脂肪代谢,减少脂肪在体内沉积,并通过提高蛋白质效率而达到提高黄颡鱼生长的作用,其具体机理还要通过营养沉积以及营养代谢调控进一步验证。
3.2 岩藻黄质对黄颡鱼消化能力的影响
鱼类体内消化酶活力直接影响着鱼类对营养物质的消化与吸收。蛋白酶能够将难被机体直接吸收的蛋白质降解为蛋白胨和氨基酸等小分子物质;脂肪酶能够催化油脂水解为脂肪酸、甘油等;淀粉酶能够将淀粉、糖原等水解为麦芽糖、葡萄糖等容易被鱼类吸收的单糖[15],营养物质的利用能力与体内脂肪酶、淀粉酶和蛋白酶的活力高低密切相关。Woo M N等[16]用一定量岩藻黄质处理肥胖的小鼠,结果发现岩藻黄质能有效抑制脂肪生成酶的活性,减少脂肪酸β-氧化反应,具有减肥作用。Matsumoto M等[17]研究表明岩藻黄质可抑制胃肠内脂肪酶的活性。本试验通过在黄颡鱼饲料中添加不同水平的岩藻黄质,结果发现岩藻黄质对促进黄颡鱼肠道消化有显著作用,在饲料中添加80 mg/kg的岩藻黄质对其肠道内的脂肪酶、淀粉酶和蛋白酶活力有提高作用,与Matsumoto等[17]从不同角度上得出岩藻黄质具有提高脂肪利用率的作用结果一致。后续可以通过脂类代谢调控进一步验证岩藻黄质对黄颡鱼脂类代谢的分子调控机制。
3.3 岩藻黄质对黄颡鱼抗氧化能力的影响
鱼体的抗氧化能力主要是由超氧化物歧化酶(SOD)、过氧化氢酶(CAT)以及丙二醛(MDA)来综合反映的。SOD是机体内专一清除超氧阴离子的抗氧化酶,促使·O2-转变为H2O2,广泛存在于鱼体组织中,活性常因组织不同而异,其中以肝脏的活性最高[18]。CAT的作用是分解H2O2生成O2和H2O,保护细胞免受损伤[19],丙二醛(MDA)是脂质过氧化作用的最终分解产物,其含量可间接反映机体的活性氧自由基和脂质的过氧化水平[20]。本试验结果显示岩藻黄质一定程度上可以有效提高黄颡鱼体内抗氧化能力,表现在提高SOD、CAT的活性,降低MDA的含量。Heo S J等[21]在细胞中加入H2O2使其发生过氧化反应,后给药岩藻黄质,发现岩藻黄质能显著减少过氧化反应,抑制了H2O2诱导的氧化反应。王纪亭等[22]研究发现,复合酶制剂能显著提高草鱼超氧化物歧化酶(SOD)的活性,并且提升CAT催化H2O2分解生产氧和水的能力,同时MDA的含量也显著降低(P<0.05),这些可与本试验结论相互印证。王国霞等[23]研制出一种以蛋白酶、淀粉酶、脂肪酶和果胶酶为主的水产用复合酶制剂对黄颡鱼进行口服试验,测定SOD活性和MDA含量,结果显示两者均无显著变化(P>0.05),说明该复合酶制剂对提升黄颡鱼的抗氧化能力无显著作用(P>0.05)。这可能与酶制剂用量、种类、添加方式与投喂的方式有关。
GSH-Px使有毒物质还原成无毒物质保护细胞膜的结构和功能,GSH能激活多种酶,从而促进GSHPx、SOD和CAT活力,GSH-Px、SOD和CAT活力的高低间接反映了机体清除氧自由基的能力。Liu C L等[24]研究发现 1~20 μmol/l岩藻黄质能有效防止BNL.2细胞由三乙酰铁引起的细胞内毒性反应,其保护作用可与减少细胞氧原子反应、TBARS硫代巴比妥酸反应、碳酰蛋白含量和增加GSH水平有联系。与本试验结果相似可做为本试验的理论支持。Kumar S R等[25]研究发现岩藻黄质主要是通过调节Na+-K+-ATP酶活性,及调节由视黄醇缺乏引起的组织及氧化氢酶和谷胱甘肽的活性,可能与岩藻黄质的抗氧化作用有联系。岩藻黄质在对其他动物的抗氧化研究上也有很多成果,在黄颡鱼的抗氧化能力方面以及在鱼类上的研究还很少,单从本次试验结果上来看,在饲料中添加岩藻黄质对提高黄颡鱼的抗氧化作用有一定的影响,但是其机理还有待后期研究探索。
4 结论
①在饲料中添加岩藻黄质对黄颡鱼的生长有促生长作用;对提高消化酶活力和提高抗氧化能力方面均有一定的影响。
② 岩藻黄质的添加量在80~320 mg/kg时效果最佳。

