壳聚糖微球/小牛松质骨支架复合缓释体系的制备及体外生物活性评价
李 箐,于 欣,周 钢,毋育伟,胡洪成,王 彤,唐志辉△
(1. 北京大学口腔医学院·口腔医院,口腔医学数字化研究中心 口腔数字化医疗技术和材料国家工程实验室 口腔数字医学北京市重点实验室, 北京 100081; 2. 北京航空航天大学生物与医学工程学院, 北京 100191; 3. 北京大学口腔医学院·口腔医院第二门诊部, 北京 100101)
·论著·
壳聚糖微球/小牛松质骨支架复合缓释体系的制备及体外生物活性评价
李 箐1,于 欣2,周 钢2,毋育伟3,胡洪成3,王 彤3,唐志辉1△
(1. 北京大学口腔医学院·口腔医院,口腔医学数字化研究中心 口腔数字化医疗技术和材料国家工程实验室 口腔数字医学北京市重点实验室, 北京 100081; 2. 北京航空航天大学生物与医学工程学院, 北京 100191; 3. 北京大学口腔医学院·口腔医院第二门诊部, 北京 100101)
目的:通过乳液交联法合成壳聚糖微球并负载骨形态发生蛋白(bone morphogenetic protein-2,BMP-2),再将其复合于脱细胞基质的小牛松质骨支架,制备壳聚糖微球/小牛松质骨支架复合缓释体系。方法: 使用红外光谱仪、扫描电镜对合成的复合缓释系统进行结构表征和形貌观察,并对微球的包封率和载药量进行检测。用动态浸泡的方法来检测BMP-2的体外释放特征,通过体外检测复合体系的细胞毒性和对细胞增殖的影响。结果: 壳聚糖发生了交联并成功包载了BMP-2,微球平均直径为5.982 μm,表面光滑,且成功负载于小牛松质骨支架,形成了新型的微球/支架药物缓释体系。缓释数据表明,5 mg微球在体外释放21 d,BMP-2逐渐释放,第21天时浓度仍达到(239.1±20.0) mg/L。体外测试表明,该缓释体系有利于小鼠前成骨细胞MC3T3-E1的生长,促进向成骨方向分化。结论: 壳聚糖微球/小牛松质骨支架复合缓释体系实现了BMP-2的生物学功能及其在骨修复部位的持续、缓慢释放,为骨组织缺损的修复治疗及骨组织工程支架材料的选择提供了依据。
壳聚糖;微球体;药物释放系统;小牛松质骨
骨组织的损伤修复与重建一直是现代医学努力寻求解决方法以应对的难题[1-2]。骨的形成、代谢及随之发生的修复重建过程是由成骨细胞、破骨细胞以及多种生长因子共同参与的复杂过程,维持这一动态平衡需要生长因子的持续释放[3]。骨形态发生蛋白(bone morphogenetic protein,BMP-2)已广泛应用于骨缺损疾病方面的治疗[4-5],但其单独应用时存在半衰期短、会扩散至全身等副作用,因此,如何有效维持BMP-2生长因子的局部持续释放,成为临床药物领域的重要发展方向[6]。
在药物控制释放行为中,药物载体材料起了非常重要的作用。理想的载药材料应该具有良好的生物相容性、生物可降解性、生物稳定性和极低的毒性,并且有较高的载药性[7-8]。壳聚糖(chitosan,CS)是一种天然聚阳离子碱性多糖,近年研究证实,CS具有生物黏附性和多种生物活性,能与活体组织相容,不会引起过敏反应和排斥现象,其被体内的溶菌酶、胃蛋白酶降解后,降解产物能完全地被人体吸收,无毒副作用,比较适于作为缓释辅料[8]。CS制成微球包封药物后,可使药物释放减慢、疗效延长,毒副作用降低,利用CS制备缓释、控释制剂已成为近年来新剂型研究的热点[9]。
为了更好地实现BMP-2的生物学功能及其在骨修复部位的持续缓慢释放,本研究将CS作为缓释载体材料,制备包裹BMP-2的CS微球(CS/BMP-2),并将其复合高温煅烧的小牛松质骨(ceramic bovine bone,CBB)支架材料,制备CS微球/CBB支架复合缓释体系(CS/BMP-2/CBB),检测该复合材料的理化性能、体外药物释放以及生物活性等特征。观察骨髓基质细胞在煅烧骨材料上的黏附、生长与增殖情况,从而进一步地研究对小鼠前成骨细胞MC3T3-E1的增殖和分化的影响,为骨组织缺损的修复治疗及骨组织工程支架材料的选择提供实验依据。
1 材料与方法
1.1 实验材料和设备
CS平均相对分子质量25×104,脱乙酰度90%,购自济南海得贝生物工程有限公司;牛骨购自中国农机院;BMP-2由美国美敦力公司提供;Ⅰ型胶原、BMP-2酶联免疫吸附(ELISA)检测试剂盒购自美国Sigma公司;香草醛购自北京瀛海精细化工厂。实验中所用的其他试剂均为分析纯。
实验所用设备包括傅立叶变换红外光谱仪(Fourier transform infrared spectroscopy,FT-IR,日本岛津-8900)和场发射扫描电子显微镜(FEI 250,美国FEI公司)。
1.2 CBB支架的制备
选用新鲜牛肱骨骨垢端松质骨,截取3 mm×3 mm×15 mm形状规则的长方形骨条,氢氧化钠、双氧水溶液浸泡后,高压蒸煮2 h,去除部分蛋白及胶原,去离子水洗净、烘干。将干燥的骨条放入马弗炉中煅烧,缓慢升至700 ℃,氧气氛围2 h煅烧,形成保留自然骨架结构的骨磷灰石骨架,将煅烧后的骨条浸入0.09 mol/L焦磷酸钠溶液中,70 ℃水浴浸泡72 h,干燥后将骨条再放入马弗炉中煅烧,缓慢升温至1 200 ℃,维持1 h,制备成经2次煅烧的牛松质骨块。将煅烧骨块研磨成颗粒,通过标准筛的标准网孔过滤,得到0.25~1.00 mm的煅烧骨颗粒。
1.3 CS/BMP-2微球缓释体系制备
采用乳化交联法制备CS/BMP-2药物缓释微球。称取1.5 g CS溶于2.4%(体积分数)稀醋酸溶液60 mL中,待其完全溶解后,加入一定量的BMP-2,机械搅拌使二者混合均匀。将混合后的溶液缓慢加入含2.7%(质量分数)的Tween 80和2.0%(质量分数)的Span 80的液体石蜡溶液380 mL,室温下机械搅拌3 h。向其中缓慢滴加香草醛乙醇溶液,使CS发生交联。滴加完毕后继续搅拌6 h,静置,取出沉淀物,用石油醚、异丙醇反复漂洗,最后将沉淀物冷冻干燥至恒重,制备出负载BMP-2的CS微球,装置示意图如图1所示。
图1 乳化交联法制备CS/BMP-2微球的装置示意图
Figure 1 Schematic of preparing CS/BMP-2 microspheres
1.4 CS/BMP-2/CBB复合缓释体系的制备
室温下用0.05 mol/L的乙酸溶液配制0.1 g/mLⅠ型胶原溶液,将CS/BMP-2微球配制成1%~2%的微球-胶原溶液,再将CBB骨粉支架均匀分散于上述微球-胶原溶液中,真空冷冻干燥8 h,得到的复合材料在4 ℃用50 mmol/L EDC和25 mmol/L NHS进行交联12 h,得到的复合材料用蒸馏水洗涤30 min后在-80 ℃冷冻1 h,再冷冻干燥24 h,得到CS/BMP-2/CBB复合缓释系统。
1.5 生物性能测试与表征
负载前后,材料通过FT-IR分析其化学结构的变化情况,再将干态微球及支架材料均匀散在样品平台上,用导电胶固定,场发射扫描电子显微镜观察微球表面形态。
1.6 包封率和载药量测定
为检测CS/BMP-2微球的包封率和载药量,本实验采用具有较高灵敏度的ELISA试剂盒检测法,使用ELISA试剂盒测试材料的离心上清液中剩余的BMP-2量来推断材料的载药率和包封率。按照ELISA试剂盒说明书操作,测定450 nm下的光密度值。根据标准曲线的标准方程计算样品中BMP-2浓度,推算出上清液中BMP-2量,同等条件重复试验3次。载药率=(投入BMP-2总量-上清液中BMP-2总量)/微球总质量×100%,包封率=(投入BMP-2总量-上清液中BMP-2总量)/投入BMP-2总量×100%。
1.7 CS/BMP-2微球的体外缓释
将5 mg BMP-2微球浸泡于2 mL磷酸盐缓冲液(phosphate buffered saline,PBS,pH 7.4)中,置于37 ℃孵箱中进行缓释。在每个测试时间点(1、3、5、7、10、14、21 d)收集缓释液并用等量的PBS更换,然后储存于-20 ℃冰箱中。CS微球用800 μL醋酸溶液溶解,稀释于3.5 mL PBS中,检测微球中BMP-2的含量。BMP-2浓度的测定严格根据BMP-2 ELISA检测试剂盒的操作方法进行,每组重复3次。
1.8 细胞培养
1.8.1 CCK-8法检测细胞增殖 取P3代MC3T3-E1细胞,以1×106个/mL的密度接种于T25培养瓶中,用α-MEM培养基培养。细胞共分为3组,CON组(不含生长因子)、BMP-2组(1 mg/L、1.25 mg/L)。实验组实验前,用70%(体积分数)乙醇和8.3 g/L的生理盐水对CS/BMP-2/CBB复合缓释体系材料进行消毒,无菌PBS完全清洗后放置于紫外灯下照射消毒。将上述各组细胞接种细胞悬液于96孔板中(1×103个/孔),隔天换培养基,分别于第1、3、5、7、14天每孔加入10 μL CCK-8溶液,孵育2 h,酶标仪(Bro-rad 680)测定450 nm处的光密度值。
1.8.2 Real-time PCR测定 通过real-time实时定量PCR的方法检测碱性磷酸酶(alkaline phosphatase,ALP)、BMP-2、骨钙素(osteocalcin,OCN)、骨桥蛋白(osteopontin,OPN)经BMP-2(1.25 mg/L)处理后的mRNA水平表达的变化,具体如下:取P3代MC3T3-E1细胞,以密度1×106个/mL接种在T25培养瓶中,用α-MEM培养。接种第2天换成诱导培养基(在上述α-MEM基础上加入10-7mol/L地塞米松、50 mg/L维生素C、10 mmol/L α-磷酸甘油)。细胞共分为2组,CON组(不含生长因子)和BMP-2组(1.25 mg/L)。隔天换培养基,MC3T3-E1细胞体外诱导基培养第3、7天收集细胞,提取总RNA(#55-11120,SinoGene Scientific)。分光光度计测定RNA浓度(Biophotometer,Eppendorf),取1 μg总RNA行脱氧核糖核酸酶Ⅰ处理以去除残留基因组DNA(EN0521,Fermentas),然后反转录(Thermo First cDNA Synthesis Kit,#33-20102,Sinogene Scientific)。ALP、BMP-2、OCN、OPN序列参照GenBank数据库(表1),qPCR反应体系按照10 μL 2×SG PCR MasterMix(#33-10201,SinoGene Scientific),引物 0.4 μL(5 μmol/L),1 μL cDNA和8.2 μL ddH2O进行配置,在定量PCR仪上进行反应(Applied Biosystems ABI Step One PLUS)。反应程序为预变性:95 ℃ 10 min;95 ℃ 30 s,61 ℃ 31 s,40个循环。按照仪器默认熔解程序(95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s)验证反应的特异性。内参基因同时检测,用2-ΔΔCt方法进行数据分析。

表1 引物信息
ALP, alkaline phosphatase;BMP-2, bone morphogenetic protein 2;OCN, osteocalcin;OPN,osteopontin.
1.9 统计学方法
采用Graph Pad Prism 4软件进行统计分析,所有实验均进行了3次独立操作。采用ANOVA检验对数据进行统计分析,两两比较采用双尾t检验,3组或3组以上比较采用Turkey-Kramer 检验。P<0.05为差异有统计学意义。
2 结果
2.1 FT-IR分析

a,CS material; b, CS microspheres; c, BMP-2; d, CS/BMP-2 microspheres.
图2 缓释材料的红外图谱
Figure2 Fourier transform infrared of materials
2.2 材料形貌观察
CS/BMP-2微球的形状及表面形态如图3所示,图3A和B分别表示在不同放大倍数下观察的CS/BMP-2微球。利用乳化交联法制备的微球呈现出很好的球形,整个球体表面光滑,应用扫描电镜测量所制备微球的平均直径为5.982 μm。
从图4A中可以看出,采用扫描电镜观察所制备的CBB多孔支架材料的内部具有明显的多孔结构,孔径约为300 pm至500 μm,且具有一定的定向性。大孔之间通过小孔连接,具有较好的连通性。当负载微球后,由于胶原包裹到微球并使其粘附在CBB多孔支架上,使得CBB的孔径得以填充,从图4B中可以看出复合缓释体的孔隙率明显减小,孔径为50~70 μm,说明CBB支架成功负载了CS微球。
2.3 包载率和包封率测定
CS/BMP-2微球的包载率和包封率如表2所示,随着BMP-2含量的增加,CS/BMP-2的包载率增加,但是包封率却在下降,这说明BMP-2能被成功包载于微球中。
2.4 CS/BMP-2微球的体外缓释实验
合成的CS/BMP-2微球中,BMP-2的含量约为(1.80±0.17) mg/g。采用动态浸泡的方法检测第1、3、5、7、10、14和21天缓释液中BMP-2的含量,BMP-2的释放速度随着时间的延长逐渐下降,第1天测得的缓释液中BMP-2的含量达15%,呈现突释效应,第21天测得的缓释液中BMP-2的浓度为(239.1±20.0) mg/L。缓释21天累积释放的BMP-2含量约占54%,释放的BMP-2总量中,最初7 d释放的约占37%(图5)。
图3 微球的扫描电镜图片(A,×16 000;B,×40 000)
Figure 3 Scanning electron microscope of microspheres (A, ×16 000;B, ×40 000)
2.5 细胞增殖检测结果
为了评价该缓释系统的体外生物相容性,本实验采用CCK-8法测量不同成骨细胞的增殖活性(图6)。总体来说,随着共培养的时间由1 d增加到14 d,实验组和对照组中的成骨细胞总量都有所增加,可见3组中成骨细胞均处于增殖状态,细胞-支架复合物培养14 d后,大量的细胞粘附于材料孔隙中增殖生长,细胞生长密集。随着BMP-2浓度的增加,MC3T3-E1细胞增殖速度加快,细胞分界不清,细胞相互融合成片状,细胞与材料结合较紧密,有大量胶原分泌,说明该缓释体系有利于小鼠前成骨细胞MC3T3-E1的增殖。同样,图7数据也可以看出以上规律,在第14天,1.25 mg/L BMP-2组细胞数量明显多于对照组和1 mg/L BMP-2组,但对照组和1 mg/L BMP-2组的数据却没有很明显的优劣趋势。
A, unload microspheres; B, load microspheres.
图4 小牛松质骨支架的扫描电镜图片(×400)
Figure4 Scanning electron microscopeof ceramic bovine bone(×400)
图5 CS/BMP-2微球中BMP-2体外累积释放曲线 图6 缓释体系对MC3T3-E1细胞增殖影响 图7 缓释体系在第1、3、7和14天的细胞增殖数量
Figure5 Cumulative release profiles of BMP-2 from CS/BMP-2 Figure 6 The MC3T3-E1 cell proliferation of materials
Figure7 Adherent cell numbers on different mediums after culturing for 1st, 3rd, 7th and 14th day
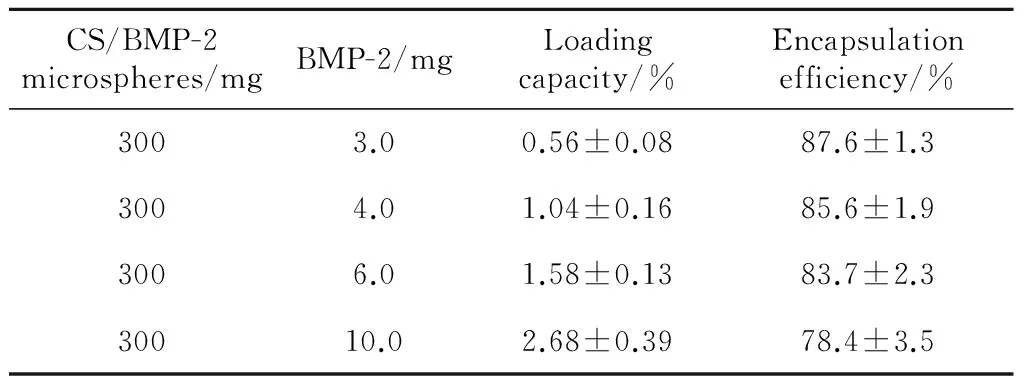
表2 BMP-2剂量对CS/BMP-2微球的包载率和包封率的影响
2.6 Real-time PCR结果
Real-time PCR结果显示,4种基因在BMP-2处理组出现上调趋势,如图8所示,经1.25 mg/L BMP-2处理3 d的MC3T3-E1细胞的ALP表达明显高于对照组,MC3T3-E1细胞在第7天OCN表达明显高于对照组,此外,基因OPN和BMP-2的表达在第3、7天与对照组相比均显著增加。试验结果表明,共培养3 d后,MC3T3-E1细胞发生了明显的形态变化,由梭形转变为多角形,表现出明显的成骨分化趋势。ALP活性检测显示,BMP-2诱导组ALP较非诱导组明显增加,OCN、OPN检测也提示BMP-2诱导组较对照组有明显增加,进一步说明BMP-2在体外促进了MC3T3-E1细胞向成骨方向分化。
3 讨论
羟基磷灰石-磷酸三钙(hydroxyapatite-tricalcium phosphate,HA-TCP)双相陶瓷是骨组织工程中广泛应用的钙磷生物支架材料[10-13],本研究采用经高温脱蛋白后的煅烧骨,其主要成分是精细的HA-TCP晶体,与化学合成的HA-TCP类骨材料相比,有效地保留了松质骨的天然大孔和微孔结构,孔隙率和内表面积分别是HA类骨材料的1.8倍和133倍,具有良好的生物相容性和最接近天然骨的理化性能。CS是一种天然高分子,具有稳定的可降解性、良好的成膜性,并且具有抗菌、止血和促进伤口愈合的功能[14-16]。生物因子借助CS包覆层的梯度设计可以实现一定的释放速率[17],因此,本研究采用CS/BMP-2/CBB系统缓释生物因子,研究BMP-2对小鼠前成骨细胞的影响。
Con, control group. Other abbreviations as in Table 1. *P<0.05, #P<0.01, ▲P<0.001, vs. Con.
图8 Real-time PCR检测MC3T3-E1细胞ALP、OCN、OPN和BMP-2基因相对表达(2)
Figure8 Real-time PCR of MC3T3-E1 on ALP, OCN, OPN and BMP-2 (2)
BMP-2是一种可溶的、低分子跨膜糖蛋白,研究表明BMP-2可以诱导骨髓干细胞分化为成骨细胞,上调ALP活性,上调OCN和Ⅰ型胶原的表达,增加矿化基质,在局部对膜内成骨和软骨内成骨均有诱导作用。
本研究以煅烧骨作为支架材料,使其在成骨过程中起骨引导作用。煅烧骨首先形成一个物理支架,再吸附周围的种子细胞,引导细胞顺此支架爬行、增殖并形成新骨,而骨生长因子在骨修复过程中能诱导间充质细胞分化为成骨细胞,刺激成骨细胞加速增殖。骨改建包括成骨细胞参与的骨形成和破骨细胞介入的骨吸收过程,二者共同构成了一个精细的动态平衡过程。本研究采用乳化交联法制备载药微球,扫描电子显微镜结果表明CS和香草醛之间发生了很好的交联作用,所以微球的球形良好,与红外光谱分析结果一致。
此外,本研究结果显示,各组基因在BMP-2处理后第3和7天均表现出明显上调趋势,ALP、OCN和OPN的基因表达水平在BMP-2组也出现明显的上调趋势,细胞增殖分析同样证实了以上结果,说明BMP-2促进了多种成骨基因水平的表达。外源性BMP-2作为新型骨替代材料缓释的生物因子,在前成骨细胞向成骨分化过程中促进了细胞的分化,说明经高温脱蛋白后的煅烧骨材料可作为骨髓基质干细胞的良好载体,复合生长因子BMP-2后,植入体内的缓释体系能够诱导新生骨组织形成,可作为骨缺损组织工程修复的支架材料。
总之,本研究制备的CS/BMP-2/CBB复合缓释体系,成功负载了生物活性因子BMP-2,且具有很好的缓释效果,体外测试表明该缓释体系有利于小鼠前成骨细胞MC3T3-E1的增殖和分化。
[1]Atala A, Kasper FK, Mikos AG, et al. Engineering complex tissues[J]. Sci Transl Med, 2012, 4(160): 160rv12.
[2]Burns JW. Biology takes centre stage[J]. Nat Mater, 2009, 8(6): 441-443.
[3]Kumar S, Wan C, Ramaswamy G, et al. Mesenchymal stem cells expressing osteogenic and angiogenic factors synergistically enhance bone formation in a mouse model of segmental bone defect[J]. Mol Ther, 2010, 18(5): 1026-1034.
[4]Raula J, Thielmann F, Naderi M, et al. Investigations on particle surface characteristicsvs. dispersion behaviour of L-leucine coated carrier-free inhalable powders[J]. Int J Pharm, 2010, 385(1-2): 79-85.
[5]Wang MB, Feng QL, Niu XF,et al. A sphere-in sphere structure for improving protein-loading poly (lactide-co-glycolide)microspheres[J]. Polym Degrad Stab, 2010, 95(1): 6-13.
[6]Bessa PC, Balmayor ER, Azevedo HS, et al. Silk fibroin micro-particles as carriers for delivery of human recombinant BMPs. Physical characterization and drug release[J]. J Tissue Eng Regen Med, 2010, 4(5): 349-355.
[7]Shi K, Jiang YB, Zhang MN, et al. Tocopheryl succinate-based lipid nanospheres for paclitaxel delivery: Preparation, characters, andinvitrorelease kinetics[J]. Drug Deliv, 2010, 17(1): 1-10.
[8]Bostman O. Osteoarthritis of the ankle after foreign k-body reaction to absorbable pins and screws: At three-to nine-year follow-up study[J]. J Bone Joint Surg Br, 1998, 80(2): 333-338.
[9]Kleiner LW, Wright JC, Wang Y, et al. Evolution of implantable and insertable drug delivery systems[J]. J Control Release, 2014, 181(1): 1-10.
[10]Franca R, Samani TD, Bayade G. Nanoscale surface characterization of biphasic calcium phosphate, with comparisons to calcium hydroxyapatite and β-tricalcium phosphate bioceramics[J]. J Colloid Interface Sci, 2014, 420(3): 182-188.
[11]Kim DH, Chun HH, Ju DL, et al. Evaluation of phase transformation behavior in biphasic calcium phosphate with controlled spherical micro-granule architecture[J]. Ceram Int, 2014, 40(4): 5145-5155.
[12]Marefat Seyedlar R, Nodehi A, Atai M, et al. Gelation behavior ofinsituforming gels based on HPMC and biphasic calcium phosphate nanoparticles[J]. Carbohydr Polym, 2014, 99(1): 257-263.
[13]Puértolas JA, Vadillo JL, Sánchez-Salcedo S, et al. Compression behaviour of biphasic calcium phosphate and biphasic calcium phosphate-agarose scaffolds for bone regeneration[J]. Acta Biomater, 2011, 7(2): 841-847.
[14]Lee JS, Sang DB, Venkatesan J, et al.Invivostudy of chitosan-natural nano hydroxyapatite scaffolds for bone tissue regeneration[J]. Int J Biological Macromolecules, 2014, 67(6): 360-366.
[15]Mattioli-Belmonte M, Cometa S, Ferretti C, et al. Characterization and cytocompatibility of an antibiotic/chitosan/cyclodextrins nanocoating on titanium implants[J]. Carbohydr Polym, 2014, 110(18): 173-182.
[16]Lai GJ, Shalumon KT, Chen SH, et al. Composite chitosan/silk fibroin nanofibers for modulation of osteogenic differentiation and proliferation of human mesenchymal stem cells[J]. Carbohydr Polym, 2014(111): 288-297.
[17]Casettari L, Illum L. Chitosan in nasal delivery systems for therapeutic drugs[J]. J Control Release, 2014(190): 189-200.
(2015-06-29 收稿)
(本文编辑:赵 波)
Synthesis and in vitro characterization of chitosan microspheres/ceramic bovine bone composite scaffold
LI Qing1, YU Xin2, ZHOU Gang2, WU Yu-wei3, HU Hong-cheng3, WANG Tong3, TANG Zhi-hui1△
(1. Center of Digital Dentistry,Peking University School and Hospital of Stomatology & National Engineering Laboratory for Digital and Material Technology of Stomatology & Beijing Key Laboratory of Digital Stomatology, Beijing 100081, China; 2. School of Biological Science and Medical Engineering,Beihang University, Beijing 100191, China; 3. The Second Dental Center, Peking University School and Hospital of Stomatology, Beijing 100101, China)
Objective:The chitosan microspheres encapsulated with bone morphogenetic protein-2 (BMP-2) were prepared by the emulsion cross-linking method. Then the chitosan microspheres were loaded in the ceramic bovine bone (CBB) to achieve the drug delivery system. Methods: The chemical structure and surface morphology of the drug delivery system were investigated by Fourier transform infrared spectroscopy (FT-IR) and scanning electron microscope (SEM) observation. Characterization preserved the loading capacity and encapsulation efficiency of the BMP-2. The dynamic immersion method was used to examine theinvitrorelease characteristic of BMP-2. Results: The chitosan microspheres were successfully encapsulated BMP-2 by cross-linking method. The microspheres were micron-sized (5.982 μm) and spherical in shape with smooth surface morphology. From the release experiments, it was found that 5 mg chitosan/BMP-2 soaked for 21 days with a gradual release of BMP-2. The concentration of BMP-2 was (239.1±20.0) mg/L on Day 21. Theinvitroexperiment showed that this novel drug delivery system could accelerate MC3T3-E1 cells proliferation and osteogenic differentiation. Conclusion: The drug delivery system achieves the biological function of BMP-2 and sustaining slow release in bone repair parts. Also it can provide the basis for repair of bone tissue defect treatment and the selection of bone tissue engineering scaffolds.
Chitosan; Microspheres; Drug delivery system; Ceramic bovine bone
首都市民健康项目(z2110005312001)资助Supported by the Capital Public Health Project(z2110005312001)
时间:2016-11-2 9:01:40
http://www.cnki.net/kcms/detail/11.4691.R.20161102.0901.004.html
R737.25
A
1671-167X(2016)06-1043-06
10.3969/j.issn.1671-167X.2016.06.021
△Corresponding author’s e-mail, tang_zhihui@live.cn

