油橄榄鲜果中主要化合物随成熟度的变化
邓俊琳 刘 露 刘 泉 向春蓉 丁春邦 李 天 杨泽身
(四川农业大学生命科学学院1, 雅安 625014) (四川农业大学农学院2, 成都 611130) (凉山州中泽新技术开发有限责任公司3,西昌 615000)
油橄榄鲜果中主要化合物随成熟度的变化
邓俊琳1刘 露1刘 泉2向春蓉1丁春邦1李 天2杨泽身3
(四川农业大学生命科学学院1, 雅安 625014) (四川农业大学农学院2, 成都 611130) (凉山州中泽新技术开发有限责任公司3,西昌 615000)
为阐明油橄榄果实成熟过程中主要化合物的变化,探索最佳成熟度,本试验以不同成熟度的皮瓜尔鲜果为材料,测定其蛋白质、还原糖、粗脂肪、总多酚的含量,以及果油中主要的脂肪酸和角鲨烯的相对含量。结果表明,随着成熟度的增加,蛋白质含量无较大差异,还原糖先降低后略有升高,粗脂肪先升高后趋于平稳,总多酚先降低后趋于平稳;各种脂肪酸相对含量在整个成熟过程中变化不一致;油酸、棕榈酸、亚油酸、亚麻酸、硬脂酸是橄榄油中含量较高的脂肪酸;角鲨烯先升高后降低。利用主成分分析对油橄榄果实品质进行综合评价,第四成熟度为油橄榄果的最佳成熟度。
油橄榄 成熟度 脂肪酸组成 主成分分析
油橄榄(OleaeuropaeaL.)属木犀科木犀榄属常绿小乔木,又名洋橄榄、齐墩果,与油茶、油棕、椰子并称为世界四大木本油料植物。原产于小亚细亚半岛,后经引种大量种植于西班牙、意大利、希腊等地中海国家,在我国主要分布于云南、甘肃、四川、陕西等省份[1]。油橄榄的主产品橄榄油,具有抗氧化、抗菌、抗癌等多种功能,有保健、美容和烹调等诸多用途,享有“液体黄金”、“食用植物油皇后”等美誉[2]。研究表明,橄榄油的优良功效不仅与其脂肪酸组成有关,还与其含有的多酚、色素、甾醇、角鲨烯等生物活性成分有密切联系[3-4]。影响橄榄油中化合物的组成及含量的因素很多,比如遗传因子、气候因子、土壤因子、加工手段、采收时间等[5-6]。Salvador等[7]研究发现,收获时间对橄榄油产量、质量、稳定性、感官特性有重要影响。Dag等[8]提出,油橄榄果中的生育酚、角鲨烯、多酚、甾醇等活性物质及脂肪酸组成随成熟度增加表现出显著差异,但不同品种差异不一定相同。
我国油橄榄产业正处于发展时期,但成熟度对油橄榄果中化合物的影响鲜有报道,本研究测定了不同成熟度皮瓜尔鲜果中蛋白质、还原糖、粗脂肪、总多酚的含量,以及主要的脂肪酸和角鲨烯的相对含量,旨在阐明这些化合物随成熟度的变化情况,以期为油橄榄果的最佳采收期以及合理开发利用提供参考。
1 材料与方法
1.1 材料与仪器
油橄榄鲜果:以生长表现良好的皮瓜尔品种为研究对象(2013年6~10月采自四川西昌的北河油橄榄基地),取6个成熟度的鲜果,成熟度以果皮、果肉色泽区分[7]:果皮青绿为第一成熟度,果皮黄绿为第二成熟度,果皮少半紫为第三成熟度,果皮多半紫为第四成熟度,果皮全紫果肉白色为第五成熟度,果肉少半紫为第六成熟度。去核,液氮辅助研磨至均匀粉末,-80 ℃储存备用。福林酚、DNS试剂:购于成都市科龙化工试剂厂;所用试剂均为分析纯。
UV-1750分光光度计、GCMS-QP2010 Ultra气相色谱-质谱联用仪:日本岛津公司;Kjeltec 8200凯氏定氮仪:丹麦Foss公司;KQ-300GDV恒温数控超声波清洗器:昆山舒美超声仪器有限公司;LGJ-10冷冻干燥机:北京四环科学仪器厂;SOX500脂肪酸测定仪:济南海能仪器有限公司。
1.2 试验方法
1.2.1 蛋白质、还原糖、粗脂肪、总多酚的测定
蛋白质测定:采用凯氏定氮法,参照国标GB 5009.5—2010。取适量鲜果粉末于消化管中,分别加入一颗消煮片(0.5 g CuSO4×5H2O,4.5 g K2SO4),10 mL浓H2SO4,在消化炉上高温(温度为420 ℃)消煮至溶液无色。蒸馏,盐酸滴定。
还原糖测定:采用DNS显色法[9],稍加改动。取鲜果粉末适量加蒸馏水于80 ℃水浴提取2 h,离心,上清液定容,取待测液0.2 mL,加0.8 mL水,摇匀,再加1.5 mL DNS试剂摇匀,静置10 min,沸水浴10 min,流水冷却,540 nm检测吸光值。以葡萄糖质量浓度(μg/mL)为横坐标,吸光值为纵坐标,绘制标准曲线,得回归方程:Y=0.008 3X-0.257 4(R2=0.998 1,线性范围40~200 μg/mL)。
粗脂肪测定:油橄榄鲜果于105 ℃烘至恒重,打碎,以石油醚为提取溶剂,采用索氏提取装置,在85 ℃提取6 h,根据所得油的质量和所取打碎干果质量计算相应的粗脂肪含量。
总多酚测定:采用Folin-Ciocalteu法[10],稍加改动。取适量鲜果粉末加80%甲醇于超声波浸提,离心,上清液定容,取待测液100 μL,加3 mL蒸馏水摇匀,再加0.2 mL福林酚试剂摇匀,约5 min左右后加0.8 mL 10%的碳酸钠溶液混匀,避光反应1 h,于765 nm检测吸光值。以没食子酸质量浓度(μg/mL)为横坐标,吸光值为纵坐标,绘制标准曲线,得回归方程:Y=0.002 9X+0.009 4(R2=0.998 9,线性范围50~250 μg/mL)。
1.2.2 橄榄油中脂肪酸及角鲨烯百分含量测定
油脂的提取:称取冷冻干燥的粉末5 g,加入适量石油醚,于4 ℃浸提24 h,除去石油醚,收集油脂。
甲酯化:用移液器移取50 μL 橄榄油于试管中,加入4.5 mL正己烷溶解,再加入4.5 mL 1mol/L的氢氧化钾的甲醇溶液,混匀后静置10 min,待分层,取上清液,无水碳酸钠除水,过滤,气相色谱法测定。
气相色谱条件:12423 Rtx-Wax(30 m×0.25 mm×0.25 μm)色谱柱;载气为氦气;FID检测器;进样口温度:245 ℃;升温程序:初始温度60 ℃,保持5 min;15 ℃/min 升至150 ℃,保持1 min;3 ℃/min升至230 ℃,保持7 min;分流比20∶1;进样量1 μL。
质谱条件:EI离子源,电子能量70 eV; 溶剂延迟3 min; 离子源温度 230 ℃; 质量扫描范围(m/z) 35~650 u。
组成成分以峰面积归一法计算。
1.3 数据处理
所有数据均为3次重复试验的平均值,应运Microsoft Excel 2010、SPSS 20、Origin 9.0对数据进行处理、分析和作图。
2 结果与讨论
2.1 蛋白质、还原糖、粗脂肪、总多酚含量
由图1可知,在整个成熟过程中,蛋白质含量均保持在稳定水平,平均含量2.249 mg/g。还原糖含量呈现先下降后上升的变化趋势,含量最高为第一成熟度46.086 mg/g,第一成熟度到第二成熟度含量快速降低,之后减速变缓,第四成熟度达最低为13.209 mg/g,之后含量又开始增加。粗脂肪含量随着成熟度增加先快速上升,从第二成熟度开始增速减缓,在第六成熟度稍有下降,最高为第五成熟度69.359%,最低为第一成熟度3.559%。由此推测,还原糖可能参与了果实成熟初期油脂的合成,导致大量还原糖的消耗,而成熟后期,油脂合成减缓,还原糖消耗速率小于合成速率使总量增加。Cecchi等[11]对粗脂肪和还原糖之间的关系也有相近的报道。
油橄榄中主要的多酚类化合物为橄榄苦甙、羟基酪醇、芦丁、木犀草素、毛蕊花糖苷等[12]。多酚类化合物对橄榄油的风味、稳定性、活性功能有重要影响,因此被当作评价最佳采收期的重要指标之一[13]。由图1可知,总多酚含量先下降后趋于平稳,这一结果与Morelló等[14]的一致。磷酸烯醇式丙酮酸和赤藓糖-4-磷酸是大部分酚类化合物的合成前体[15],而这些前体物质又与糖代谢、脂代谢和氨基酸代谢有关,这可能是总多酚含量在油橄榄成熟过程中减少的主要原因。

图1 油橄榄鲜果中还原糖、蛋白质、粗脂肪、总多酚含量随成熟度的变化
2.2 脂肪酸组成及角鲨烯相对含量
由表1可知,橄榄油中油酸含量最高,其次为棕榈酸、亚油酸、亚麻酸、硬脂酸、角鲨烯,花生酸、花生烯酸、二十二烷酸、二十四烷酸含量较低。油酸与棕榈酸含量均为先下降后上升;亚油酸在整个成熟过程中处于波动性变化;亚麻酸、二十二烷酸、二十四烷酸均为先下降后上升再下降;棕榈油酸、硬脂酸、花生酸、花生烯酸含量均为先上升后下降。变化幅度最大的为油酸(7.05%),其中第一成熟度质量分数最高(64.2%),第四成熟度最低(57.15%);变化幅度最小的为二十二烷酸(0.18%),第四成熟度质量分数最高(0.45%),第六成熟度最低(0.27%)。此外,花生酸、花生烯酸、二十四烷酸质量分数变化幅度均小于1%,棕榈酸、棕榈油酸、硬脂酸等质量分数变化幅度均大于3%。
角鲨烯是一种链状三萜化合物,是胆固醇类生物合成的中间产物,为皮肤表面多不饱和脂质的主要成分,有抗衰老、抗肿瘤等功效[16]。角鲨烯在植物中分布较广,但含量较低,研究表明角鲨烯是影响橄榄油品质的重要化合物[17]。本试验中,随着成熟度增加,角鲨烯含量先增加后降低(见表1),这与Sakouhi等[18]的研究结果一致。这可能与角鲨烯参与固醇和三萜类化合物的生物合成有关[19]。

表1 不同成熟度油橄榄果油的主要脂肪酸和角鲨烯质量分数/%
2.3 主成分分析
将15个单项指标分别命名为V1、V2、V3……V15,利用SPSS软件进行主成分分析,得到主成分个数及累积方差贡献率,如表2所示。第一主成分的贡献率为63.724%,第二主成分的贡献率为22.283%,第三主成分的贡献率为7.905%,前3个主成分的累积方差贡献率达到93.912%,说明这3个主成分能够代表15个指标的绝大部分信息。
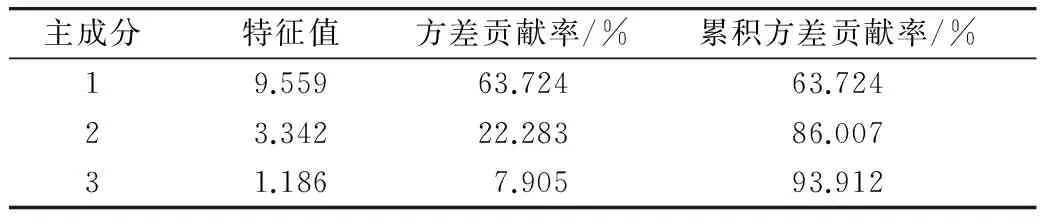
表2 主成分累积方差贡献率
注:V1,蛋白质;V2,还原糖;V3,粗脂肪;V4,总多酚;V5,棕榈酸;V6,棕榈油酸;V7,硬脂酸;V8,油酸;V9,亚油酸;V10,亚麻酸;V11,花生酸;V12,花生烯酸;V13,二十二烷酸;V14,二十四烷酸;V15,角鲨烯。
15个指标的主成分分析散点图如图2所示。由图可知,第一主成分上的主要物质是还原糖、粗脂肪、总多酚、棕榈酸、棕榈油酸、硬脂酸、油酸、花生酸、花生烯酸、角鲨烯,第二主成分上的主要物质是亚麻酸、二十二烷酸、二十四烷酸,第三主成分上的主要物质是蛋白质和亚油酸。第一主成分方差贡献率最大,所以第一主成分上的指标对油橄榄果实品质影响较大。

图2 油橄榄果中主要化合物的主成分分析
根据主成分的特征向量和特征值,计算主成分得分,得到不同成熟度在主成分分析图上的分布,如图3所示。第一、三、四成熟度油橄榄主要化合物主要存在于第一主成分,第二、五成熟度的主要化合物主要存在于第一、二主成分,第六成熟度主要化合物主要存在于第二主成分。第一成熟度与其他成熟度的油橄榄在第一主成分分析图上距离较远,说明油橄榄经过不同阶段的成熟后,化合物种类和含量产生较大变化。
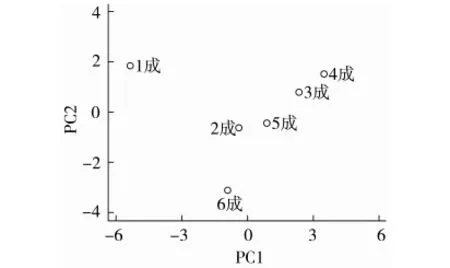
图3 不同成熟度油橄榄在主成分分析图上的分布
依据每个成熟度3个主成分得分排序(表3),综合主成分分值越高,综合品质越好,得分最高为第四成熟度,因此选择第四成熟度为油橄榄果实的最佳成熟度,与该成熟度果实品质关联度较大的物质是还原糖、粗脂肪、总多酚、棕榈酸、棕榈油酸、硬脂酸、油酸、花生酸、花生烯酸、角鲨烯、亚麻酸等。
3 结论
在整个成熟过程中,蛋白质含量较稳定;还原糖先降低后上升,粗脂肪先快速增长后趋于平稳,总多酚先下降后趋于平稳。橄榄油中含量较高的脂肪酸为油酸、棕榈酸、亚油酸、亚麻酸、硬脂酸等。各种脂肪酸变化趋势并不完全一致;变化幅度最大为油酸,变化幅度最小为二十二烷酸;角鲨烯质量分数先升高后降低,质量分数最高时为2.71%,最低时为0.69%。对15个指标进行主成分分析,结果表明还原糖、粗脂肪、总多酚、棕榈酸、棕榈油酸、硬脂酸、油酸、花生酸、花生烯酸、角鲨烯对油橄榄果实的成熟影响较大,依据主成分得分综合排序,第四成熟度为皮瓜尔的最佳成熟度。不同品种可能有不同的最佳成熟度,而关于最佳采收期,应对成熟度、降雨、温度等综合评价确定。对于我国栽种的不同品种的油橄榄,其最佳成熟度有待进一步研究。
[1]邓明全, 俞宁. 油橄榄引种栽培技术[M]. 北京: 中国农业出版社, 2011: 10-16
Deng Mingquan, Yu Ning. Olive cultivation techniques[M]. Beijing:China Agriculture Press, 2011:10-16
[2]于长青. 橄榄油的化学组成及对人体的营养价值[J]. 食品科技, 2000(2): 59-60
Yu Changqing. Chemical composition of olive of olive oil and its nutrient value[J]. Food Science and Technology, 2000(2): 59-60
[3]Lazzez A, Perri E, Caravita M A, et al. Influence of olive maturity stage and geographical origin on some minor components in virgin olive oil of the Chemlali variety[J]. Journal of Agricultural and Food Chemistry, 2008, 56(3): 982-988
[5]Baccouri O, Guerfel M, Baccouri B, et al. Chemical composition and oxidative stability of Tunisian monovarietal virgin olive oils with regard to fruit ripening[J]. Food Chemistry, 2008, 109(4): 743-754
[6]Abaza L, Taamalli W, Ben Temime S, et al. Natural antioxidant composition as correlated to stability of some Tunisian virgin olive oils[J]. Rivista Italiana delle Sostanze Grasse, 2005, 82(1): 12-18
[7]Salvador M D, Aranda F, Fregapane G. Influence of fruit ripening on ‘Cornicabra’ virgin olive oil quality A study of four successive crop seasons[J]. Food Chemistry, 2001, 73(1): 45-53
[8]Dag A, Kerem Z, Yogev N, et al. Influence of time of harvest and maturity index on olive oil yield and quality[J]. Scientia Horticulturae, 2011, 127(3): 358-366
[9]孙文, 巢志茂, 王淳, 等. 不同挂果期瓜蒌的糖分与质量相关性研究[J]. 中国中医药信息杂志, 2013, 20(4):57-59
Sun Wen, Chao Zhimao, Wang chun, et al. Correlation between sugar and quality of trichosanthis fructus with different fruit bearing periods[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2013, 20(4): 57-59
[10]何志勇, 夏文水. Folin-Ciocalteu 比色法测定橄榄中多酚含量的研究[J]. 林产化学与工业, 2008 (4): 15-18
He Zhiyong, Xia Wenshui. Study on determination of polyphenol content in Canarium album (Lour) rauesch. by Folin-Ciocalteu colorimetry[J]. Chemistry and Industry of Forest Products, 2008 (4): 15-18
[11]Cecchi L, Migliorini M, Cherubini C, et al. Phenolic profiles, oil amount and sugar content during olive ripening of three typical Tuscan cultivars to detect the best harvesting time for oil production[J]. Food Research International, 2013, 54(2): 1876-1884
[13]Gutiérrez F, Jimenez B, Ruiz A, et al. Effect of olive ripeness on the oxidative stability of virgin olive oil extracted from the varieties Picual and Hojiblanca and on the different components involved[J]. Journal of Agricultural and Food Chemistry, 1999, 47(1): 121-127
[14]Morelló J R, Romero M P, Motilva M J. Effect of the maturation process of the olive fruit on the phenolic fraction of drupes and oils from Arbequina, Farga, and Morrut cultivars[J]. Journal of Agricultural and Food Chemistry, 2004, 52(19): 6002-6009
[15]Ho L C. Metabolism and compartmentation of imported sugars in sink organs in relation to sink strength[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1988, 39(1): 355-378
[16]Huang Z R, Lin Y K, Fang J Y. Biological and pharmacological activities of squalene and related compounds: potential uses in cosmetic dermatology[J]. Molecules, 2009, 14(1): 540-554
[17]Fernández-Cuesta A, León L, Velasco L, et al. Changes in squalene and sterols associated with olive maturation[J]. Food Research International, 2013, 54(2): 1885-1889
[18]Sakouhi F, Herchi W, Sbei K, et al. Characterisation and accumulation of squalene and n-alkanes in developing TunisianOleaeuropaeaL. fruits[J]. International Journal of Food Science and Technology, 2011, 46(11): 2281-2286
[19]Furubayashi M, Li L, Katabami A, et al. Directed evolution of squalene synthase for dehydrosqualene biosynthesis[J]. Febs Letters, 2014, 588(18): 3375-3381.
Effect of Ripening Stages on the Main Compounds of Olive Fresh Fruit
Deng Junlin1Liu Lu1Liu Quan2Xiang Chunrong1Ding Chunbang1Li Tian2Yang Zeshen3
(College of Life Sciences, Sichuan Agricultural University1,Ya′an 625014)(College of Agronomy, Sichuan Agricultural University2, Chengdu 611130)(Liangshan Zhongze New Tech Development Co.Ltd3, Xichang 615000)
The aim of this paper was to study the effect of the ripening stage on the main components, which determain oil quality, as well as to explore an optimum harvesting time for olives. The contents of protein, reducing sugar, crude fat, total polyphenols, main fatty acids and squalene in different ripening stage of Picual fresh fruits were studied. The result showed that, with increasing of ripening stages, the protein contents had slight fluctuated. The contents of reducing sugar had slight increased after an intensive decline, crude oils had stabilized after a rapid increase and total polyphenols had stabilized after an initial decline. The main fatty acids showed inconsistent changes in all ripening stage. Olive oil was mainly composed of oleic acid, palmitic acid, linoleic acid and stearic acid. Squalene declined after initial increase. The principal component analysis of the comprehensive quality indicated that fourth ripening stages were the best maturity for olives.
olive, ripening stage, fatty acid composition, principal component analysis
S565.7
A
1003-0174(2016)10-0073-05
四川省科技厅科技支撑计划(2013NZ0047)
2015-01-26
邓俊琳,女,1988年出生,硕士,油橄榄优良品种选育
丁春邦,女,1966年出生,教授,种质资源研究

