混合三模板分子印迹固相萃取柱应用于粮谷中三唑类农药的检测
高 林 李亚丽 刘 博 高文惠
(河北科技大学生物科学与工程学院1,石家庄 050000) (河北省发酵工程技术研究中心2,石家庄 050000) (张家口卷烟厂有限责任公司3,张家口 075000)
混合三模板分子印迹固相萃取柱应用于粮谷中三唑类农药的检测
高 林1,2李亚丽1,2刘 博1,3高文惠1,2
(河北科技大学生物科学与工程学院1,石家庄 050000) (河北省发酵工程技术研究中心2,石家庄 050000) (张家口卷烟厂有限责任公司3,张家口 075000)
建立了采用混合三模板分子印迹固相萃取-高效液相色谱法分离检测粮谷样品中3种三唑类杀菌剂残留的方法。以联苯三唑醇、腈菌唑、烯唑醇为混合模板分子,采用本体聚合法合成了具有高选择性的混合三模板分子印迹聚合物,以该聚合物为填料制备混合三模板分子印迹固相萃取柱,并结合高效液相色谱法检测粮谷中联苯三唑醇、腈菌唑、烯唑醇残留。结果表明,以20 mL水为淋洗剂,15 mL甲醇为洗脱剂,并在最佳色谱条件下,联苯三唑醇、腈菌唑、烯唑醇的平均回收率分别为74.0%~82.4%、79.0%~86.2%、77.5%~85.1%,相对标准偏差(RSD)≤4.4%,该混合三模板分子印迹聚合物对3种杀菌剂具有特异性吸附能力,该分析方法可用于样品中三唑类杀菌剂残留的分离检测。
粮谷 三唑类农药 混合模板 分子印迹固相萃取柱 高效液相色谱法
联苯三唑醇、腈菌唑和烯唑醇是保护、广谱、内吸性三唑类杀菌剂,被用于防治植物病害,对病源微生物有杀死作用或抑制生长作用,但同时又不妨碍植物的正常生长,同时能够起到治疗作用[1]。近些年三唑类杀菌剂被广泛应用于农作物的种植过程中,但是大量或不合理地使用杀菌剂必然会造成食品、饲料、环境等农药残留超标,从而对人体、动物和环境造成危害。因此,开展从复杂基质中高选择性分离净化三唑类杀菌剂的前处理技术研究和开发样品中三唑类杀菌剂的检测方法具有重要意义。目前,三唑类杀菌剂的检测方法有高效液相色谱法[2-3]、气相色谱法[4-5]等,样品前处理主要采用传统的固相萃取小柱,但该小柱选择性低、净化效果不佳,无法避免复杂基质中杂质的干扰。
分子印迹技术(Molecularly imprinted technology, MIT)多用于合成具有识别特性的印迹聚合物,目标分子与功能单体通过共价键或非共价键结合,反应完全后洗脱目标分子,从而形成有固定空穴大小和形状的高度交联的聚合物,该聚合物具有专一识别性强、可再生等优势,被广泛应用于固相萃取、传感器技术等领域[6-8]。近些年分子印迹聚合物(Molecularly imprinted Polymer,MIP)作为一种特异性强的填料被应用于固相萃取技术受到广泛关注[9-13],因其具有特异选择性强、可重复利用、简化样品前处理、净化效果好等优点,在医药、食品、化工、环境等领域得到广泛应用。
但是在分子印迹固相萃取技术的研究与应用上,目前大多局限于研究单一模板分子印迹技术,不能实现多种物质同时分离、富集。本试验在前期研究工作的基础上,以联苯三唑醇、腈菌唑和烯唑醇为混合模板物质合成混合模板分子印迹聚合物,以该聚合物作为固相萃取剂,制备同时能富集3种杀菌剂的混合三模板分子印迹固相萃取柱,并对实际样品净化处理,采用高效液相色谱法进行测定。
1 材料与方法
1.1 试剂及仪器
1.1.1 仪器
LC-20A高效液相色谱仪:日本岛津公司;TU-1810紫外可见分光光度计:北京普析通用有限责任公司;SHZ-82A型恒温水浴振荡器:江苏省太仓医疗器械厂;ASE-12固相萃取仪:天津奥特赛恩斯仪器有限公司。
1.1.2 试剂
联苯三唑醇(纯度为99%):上海酶联生物科技有限公司;腈菌唑(纯度为97.7%)、烯唑醇(纯度为98%):北京金宝在线科技有限公司;乙腈(分析纯):天津市永大化学试剂有限公司;甲醇(色谱纯):天津市光复精细化工研究所;α-甲基丙烯酸酯(MAA,分析纯):天津市化学试剂一厂;乙二醇二甲基丙烯酸酯(EDMA,分析纯):抚顺安信化学有限公司;偶氮二异丁腈(AIBN,化学纯):天津市大茂化学试剂厂。
200 μg/mL混合标准储备液的配制:腈菌唑、联苯三唑醇和烯唑醇各取0.010 0 g,用乙腈溶解,置于50 mL容量瓶中定容。
大米、玉米、黄豆均购自市场。
1.2 不同比例的单体与模板物质的紫外光谱测定
取1 mmol/L模板物质的乙腈溶液100 μL于10 mL比色管中,分别加入2 mmol/L MAA的乙腈溶液,使模板物质与MAA浓度比分别为1∶0、1∶2、1∶4、1∶6、1∶8、1∶10,乙腈定容,超声10 min后,在2 ℃环境下静置14 h,以不含模板物质的MAA的乙腈溶液为参比溶液,在波长190~300 nm之间进行紫外光谱扫描。
1.3 预组装体系差示紫外光谱测定
取1 mmol/L模板物质的乙腈溶液100 μL于10 mL比色管中,分别加入2 mmol/L MAA的乙腈溶液,使模板物质与MAA浓度比分别为1∶2、1∶4、1∶6、1∶8、1∶10和1∶7、1∶9、1∶10、1∶11、1∶12、1∶13,乙腈定容,超声10 min后,置于2 ℃环境中静置14 h,以模板物质标准溶液作为参比,于波长190~300 nm进行紫外光谱扫描。
1.4 混合三模板物质分子印迹聚合物的制备
将0.05 mmol烯唑醇、0.075 mmol联苯三唑醇及0.075 mmol腈菌唑和1.2 mmol α-甲基丙烯酸酯(MAA)放入50 mL的安瓿瓶中,加15 mL乙腈,超声1 h,再加交联剂EDMA 8 mmol和引发剂AIBN 0.02 g。然后超声30 min,混匀后通入N2脱氧15 min,再抽真空1 min后密封,在55 ℃的恒温水浴中静置24 h,得块状固体分子印迹聚合物(MIP)。经研磨、粉碎,过200目筛,再用水洗涤沉降3次,除去过细粉末。将最终得到的MIP颗粒用甲醇-乙酸溶液(体积比95∶5)洗脱至无模板物质,最后用甲醇浸泡1 h除去残留的乙酸,洗脱后的聚合物放入真空干燥器中(45 ℃)干燥6 h,得到混合模板分子印迹聚合物(MIPs)。
1.5 混合三模板分子印迹固相萃取柱的制备
称取步骤1.4所得的混合模板分子印迹聚合物适量,置于水中匀浆,装入内径为1.5 cm的固相萃取空柱内,用固相萃取装置将匀浆液抽出后,先用甲醇润湿柱子,再用水淋洗柱子,最后在上端再加上少许脱脂棉,轻轻按压使柱子填充紧实备用;即得混合三模板分子印迹固相萃取柱。
1.6 色谱条件
色谱柱:Promosil C18(4.6 mm×150 mm,5 μm),检测波长210 nm,流动相:甲醇-水(85∶15,V/V),流速1 mL/min,柱温为25 ℃。
1.7 样品前处理
样品的提取:准确称取5 g样品,粉碎,用20 mL乙腈提取(提取2次,每次10 mL),超声15 min,于4 000 r/min离心10 min,合并2次上清液,氮吹后定容至10 mL。
样品的净化:分子印迹固相萃取柱使用前先用10 mL甲醇过柱,然后用水清洗至无甲醇。加入1 mL样品提取液,再用水淋洗柱子,最后用10 mL甲醇洗脱模板,洗脱液供高效液相色谱仪检测。
2 结果与讨论
2.1 不同比例的功能单体与模板物质对预组装体系紫外光谱的影响
图1是不同比例的功能单体与烯唑醇对预组装体系紫外光谱的影响。由图1a可知,最大吸收波长发生了红移,这是氢键对烯唑醇的三唑环共轭双键的π电子吸收能量跃迁到π*共轭反键轨道引起的。说明烯唑醇中N原子与MAA分子中-COOH形成了氢键。
吸光值变化趋于平缓时,说明体系在平缓区域所对应的混合物浓度比在此范围内趋于稳定,此时进入平缓区的转折点所对应的混合物比例是最佳配比。从图1 b可知烯唑醇与MAA在浓度比为1∶6(图中对应点为4’)之后吸光值和波长变化趋于平缓。可以推断浓度比为烯唑醇∶MAA=1∶6为聚合时最佳的配比。
按照选择烯唑醇与MAA最佳比例的分析方法,可得联苯三唑醇及腈菌唑与MAA最佳浓度比均为1∶4。因此,制备此分子印迹聚合物应选择烯唑醇:联苯三唑醇:腈菌唑:MAA的摩尔比为1∶1.5∶1.5∶6。
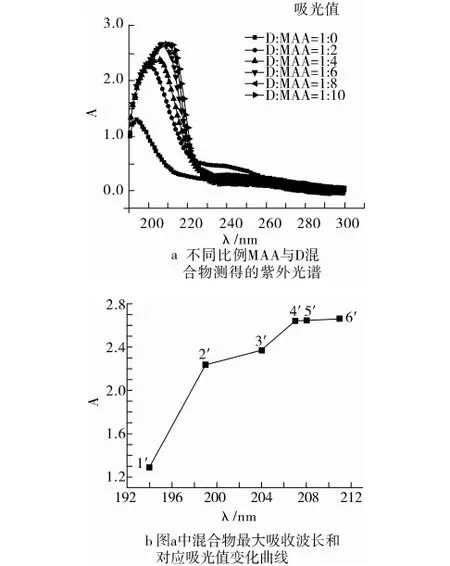
注:a图右上角的标注为浓度比,D为烯唑醇;1′~6′分别是D与MAA浓度比1∶0~1∶10。
图1 不同比例功能单体和模板物质对预组装体系紫外光谱的影响
2.2 固相萃取柱装柱高度的选择
试验比较了混合模板分子印迹固相萃取柱装柱高度分别为1、2和3 cm时,萃取柱对样品的净化和吸附能力的影响。当装柱过高,即装柱高度为3 cm或大于3 cm时,由于柱压增加,需要很高的压力进行淋洗和洗脱,这样既耗费过多溶剂,又不利于操作。填柱高度为1 cm时,模板物质不能全部被吸附在萃取柱上,即柱吸附容量偏低。当装柱高度为2 cm时,与3 cm柱高相比,吸附、净化效果相当,且这时柱压低,操作方便快速,因此选择装柱高度为2 cm。
2.3 固相萃取柱柱压的选择
试验考察了柱压分别为10、20、30、45和55 kPa时对样品净化效果的影响。结果显示,在10、20、30和45 kPa柱压下,样品的净化效果相同,而55 kPa柱压下,过液速度大于目标物在聚合物中的解析速度,当洗脱剂全部通过萃取柱后,目标物质在聚合物中仍有残留,导致洗脱效果差。因此为了节省前处理时间提高效率,选择45 kPa柱压下进行样品前处理。
2.4 淋洗剂及其用量的选择
试验在其他条件相同且非饱和上样的情况下进行淋洗,考察了氯仿、乙腈和水3种淋洗剂的淋洗效果,按照1.7色谱条件测定。结果表明,乙腈和氯仿2种有机溶液均能将模板物质淋洗下来,所以可以作为洗脱剂的备选溶剂,不适合作为淋洗剂。而水作为淋洗剂不仅可将杂质洗去,而且不会将模板物质淋洗下来。故本试验选择水作为淋洗剂。
试验考察了不同用量的淋洗剂对样品中杂质的淋洗效果。将1 mL样品提取液加入分子印迹固相萃取柱装置,分别用5、10、15、20和25 mL的去离子水进行淋洗,收集各淋洗液,用高效液相色谱仪检测。结果为淋洗液用量是20 mL时,即可将样品中杂质淋洗干净。
2.5 洗脱剂及其用量的选择
试验在其他条件相同且非饱和上样的情况下进行洗脱,考察了甲醇、乙腈和氯仿3种洗脱剂,按照1.7色谱条件测定。结果显示,甲醇的洗脱能力强于乙腈和氯仿的洗脱能力。结合淋洗剂选择的结果,并兼顾溶剂毒性和价格因素,本试验选择甲醇为洗脱剂。
试验考察了不同用量的洗脱剂对样品中目标物质萃取效果的影响。将1 mL一定浓度的混合标准溶液加入分子印迹固相萃取柱装置,进行饱和上样,分别用5、10、15、20和25 mL的甲醇进行洗脱,收集各洗脱液用高效液相色谱仪进行检测。结果表明,当洗脱剂用量大于15 mL时,已经不能检测到目标物,说明15 mL洗脱剂可以完全将目标物质洗脱下来,并且不会造成洗脱剂的浪费,故最佳洗脱剂用量为15 mL。
2.6 3种杀菌剂色谱条件的确定
2.6.1 检测波长的选择
不同物质在不同检测波长下的响应值是不一样的,通过紫外可见分光光度计对联苯三唑醇、腈菌唑和烯唑醇进行紫外光谱扫描,以确定液相色谱的检测波长,如图2所示。
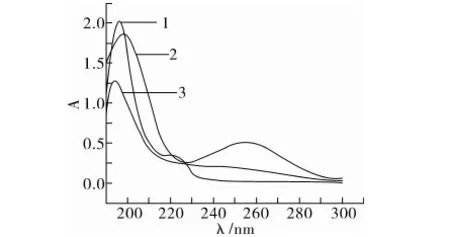
注:1 腈菌唑,2 联苯三唑醇,3 烯唑醇。
图2 腈菌唑、联苯三唑醇和烯唑醇紫外光谱图
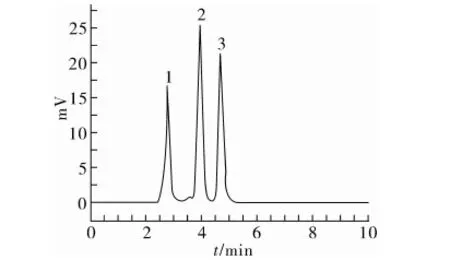
由图2可知,腈菌唑的最大吸收波长为196 nm;联苯三唑醇有2个吸收峰,分别为199 nm和255 nm;烯唑醇的最大吸收波长为194 nm。综合考虑被测物的最大吸收值以及溶剂本身吸收情况,确定210 nm作为最佳检测波长。
2.6.2 流动相配比的选择
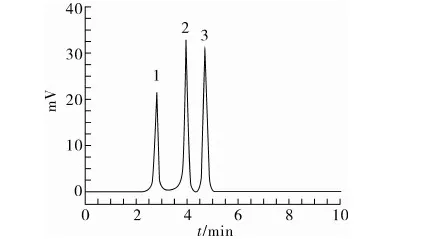
本试验以甲醇-水为流动相,不同的体积比直接影响到3种杀菌剂的分离效果。试验考察了甲醇-水体积比分别为100∶0、90∶10、85∶15、80∶20、75∶25时3种物质的分离情况。由图3所示,当流动相比例为85∶15时,3种被测物不仅能很好分离,且分析时间较短。故选用甲醇与水的体积比为85∶15作为最佳流动相配比。
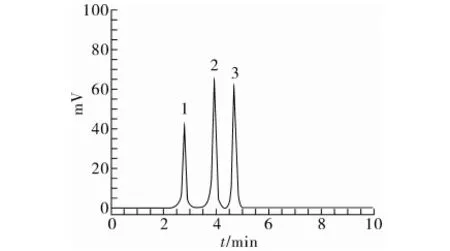
注:1 腈菌唑,2 联苯三唑醇,3 烯唑醇。
图3 3种杀菌剂的色谱分离图(甲醇-水体积比为85∶15)
2.7 线性关系与方法检测限
将联苯三唑醇、腈菌唑和烯唑醇分别配制成质量浓度为100、50、20、10、5、2、1、0.6、0.3、0.1、0.05 μg/mL的一系列标准溶液,绘制标准曲线。其线性关系和检测限如表1所示。3种物质在0.3~100 μg/mL范围内呈现良好线性关系(R≥0.999 2),检测限在0.1~0.2 μg/mL之间。
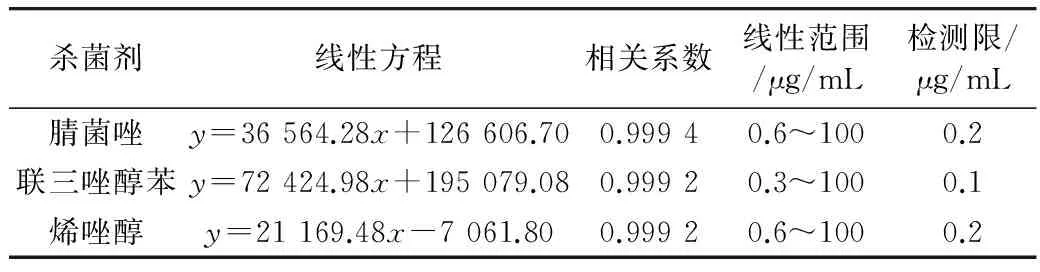
表1 腈菌唑、联苯三唑醇和烯唑醇的线性方程、相关系数和检测限
2.8 混合三模板分子印迹固相萃取柱对样品的净化和检测效果
用已制备好的混合三模板分子印迹固相萃取柱对粮谷样品进行前处理。图4~图9是典型样品提取液、样品提取液过柱后洗脱液和样品加标提取液过柱后洗脱液的色谱图。分子印迹固相萃取柱只对模板物质有吸附作用,而对样品中其他基质干扰物没有吸附能力,表现出它对样品有很好的净化效果,而且表现出它在复杂基质条件下分离富集目标物的优越性能。
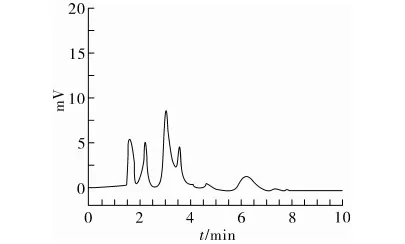
图4 大米样品提取液色谱图
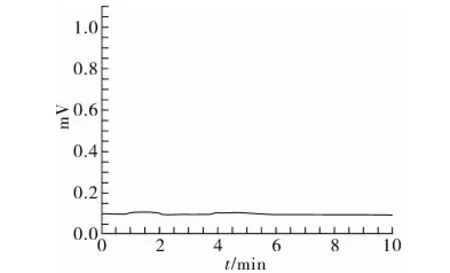
图5 大米样品提取液过柱后洗脱液色谱图
注:1腈菌唑,2联苯三唑醇,3烯唑醇。
图6 大米样品加标提取液过柱后洗脱液色谱图
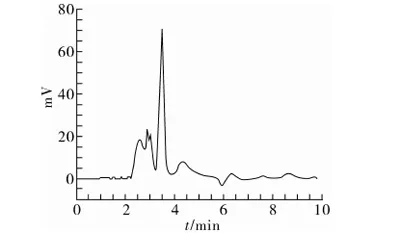
图7 黄豆样品提取液色谱图
图8 黄豆样品过柱后洗脱液色谱图
注:1腈菌唑,2联苯三唑醇,3烯唑醇。
图9 黄豆样品加标提取液过柱后洗脱液色谱图
2.9 回收率和精密度试验
采用本方法对粮谷样品在1、20 μg/mL 2个添加水平下,进行样品加标回收率试验,分析结果如表2所示,3种杀菌剂平均回收率在74.0%~86.2%之间,相对标准偏差(RSD)在1.3%~4.4%之间(n=5),说明本方法的回收率和精密度良好。
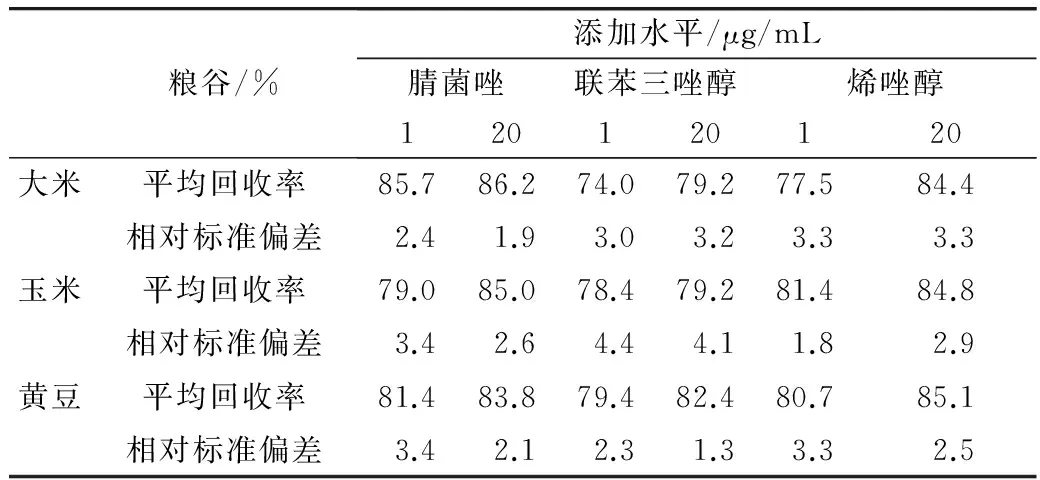
表2 粮谷样品的加标回收率和精密度试验(n=5)
3 结论
以联苯三唑醇、腈菌唑、烯唑醇3种杀菌剂为模板分子,采用本体聚合法合成混合模板分子印迹聚合物,制备出混合三模板分子印迹固相萃取柱,并对实际样品进行前处理,利用高效液相色谱法检测粮谷样品中3种杀菌剂残留。结果表明,自制的混合模板分子印迹固相萃取柱对样品有良好的净化效果,对目标分子表现出特异性吸附能力,在0.3~100 μg/mL浓度范围线性关系良好,线性相关系数≥0.999 2,相对标准偏差(RSD)在1.3%~4.4%之间(n=5),平均回收率在74.0%~86.2%之间,联苯三唑醇、腈菌唑、烯唑醇3种杀菌剂的检出限分别为0.1、0.2、0.2 μg/mL。该分析方法可用于样品中三唑类杀菌剂残留的分离检测。
[1]纪明山,滕淳茜. 新编农药使用技术[M]. 沈阳:辽宁大学出版社,2010,158-162
Ji Mingshan,Teng Chunqian. Pesticide application technology[M]. Shenyang:Liaoning University Press,2010,158-162
[2] Charlton A J A, Jones A. Determination of imidazole and triazole fungicide residues in honeybees using gas chromatography-mass spectrometry[J]. Journal of Chromatography A,2007, 1141:117-122
[3] 吴俐,陈铭学,牟仁祥,等. 植物源食品中6种三唑类杀菌剂残留量的气相色谱法测定[J]. 分析测试学报,2009,28(7):846-848
Wu Li, Chen Mingxue, Mu Renxiang, et al. Determination of six trizole bactericides residues in vegetable origin food by gas chromatography[J]. Journal of Instrumental Analysis, 2009,28(7):846-848
[4] 王菲,李彤,马辰. 超高效液相色谱-串联质谱法测定中药材中三唑类杀菌剂及三嗪类除草剂的残留量[J]. 色谱,2013,31(3):191-199
Wang Fei,Li Tong,Ma Chen. Determination of triazole fungicide and triazine herbicide residues in Chinese herbs by ultra-performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2013,31(3):191-199
[5]Tang T,Qian K,Shi T,et al. Determination of triazole fungicides in environmental water samples by high performance liquid chromatography with cloud point extraction using polyethylene glycol 600 monooleate[J]. Analytica Chimica Acta,2010,680:26-31
[6]Bakas I,Oujji N B,Moczko E,et al. Molecular imprinting solid phase extraction for selective detection of methidathion in olive oil[J]. Analytica chimica acta,2012,734:99-105
[7]Liang R,Zhang R,Qin W. Potentiometric sensor based on molecularly imprinted polymer for determination of melamine in milk[J]. Sensors and Actuators B:Chemical,2009,141(2): 544-550
[8]Prasad K,Prathish K P,Gladis J M,et al. Molecularly imprinted polymer (biomimetic) based potentiometric sensor for atrazine[J]. Sensors and Actuators B:Chemical, 2007,123(1):65-70
[9]Duan Z,Yi J,Fang G, et al. A sensitive and selective imprinted solid phase extraction coupled to HPLC for simultaneous detection of trace quinoxaline-2-carboxylic acid and methyl-3-quinoxaline-2-carboxylic acid in animal muscles[J]. Food Chemistry,2013, 139:274-280
[10]Sadeghi S, Jahani M. Selective solid-phase extraction using molecular imprinted polymer sorbent for the analysis of Florfenicol in food samples[J]. Food Chemistry,2013,141:1242-1251
[11]Bakas I,Oujji N B,Moczko E,et al. Molecular imprinting solid phase extraction for selective detection of methidathion in olive oil[J]. Analytica Chimica Acta,2012,734: 99-105
[12]He J,Lü R,Zhu J,et al. Selective solid-phase extraction of dibutyl phthalate from soybean milk using molecular imprinted polymers[J]. Analytica Chimica Acta,2010,661(2):215-221
[13]胡静,吴晓燕,高文惠. 分子印迹固相萃取-高效液相色谱法分析2种三唑类杀菌剂残留[J]. 药物分析杂志,2012,32(6):1043-1047
Hu Jing, Wu Xiaoyan, Gao Wenhui. HPLC analysis of two trizole fungicide residues by moleculary imprinted solid phase exraction[J]. Chinese Journal of Pharmaceutical Analisis,2012,32(6):1043-1047.
Application of Mixing Three-Template Molecularly Imprinted Solid Phase Extraction Column toDetermin Triazole Pesticides in Grains
Gao Lin1,2Li Yali1,2Liu Bo1,3Gao Wenhui1,2
(College of Biological Science and Engineering, Hebei University of Science and Technology1, Shijiazhuang 050000)(Research Center for Fermentation Engineering of Hebei2, Shijiazhuang 050000)(Zhangjiakou Cigarette Factories Company, LTD3, Zhangjiakou 075000)
A mixing three-template molecularly imprinted solid phase extraction column (MISPEC)-high performance liquid chromatography (HPLC) method was developed for simultaneous determination of three triazole fungicide residues in grain samples. The mixing three-template molecularly imprinted polymer (MIP) with high selectivity was synthesized through bulk polymerization using bitertanol, myclobutanil and diniconazole as mixing three-template molecules. On this basis, the mixing three-template molecularly imprinted solid phase extraction column was prepared and used coupled with HPLC to detect bitertanol, myclobutanil and diniconazole in grains. The experimental results showed that with water of 20 mL as washing agent, methanol of 15 mL as eluent, and under the best chromatographic conditions, the average recoveries of bitertanol, myclobutanil and diniconazole were respectively 74.0%~82.4%, 79.0%~86.2% and 77.5%~85.1% with the relative standard deviations (RSD) less than 4.4%. In conclusion, the polymer had a good specificity absorption capacity for the three fungicides, and the analytical method could be used for the separation and detection of triazole fungicides in samples.
grain, triazole fungicide, mixing template, solid phase extraction column, high performance liquid chromatography
O652.6
A
1003-0174(2016)10-0131-06
河北省科技支撑计划(14227504D), 河北省食品药品监督管理局食品药品安全科技计划(ZD2015015)
2015-02-13
高林,男,1990年出生,硕士,食品质量与安全检测
高文惠,女,1963年出生,教授,食品安全与分离技术

