IgG4相关硬化性涎腺炎4例临床病理分析
张晓岚 石麒麟 平金良 崔戈
IgG4相关硬化性涎腺炎4例临床病理分析
张晓岚 石麒麟 平金良 崔戈
IgG4相关硬化性疾病是近年来被认知的一组系统性疾病,是以累及胰腺以及肺间质,腮腺、泪腺、颌下腺等外分泌腺,胆道、后腹膜、肾脏、胃肠道、肝脏、乳腺等器官的慢性炎症性疾病。IgG4相关硬化性涎腺炎为其在唾液腺的表现,该病变相关报道国内少见,临床上缺乏特异性及对该病的认识,易误诊及漏诊,以至延误治疗,但其特征性的病理形态改变及免疫组化表达使其有别于涎腺的其他病变。笔者总结4例IgG4相关硬化性涎腺炎的临床病理特征,探讨其临床病理诊断、鉴别诊断、免疫组化特点及生物学行为,以期为临床诊断和治疗提供帮助。
1 资料和方法
1.1 一般资料 收集湖州市第一人民医院、湖州市中心医院2010年1月至2015年10月经手术切除及涎腺穿刺确诊为IgG4相关硬化性涎腺炎标本4例,其中男3例,女1例,年龄35~64岁,平均51.4岁。发病部位颌下腺3例,腮腺1例,2例颌下腺及1例腮腺为双侧性,1例颌下腺为右侧。4例患者局部组织渐进性肿大,偶有局部酸胀感及轻度口干现象,病程2个月~4年,以触及质地较硬、边界欠清的不规则肿物就诊,其中1例患者发现双侧腮腺区肿大4年,2年前在当地医院手术,术后病理诊断“左腮腺组织慢性炎伴嗜酸性细胞浸润”,术后2年左腮腺区肿块复发再次入院手术。发病以来4例患者无发热及全身症状,临床检查均未见面瘫及舌体麻木等侵犯神经症状。实验室检查:血细胞分析中性粒细胞减少,淋巴细胞增多,血清IgG滴度11.2~18.8g/L(正常范围7~16g/L),IgG4滴度明显增高1.36~1.59g/L(正常范围0.07~0.64g/L);免疫功能检测提示细胞免疫功能低下,肿瘤免疫相关因子正常。超声影像学检查:病变部位多枚结节状低回声影,边界欠清,形态欠规则,血流较丰富。
1.2 方法 3例患者行手术治疗,1例颌下腺患者B超引导下穿刺活检。标本经4%中性甲醛溶液固定、取材,常规脱水,石蜡包埋,4μm连续切片,HE染色,光镜观察。免疫组化一抗选用:CD138、CD38、CD79a、S-100、IgG4、IgG、AE1/AE3、CD3、CD20和Ki-67。采用EnVision染色,所有试剂均购自福州迈新生物技术开发有限公司。用PBS代替一抗作阴性对照,操作步骤严格按照说明书进行。
2 结果
2.1 巨检 颌下腺及腮腺组织呈多结节状,大小1.8~5.5cm,切面灰白色或灰红色,质韧或质硬;穿刺组织为灰白色线型组织,长0.8~1.1cm,直径0.05cm。
2.2 镜检 颌下腺和腮腺病理改变相似,不同小叶病变程度不一,小叶内涎腺腺泡萎缩,数目减少,小导管周围形成胶原鞘(图1),小叶间可见明显的纤维组织增生及玻璃样变,部分区呈席纹状改变(图2),病变组织内有较多的淋巴细胞、浆细胞浸润,局部淋巴滤泡形成(图3)。4例患者由于病程发展不同,淋巴细胞及浆细胞浸润程度和间质纤维组织增生、玻变成分的比例有所不同。穿刺标本组织较少,仅见淋巴细胞和浆细胞浸润,小灶纤维组织增生,席纹状纤维化不明显,未见淋巴滤泡形成。

图1 小叶内涎腺腺泡萎缩,数目减少,大量淋巴细胞、浆细胞浸润,小导管周围形成胶原鞘形成(×200)

图2 小叶间可见明显的纤维组织增生及玻璃样变,部分区呈席纹状改变(×100)

图3 病变组织内有较多的淋巴细胞、浆细胞浸润,局部淋巴滤泡形成(×100)
2.3 免疫组化 病变组织内淋巴细胞 AE1/AE3-,CD20+,CD38+,CD138+,CD3+,IgG+(图4),IgG4+(图5),Ki-67生发中心阳性率较高,IgG4+细胞绝对值>50/ HPF,IgG4/IgG阳性细胞比例>40%。
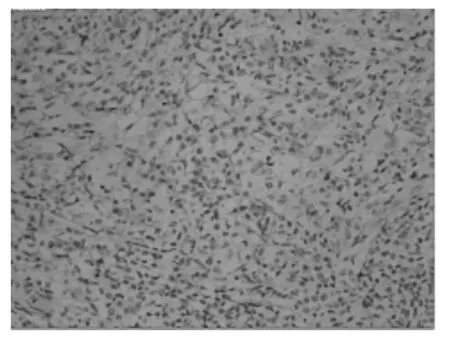
图4 免疫组化:病变组织IgG阳性染色(×200)

图5 免疫组化:病变组织IgG4阳性染色(×200)
2.4 术后随诊 4例患者参照文献[1]标准诊断为IgG4相关硬化性疾病,明确诊断后激素治疗均有效,1例颌下腺穿刺患者停药后半年复发,再次激素治疗有效,随访1~3年未见复发。
3 讨论
免疫球蛋白有四个亚型:IgG1、IgG2、IgG3和IgG4,而IgG4是最少的一个亚型[2-3],正常情况下仅占血清全部IgG的3%~6%,IgG4不能激活补体,并且对抗体的亲和力较低[4],它在变态反应疾病中具有重要作用,在寄生虫感染中,IgG4作为一种保护性抗体可阻止变应原诱导IgE介导效应细胞的启动[5]。近年来,IgG4相关硬化性疾病作为一种新的临床病理学名称已经越来越引起临床及病理医生的关注。IgG4相关硬化性疾病的提出首先来自于自身免疫性胰腺炎(AIP)的概念[6],2003年Kamisawa等[7]证明,部分AIP患者除胰腺病变外,胆道、涎腺、淋巴结等组织器官也有相似的病变,因此指出AIP是系统性自身免疫性疾病的一个表现,因患者IgG4水平升高,故称为IgG4相关硬化性疾病。涎腺是IgG4相关硬化性疾病的好发部位,有研究认为,在所有非特异性慢性涎腺炎中有33%的病变是IgG4相关性的[8]。
3.1 诊断 IgG4相关硬化性涎腺炎好发于中老年男性,患者表现为无明显诱因的单侧或双侧腺体渐进性肿大,边界不清,局部无明显压痛,或仅表现为轻度酸胀感或口感现象,实验室检查血清IgG及IgG4水平升高,当IgG4>1.35g/L时诊断意义较大,此外血清IgG4水平对治疗效果及复发评估有较大指导意义[9]。本组4例血清IgG,特别是IgG4滴度均有升高,与文献报道一致。
3.2 病理诊断 IgG4相关硬化性涎腺炎病理改变表现为腺泡的萎缩和消失,小叶间纤维组织增生,间质淋巴细胞和浆细胞浸润,反应性淋巴滤泡形成,小导管周围胶原鞘,与发生于胰腺、胆管部位的IgG4相关硬化性疾病不同,席纹状纤维化及阻塞性静脉炎少见[10];部分病例淋巴细胞及浆细胞浸润和纤维组织增生的比例常有所不同,病程短的病例以小淋巴细胞和浆细胞浸润为主要特征,病程长的病例以明显的纤维组织增生为主要特征,而淋巴细胞浆细胞则散在其间呈巢状浸润。本组4例患者基本病理改变与上述一致,除1例颌下腺穿刺标本无席纹状纤维化外,均可见席纹状纤维化改变,与文献报道不同,推测本组患者因病程较长,可由于显著的纤维组织增生而导致席纹状纤维化的形成,提示除淋巴浆细胞浸润外,席纹状纤维化可作为IgG4相关硬化性涎腺炎的一个诊断依据。免疫组化结果中,IgG4阳性细胞绝对值>50/HPF,IgG4+/IgG+细胞的比值>40%,组织学形态加免疫组织化学是诊断此病的金标准[11-13],本组4例免疫组化结果均与上述表达一致。
3.3 鉴别诊断 IgG4相关硬化性涎腺炎需与Mickulicz病及非特异性慢性涎腺炎等鉴别。(1)Mickulicz病:又称良性淋巴上皮病变,可以由许多不同疾病所引起,IgG4相关硬化性涎腺炎是Mickulicz病的主要病因[14],其临床表现为泪腺、腮腺及颌下腺不明原因、双侧对称性无痛性肿大,可出现口干、眼干,血清学抗SSA抗体、抗SSB抗体阳性的干燥综合征表现,但其血清IgG4水平无升高,病理形态表现淋巴细胞弥漫浸润唾液腺或泪腺,呈淋巴上皮改变,无硬化性改变,浆细胞免疫表型也无上述诊断标准,可以与IgG4相关硬化性涎腺炎鉴别。(2)非特异性慢性涎腺炎:临床表现为单侧或双侧涎腺肿大,血清IgG4水平无增高,病理表现为涎腺小叶间的淋巴细胞和浆细胞浸润,但小叶间纤维组织增生不显著,无席纹状改变及小导管周围胶原鞘。免疫组化显示浸润的IgG4阳性浆细胞数目少,呈散在分布,且IgG4+/IgG+细胞比值达不到诊断标准,可以与IgG4相关硬化性涎腺炎鉴别。(3)非霍奇金淋巴瘤:原发于涎腺的非霍奇金淋巴瘤少见,临床上可有腮腺、颌下腺肿大,可多个腺体发生,10%患者有干燥综合征,病理改变是涎腺组织被小到中等大淋巴细胞弥漫浸润伴淋巴上皮病变,无明显纤维组织增生,免疫组化显示单克隆性增生,都与IgG4相关硬化性涎腺炎不同。(4)涎石病:根据其临床症状及影像学检查较易鉴别。
3.4 治疗与预后 有关IgG4相关硬化性涎腺炎的发病机制目前所知甚少,IgG4可能只是一个标志物而不是一个致病因素,这个疾病本质上可能是自身免疫性的,也可能是过敏性反应,本组患者腮腺肿块首次手术中可见大量嗜酸性细胞浸润也提示与过敏有关,本病具体发病机制有待进一步深入研究。该病对类固醇激素治疗有效,总体预后较好[15],但其复发率比较高,复发后继续应用激素治疗依然有效。目前美国学者将“激素治疗有效”列入诊断IgG4相关硬化性疾病的诊断标准[16]。本组4例患者激素治疗后均有缓解,1例行穿刺患者复发后再次应用激素仍有效,随访1~3年未见复发。
[1] Futei Y,Amagai M,Ishii K,et al.Predominant IgG4 subclass in autoantibodies of pemphigus vulgaris and foliaceus[J].J Dermatol Sci,2001,26:55-61.
[2] Grey H M,Kunkel H G.H chain subgroups of myeloma ang normal 7s gamma-globulin[J].J Exp Med,1964,120:253-266.
[3] Spiegelberg H l.Biological activities of different classes and subclasses[J].Adv Immunol,1974,19:259-294.
[4] Van der Zee J S,van Swielen P,Aaleherse R C.Inhibition of complement activation by IgG4 antibodies[J].Clin Exp Immunol, 1986,64(2):415-422.
[5] Neild G H,Rodriguez Justo M,Mall C,et al.Systemic extrapancreatic lesions associated with autoimmune pancreatitis[J]. BMC Med,2005,31:232-237.
[6] Yoshida K,Toki F,Takeu chi T,et al.Chronicpancreatitis caused by an autoimmune abnormality.Proposal of the concept of autoimmune pancreatitis[J].Dig Dis Sci,1995,40(7):1561-1568.
[7] Kamisawa T,Funata N,Hayashi Y,et al.A new clinicopathological entity of IgG4-related autoimmune disease[J].J Gastroenterol,2003,38(10):982-984.
[8] Geyer J T,Ferry J A,Harris N L,et al.Chronicsclerosing sialadenitis(kuttner tumor)is an IgG4-associated disease[J]. Am J Surg Pathol,2010,34(2):202-210.
[9] Tabata T,Kamisawa T,Takuma K,et al.Serial changes of elevated serum IgG4 leves in IgG4-related systemic disease [J].Intern Med,2011,50(2):69-75.
[10] Okazaki K,Umehara H.Are classification criteria for IgG4-RD now possible?The concept of IgG4-related disease and proposal of comprehensive diagnostic criteria in Japan[J]. Int J eumatol,2012,12:357-371.
[11] 陈刚,卓华,陈国璋.IgG4相关硬化性疾病:一种演变中的综合征[J].中华病理学杂志,2010,39:851-863.
[12] Dh Sall D,Suriawihata A A,Tang L H,et al.Use of immunohistochemistry for IgG4 in the distinction of autoimmune pancreatitis from peritumoral pancreatitis[J].Hum Pathol,2010,41: 643-652.
[13] 荣娜,魏日胞,王远大.1例IgG4相关硬化性疾病临床病理分析及文献复习[J].军医进修学院学报,2011,32:1277-1279.
[14] Masaki Y,Dong L,Kurose N,et al.Proposal for a new clinical erntity,IgG4-positive multiorgan lymphoproliferative syndrome:analysis of 64 cases of IgG4-related disoders[J]. Am Rheum Dis,2009,68(8):1310-1315.
[15] Kamisawa T,Yoshiike M,Egawa N,et al.Treating patients with autoimmune pancreatitis:results from a long-term follow-up study[J].Pancreatology,2005,5(2-3):234-238.
[16] Kim H M,Chung M J,Chung J B.Remission and relapse of autoimmune pancreatitis:focusing on corficosteroid treatment [J].Pancreas,2010,39:555-560.
2015-12-18)
(本文编辑:田云鹏)
313000 湖州市第一人民医院病理科(张晓岚、石麒麟、崔戈);湖州市中心医院病理科(平金良)
张晓岚,E-mail:zxlld@126.com

