血小板平均体积与糖尿病性视网膜病变的相关性研究
杜颖红 郑海华
血小板平均体积与糖尿病性视网膜病变的相关性研究
杜颖红 郑海华
目的 探讨血小板平均体积(MPV)和视网膜厚度(RT)两项指标在糖尿病性视网膜病变(DR)中的临床意义,并分析MPV与RT在糖尿病各期的相关性,为早期诊断黄斑水肿、判断DR严重程度提供临床诊断依据。方法 选取确诊为2型糖尿病(DM)患者80例(159眼),其中男42例(84眼),女38例(75眼),将DM患者分为糖尿病无视网膜病变组(NDR)、非增殖性视网膜病变组(NPDR)和增殖性视网膜病变组(PDR),检测DR患者不同分期的MPV,观察糖尿病黄斑水肿在光学相干断层扫描(OCT)中的形态,定量测定黄斑区RT,并与30例健康成年人(对照组)比较。结果 4组MPV比较差异有统计学意义(P<0.01);NPDR组和PDR组与对照组比较差异有统计学意义(P<0.01);NDR组与NPDR组比较差异有统计学意义(P<0.05);NDR及NPDR组与PDR组比较差异均有统计学意义(P<0.05)。黄斑区以中心凹1mm为直径RT对照组为(243.35±11.76)μm、NDR组(249.95±10.81)μm、NPDR组(279.50±34.67)μm、PDR组(305.12±66.01)μm。4组A1~A9的RT比较,NPDR、PDR组与对照组差异有统计学意义(P<0.05),NDR组与NPDR、PDR组及NPDR与PDR组比较差异均有统计学意义(均P<0.05)。NDR、NPDR和PDR组的MPV与黄斑区中心凹的RT均呈正相关(r=0.54、0.72、0.85,均P=0.00)。对照组的MPV与黄斑区中心凹的RT不相关(r=0.27,P=0.14)。结论 MPV增大是DM患者发生DR的危险因素;黄斑区RT与DR严重程度有关,DR程度越重,RT增大的概率就越大,RT大小与是否发生DME相关;DR患者MPV和RT呈正相关,且随着DR分级的加重,相关度越来越高。
糖尿病性视网膜病变 血小板平均体积 光学相干断层扫描 视网膜厚度
随着人们饮食结构的改变和平均寿命的延长,糖尿病的患病率呈逐年上升的趋势。据统计,2011年我国糖尿病的患者数达到了9 240万[1]。糖尿病是一种慢性代谢性疾病,糖尿病性视网膜病变(diabetic retinopathy,DR)是眼部最常见、也是最棘手的并发症,它造成的糖尿病黄斑水肿(diabetic macular edema,DME)和增殖性视网膜病变(proliferative diabetic retinopathy,PDR),其发生率在1型和2型糖尿病(diabetes mellitus,DM)患者中分别是23%和14%[2-3],一旦发生,视力损害严重,且较难恢复。DR现已成为成年人后天致盲的主要原因[4]。光学相干断层扫描(optical coherence tomography,OCT)是近年来广泛开展的一种无创伤的检查方法,其分辨率高、探测灵敏,只需患者屈光介质清晰、有一定的配合度,就可以准确直观地显示视网膜各层的细微结构,并能测量视网膜厚度,在黄斑部疾病的诊断上处于举足轻重的地位[5]。且可以重复检查,受检者无创伤、无痛苦,对早期的黄斑水肿和水肿程度的判断有着非常高的灵敏度。
本研究对DM患者的平均血小板体积(mean platelet volume,MPV)及黄斑区视网膜厚度(retinal thickness,RT)进行测定,并与正常人比较,评价这两项指标在DR患者病程进展中的临床意义,分析DM各期MPV与RT的相关性,现报道如下。
1 资料和方法
1.1 一般资料 收集2014年1至4月在温州医科大学附属第二医院(59例)和普陀人民医院(21例)就诊的2型DM患者80例,共159眼。对所有研究对象通过血常规、验光、裂隙灯眼前节检查、散瞳后眼底检查、OCT检查、对部分眼底镜不能确定的行眼底荧光造影明确眼底病变程度,参照2002年DR国际临床分型标准[6],将DM患者分为3组:糖尿病无视网膜病变(non-diabetic retinopathy,NDR)组30例60眼,其中男17例34眼,女13例26眼,年龄30~70(54.00±9.41)岁;非增殖性视网膜病变组(nonproliferative diabetic retinopathy,NPDR)组25例50眼,其中男14例28眼,女11例22眼,年龄47~68(56.56±7.00)岁;PDR组25例49眼,其中男11例22眼,女14例27眼,年龄48~72(57.32±7.02)岁;对照组为身体健康的正常志愿者,共30例60眼,其中男16例32眼,女14例28眼,年龄43~70(55.20±8.99)岁。4组患者性别、年龄比较差异均无统计学意义(均P>0.05),具有可比性。
DM组入选标准:(1)2型DM患者;(2)屈光度在-1.00~+1.00D;(3)患者能配合检查,能中心固视,屈光介质清,OCT图像清晰。排除标准:(1)半年内眼内手术史和视网膜激光手术史的患者;(2)屈光介质不清,致OCT图像不清者,如角膜混浊、白内障、玻璃体积血者;(3)其他非糖尿病性的黄斑病变者,如黄斑区出血、黄斑前膜、黄斑水肿、黄斑变性等;(4)黄斑区有新生血管膜,视网膜脱离者;(5)1个月内服用过阿司匹林、肝素等抗凝药物,排除血液病、肾脏疾病;(6)不能配合OCT检查者。对照组入选标准:年龄>18岁,身体健康的志愿者,屈光度在-1.00~+1.00D,矫正或裸眼视力≥1.0,眼底正常;排除DM、血液系统疾病、白内障、青光眼及病理性近视者。
1.2 方法 被检查者抽取静脉血2ml,标本无溶血、凝血块,放置于EDTA-K2抗凝剂的生物试管中,颠倒混匀6次,采用XT-1800i的全自动血液分析仪,检测血常规。采用ZEISS公司生产的STRATUS OCT4000扫描仪扫描黄斑区的RT(视网膜内界膜到色素上皮层的距离,即ILM~RPE之间的距离),检查由笔者亲自完成,被检查者采用内注视,将注视点设于黄斑中心凹最薄处,扫描模式为512×128,扫描区域为6.0mm×6.0mm,以中心凹为中心,进行水平和垂直方向线性扫描。扫描结果记录3次,取最清晰的图像进行测量。采用机器自带软件分析测量黄斑中心直径为1.0mm的RT、1.0~3.0mm区域视网膜上方、下方、颞侧、鼻侧4个方位的RT,3.0~6.0mm区域视网膜上方、下方、颞侧、鼻侧4个方位的RT。得到黄斑区9个区域RT的A1~A9,其中中心凹最低处为RT A1[7](图1)。
由图1可见,以右眼为例,A1代表直径1.0mm内的黄斑中心区;A2~A5分别代表直径3.0mm内的上方、颞侧、下方及鼻侧分区;A6~A9分别代表直径6.0mm内的上方、颞侧、下方及鼻侧分区。
1.3 统计学处理 应用SPSS17.0统计软件。计量资料以表示,多组均数比较采用单因素方差分析,相关性分析采用线性相关分析,组间计数资料比较采用χ2检验。

图1 用Macular Thickness分析软件进行9分区模式分析示意图(以右眼为例)
2 结果
2.1 4组患者MPV比较 4组患者MPV值分别为对照组(8.34±1.39)fl、NDR组(8.84±1.48)fl、NPDR组(9.59±1.32)fl和PDR组(10.25±1.12)fl。4组差异有统计学意义(F=10.67,P<0.01)。NDR组与对照组比较差异无统计学意义(P>0.05);NPDR组及PDR组与对照组比较差异均有统计学意义(均P<0.01);NDR组与NPDR组比较差异有统计学意义(P<0.05);NDR组与PDR组比较差异有统计学意义(P<0.01);NPDR组与PDR组比较差异有统计学意义(P<0.05)。
2.2 4组患者黄斑区A1~A9RT比较 黄斑区以中心凹1mm为直径RT分别为对照组(243.35±11.76)μm、NDR组(249.95±10.81)μm、NPDR组(279.50±34.67)μm、PDR组(305.12±66.01)μm。4组患者A1~A9RT比较:NDR组与对照组比较差异无统计学意义(P>0.05);NPDR、PDR组与对照组比较差异均有统计学意义(均P<0.05);NDR组与NPDR组比较差异有统计学意义(P<0.05);NDR组与PDR组比较差异有统计学意义(P<0.05);NPDR与PDR组比较差异有统计学意义(P<0.05)。详见表1。
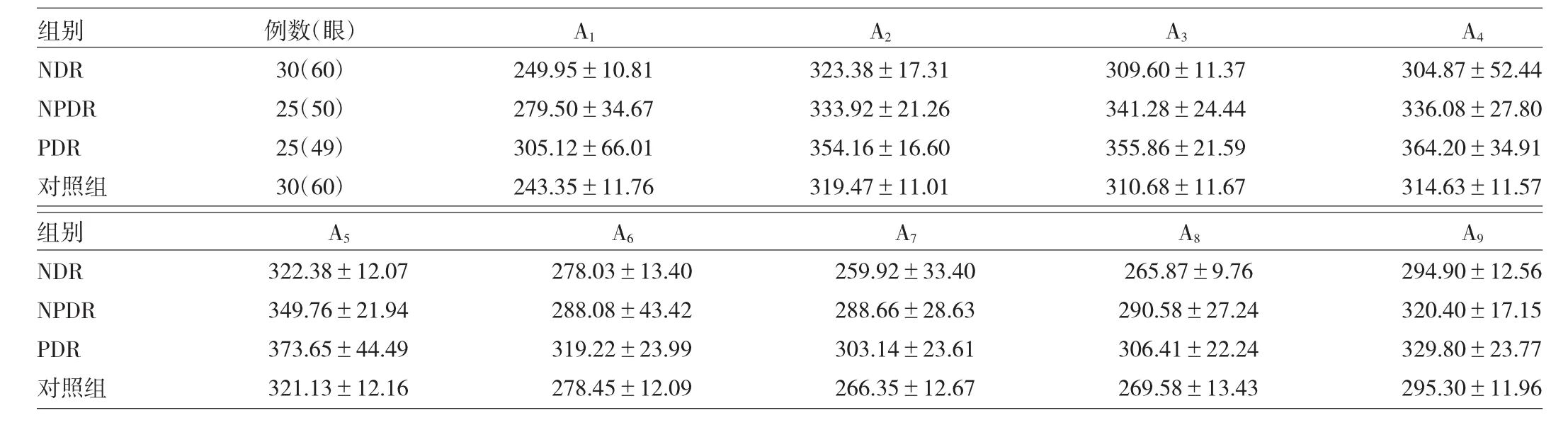
表1 4组患者黄斑区A1~A9RT比较(μm)
2.3 4组患者MPV与RT的相关性分析 NDR、NPDR和PDR组的MPV与黄斑区中心凹的RT均呈正相关(r=0.54、0.72、0.85,均P=0.00)。对照组的MPV与黄斑区中心凹的RT无相关性(r=0.27,P=0.14)。4组患者MPV与黄斑区中心凹RT关系散点图见图2-5。
3 讨论
胡安娣娜等[8]认为年龄是PDR的危险因素,年龄越小,其PDR的发病年龄也越小。Haddad等[9]报道NDR患者与DR患者的平均年龄差异无统计学意义。本研究NDR组患者平均年龄(54.00±9.41)岁;NPDR组患者平均年龄(56.56±7.00)岁;PDR组患者平均年龄(57.32± 7.02)岁。3组患者年龄差异无统计学意义,研究结果与Haddad等[9]报道相符。本研究中的分组比较中,NDR组中男17例占56.67%,女13例占43.33%;NPDR组中男14例占56.00%,女11例占44.00%;PDR组男11例占44.00%,女14例占56.00%。3组患者性别分布差异无统计学意义。
MPV是反映骨髓造血功能、巨核细胞增生和代谢以及血小板生成情况的一个指标。MPV越高表示新生的血小板比率高,说明血小板功能越强。MPV也是血小板活化的参数,与小血小板相比,大血小板更容易被活化。因为其含有较多的致密颗粒,能分泌5-羟色胺和β-凝血酶球蛋白,从而产生更多的血栓烷A2,其聚集功能也更强[10]。MPV增大可能会导致DM患者发生DR的风险增加。在本研究中,我们得出MPV在NPDR组与PDR组明显高于对照组的结论,与文献报道相符[10],但NDR组与对照组差异无统计学意义,分析其原因可能是DM患者长期的糖代谢紊乱导致了巨核细胞功能紊乱和膜分化障碍,使大体积血小板被生产过快,从而导致MPV增大。而NDR组相对病程短,病情轻,糖代谢紊乱程度轻,故与对照组的MPV差异无统计学意义。本研究还得出MPV在NPDR组与PDR组比较差异有统计学意义,而Tuzcu等报道两组无差异[10],分析原因,可能与本研究样本量较小造成的偏倚有关,也有可能与DR的患病病程有关。总之,血小板体积越大,其功能和代谢越活跃,能释放各种活化因子,从而引起血管内皮损伤,促进血液凝固,加重DR患者的微循环障碍,使DR向着更严重的程度发展。所以推断MPV对DR的严重程度评价有很大的意义,在患者的随访过程中,适时的用药可能会延缓疾病向更重的程度发展。

图2 对照组MPV与黄斑区中心凹RT的关系散点图

图3 NDR组MPV与黄斑区中心凹RT的关系散点图

图4 NPDR组MPV与黄斑区中心凹RT的关系散点图

图5 PDR组MPV与黄斑区中心凹RT的关系散点图
本研究利用频域OCT进行了黄斑区形态的观察,并用机器自带的黄斑地形图软件对NDR、NPDR、PDR及对照组进行RT量化测定比较。罗洁等[11]应用频域OCT测量对照、NDR、NPDR及PDR组的黄斑区中心凹1mm的RT,所测值分别为(246.37±17.50)、(252.13±16.24)、(316.28±56.99)、(407.90±214.89)μm。我们的相应结果分别为(243.35±11.76)、(249.95±10.81)、(279.50±34.67)、(305.12±66.01)μm。对照组和NDR组与其测量结果基本相似,但NPDR和PDR组厚度明显偏低,分析原因:(1)可能和测量的机器不是同一型号有关;(2)可能与入选NPDR组和PDR组的病例有关,我们入选的患者黄斑区水肿程度轻,病变严重的少,样本例数少,他们的研究对象可能黄斑水肿程度重的多,所以导致结果差异大。本研究4组的A1~A9RT比较:NDR组与对照组比较差异无统计学意义;NPDR、PDR组与对照组比较差异有统计学意义,NDR、NPDR与PDR组两两比较差异均有统计学意义,这点与罗洁等[11]报道相符。说明RT会随着DR的加重而增加,分析原因:(1)可能是因为玻璃体腔内积聚了某些化学趋化物质,导致细胞发生迁徙,从而引起了玻璃体视网膜的牵引。内层视网膜细胞外间隙扩张,液体积聚在内核层和外丛状层之间,临床上表现为RT增厚。(2)长期高血糖会刺激血管内皮生长因子(vascular endothelial growth factor,VEGF)的产生,而VEGF通过诱导紧密连接蛋白发生变化,使血管通透性增加,破坏了血视网膜屏障[12]。如视网膜渗液存在于外丛状层,可形成黄斑囊样水肿,进一步增加了RT的厚度。DR患者黄斑区水肿、硬性、软性渗出,视网膜新生血管的形成,都会使视网膜神经上皮水肿增厚,其严重程度与DR的分期密切相关,且随着病情程度的加重而增厚,所以RT是反映DR严重程度的一个重要指标。
DM受慢性高血糖的刺激,长期的糖代谢紊乱导致了巨核细胞功能紊乱,使其生产过快以及膜分化障碍产生大体积的血小板,而大血小板的功能和代谢活跃,会刺激各种活化因子的释放,从而引起了血管内皮损伤,促进了VEGF的释放,它和其他新生血管因子共同作用会降低血管内皮细胞间紧密蛋白表达,增加了血管的通透性,破坏了血视网膜屏障,引起了黄斑水肿,增加了RT,DR患者的硬、软性渗出,视网膜新生血管的形成,都会使视网膜神经上皮水肿增厚。可以推测DR的RT随着DR的程度而增厚。反过来,DR的程度越重,引起视网膜血管损伤越重,大量血小板聚集在损伤部位,发挥止血作用,血小板被大量消耗后会刺激骨髓代偿性增生,大量大体积的新生血小板被释放到外周血液。上述原因使DR成为难以逆转的病变。本研究得出的结果NDR、NPDR和DR组的MPV与黄斑区RT均成正相关,r值分别为0.54、0.72、0.85,随着DR程度的加重而相关度增加。我们认为数据结果是可信的,并与文献报道相符[13]。
MPV增大是DM患者发生DR的危险因素,随着DR程度的加重,MPV呈增大趋势。RT与DR严重程度有关,DR程度越重,RT增大的概率就越大,RT大小与是否发生DME密切相关。DR患者MPV与RT呈正相关,且随着DR分级的加重,相关度越来越高。综上所述,MPV和RT是反映DR严重程度且有临床意义的指标。
[1] Yang W,Lu J,Weng J,et al.Prevalence of diabetes among men and women in china[J].N EnglJ Med,2010,362(12):1090-1101.
[2] Kempen J H,O'Colmain B J,Leske M C,et al.The prevalence of diabetic retinopathy among adults in the United States[J]. Archives ofOphthalmology,2004,122(4):552-563.
[3] Porta M,MaldariP,Mazzaglia F.New approaches to the treatment ofdiabetic retinopathy[J].Diabetes Obesityand Metabolosm,2011, 13(9):784-790.
[4] Giuliari G P,Sadaka A,Chang P Y.Diabetic papillopathy:current and new treatment options[J].Current Diabetes Reviews,2011,7 (3):171-175.
[5] Broecker E H,Dunbar M T.Optical coherence tomography:its clinical use for the diagnosis,pathogenesis and management of macular conditions[J].Optometry,2005,76(2):79-101.
[6] Wilkinson C P,Ferris F L,Klein R E,et al.Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales[J].Ophthalomlogy,2003,110(9):1677-1682.
[7] Hannouche R Z,Avila M P D.Retinal thickness measurement and evaluation of natural history of the diabetic macular edema through opticalcoherence tomography[J].Arq Bras Oftalmol,2009, 72(4):433-438.
[8] 胡安娣娜,理涛,罗燕,等.增殖性糖尿病视网膜病变的危险因素分析[J].中国实用眼科杂志,2011,29(9):925-928.
[9] Haddad O A,Saad M K.Prevalence and risk factors for diabetic retinopathy among Omani diabetics[M].British Journal of Ophthalmology,1998,82:901-906.
[10] Tuzcu E A,Arica S,IIhan N,et al.Relationship between mean platelet volume and retinopathy in patients with type 2 diabetes mellitus[J].Graefes Arch Clin Exp Ophthalmol,2014,252(2): 237-240.
[11] 罗洁,赵菊莲,李小平,等.频域光学相干断层扫描对糖尿病患者黄斑部视网膜厚度分区测定的研究[J].眼科新进展,2012,32(2):163-165.
[12] Antcliff R J,Marshall J.The pathogenesis of edema in diabetic maculopathy[J].Semin Ophthalmol,1999,14:223-232.
[13] 贾安奎,刘彦轩.糖尿病视网膜病变患者血小板平均体积与视网膜厚度及尿清蛋白排泄率的关系[J].中国实用内科杂志,2007,27(15): 1202-1204.
(本文编辑:田云鹏)
《浙江医学》对作者署名的一般要求
同时具备以下3项条件者方可署名为作者:(1)参与选题和设计或资料的分析与解释者;(2)起草或修改论文中关键性理论或其他主要内容者;(3)能对编辑部的修改意见进行核修,在学术界进行答辩,并最终同意该文发表者。仅参与研究项目资金的获得或收集资料者不能列为作者,仅对科研小组进行一般管理者也不宜列为作者。对文章中的各主要结论,均必须至少有1位作者负责。作者中如有外籍作者,应征得其同意,并在投稿时向编辑部提供相应证明材料。集体署名的文稿,在题名下列出署名单位,于文末列出整理者姓名,并须明确该文的主要负责人,在论文首页脚注通信作者姓名、单位、邮政编码及E-mail地址。通信作者一般只列1位,由投稿者确定。如需注明协作组成员,则于文末参考文献前列出协作组成员的单位及姓名。作者的具体排序应在投稿前即确定,在编排过程中不应再改动,确需改动时必须出示单位证明。
本刊编辑部
Research of the correlation between mean platelet volume and diabetic retinopathy
DU Yinghong,ZHENG Haihua.Department of Ophthalmology,the Second Affiliated Hospital of Wenzhou Medical University,Wenzhou 325027,China
Objective To assay the mean platelet volume (MPV)ofdifferent stages ofpaints with diabetic retinopathy(DR), to morphologically observe in optical coherence tomography(OCT)scanning diabetic macular edema(DME)of diabetes,and quantitatively assay the retina thickness(RT)ofmacular area and compare with that ofhealthy adults. Methods Select 80 patients (159 eyes)who were diagnosed as diabetes mellitus(DM)between January to February 2014 in Zhejiang Putuo People's Hospital. Among them there were 42 male patients(84 eyes),38 female patients(75 eyes).They were divided into non-diabetic retinopathy (NDR)group,non-proliferative diabetic retinopathy (NPDR)group and proliferative diabetic retinopathy (PDR)group.The MPV and RT of the patients were assayed and compared with that of 30 healthy people as control group.To analyze DR patients in 3 groups(NDR,NPDR,PDR)and 30 healthy people in terms ofMPVand RT changes,analyze the significance of MPVand RT in the DR classification and treatment,and discussing the correlation between MPV and RT of patients with DM and its clinical significance. Results There was significant difference comparing MPVof 4 groups(P<0.01).Comparing NPDR group and PDR group with control group,there was significant difference(P<0.01);NDR group comparing with NPDR group,there was significant difference (P<0.05);NDR group and NPDR group comparing with PDR group,there was significant difference (P<0.05).The RT of Macular center 1mm diameter area of control group is (243.35±11.76)μm,NDR group (249.95±10.81)μm,NPDR group (279.50±34.67)μm,PDR group (305.12±66.01)μm.The comparison ofA1-A9RTof4 groups:comparing NPDR,PDR groups with controlgroup,there was significant difference(P<0.05).Comparing NDR group with NPDR,and PDR group with PDR group,there was both significant difference (P<0.05).MPV of NDR,NPDR and DR groups showed positive correlation with RT of Macular center 1mm diameter area:(r=0.54,0.72,0.85,P=0.00 for all).MPV of control group showed no correlation with RT of Macular center 1mm diameter area(r=0.27,P=0.14). Conclusion The increasing ofMPVis a risk factor of DR development in patients with DM;RT has close relation with the severity of DR:more severe DR,more odds for increased RT.RT value is closely related towhether DME occurs.MPVand RT of macular center of patients with DR showed positive correlation,and with further progress of DR,such correlation becomes higher.
Diabetic retinopathy Mean platelet volume Opticalcoherence tomography Retinalthickness
2015-12-21)
325027 温州医科大学附属第二医院眼科(杜颖红系在职研究生,现在舟山市普陀区人民医院工作)
郑海华,E-mail:eyezhh@126.com

