脑膜血管周细胞瘤临床病理学分析
王秋鹏 翁寿向 谢彩萍 甘梅富
●诊治分析
脑膜血管周细胞瘤临床病理学分析
王秋鹏 翁寿向 谢彩萍 甘梅富
脑膜血管周细胞瘤(meningeal haemangiopericytoma,M-HPC)临床非常少见,占所有中枢神经系统肿瘤的0.4%[1]。M-HPC容易复发和远处转移,临床与影像学表现与脑膜瘤相似,形态学及免疫表型相似于孤立性纤维性肿瘤(solitary fibrous tumor,SFT),因而需要结合常规HE形态及免疫组化鉴别。本院近年来收治数例M-HPC患者,笔者现回顾患者的临床及病理资料,并结合文献探讨其临床病理学特征。
1 临床资料
2009年5月至2010年8月,本院共收治3例MHPC患者。
例1,女,60岁。患者入院前1个月无明显诱因出现头痛,位于右侧额部,呈持续性胀痛,程度中等,伴有头昏。无畏寒发热,无恶心呕吐,无肢体抽搐,无视物模糊,无饮水呛咳,无口齿不清,无四肢活动障碍,无大小便失禁。患者一直头痛头昏,未受重视故未就诊。3d前患者出现头痛加重,于2009年11月3日至本院门诊就诊。头颅CT检查示“右侧颞叶病变”。行颅内肿瘤切除术,术中见肿瘤基底位于右侧中颅窝底及海绵窦,边界清,多支血管供应肿瘤组织,血供极丰富,瘤体大小5cm× 4cm×4cm。术后予以放疗,3年后复发,但未转移,再次术后随访已35个月,至今健在。
例2,男,52岁。患者入院前8个月弯腰时无明显诱因突发晕厥,随即摔倒在地,呼之不应,不伴四肢抽搐,不伴口吐白沫,不伴大小便失禁,约10min好转,行动如常。入院前1d无明显诱因自觉头痛,呈持续性,程度中等,伴头昏。患者于2009年5月20日至本院门诊就诊。头颅MRI检查示“右侧颞叶占位,首先考虑胶质瘤,不能完全排除脑膜瘤可能”。术中见肿瘤大小约5cm× 4cm×4cm,深部与中颅窝底脑膜相连,部分与脑组织粘连,多支血管供应肿瘤组织。术后予以放疗,现已随访76个月,至今健在。
例3,男,33岁。患者入院前4h无明显诱因突发头痛,较剧难忍,呈持续性胀痛,无放射性,伴有呕吐,非喷射性,呕吐物为胃内容物。于2010年8月1日来本院就诊。头颅CT检查示“两侧枕顶部见团状占位影,大约4.4cm×7.4cm,内部密度不均匀,首先考虑肿瘤伴出血,周围可见水肿,两侧侧脑室后角受压,中线结构略右偏”。术中见肿瘤边界清,大小约6cm×5cm×4cm,广基与脑膜相连,血供丰富,质地韧。术后予以放疗,现已随访61个月,至今健在。
2 病理检查
2.1 方法 肿瘤组织均充分取材,4%中性甲醛固定,常规石蜡切片,HE染色后光镜下观察。免疫组化均采用En Vision法染色,抗体包括Vim、EMA、GFAP、CD34、Desmin、SMA、CD99、Bcl-2、HMB45、CK、S-100、NF、CD117、Ki-67、Actin,均为上海基因生物技术开发有限公司产品。
2.2 患者肿瘤标本巨检 3例肿瘤组织标本均为破碎组织,大小分别为5.2cm×4cm×4cm,6.5cm×6.5cm×3cm,5cm×3cm×3cm,例1切面为暗红色,余2例呈灰白色,质地中等。
2.3 患者肿瘤标本镜检及免疫组化检查 瘤细胞核呈圆形、椭圆形,弥漫分布,可见较多裂隙状、鹿角状血管(图1),局部可见出血(图2),细胞核分裂多少不等(2~13个/ 10HPF)。免疫组化检测提示瘤组织均表达Vim、CD99,均呈弥漫着色,2例Bcl-2及1例CD34阳性(图3),CK、EMA(图4)、GFAP、S-100、SMA、CD117、Desmin、HMB45、NF及Actin均阴性。Ki-67阳性率分别为15%、12%、5%。术后分级2例为WHOⅢ级,1例为WHOⅡ级。
3 讨论
1954年Begg等[2]首次报道原发于脑膜的血管周细胞瘤(HPC),其形态学特点与软组织HPC相似。既往将中枢神经系统HPC归类于脑膜瘤的一个亚型,随着免疫组化染色技术的进展和电镜观察的深入,证实中枢神经系统HPC与脑膜瘤在生物学行为、组织学及治疗预后方面均不相同,1993年WHO将其归为HPC。目前认为M-HPC起源于脑膜间叶细胞而非脑膜上皮细胞,但对是否起源于血管周细胞尚有争议[3]。
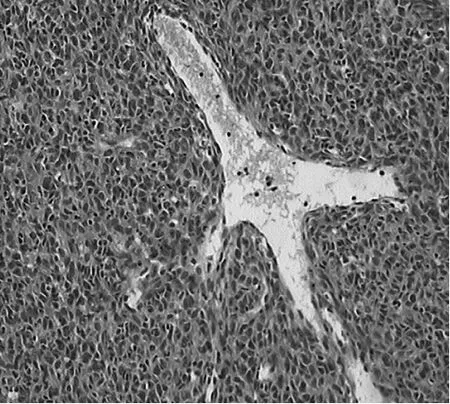
图1 H PC肿瘤细胞形态学观察(细胞呈圆形、卵圆形,可见“鹿角状”血管;H E染色,×200)
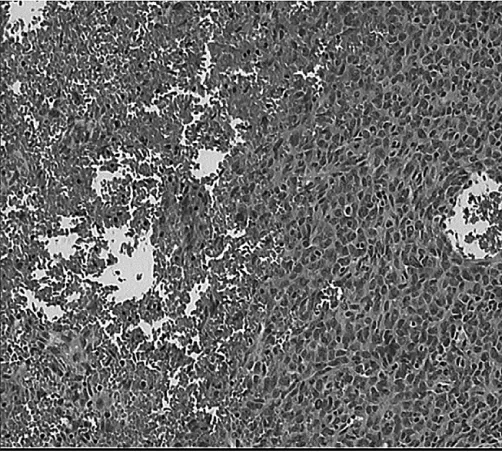
图2 H PC肿瘤细胞形态学观察(肿瘤细胞密集排列,可见出血;H E染色,×200)
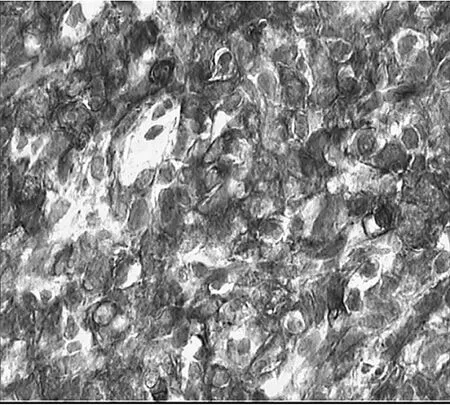
图3 H PC肿瘤细胞免疫组化(肿瘤细胞局灶表达CD34;免疫组化En Vi si on法染色,×400)
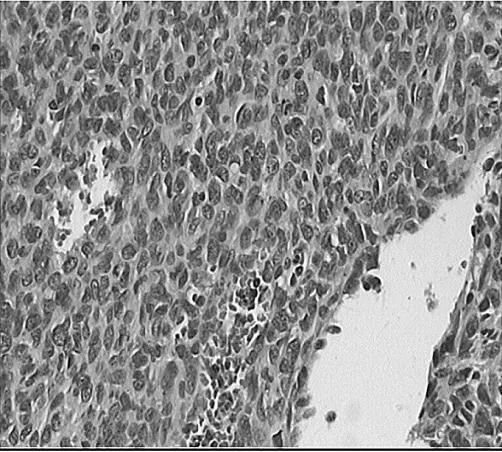
图4 H PC肿瘤细胞免疫组化(瘤细胞EM A阴性;免疫组化En Vi si on法染色,×200)
3.1 M-HPC的临床特征 M-HPC可发生于任何年龄,多见于中年人,诊断时年龄范围为40~50岁[4],男性略多于女性,本组病例中2例为男性,1例为女性。MHPC肿瘤生长迅速,术前病程大多<1年,常压迫周围脑组织而引起相应的症状和体征,故患者的症状和肿瘤的位置有关。患者的临床表现以头痛、呕吐、视乳头水肿、偏瘫、头面部麻木多见,少见的症状有声嘶、咳嗽、晕厥及抽搐等。M-HPC常呈侵袭性生长,可破坏附近骨质,呈溶骨性破坏。该肿瘤CT及MRI检查显示界限清楚,附于硬脑膜,增强后可有强化,一般无骨质增生肥厚。MRI增强扫描见明显不均匀强化,有血管流空征象,脑血管造影示肿瘤血供丰富。有时临床上与脑膜瘤及孤立性纤维肿瘤(SFT)难以区别,但如出现钙化则支持为脑膜瘤。绝大部分颅内M-HPC发生于脑膜,半数以上位于幕上,少部分发生于脑实质,本组3例肿瘤均位于幕上,与脑膜相连。
3.2 病理学特征 M-HPC由密度较大,形态较一致的细胞构成,瘤细胞核圆形或卵圆形,胞质少,细胞界限不清,间质内见大量裂隙状血管,内衬扁平的内皮细胞,可见典型的“鹿角状”血管。2007年WHO中枢神经系统肿瘤病理学分类中提出HPC组织学相当于WHOⅡ级,间变型HPC组织学相当于WHOⅢ级[5]。按此标准,本研究中2例患者组织学分级为WHOⅢ级,1例组织学分级为WHOⅡ级。M-HPC尚无特异性标志物,文献报道肿瘤均高表达Vim及CD99,大部分病例表达Bcl-2[4],CD34的阳性率差异较大,33%~100%不等[3],少数瘤组织可表达EMA、S-100,不表达SMA、FⅧRAg、CD31、GFAP、CD117。本组病例均表达Vim及CD99,2例表达Bcl-2,1例局灶性表达CD34,均不表达EMA、SMA、S-100、CD31、GFAP,与文献报道相符。
3.3 鉴别诊断 (1)脑膜瘤:血管瘤性脑膜瘤富含血管,与M-HPC有相似之处,但前者可见分布血管之间的脑膜上皮细胞,且EMA阳性可以鉴别。部分M-HPC易误诊为纤维型脑膜瘤,免疫表型具有鉴别价值。脑膜瘤表达EMA、Claudin-1,不表达CD34、CD99及Bcl-2,M-HPC则相反,结合组织学形态可以鉴别。(2)SFT:有学者将SFT与M-HPC归类为一种肿瘤的两个谱系,但SFT组织学分级为Ⅰ级,生物学行为一般脑膜瘤相似。SFT瘤细胞以梭型常见,细胞间胶原纤维较丰富,CD34为弥漫强阳性,而M-HPC瘤细胞主要呈圆形或卵圆形,细胞密度大,弱表达CD34,但Ki-67高。(3)间叶性软骨肉瘤:可发生于颅内,常见瘤细胞排列成血管外皮瘤样结构,但其细胞较幼稚,可见软骨小岛,免疫组化表达NSE、S-100,不表达CD34,可与M-HPC鉴别。
3.4 治疗与预后 目前对于M-HPC治疗方法是先手术切除肿瘤以解除占位效应,术后再辅以放疗。大部分肿瘤可以在肉眼及显微镜下完全切除,但长期随访结果显示,85%~91%的肿瘤在术后15年复发,64%~68%的肿瘤发生远处转移[1]。本组中例1术后3年复发,但未发生转移,另2例患者仍在术后随访中。
[1]Louis D N,Ohgaki H,Wiestler O,et al.WHO classification of tumors of the central nervous system[M].Lyon:IARC Press,2007: 178-180.
[2]Begg C F,Garret R.Hemangiopericytoma occurring in the meninges:case report[J].Cancer,1954,7(3):602-606.
[3]Shetty P M,MoiyadiAV,Sridhar E.Primary CNS hemangiopericytoma presenting as an intraparenchymal mass-case report and review ofliterature[J].Clin NeurolNeurosurg,2010,112(3):261-264.
[4]Mekni A,Kourda J,Chelly I,et al.Hemangiopericytoma in the centralnervous system:a study of eight cases[J].Neurochirurgie, 2008,54(1):15-20.
[5]Scheithauer B W,Fuller G N,VandenBerg S R.The 2007 WHO classification of tumors of the nervous system:controversies in surgicalneuropathology[J].Brain Pathol,2008,18(3):307-316.
2015-06-12)
(本文编辑:胥昀)
317000 浙江省台州恩泽医疗中心台州医院病理科

