DNA疫苗pRSC- gD.gC- IL- 21的构建及其预防HSK的动物实验初步研究
董莉莉,胡凯,汤明霞
(1.东南大学医学院 眼科学系,江苏 南京 210009; 2.江苏省泰州市人民医院 眼科,江苏 泰州 225300;3.南京大学医学院附属鼓楼医院 眼科,南京宁益眼科中心,江苏 南京 210008)
·论 著·
DNA疫苗pRSC- gD.gC- IL- 21的构建及其预防HSK的动物实验初步研究
董莉莉1,2,胡凯1,3,汤明霞1
(1.东南大学医学院 眼科学系,江苏 南京 210009; 2.江苏省泰州市人民医院 眼科,江苏 泰州 225300;3.南京大学医学院附属鼓楼医院 眼科,南京宁益眼科中心,江苏 南京 210008)
目的:构建DNA疫苗pRSC- gD.gC- IL- 21,探讨其是否能诱导动物免疫应答及抵抗眼角膜单纯疱疹病毒Ⅰ型(HSV- 1)的感染。方法:提取HSV- 1基因组DNA,PCR扩增获得gC基因。以pRSC- gD- IL- 21质粒为模板(本实验室2011年构建),构建重组质粒pRSC- gD.gC- IL- 21,用纳米材料壳聚糖(chitosan)包裹,采用黏膜接种的方式分别以pRSC- gD.gC- IL- 21+chitosan、pRSC- gD- IL- 21+chitosan、pRSC+chitosan及chitosan免疫小鼠3次,间隔2周,末次免疫2周后检测各项免疫学指标,同时评价小鼠对病毒攻击角膜的免疫保护作用。结果:经测序、酶切及Western blot鉴定,重组质粒pRSC- gD.gC- IL- 21构建成功,chitosan包裹率高。与对照鼠相比,该疫苗在鼠体内产生了更强的特异性中和抗体、细胞毒性T淋巴细胞(CTL)及自然杀伤细胞(NK)杀伤活性增强、泪液中特异性sIgA水平增高,同时使小鼠产生了较强的针对眼角膜HSV- 1感染的免疫保护作用。结论:DNA疫苗pRSC- gD.gC- IL- 21构建成功,能诱导小鼠产生较强的免疫应答及针对HSV- 1眼部感染的免疫保护作用,能够预防单纯疱疹病毒性角膜炎(HSK)的发生、发展。
单纯疱疹病毒1型; DNA疫苗; 糖蛋白C; 壳聚糖; 单纯疱疹病毒性角膜炎; 小鼠
单纯疱疹病毒性角膜炎(HSK)是一种严重的世界性致盲性眼病,主要由单纯疱疹病毒I型(HSV- 1)感染引起,它病情迁延、易复发,终身不愈,居角膜盲的首位[1]。鉴于目前尚无针对HSV- 1感染的有效药物,因此,HSV DNA疫苗的研制及使用,使HSK的预防和根治成为可能。
HSV- 1包膜糖蛋白定位于病毒囊膜上,其中病毒糖蛋白D(gD)是HSV主要的免疫原,能诱导细胞和体液免疫,产生高滴度中和抗体。而病毒糖蛋白C(gC)可以干扰机体的免疫反应,是造成现有疫苗效果不佳的主要原因之一。2011年,我们研制了DNA疫苗pRSC- gD- IL- 21,已证明该疫苗对小鼠原发性HSK有明显预防作用[2]。但我们认为先前疫苗所诱发的特异性主动免疫还不足以强到能有效清除或杀伤复发感染病毒。因此,需要在此基础上进行改进,研制新型的DNA疫苗,诱导更强有力的特异性主动免疫应答,以治疗复发性HSK。所以,本次实验在原有基础上,将gC与gD进行基因融合,构建了新的疫苗pRSC- gD.gC- IL- 21,采用纳米材料壳聚糖(chitosan)包裹,对BALB/c小鼠免疫后,观察其免疫效应,评价其预防HSK发生、发展的效果,取得了一定成绩,并为下一步最终应用于复发性HSK鼠眼模型打下基础,现报道如下。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌DH5a、重组质粒pRSC- gD- IL- 21由东南大学医学院病原微生物与免疫学系实验室保存。
1.1.2 细胞与病毒
SP2/0细胞、293T细胞、YAG- 1细胞购自中科院上海细胞所;绿猴肾传代细胞(Vero细胞)及HSV- 1 F株由东南大学医学院病原微生物与免疫学系实验室常规培养及保存。
1.1.3 主要试剂
Taq DNA聚合酶、dNTP混合液购自美国Promega公司;T4DNA连接酶、限制性核酸内切酶HindⅢ、KpnⅠ、NheⅠ购自MBI公司;鼠抗HSV- 1gD Ab、羊抗鼠IgG- HRP、壳聚糖购自Sigma公司;质粒抽提试剂盒购自Qiagen公司;琼脂糖凝胶回收试剂盒购自江苏省弗泰生物科技有限公司。
1.1.4 实验动物
6周龄BALB/c小鼠,雌性,购自扬州大学动物实验中心。
1.2 方法
1.2.1 DNA疫苗pRSC- gD.gC- IL- 21的构建
1.2.1.1 细胞和病毒的培养 复苏并培养Vero细胞,单层细胞饱和至90%时接种HSV- 1病毒悬液,待细胞病理改变达到60%左右时收获细胞,-70 ℃保存备用。
1.2.1.2 gC基因的获得 常规酚抽提法提取HSV- 1感染的Vero细胞基因组DNA。设计引物,以HSV- 1基因组DNA为模板,PCR扩增gC胞外区基因。上游引物:5′- AAGCTTGGCTCGGAAACTGCCTCCAC- 3′;下游引物:5′- GCTAGCTCATTGCCCCCACCCACTCGATCGCCTCGA- 3′。
1.2.1.3 pRSC- gD- Linker- IL- 21质粒的构建 (1) 设计引物,采用(GGGS)3柔性肽作为连接物(Linker),以pRSC- gD- IL- 21质粒为模板,经两轮PCR扩增后获得gD- Linker基因片段。上游引物:5′- GGTACCGCCGC CACCATGGGGGGGGCTGCCGCCA- 3′;第一轮扩增下游引物:5′- CCACCCGAACCTCCACCTTHCCATGTTGTTCGG GGTGGCCGGGGGAT- 3′;第二轮扩增下游引物:5′- AAGCTTAGAACCTCCACCTGAACCTCCACCCGAACCTCC ACCCATG- 3′。(2) 从质粒PRSC- gD- IL- 21中切下gD片段获得PRSC- IL- 21,将gD- Linker基因片段和pRSC- IL- 21进行KpnⅠ/HindⅢ双酶切及连接反应,获得pRSC- gD- Linker- IL- 21质粒,转化入DH5α大肠杆菌中。
1.2.1.4 pRSC- gD.gC- IL- 21重组质粒的构建 将纯化的gC基因片段和质粒pRSC- gD- Linker- IL- 21进行NheⅠ/HindⅢ双酶切及连接反应,获得质粒pRSC- gD.gC- IL21,转化入DH5α大肠杆菌中。
1.2.2 重组质粒pRSC- gD.gC- IL- 21的鉴定
对重组质粒pRSC- gD.gC- IL- 21进行PCR鉴定及双酶切鉴定,阳性克隆寄送南京金斯瑞生物科技有限公司测序,将重组质粒转染入293T细胞进行Western blot鉴定。
1.2.3 DNA疫苗pRSC- gD.gC- IL- 21+chitosan纳米颗粒的制备
1.2.3.1 缓冲液的配制 配制pH值为5.5的NaAc缓冲液,将壳聚糖溶于其中,浓度为0.02%(w/v),将质粒DNA用Na2SO4溶液稀释为100 μg·ml-1,将壳聚糖溶液和质粒溶液55 ℃水浴10 min后以等体积混合,振荡混匀制成pRSC- gD.gC- IL- 21+chitosan溶液。
1.2.3.2 质粒DNA包封率的检测 取适量pRSC- gD.gC- IL- 21+chitosan溶液,离心,设pRSC- gD.gC- IL- 21+chitosan颗粒溶液为阳性对照,pRSC- gD.gC- IL- 21为阴性对照,对沉淀和上清中质粒的量比进行琼脂糖凝胶电泳检测。取pRSC- gD.gC- IL- 21+chitosan溶液(含1 μg质粒DNA),离心,上清液用无水乙醇沉淀溶于20 μl去离子水中,检测上清液中质粒DNA的浓度及含量(紫外分光光度计),计算包裹效率的公式:包裹效率(%)=100%×(质粒DNA加入的总量-质粒DNA未被包裹的量)/质粒DNA加入的总量。
1.2.3.3 包裹质粒DNA的DpnⅠ保护试验 分别取pRSC- gD.gC- IL- 21+chitosan溶液及pRSC- gD.gC- IL- 21溶液定量,加入定量水,反应缓冲液和DpnⅠ构成50 μl反应体系。37 ℃孵育1 h后加入加样缓冲液终止反应,两种溶液均设酶消化前的阴性对照,进行琼脂糖凝胶电泳,鉴定DpnⅠ消化结果。
1.2.4 纳米质粒的大量制备
用质粒大量抽提QIAGENTM试剂盒分别抽提和纯化pRSC- gD.gC- IL- 21、pRSC- gD- IL- 21、pRSC 3组质粒,用壳聚糖包裹好备用。
1.2.5 动物免疫
取6周龄BALB/c小鼠48只,随机分为pRSC- gD.gC- IL- 21+chitosan组、pRSC- gD- IL- 21+chitosan组、pRSC+chitosan组、chitosan组4组,每组12只,每只鼠双眼结膜囊滴相应质粒5 μl(含25 μg DNA)。免疫3次,每次间隔2周。于末次加强免疫后2周,上述各组免疫小鼠12只中的6只用于免疫学指标检测,6只用于病毒角膜攻击实验。
1.2.6 免疫学指标检测
1.2.6.1 免疫鼠血清中和抗体检测 小鼠眼眶静脉取血,分离血清,将其置于56 ℃水浴中灭活30 min后进行倍比稀释,加入相同体积的病毒悬液(滴度为7.1×106TCID50·ml-1)于37 ℃孵育1 h,然后接种于Vero细胞中孵育3 d,显微镜下观察,以能导致50%的细胞产生病变的血清稀释度的倒数计算中和抗体的效价。
1.2.6.2 脾淋巴细胞特异性靶细胞杀伤以及NK细胞杀伤活性检测 处死小鼠,取脾,制成细胞浓度为1×106ml-1的脾细胞悬液,作为检测脾细胞、NK细胞活性的效应细胞。培养转染质粒pRSC- gD- IL- 21及空质粒pRSC(阴性对照)的SP2/0细胞分别作为各组脾细胞特异性杀伤活性检测的靶细胞;同样处理的YAC- 1细胞作为检测各组NK细胞活性的靶细胞,靶细胞浓度为1×104ml-1。检测在96孔板中进行,各组设实验孔(A)、靶细胞最大释放孔(B)、靶细胞自然释放孔(C)及背景空白对照孔(D)。效靶比为50∶1,常规LDH释放法检测细胞毒性。杀伤率(%)=(A OD490 nm-C OD490 nm-D OD490 nm)/(B OD490 nm-C OD490 nm-D OD490 nm)×100。
1.2.6.3 小鼠泪液中特异性分泌性IgA水平比较 每只鼠两眼各用眼科专用棉签完全置入眼结膜囊中,使小鼠眼睑闭合5 min,取出被泪液浸湿的棉签置入已加入100 μl PBS的EP管,每隔3 h取1次,共5次。采用间接ELISA方法测定泪液中抗gD IgA抗体:用HSV- 1gD抗原包被酶标板,加1∶2稀释度的待检小鼠泪液,二抗为羊抗鼠IgA- HRP,DAB底物显色后,测OD490 nm光吸收值,以正常小鼠泪液作阴性对照,阳性泪液与阴性泪液的OD值之比,即P/N≥2.1为阳性。
1.2.7 病毒攻击实验
用病毒HSV- 1 F株攻击小鼠眼角膜。小鼠腹腔注射麻醉后在显微镜下用1 ml空针头划伤角膜,深度控制在上皮层,向结膜囊内滴加5 μl病毒悬液,闭眼睑5 min。从次日开始,每天用眼科裂隙灯显微镜观察并记录小鼠角膜病变情况。角膜病变程度积分评价标准如下。0分:上皮无病变或点状病变,基质无水肿、混浊;1分:上皮星状病变或基质轻度水肿、混浊;2分:上皮树枝状或地图样病变面积小于角膜四分之一,或者基质水肿、混浊病变小于二分之一角膜直径;3分:上皮树枝状或地图样病变面积小于角膜二分之一,或者基质水肿、混浊病变大于二分之一角膜直径;4分:上皮树枝状或地图样病变面积超过角膜面二分之一,或者基质严重水肿、混浊,虹膜不可见。
1.3 统计学处理
2 结 果
2.1 重组质粒pRSC- gD.gC- IL- 21的双酶切鉴定及PCR鉴定
重组质粒pRSC-gD.gC-IL- 21经测序,序列与GenBank符合率为97%,采用gC引物经PCR鉴定,结果亦显示符合gC序列长度(1 393bp),说明重组质粒基因构建正确。重组质粒经KpnⅠ/NheⅠ双酶切及HindⅢ/NheⅠ双酶切,分别切出目的基因gD+gC(2 454bp)及gC(1 393bp)。说明插入的基因正确(图1)。

Lane1.阳性克隆KpnⅠ/NheⅠ双酶切验证(gD+gC,2 454bp);
Lane2.阳性克隆HindⅢ/NheⅠ双酶切验证(gC,1 393bp);
Lane3.阳性克隆扩增gC基因;LaneM.DNAMarker
图1 重组质粒pRSC- gD.gC- IL- 21的双酶切鉴定及PCR鉴定
2.2 重组质粒pRSC- gD.gC- IL- 21 Western blot蛋白表达鉴定
有目的蛋白gD.gC表达,约为117 KD,分子量适当,说明DNA疫苗PRSC- gD.gC- IL- 21制备成功(图2)。

Lane 1.转染表达质粒的细胞扩增出gD+gC(48+69 KD);Lane 2.未转染的空细胞;Lane M.Western Marker
图2 重组质粒pRSC- gD.gC- IL- 21 Western blot鉴定
2.3 壳聚糖包封率琼脂糖凝胶电泳检测
上清的OD260 nm值为1.5 ng·μl-1,包裹效率=100%×(1 000 ng-30 ng)/1 000 ng=97%。电泳检测示裸质粒泳道显示出明显的条带,pRSC- gD.gC- IL- 21+chitosan纳米颗粒离心上清的泳道中未见明显条带,而槽内可见被染色的pRSC- gD.gC- IL- 21+chitosan纳米颗粒,说明质粒已被壳聚糖包裹(图3)。
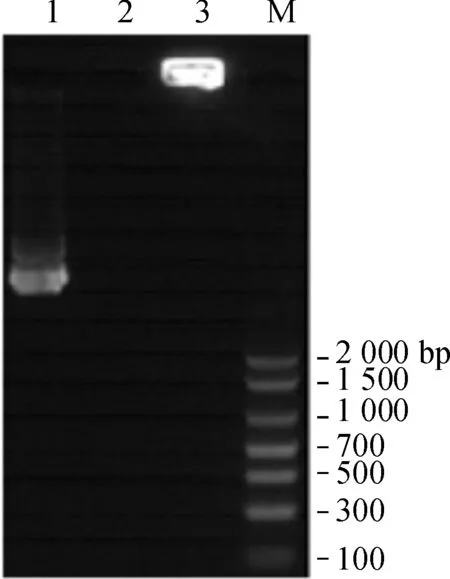
Lane 1.pRSC- gD.gC- IL- 21;Lane 2.pRSC- gD.gC- IL- 21+chitosan离心上清;Lane 3.pRSC- gD.gC- IL- 21+chitosan颗粒溶液
图3 壳聚糖包封质粒DNA的电泳分析
2.4 pRSC- gD.gC- IL- 21+chitosan DpnⅠ保护试验
使用等量的DpnⅠ酶,可见pRSC- gD.gC- IL- 21被降解成小片段,而等量DNA的pRSC- gD.gC- IL- 21+chitosan颗粒仍留在槽中无变化,说明壳聚糖能保护质粒DNA不被DpnⅠ消化(图4)。
2.5 免疫鼠血清中和抗体检测
pRSC- gD.gC- IL- 21+chitosan组血清特异性中和抗体平均效价(1∶512)显著高于pRSC- gD- IL- 21+chitosan组(1∶181)(P<0.05)、pRSC+chitosan组(1∶1.83)(P<0.001)及chitosan组(1∶2.33)(P<0.001),见图5。此结果表明新疫苗可诱导更强的体液免疫应答。

Lane 1.pRSC- gD.gC- IL- 21;
Lane 2.pRSC- gD.gC- IL- 21+DpnⅠ;
Lane 3.pRSC- gD.gC- IL- 21+chitosan;Lane 4.pRSC- gD.gC- IL- 21+chitosan+DpnⅠ
图4 pRSC- gD.gC- IL- 21+chitosan颗粒DpnⅠ保护试验

aP<0.05;bP<0.001
图5 各组免疫鼠血清中和抗体效价水平
2.6 脾淋巴细胞特异性靶细胞杀伤以及NK细胞杀伤活性检测
pRSC- gD.gC- IL- 21+chitosan组小鼠的脾淋巴细胞特异性的细胞毒杀伤效应明显增强(78.86±9.09)%,分别高于pRSC- gD- IL- 21+chitosan组[(65.94±5.01)%,P<0.001]及pRSC+chitosan组[(5.31±4.98)%,P<0.001]、chitosan组[(5.58±5.23)%,P<0.001]。同时NK细胞杀伤活性pRSC- gD.gC- IL- 21+chitosan组亦显著增强[(74.63±8.62)%],分别高于pRSC- gD- IL- 21+chitosan组[(61.86±4.28)%,P<0.001]、pRSC+chitosan组[(4.78±6.02)%,P<0.001]及chitosan组[(5.16±5.26)%,P<0.001]。见图6。此结果说明新疫苗可诱导更强的特异性细胞免疫应答及非特异性的固有免疫应答。
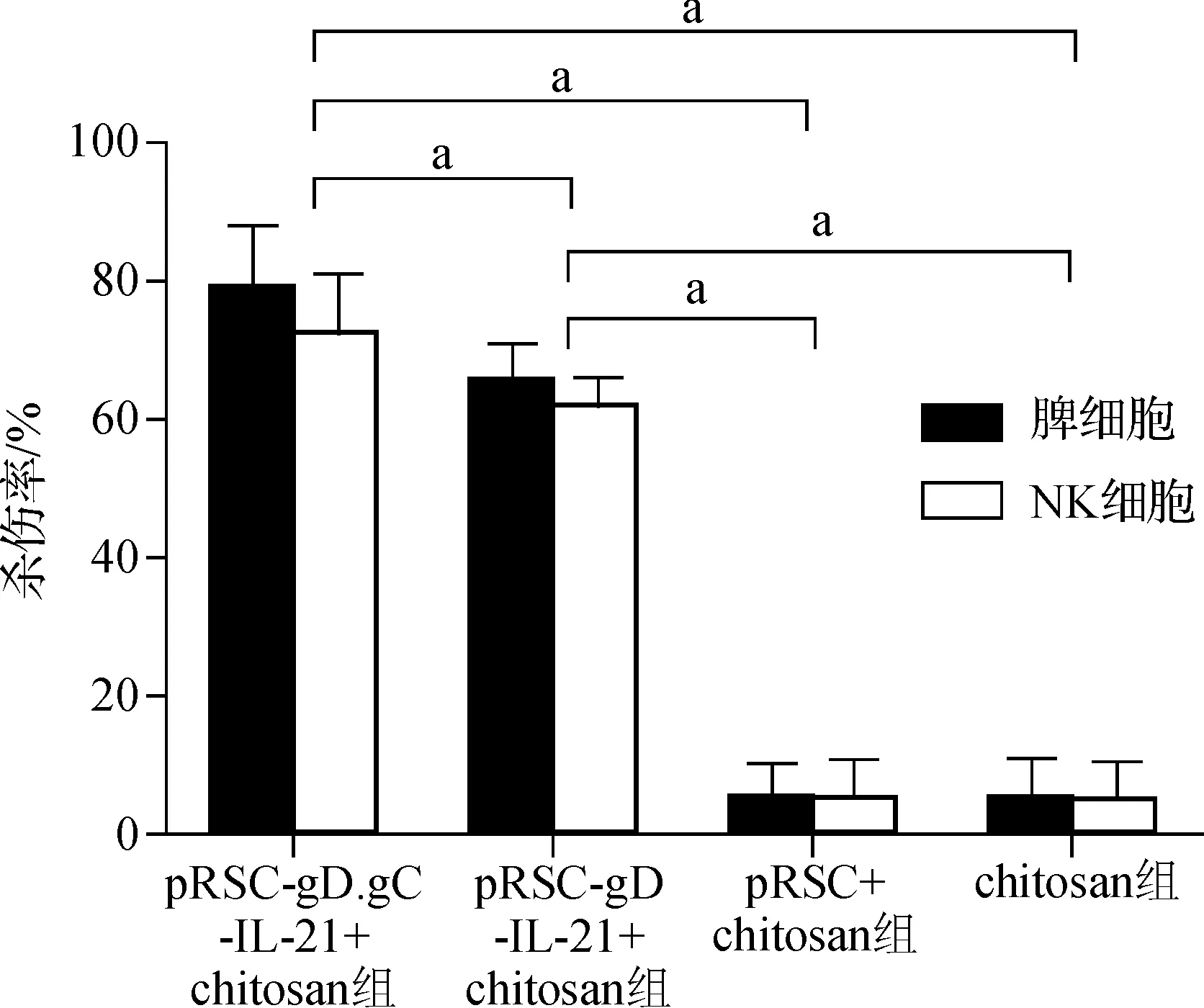
aP<0.001
图6 各组免疫鼠脾淋巴细胞、NK细胞体外靶细胞杀伤活性
2.7 小鼠泪液中特异性sIgA水平比较
pRSC- gD.gC- IL- 21+chitosan组泪液中sIgA含量显著高于pRSC- gD- IL- 21+chitosan组(P<0.01)、pRSC+chitosan组(P<0.001)及chitosan组(P<0.001),提示新疫苗相对于其它对照组疫苗可诱导眼表黏膜产生更高水平sIgA分泌。

aP<0.01;bP<0.001
图7 各组免疫鼠泪液分泌性IgA水平
2.8 小鼠角膜病毒攻击实验结果
pRSC- gD.gC- IL- 21+chitosan组与pRSC- gD- IL- 21+chitosan组相比,角膜病变程度明显减轻,其病变持续时间(5 d)也短于pRSC- gD- IL- 21+chitosan组(9 d),而pRSC+chitosan和chitosan组角膜病变程度较重,且病变持续时间较长,于第15天才基本消失。见图8。以上结果表明,新疫苗对角膜抗HSV- 1感染的免疫保护作用优于其它组。
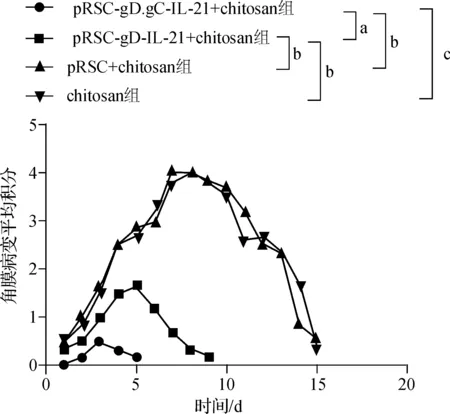
aP<0.05;bP<0.01;cP<0.001
图8 各组免疫鼠病毒攻击后角膜病变积分动态变化
3 讨 论
HSK为人类的一种常见病、多发病,HSV- 1感染角膜后易潜伏在三叉神经节,产生复发性的HSK。抗病毒药物虽能使病情得到一定控制,但要达到根治及控制传播的目的,还远远不够,并且长期使用会导致病毒耐药株[3],因此研制抗HSV疫苗是最有效途径。而DNA疫苗有同时可诱导机体产生强烈的体液免疫应答、细胞免疫应答及黏膜免疫应答的优势,已成为目前研究的焦点。现在,已经有一些DNA疫苗在人类进行测试,如疟疾、艾滋病疫苗,并取得了比较乐观的结果,预示HSV DNA疫苗也有着光明前景。HSV- 1包膜糖蛋白是病毒颗粒表面的抗原决定簇,是HSV感染发病的关键[4],其中gD是主要的免疫原[5]。而gC不仅可与补体C3b结合,阻止补体系统的激活[6],而且还能介导病毒结合细胞表面硫酸乙酰肝素。因而HSV可以通过gC干扰机体的免疫反应,使病毒逃避宿主的攻击,为病毒提供生存优势。这种免疫逃逸行为是造成现有疫苗效果不佳的主要原因之一。有研究者发现,HSV gC免疫所产生的抗体可以有效阻断机体逃避免疫,但在小鼠体内感染产生的gC抗体无明显作用。有专家指出,当前研究HSV疫苗的一个重要思路就是从gC逃逸区域方面进行研究,如果在活体内就可以将免疫逃逸区域中断,那么可有效降低病毒的致病力;此外,还有研究者认为,在gD亚单位疫苗中加入gC可有效提高疫苗保护作用。我们已经知道,在病毒穿膜进入靶细胞的过程中,gB、gD、gH/gL彼此之间的相互作用是关键,而gC可以通过屏蔽中和抗体来扰乱它们之间的相互作用。所以,无论在介导病毒感染、参与病毒的免疫逃逸还是在诱导宿主免疫反应中,HSV gC的作用都是至关重要的[7]。
通常裸DNA进行眼表黏膜接种,因为黏膜吸收率低,且眼有不断的瞬目动作,所以免疫原性相对较差,因而选择合适的基因载体非常重要。壳聚糖作为非病毒纳米载体的一种,除了具有传递质粒DNA进入机体、生物可降解性好、生物相容性高和低毒性、低成本等优点外,还可以使质粒DNA在体内产生更高的抗体效价和免疫应答,这些国内外已有大量研究证实[8- 10]。鉴于上述种种良好的生物特性,壳聚糖已成为药物载体的研究热点和重点[11]。因此,本次实验采用壳聚糖作为基因载体。从实验结果可以看出,壳聚糖/DNA质粒包裹率高达97%,并且能抵抗DpnⅠ的消化作用。
本次实验在原有DNA疫苗pRSC- gD- IL- 21的基础上,将与HSV- 1病毒免疫逃避分子相关的gC与HSV- 1的主要免疫原gD进行基因融合[采用柔性肽(GGGS)3连接[12]],插入到质粒pRSC中,保留原有免疫佐剂IL- 21,构建了新的疫苗pRSC- gD.gC- IL- 21,经酶切、测序以及Western blot目的蛋白表达鉴定,证明新疫苗构建成功。在小鼠动物模型实验中,本研究结果表明,DNA疫苗pRSC- gD.gC- IL- 21+chitosan接种组与pRSC- gD- IL- 21+chitosan组、pRSC+chitosan及chitosan组相比,在细胞免疫、体液免疫、局部黏膜免疫应答上,都有明显优势。首先,在细胞免疫应答方面,我们检测了体外脾淋巴细胞特异性靶细胞杀伤以及NK细胞杀伤活性,pRSC- gD.gC- IL- 21+chitosan组明显高于其它组,它们之间存在统计学差异。其次,在体液免疫方面,我们检测了血清中和抗体,pRSC- gD.gC- IL- 21+chitosan组血清特异性中和抗体分泌水平亦显著高于其它组。再有,pRSC- gD.gC- IL- 21+chitosan组泪液中sIgA含量与其它组相比亦有显著差异,提示新疫苗可诱导更强的眼表黏膜免疫。更主要的是,pRSC- gD.gC- IL- 21+chitosan组抵抗HSV- 1眼部感染的效应大大强于其它各组,该组小鼠发生HSK的严重程度明显减轻,持续时间也明显缩短。DNA疫苗pRSC- gD.gC- IL- 21+chitosan的研制成功为复发性HSK防治的动物实验打下了坚实的基础。
[1] JOSE G G,LARSEN I V,GAUGER J,et al.A cationic peptide,TAT- Cd°,inhibits herpes simplex virus type 1 ocular infectioninvivo[J].Invest Ophthalmol Vis Sci,2013,54(2):1070- 1079.
[2] HU K,DOU J,YU F L,et al.An ocular mucosal administration of nanoparticles containing DNA vaccine pRSC- gD- IL- 21 confers protection against mucosal challenge with herps simplex virus type 1 in mice[J].Vaccine,2011,29(7):1455- 1462.
[3] PIRET J,BOIVIN G.Resistance of herpes simplex vivuses to nucleoside analogues:mechanisms,prevalence,and management[J].Antimicrob Agents Chemother,2011,55(2):459- 472.
[4] BRANS R,YAO F.Immunization with a dominant- negative recombinant herpes simplex virus(HSV)type 1 protects against HSV- 2 genital disease in guinea pigs[J].BMC Microbiol,2010,10:163.
[5] ALLEN S J,MOTT K R,ZANDIAN M,et al.Immunization with different viral antigens alters the pattern of T cell exhaustion and latency in herpes simplex virus type 1- infected mice[J].J Virol,2010,84(23):12315- 12324.
[6] HAZLETT L D,HENDRICKS R L.Reviews for immune privilege in the year 2010:immune privilege and infection[J].Ocul Immunol Inflamm,2010,18(4):237- 243.
[7] HOOK L M,HUANG J L,JIANG M,et al.Blocking antibody access to neutralizing domains on glycoproteins involved in entry as a novel mechanism of immune evasion by herpes simplex virus type 1 glycoproteins C and E[J].J Virol,2008,82(14):6935- 6941.
[8] GASPAR V M,MOREIRA A F,COSTA E C,et al.Gas- generating TPGS- PLGA microspheres loaded with nanoparticles(NIMPS)for co- delivery of minicircle DNA and anti- tumoral drugs[J].Colloids Surf B,2015,134:287- 294.
[9] 何亮,甄勇,张恒柱,等.新型温度敏感水凝胶作为动脉瘤栓塞材料的初步研究[J].东南大学学报:医学版,2016,35(1):63- 67.
[10] 张磊,丁琪,夏扬,等.掺杂F3O4磁性纳米粒子壳聚糖凝胶的制备及其性质研究[J].东南大学学报:医学版,2012,31(5):567- 571.
[11] PRABAHARAN M.Chitosan- based nanoparticles for tumor- targeted drug delivery[J].Int J Biol Macromol,2015,72:1313- 1322.
[12] TAPAS K M,SHINYA T,SEWON K,et al.Functional Silencing of TATA- binding protein(TBP)by a covalent linkage of the N- terminal domain of TBP- associated Factor 1[J].J Biol Chem,2007,282(30):22228- 22238.
Construction of DNA vaccine pRSC- gD.gC- IL- 21 and preliminary research on its immunoprotection against HSK in mice model
DONG Li- li1,2,HU Kai1,3,TANG Ming- xia1
(1.DepartmentofOphthalmology,MedicineCollegeofSoutheastUniversity,Nanjing210009,China; 2.DepartmentofOphthalmology,TaizhouPeople’sHospital,Taizhou225300,China; 3.DepartmentofOphthalmology,NanjingDrumTowerHospital,MedicalCollegeofNanjingUniversity,Nanjing210008,China)
Objective: To construct DNA vaccine pRSC- gD.gC- IL- 21 and to investigate its ability to induce immune response and resist the herpes simplex virus type 1(HSV- 1)infection of cornea in mice. Methods: HSV- 1 genomic DNA was extracted and the gene of gC was amplified by PCR. As a template with pRSC- gD- IL- 21 plasmid(in 2011, our laboratory has been building successful), DNA vaccine pRSC- gD.gC- IL- 21 was constructed. After being identifed by molecular methods, we packaged them with nanometer materials chitosan. With the method of mucosal immunization, the vaccine pRSC- gD.gC- IL- 21+chitosan, the pRSC- gD- IL- 21+chitosan, the blank pRSC+chitosan and the chitosan were respectively inoculated into BALB/c mice for 3 times with 2 weeks interval. A number of immunological indexes were detected 2 weeks after the last immunization. At the same time, the immunoprotective against HSV- 1 challenging on cornea in mice was also evaluated. Results: By DNA sequencing, the restricted endonuclease analysis, and Western blot expression, the construction of DNA vaccine pRSC- gD.gC- IL- 21 was proved to be constructed successful, and chitosan package rate was high. Compared with the control mice, the DNA vaccine induced the mice to generate higher levels of antibody, enhanced the splenic cell proliferation response as well as the activities of cytotoxic T lymphocyte(CTL)cell and natural killer(NK)cell, and increased the specificity sIgA levels in tears. Meanwhile, the pRSC- gD.gC- IL- 21+chitosan could elicit a stronger immunoprotective effect against the corneal infection of HSV- 1 in mice. Conclusion: The construction of DNA vaccine pRSC- gD.gC- IL- 21 is successful. The DNA vaccine pRSC- gD.gC- IL- 21 may induce an effective immune response in immunized mice. More importantly, the efficacy against the HSV- 1 challenge in mouse cornea is enhanced markedly. It can prevent the occurrence and development of the herpes simplex keratitis(HSK).
herpes simplex virus type 1; DNA vaccine; glycoprotein C; chitosan; herpes simplex keratitis; mice
2016- 06- 05
2016- 08- 24
董莉莉(1978-),女,江苏泰州人,副主任医师,在读硕士研究生。E- mail:13615190290@163.com
胡凯 E- mail:hukai70@163.com
董莉莉,胡凯,汤明霞.DNA疫苗pRSC- gD.gC- IL- 21的构建及其预防HSK的动物实验初步研究[J].东南大学学报:医学版,2016,35(6):932- 938.
R392.11
A
1671- 6264(2016)06- 0932- 07
10.3969/j.issn.1671- 6264.2016.06.021

