谷丙、谷草转氨酶与丙种球蛋白无反应型川崎病相关性的Meta分析
李晨 施红英 何跃娥 郭育屏 潘璐璐 翁奉奉 吴蓉洲 褚茂平
●论 著
谷丙、谷草转氨酶与丙种球蛋白无反应型川崎病相关性的Meta分析
李晨 施红英 何跃娥 郭育屏 潘璐璐 翁奉奉 吴蓉洲 褚茂平
目的 通过Meta分析探讨ALT、AST与静脉注射丙种球蛋白针(简称丙球)无反应型川崎病的相关性。方法 检索Pubmed等6个中英文数据库关于ALT、AST与丙球无反应型川崎病相关性的研究报道,检索时间为2002至2016年,对符合要求的文献提取数据,对于可以合并统计量的研究采用Review Manager软件(Revman 5.2)进行Meta分析,对于无法进行Meta分析的研究进行定性综合。结果 共计25个研究纳入最终的系统评价,其中20个研究可以合并统计量,另外5个研究不能合并统计量,进行定性系统评价。在进行Meta分析的20个研究中,ALT共纳入19个研究用于Meta分析,AST共纳入16个研究用于Meta分析;Meta分析结果显示,与丙球敏感的患儿比较,丙球无反应的患儿血中ALT(overall SMD=0.63,95%CI:0.44~0.82,P<0.01)、AST(overall SMD=0.57,95%CI:0.49~0.65,P<0.01)水平更高。结论 与丙球敏感的患儿相比,丙球无反应的患儿血清中ALT、AST水平更高。
川崎病 无反应 转氨酶 Meta分析 系统评价
【 Abstract】 Objective To investigate the correlation between alanine aminotransferase (ALT)and aspartate aminotransferas(AST)and intravenous immunoglobulin(IVIG)-resistance in children with Kawasaki disease by a systematic review. Methods PubMed,the Cochrane Library,EMBASE,Wanfang database,VIP,CNKI database from January 2002 to January 2016 were searched for study reports about the correlation between ALT,AST and IVIG-resistance in Kawasaki disease, the data of studies meeting the requirements were extracted and quantitatively synthesized. Results A total of 25 studies were included in the final systematic review,among which statistics were able to be merged in 20 studies;qualitative analysis was performed in other 5 studies.Among 20 studies,19 were included in ALT analysis and 15 were included in AST analysis.The results showed that ALT(overall SMD=0.63,95%CI 0.44-0.82,P<0.01)and AST(overall SMD=0.57,95%CI 0.49-0.65,P<0.01) are associated with the occurrence of IVIG-resistance in Kawasaki disease. Conclusion The serum levels of ALT and AST are higher in children with IVIG-resistant Kawasaki disease than those in the children with IVIG-sensitive Kawasaki disease.
川崎病又称皮肤黏膜淋巴结综合征,是一种以全身中小血管炎为主要病理变化的小儿急性发热性疾病,冠状动脉损害是其严重并发症。川崎病可造成冠状动脉瘤和冠状动脉狭窄,目前已成为全世界多数国家儿童获得性心脏病的首位原因,并且是成年后发生缺血性心脏病的潜在危险因素[1]。静脉注射丙种球蛋白针(简称丙球)1~2g/kg联合阿司匹林口服治疗已成为国际公认的治疗方案,可使大部分患者急性期病情得到控制,体温及炎症指标降至正常,但仍有部分患者经上述治疗后体温不降或体温下降后再次升高,称为丙球无反应型川崎病,往往需要再次使用丙球或追加其他药物治疗[2]。研究显示,丙球无反应型川崎病冠状动脉损害的发生率明显增加[3]。近年来,对丙球无反应型川崎病的预测已引起国内外学者的广泛关注,并进行了大量的研究。ALT是敏感的判断肝功能损害的指标,AST是反映肝脏、心肌细胞以及骨骼肌细胞等损伤的指标,目前临床观察及国内外研究发现,部分川崎病患儿存在血清ALT、AST水平升高[4],而导致其升高的原因目前仍不明确。部分学者通过研究发现,丙球无反应组患儿ALT、AST的水平较敏感组显著升高,甚至通过多因素分析,发现ALT、AST升高是丙球无反应发生的独立危险因素,可作为丙球无反应型川崎病的重要预测因素[4-6],但也有一些研究结果并不支持该观点[7-8]。鉴于此,本研究拟对ALT、AST水平与丙球无反应型川崎病之间的相关性进行系统评价,进一步明确ALT、AST水平升高能否早期预测丙球无反应型川崎病,为临床早期干预,减少冠状动脉损害并发症提供证据。
1 资料和方法
1.1文献检索 参考系统评价报告指南Preferred Reporting Items for Systematic Reviews and Meta-Analyses(PRISMA)进行本次研究[9]。2位研究者通过计算机独立检索Pubmed、Cochrane Library、EMBASE、万方数据库、维普网、中国知网数据库,文献检索时间为2002年1月至2016年1月。检索策略同温州医科大学图书馆专业人员协商制定。英文检索词为:“Kawasaki disease”、(alanine aminotransferase or ALT*or AST*or GPT*or-GOT*or alanine*or aspartate*or glutamic*or SGOT),中文检索词为:“川崎病”和“转氨酶”。
1.2 文献纳入及排除标准 文献纳入标准:(1)研究对象为采用丙球(不管剂量)进行初始治疗的16岁以下川崎病患者,并有明确的川崎病诊断标准;(2)有明确的丙球无反应的判断标准;(3)研究因素包含ALT和(或)AST,进行Meta分析的研究需提供丙球无反应组和敏感组患者的AST和(或)ALT的均数和标准差,或者提供OR或RR及95%CI者;(4)研究类型不限。文献排除标准:(1)重复研究或者综述文章;(2)没有将ALT和(或)AST纳入统计分析的研究;(3)没有原始数据的文献。
1.3 文献筛查 由2位研究者根据制定的文献纳入和排除标准,独立筛查文献。首先通过阅读文献标题和摘要进行初筛,明显不符合标准者予以排除,符合纳入标准或者不能完全确定是否应纳入者均进一步行全文阅读,符合标准者纳入。最终纳入文献进行2人交叉核对,出现争议的文章经研究小组讨论决定是否纳入。如有文章未提供所需信息,以电子邮件、通信等方式联系作者取得所需信息,如不能提供完整信息则予以排除。
1.4 文献质量评价 质量评估标准采用“Newcastle-Ottawa Scale(NOS)文献质量评价量表”。满分为9分,评分>6分的为高质量研究,评分<6分的为低质量研究[10]。
1.5 数据提取 2位研究者独立提取所纳入文章的数据,提取数据信息包括基本信息(第一作者、发表年份、所发表杂志名),研究对象基本特征(研究人群所属地区,研究的患者数量,患者年龄、性别,川崎病诊断标准,初次丙球治疗剂量),结局指标即丙球无反应型川崎病的定义,主要结果包括丙球无反应组和敏感组患者ALT和AST的均数和标准差、OR或RR及95%CI及其调整的混杂因素情况。
1.6 统计学处理 采用Cochrane协作网提供的Review Manger软件(Revman 5.2)进行Meta分析。考虑到可能存在生化检测的方法或者试剂不同,以标准化均数差(SMD)为效应指标,计算合并SMD和95%CI。异质性检验采用I2检测,I2<50%表示异质性可接受,结果使用固定效应模型;I2>50%表示异质性明显,积极寻找可能导致异质性产生的原因,并进行亚组分析消除异质性,若异质性无法消除且无明显临床异质性,使用随机效应模型进行处理。采用敏感性分析检测Meta分析结果是否稳定可靠,通过:(1)比较入选全部文献和排除小样本研究后文献分析的结果;(2)比较随机效应模型和固定效应模型的分析结果来进行敏感性分析。发表偏倚采用漏斗图和Beggs检验进行分析。
2 结果
2.1 研究对象基本特征 共检索到可能相关的研究文献447篇,删除重复文献以及通过标题和摘要进行初步筛选,剩下55篇进行全文筛选,经文献资料筛选与提取,最后共25篇文献纳入最终的系统评价[4-8,11-30]。研究类型均为病例对照研究,川崎病的诊断均参考美国AHA川崎病诊断指南[31]或者日本循环协会制定的川崎病诊断指南[32]。文献质量评价采用NOS评分,详见表1、2。
2.2 Meta分析结果
2.2.1 丙球敏感组与无反应组ALT、AST水平的比较 25个研究中,20个研究提供丙球无反应组和敏感
组患者的AST或ALT的均数和标准差[5-8,11-26],纳入最终的Meta分析。各研究间统计学异质性明显(ALT组I2= 83%,AST组I2=85%),而临床异质性可接受,最终选择随机效应模型进行Meta分析。结果显示,与丙球敏感组相比,无反应组血清中ALT(overall SMD=0.63,95%CI:0.44~0.82,P<0.01)、AST(overall SMD=0.66,95%CI:
0.43~0.90,P<0.01)水平更高,详见图1、2。

表1 纳入文献的基本特征

表2 纳入研究的质量评价和标本采集时间
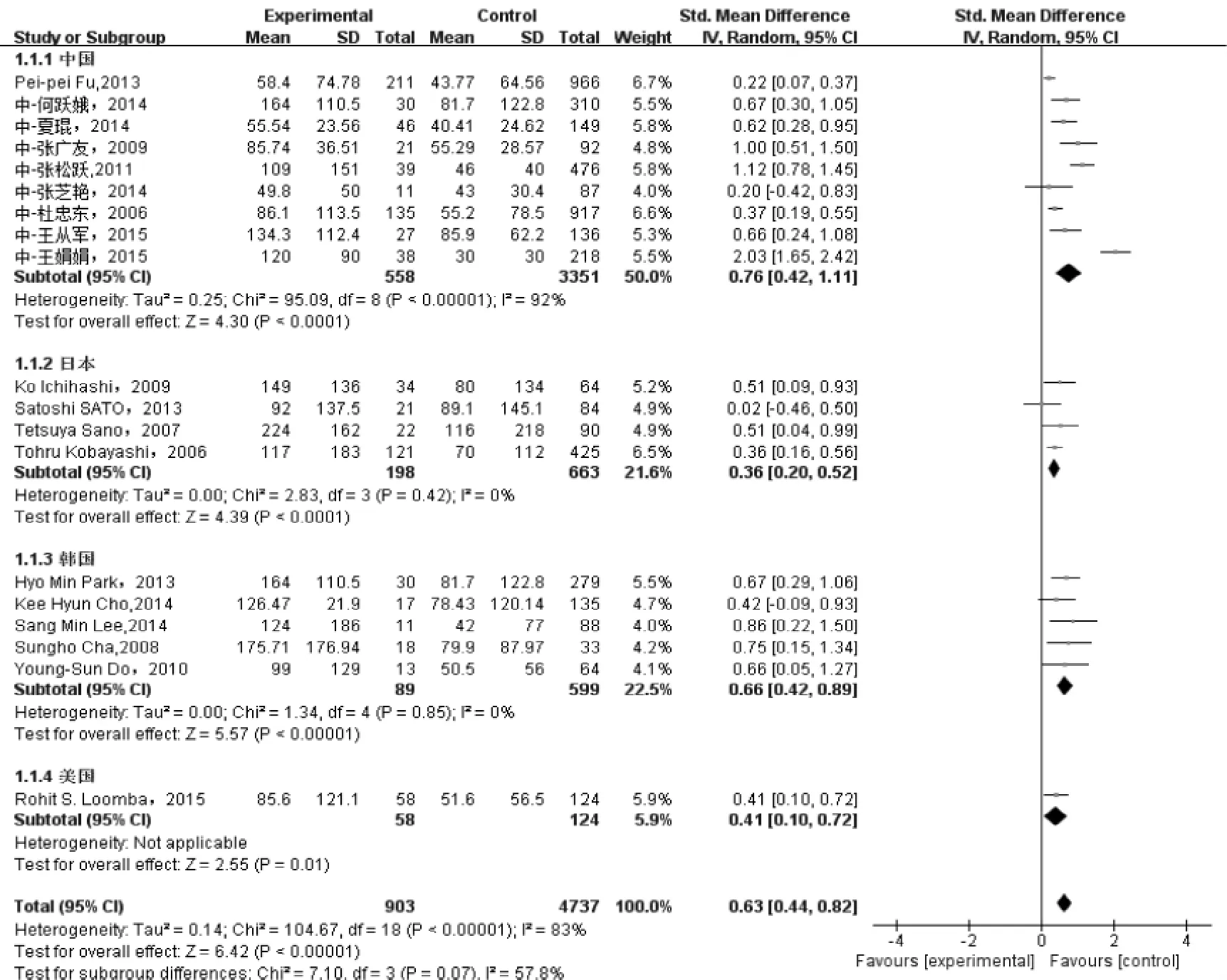
图1 ALT与丙球无反应型川崎病相关性的Meta分析结果

图2 AST与丙球无反应型川崎病相关性的Meta分析结果
2.2.2 异质性检验 各研究间存在明显异质性,采用亚组分析减少异质性,按国家地区分为中国、日本、韩国、美国4个亚组,在ALT组,韩国(I2=0%)和日本(I2=0%)的各研究异质性基本消除,而中国地区各文献仍存在明显的异质性(I2=92%)。对于AST组,韩国组研究无明显异质性(I2=0%),而中国(I2=94%)、日本(I2=67%)各文献异质性仍然明显。
2.2.3 敏感性分析 通过纳入和排除样本量较小的文献、切换随机效应模型和固定效应模型来行敏感性分析后Meta分析结果无变化,敏感性良好,表示Meta分析结果较稳定。
2.2.4 发表偏倚 两组漏斗图基本对称,通过Beggs检验(ALT:P=0.05,AST:P=0.22)提示无明显发表偏倚,详见图3。

图3 转氨酶和丙球无反应关联性系统评价的漏斗图(a:ALT相关文章的漏斗图;b:AST相关文章的漏斗图)
2.3 定性系统评价 有5个研究无法合并统计量,其中纳入ALT的研究有4个[4,28-30],其中3个研究结果显示,丙球无反应型川崎病患儿具有更高的血ALT水平[4,29-30],另1个研究显示,两者无明显相关性[28];纳入AST的研究有4个[4,27-28,30],2个研究结果显示,丙球无反应型川崎病患儿具有更高的血AST水平[4,30],另2个研究结果发现两者无相关性[27-28]。5个定性研究的各效应指标详见表3。
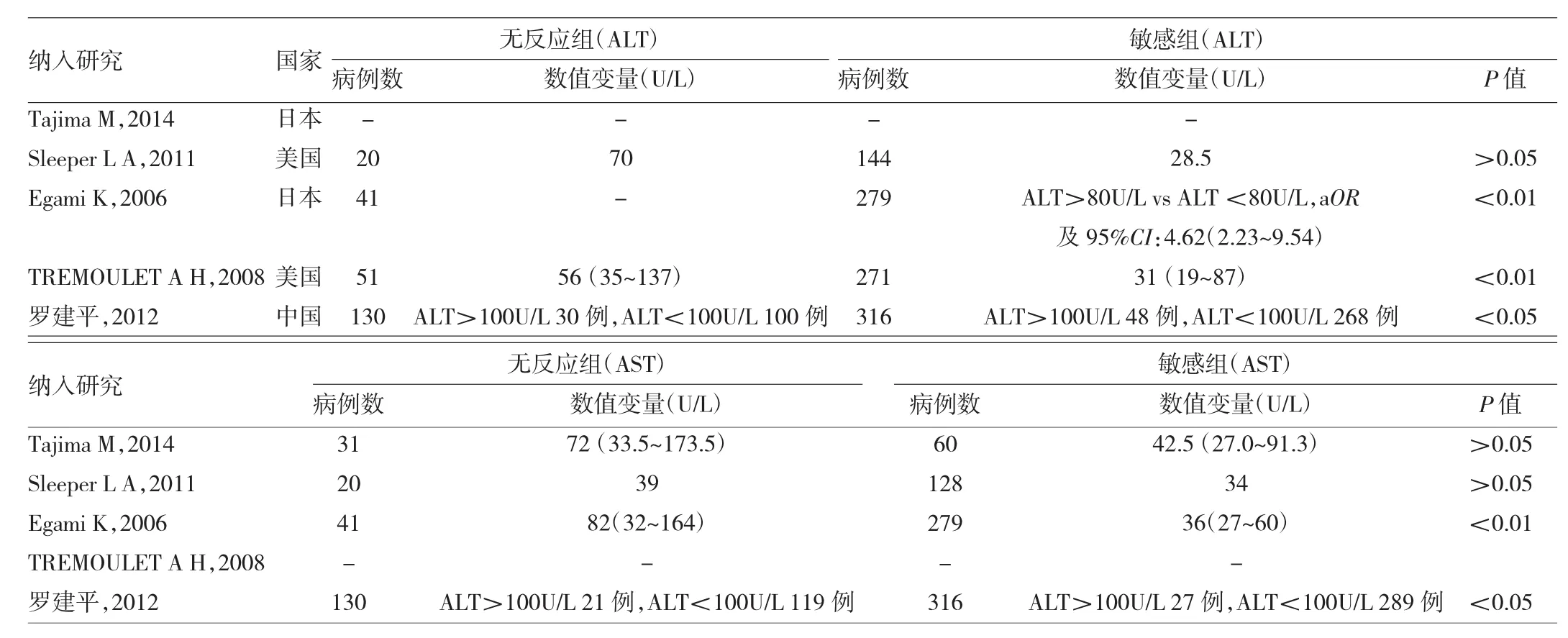
表3 定性分析研究数据结果
3 讨论
川崎病是一种自限性疾病,若缺乏积极有效的治疗往往会导致各系统并发症,其病因及发病机制仍存在争议,多数学者认为外在因素(感染)、遗传因素及环境因素共同参与了川崎病的发生,且季节性明显,北半球以11月至次年3月最高发,而南半球以5至6月为最高发[33]。在经过临床医师以及研究者多年的观察和探索,目前川崎病的诊断和治疗已经趋于成熟。在及时给予足量的丙球联合阿司匹林的治疗下,冠状动脉损伤的发病率已经由25%下降至5%左右[31]。而对于丙球无反应型川崎病的发病率,各文献报道的差异较大,日本2007~2008年的川崎病流行病学调查显示,丙球无反应型川崎病总发病率为22.1%[34]。Moffett等[35]通过对2004~2012年美国33所医院共计9 721例川崎病患者进行统计,丙球无反应型川崎病发病率为16.3%,其中非洲裔美国人丙球耐药的发病率明显高于其他种族人群,且各儿科医院之间发病率差异较大。谢利剑等[36]通过对上海市儿童医院2007~2012年收治的602例川崎病患儿回顾性分析,丙球耐药的概率为4.7%。Fu等[14]通过回顾性分析2002~2010年北京儿童医院1 177例川崎病患儿,丙球无反应的发病率为17.9%。Egami等[4]回顾了日本久留米大学和北里大学儿科部320例川崎病患儿,丙球无反应发生率为13%。以上这些提示,丙球无反应型川崎病的发病率可能与地区及种族密切相关。
转氨酶升高是川崎病患儿的常见现象,具体机制尚不明确。ALT存在于肝细胞胞浆中,肝细胞坏死后,ALT释放入血中导致其水平升高,是较为敏感的判断肝功能损害的指标,川崎病患儿中ALT升高的原因可能是在急性期,激活的NK细胞在肝窦中聚集,引起肝细胞损伤,也可能是由于胆囊及胆总管的血管炎引起胆囊积水,胆道阻塞导致转氨酶及胆红素等升高[37]。急性期IL-1、IL-6、TNF-α升高引起的免疫损伤也可能是导致ALT升高的原因[38]。AST主要存在于心肌细胞、肝细胞中,其升高除了提示存在肝功能损害外,也提示心功能受损。Emgi等[4]认为ALT是丙球无反应发生的高危因素之一,Kobayashi等[5]认为,AST升高在预测丙球无反应型川崎病的发生中有很大的权重。Sungho和Cha等[6-7]认为,AST升高是丙球无反应型川崎病发生的独立危险因素。本研究发现,与丙球敏感的患儿相比,丙球无反应的患儿血清中ALT、AST水平更高。
本研究纳入的文献包括了国内外的临床研究,最终的研究结果是基于目前国内外已发表的研究结果,从证据质量上来看,大部分文献质量均较良好。部分研究丙球无反应型患儿数量较少,导致研究数据95%CI较大,今后此类研究可能需要更多样本量来减少误差。另外,一些研究对于实验室指标收集的时机也没有明确指明,在中文文献中这一问题格外突出,这也是存在较大的问题之一。此外需特别指出的是,各研究间无反应型的定义均有出入,对于发热的定义也存在区别,这导致不同研究间丙球无反应型川崎病的发病率出入较大,同时也可能是造成各研究间异质性较大的因素之一。临床医师也不能完全凭借书面定义来诊断丙球无反应型川崎病,更应结合体温持续情况、炎症指标的波动、典型表现的复发以及除外其他发热性疾病来进行判断。
总之,通过此系统评价,与丙球敏感的患儿相比,丙球无反应的患儿血清中ALT、AST水平更高。这提示在临床诊治过程中,对ALT、AST升高的川崎病患儿,应更仔细地观察其临床表现,当足量丙球使用后若体温仍反复不降,应意识到丙球无反应发生的可能。另一方面,介于部分文献存在的一些局限性,今后仍需更大样本量、研究设计更加合理的临床试验来继续验证这一观点。
[1]Joint working Group.Guidelines for diagnosis and management of cardiovascular sequelae in Kawasakidisease[J].Circulation Journal,2014,78(10):2521-2562.
[2]Urns J C,Capparelli E V,Brown J A,et al.Intravenous gammaglobulin treatment and retreatment in Kawasaki disease.US/ Canadian KawasakiSyndrome Study Group[J].Pediatr Infect DisJ,1998,17(12):1144-1148.
[3]Uehara R,Belay E D,Maddox R A,et al.Analysis of PotentialRisk Factors Associated With Nonresponse to Initial Intravenous Immunoglobulin Treatment Among Kawasaki Disease Patients in Japan[J].Pediatr Infect Dis J,2008,27:155-160.
[4]Egami K,Muta H,Ishii M,et al.Prediction of resistance to intravenous immunoglobulin treatment in patients with Kawasaki disease[J].J Pediatr,2006,149:237-240.
[5]Kobayashi T,Inoue Y,Takeuchi K,et al.Prediction of Intravenous Immunoglobulin Unresponsiveness in Patients With Kawasaki Disease[J].Circulation,2006,113:2606-2612.
[6]Sano T,KurotobiS,MastuzakiK,et al.Prediction of non-responsiveness to standard high-dose gamma-globulin therapy in patients with acute Kawasakidisease before starting initial treatment [J].Eur J Pediatr,2007,166:131-137.
[7]Cha S,Yoon M,Ahn Y,et al.Risk Factors for Failure of Initial Intravenous Immunoglobulin Treatment in Kawasaki Disease[J].J Korean Med Sci,2008,23:718-722.
[8]Loomba R S,Raskin A,Gudausky T M,et al.Role of the Egami Score in Predicting Intravenous Immunoglobulin Resistance in KawasakiDisease Among Different[J].American Journal of Therapeutics,2015,0:1-7.
[9]The PRISMA Group.Preferred Reporting Items for Systematic Reviews and Meta-Analyses:The PRISMA Statement[J].Journal of ClinicalEpidemiology,2009,62:1006-1012.
[10]Wells G,Shea B,O'Connell D,et al.The Newcastle-Ottawa scale(NOS)for assessing the quality of nonrandomised studies in meta-analyses.Ottawa,ON:Ottawa HospitalResearch Institute.Available:Accessed 25 Oct 2011.doi:10.1371/journal. pntd.0002195.pmid:23658850.
[11]Park H M,Lee D W,Hyun M C,et al.Predictors of nonresponse to intravenous immunoglobulin therapy in Kawasaki disease[J]. Korean J Pediatr,2013,56(2):75-79.
[12]Cho K H,Kang S J.Clinically useful predictors of resistance to intravenous immunoglobulin and prognosis of coronary artery lesions in patients with incomplete kawasaki disease[J].Korean Circ J,2014,44(5):328-335.
[13]Ichihashi K,Shiraishi H,Momoi M.Prediction of responsiveness or non-responsiveness to treatment of acute Kawasaki disease using 1 gram per kilogram of immunoglobulin-an effective and cost-saving schedule of therapy[J].Cardiol Young,2009,19(3): 224-227.
[14]Fu P P,Du Z D,Pan Y S.Novel predictors of intravenous immunoglobulin resistance in Chinese children with Kawasaki disease[J].Pediatr Infect Dis J,2013,32:e319-e323.
[15]Lee S M,Lee J B,Go YB,et al.Prediction of resistance to standard intravenous immunoglobulin therapy in kawasaki disease [J].Korean Circ J,2014,44:415-422.
[16]Sato S,Kawashima H,Kashiwagi Y,et al.Inflammatory cytokines as predictors of resistance to intravenous immunoglobulin therapy in Kawasaki disease patients[J].Int J Rheum Dis, 2013,16:168-172.
[17]Do YS,Kim K W,Chun J K,et al.Predicting Factors for Refractory KawasakiDisease[J].Korean Circ J,2010,40:239-242.
[18]何跃娥,张园海,仇慧仙,等.丙种球蛋白无反应型川崎病的预测指标[J].药物治疗学,2014,19(12):1393-1397.
[19]夏琨,尹薇,王瑞耕,等.静脉注射丙种球蛋白无反应性川崎病临床分析[J].中国妇幼保健,2014,29:1570-1573.
[20]张广友.IVIG不敏感川崎病21例临床分析[J].医学理论与实践, 2009,22(5):561-562.
[21]张松跃,张园海,荣星,等.静脉丙种球蛋白无反应性川崎病的危险因素分析[J].中国临床药理学与治疗学,2011,16(6):657-660.
[22]张芝艳,朱洁,钮建宏.等.川崎病患者对静注丙种球蛋白无反应的影响因素及冠状动脉损伤程度[J].山东医药,2014,54(41):65-66.
[23]杜忠东,张永兰,林瑶,等.静脉丙种球蛋白无反应性川崎病的治疗及危险因素分析[J].中国实用儿科杂志,2006,21(10):48-49.
[24]王从军,雷中劲.川崎病患儿对静脉注射免疫球蛋白治疗反应的病例对照研究[J].实用儿科杂志,2015,31(16):2651-2654.
[25]王娟娟,陈爱武.川崎病静脉内注射丙种球蛋白治疗耐药的危险因素积分的临床意义[J].安徽医学,2015,36(11):1333-1335.
[26]刘凡,丁艳,尹薇.可溶性黏附分子在丙种球蛋白无反应型川崎病中的表达[J].中国当代儿科杂志,2013,15(12):1109-1112.
[27]Tajima M,Shiozawa Y,Kagawa J.Early appearance of principal symptoms of Kawasaki disease is a risk factor for intravenous immunoglobulin resistance[J].Pediatr Cardiol,2015,36:1159-1165.
[28]Sleeper L A,Minich L L,McCrindle B M,et al.Evaluation of Kawasaki disease risk-scoring systems for intravenous immunoglobulin resistance[J].J Pediatr,2011,158(5):831-835.
[29]Tremoulet A H,Best B M,Song S,et al.Resistance to intravenous immunoglobulin in children with Kawasaki disease[J].J Pediatr,2008,153:117-121.
[30]罗建平.川崎病丙种球蛋白耐药及并发冠状动脉病变危险因素分析[D].浙江大学硕士学位论文,2012:4.
[31]Newburger,Takahashi M,Gerber M A,et al.Diagnosis,Treatment,and Long-Term Management of Kawasaki Disease:A Statement for Health Professionals From the Committee on Rheumatic Fever,Endocarditis,and Kawasaki Disease,Council on Cardiovascular Disease in the Young[J].American Heart Association.Pediatrics,2004,114(6):1708-1733.
[32]Ayusawa M,Sonobe T,Uemura S,et al.Kawasaki Disease Research Committee.Revision ofdiagnostic guidelines for Kawasaki disease (the 5th revised edition)[J].Pediatr Int, 2005,47:232-234.
[33]陈树宝,黄美容.第10届川崎病研讨会概述[J].中华儿科杂志,2012, 50(9):714-717.
[34]Nakamum Y,Yashiro M.Epidemiologic features of Kawasaki disease in Japan:Results of the 2007-2008 nationwide survey [J].J Epidemiol,2010,20(4):302-307.
[35]Moffett B S,Syblik D,Denfield S,et al.Epidemiology of Immunoglobulin Resistant KawasakiDisease:Results from a Large, National Database.Springer Science+Business Media New York 2014[J].Pediatr Cardiol.DOI 10.1007/s00246-014-1016-1
[36]谢利剑,周翠臻,王韧健,等.基于电子数据采集系统的川崎病602例回顾性分析[J].中华儿科杂志,2015,53(1):34-39.
[37]Ohshio G,Furukawa F,Fujiwara H,et al.Hepatomegaly and splenomegaly in Kawasaki disease[J].Pediatr Pathol,1985,4 (3/4):257-264.
[38]吴海英.丙种球蛋白治疗不耐受川崎病患儿人免疫球蛋白G亚型及肿瘤坏死因子α的改变[J].中国全科医学,2010,13(5):1691.
(本文编辑:马雯娜)
《浙江医学》对医学论文中有关实验动物描述的要求
在医学论文的描述中,凡涉及实验动物者,在描述中应符合以下要求:(1)品种、品系描述清楚;(2)强调来源;(3)遗传背景;(4)微生物学质量;(5)明确等级;(6)明确饲养环境和实验环境;(7)明确性别;(8)有无质量合格证;(9)有对饲养的描述(如饲料型、营养水平、照明方式、温度、温度要求);(10)所有动物数量准确;(11)详细描述动物的健康状况;(12)对动物实验的处理方式有单独清楚的交代;(13)全部有对照,部分可采用双因素方差分析。
本刊编辑部
Alanine aminotransferase and aspartate aminotransferase levels and intravenous immunoglobulin-resistance in children with Kawasaki disease:a systematic review
LI Chen,SHI Hongying,HE Yue'e,et al.Children's Heart Center,the Second Affiliated Hospital& Yuying Children's Hospital,Institute of Cardiovascular Development and Translational Medicine,Wenzhou Medical University,Wenzhou 325000,China
Kawasaki disease ResistantTransaminase Meta-analysis Systematic review
2016-06-16)
国家自然青年科学基金项目(81502893);浙江省公益性技术应用研究计划项目(2014C33161);浙江省自然青年基金项目(Q16H020015);浙江省医药卫生科技项目(2016KYB197);温州市公益性科技计划项目(Y20150015)
325000 温州医科大学附属第二医院、育英儿童医院儿童心脏中心,温州医科大学心脏发育与转化医学研究所(李晨、何跃娥、郭育屏、潘璐璐、翁奉奉、吴蓉洲、褚茂平);温州医科大学环境与公共卫生学院预防医学系(施红英)
褚茂平,E-mail:chmping@hotmail.com

