衰老的卵巢间质成纤维细胞对肿瘤细胞增殖、侵袭能力的影响
高雯 朱滔
衰老的卵巢间质成纤维细胞对肿瘤细胞增殖、侵袭能力的影响
高雯 朱滔
目的 探讨衰老的卵巢间质成纤维细胞对卵巢癌细胞系SKOV3的增殖、侵袭能力的影响。方法 原代培养人卵巢正常成纤维细胞(NOF),在体外持续传代诱导细胞衰老,用衰老相关的β半乳糖苷酶染色(SA-b-gal)试验检测细胞是否发生衰老。收集正常成纤维细胞的条件培养基(CMn)及衰老成纤维细胞的条件培养基(CMs)。用CMn和CMs分别处理SKOV3细胞,利用CCK8试剂盒、Transwell小室及三维培养试验检测细胞的增殖、侵袭能力的变化。结果 卵巢正常成纤维细胞在体外持续传代会导致细胞复制性衰老,在SA-b-gal试验中有明显的深蓝色沉淀产物。用CMs处理SKOV3细胞,CCK8试验显示细胞培养第5天的OD(2.067±0.058)高于CMn组(1.073±0.056)(t=21.19,P<0.01),表明细胞的增殖能力增强。Transwell试验显示CMs组穿透Matrigel胶的细胞数(235.00±29.68)个,较CMn组的(129.30±15.52)个明显增多(t=5.47,P<0.01);三维培养中形成的克隆球CMs组较CMn组明显增大、数量明显增多(27.00±2.16 vs 11.67±2.50;t=8.04,P<0.01),向外侵袭能力增强。结论 衰老的卵巢间质成纤维细胞在体外培养中能促进卵巢癌细胞的增殖和侵袭能力。
卵巢癌 衰老 间质成纤维细胞 三维培养
近年来,对肿瘤的研究热点逐渐从肿瘤本身过度到肿瘤微环境,在肿瘤微环境中最主要的是基质细胞,而成纤维细胞是最重要的一种基质细胞[1]。癌相关成纤维细胞通过多种方式与肿瘤细胞相互作用,从而调节肿瘤发生、发展。在卵巢正常的微环境中,也存在着间质成纤维细胞,幼稚的基质可为上皮肿瘤形成提供一个抑制性的环境[2]。而随着年龄的增长及炎症因子的刺激,间质成纤维细胞会发生衰老[3]。本文旨在研究外源性衰老的间质成纤维细胞对卵巢癌细胞增殖、侵袭能力的影响,现报道如下。
1 材料和方法
1.1 细胞系和培养基 组织标本来自本院妇瘤科2014年10至12月收治的早期宫颈癌切除卵巢的标本2例,经病理证实卵巢正常。标本获取前均与患者签署知情同意书,获得本人许可。从组织标本成功分离到2株卵巢正常成纤维细胞(NOF),体外培养,状态良好。人卵巢癌细胞株SKOV3购自美国模式培养物集存库(American type culture collection,ATCC);培养基为含10%胎牛血清(购自美国Gibco公司)、100U/ml青霉素及100μg/ml链霉素的DEME(购自美国Gibco公司)。
1.2 方法
1.2.1 NOF的分离和培养 (1)细胞培养:取生长状态良好的NOF细胞,用含10%FBS的DMEM基培养,48h后细胞汇合度约80%;(2)收集条件培养基;取培养第3代的NOF(NOF3)培养24h后,更换无血清培养基,继续培养48h后收集培养基即为正常条件培养基(CMn)。取培养第10代的NOF(NOF10)培养24h后,更换无血清培养基,继续培养48h后收集培养基即为衰老条件培养基(CMs)。收集的条件培养基,1 500r/min,离心10min,吸取上清液并用 0.22pm一次性滤器过滤,可立即使用,也可-80℃保存备用。
1.2.2 β-半乳糖苷酶染色(SA-b-gal) GENMED细胞衰老特异性β-半乳糖苷酶检测试剂盒购自上海杰美医药科技有限公司。在6孔板分别接种NOF3和NOF10,37℃、CO2体积分数为5%的恒温培养箱培养过夜,第2天待细胞密度达到50%~60%时,按照β-半乳糖苷酶试剂盒的说明书进行染色,之后在显微镜下拍照。
1.2.3 CCK8实验检测细胞增殖能力 CCK8试剂盒购自日本Dojindo公司。分别使用CMn和CMs作用于SKOV3细胞。取2 500个/孔(100μl/孔)的浓度将处于对数期的细胞接种到96孔板,每孔设3个对照;待细胞贴壁后,加入10μl CCK8,温育2h;用自动酶标仪在450nm波长处,测定各孔的吸光度值(用OD值来表示)。连测5d,最后取各样本的平均值进行比较。根据OD值推测出活细胞的数目,进而了解细胞的增殖能力。
1.2.4 Transwell法检测细胞侵袭能力 8μm微孔聚碳酸酯膜的Transwell小室购自美国BD公司。先将Matrigel(50mg/L)胶和无血清DMEM培养基以1∶3比例进行混合。小室上室铺100 μl混合好的Matrigel,37℃无菌保持过夜,确保Matrigel充分凝固。收集对数生长期的细胞,分别用CMn和CMs培养细胞,调整细胞浓度为1× 106/ml,每孔加100μl细胞悬液于上室,设3个重复孔,下室加入10%FBS的DMEM培养基600μl。在37℃、体积分数为5%的CO2培养箱中温育24h后取出小室,滤膜用4%甲醛固定20min。用棉签小心擦去未侵袭的滤膜表面细胞,结晶紫染色,之后在显微镜下拍照,本实验重复3次。根据穿过膜的细胞数检测其侵袭能力。
1.2.5 体外三维培养法 包被:(1)用0.02mol/L乙酸稀释Ⅰ型鼠尾胶原(购自美国BD公司)至50μg/ml;(2)在24孔板中每孔加入以上 300~500μl已稀释好的Ⅰ型鼠尾胶原,室温孵育1h;(3)将24孔板中的液体吸走,PBS清洗3次;(4)24孔板可以立即使用或无菌条件下晾干备用。接种细胞24孔板每孔最终接种250个细胞,先取2个试管(A、B),A中加入培养基和一定数目的细胞,B中加入培养基、Ⅰ型鼠尾胶原和NaOH(比例为5∶1∶0.0235)在冰上操作,A和B的比例为1∶1,在冰上混和A、B,混匀后加入到已包被好的24孔板中,每孔加入1ml,仔细操作不要有气泡产生,然后放进37℃培养箱孵育。10d后,荧光倒置显微镜下观察克隆的形态,拍照,并计数克隆数量。
1.3 统计学处理 采用SPSS 17.0统计软件,计数资料以表示,比较采用t检验。
2 结果
2.1 卵巢NOF及衰老成纤维细胞形态表现 正常卵巢组织培养7d后见稀疏的NOF从组织块周围长出,约14d铺满瓶底,正常上皮细胞较少见。NOF3生长状态良好,未见上皮细胞混杂生长(图1a)。NOF在体外培养6~10代后逐渐进入复制性衰老(图1b),表现为细胞表型改变,增殖能力丧失,但基本代谢过程仍能维持。与NOF3比较,NOF10体积增大、细胞扁平、胞核与核仁体积增加,胞质内颗粒明显增多等。将成纤维细胞分为NOF3和NOF10,观察细胞衰老情况,经过SA-b-gal染色后,NOF10有明显的深蓝色沉淀产物,体外持续传代诱导了成纤维细胞的复制性衰老(图2)。
2.2 不同培养基处理后对SKOV3细胞增殖能力的影响 细胞培养1、2、3、4、5d,CMs组OD值分别为:0.152±0.012、0.285±0.010、0.884±0.036、1.572±0.050、2.067±0.058;CMn组OD值分别为:0.149±0.007、0.250± 0.010、0.485±0.018、0.775±0.045、1.073±0.056(其中第5天两组比较t=21.19,P<0.01)。以每日OD值均数绘制各组细胞的生长曲线,结果显示,CMs组SKOV3的增殖能力明显高于CMn组(图3)。
2.3 不同培养基处理后对SKOV3细胞侵袭能力的影响 CMs组及CMn组穿过膜的细胞数分别为:235.00±29.68和129.30±15.52(t=5.47,P<0.01)。CMs处理后SKOV3细胞的侵袭能力明显增强(图4)。
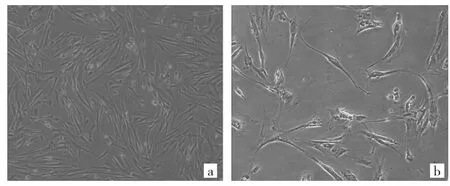
图1 普通显微镜下观察正常成纤维细胞和衰老成纤维细胞形态(a:正常的卵巢成纤维细胞,b:衰老的卵巢成纤维细胞;×40)

图2 荧光倒置显微镜下观察SA-b-gal染色后正常成纤维细胞和衰老成纤维细胞形态(a:正常的卵巢成纤维细胞,b:衰老的卵巢成纤维细胞;×40)

图3 CCK-8法检测不同培养基处理后SKOV3细胞的增殖能力
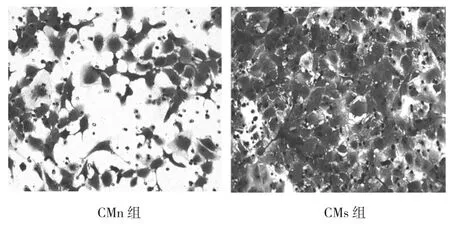
图4 Transwell小室检测不同培养基处理后SKOV3细胞穿过膜到达下室的细胞形态和数量图(×100)
2.4 三维培养中观察不同培养基对SKOV3细胞的作用 CMs组和CMn组形成的克隆球数量分别为27.00± 2.16和11.67±2.50(t=8.04,P<0.01)。与CMn组比较,CMs组形成的克隆球明显增大(图5),数量增多。

图5 三维培养观察不同培养基处理后SKOV3的克隆球形态(×100)
3 讨论
20世纪60年代初,美国科学家Leonard Hayflick在体外培养细胞时发现了一种特殊的细胞生命活动状态,并将其命名为细胞衰老[5]。最初衰老被认为能阻止癌细胞的增殖潜能,从而在对抗癌症中发挥重要作用,近来研究认为衰老还能促进肿瘤的发生、发展[6]。越来越多的证据表明:细胞衰老不仅仅是简单的细胞生长中止现象,此外细胞衰老还涉及肿瘤抑制、肿瘤进展、组织修复及炎症反应等复杂的生理活动[7]。细胞衰老分为三大类:复制性衰老、癌基因诱导的衰老和应激因素诱导的衰老。复制性衰老是指体外连续培养的细胞在有限次数的细胞分裂后,丧失合成DNA及分裂的能力,最后导致增殖能力的丧失,但基本代谢过程仍能维持[8]。衰老细胞进入一种既不同于静止又不同于终末分化的独特的生存状态。此时衰老的成纤维细胞可使一种分泌型蛋白谱表达增加,并将其定义为衰老相关分泌因子或SASP[9]。通过cDNA微点阵分析,Bavik等[10]发现SASP由大量的旁分泌介质组成,如Gro-1、IL-8和MMP2等,这些介质在衰老的间质成纤维细胞中与未衰老的成纤维细胞相比呈过度表达状态。且这些因子又可以反过来促进细胞的衰老。
本研究对人体正常卵巢组织中分离的NOF进行了研究,通过持续传代发现:正常卵巢成纤维细胞在传代过程中逐渐进入衰老,最多传10代。衰老的细胞衰老相关beta半乳糖苷酶活性上升[11],表现为细胞有明显的深蓝色沉淀物。衰老成纤维分泌的条件培养基CMs对比于CMn明显促进卵巢肿瘤SKOV3的增殖和侵袭能力,在体外二维和三维培养都得到了证实。这可能在一定程度上解释了卵巢癌易腹腔播散种植的生物学特性。由于三维培养更接近于体内生长模式,形成类似体内组织的结构,可以动态观察到肿瘤细胞的侵袭转移状况。相较于一维的细胞划痕实验及二维的Transwell实验具有明显的优势[12-13]。三维培养模型中观察到的克隆球对于体外研究肿瘤的增殖和侵袭转移具有重要的价值。CMs促进卵巢肿瘤SKOV3的增殖和侵袭能力,可能是由于衰老相关的分泌表型(SASP)发挥的作用。SASP包含一系列的炎症细胞因子和生长因子,这些因子相互作用,在局部形成复杂的炎症网络结构[9,14]。SASP还具有潜在的导致上皮间质转化(EMT)的作用[15],而EMT在恶性肿瘤的侵袭和转移中都是至关重要的一步,最终促进卵巢癌侵袭转移等恶性生物学行为。这将是我们下一步的研究内容。
[1]Mao Y,Keller E T,Garfield D H,et al.Stromal cells in tumor microenvironment and breast cancer[J].Cancer Metastasis Rev, 2013,32(1-2):303-315.
[2]Salameh T S,Le T T,Nichols M B,et al.An ex vivo co-culture model system to evaluate stromal-epithelial interactions in breast cancer[J].Int J Cancer,2013,132(2):288-296.
[3]SMarthandan S,Priebe S,Hemmerich P,et al.Long-term quiescent fibroblast cells transit into senescence[J].PLoS One,2014,9 (12):e115597.
[4]DePinho R A.The age of cancer[J].Nature,2000,408(6809):248-254.
[5]Hayflick L.The Limited in Vitro Lifetime of Human Diploid Cell Strains[J].Exp CellRes,1965,37:614-636.
[6]Campisi J.Cellular senescence:putting the paradoxes in perspective[J].Curr Opin Genet Dev,2011,21(1):107-112.
[7]Rodier F,Campisi J.Four faces of cellular senescence[J].J Cell Biol,2011,192(4):547-556.
[8]Wang M C,Oakley H D,Carr C E,et al.Gene pathways that delay Caenorhabditis elegans reproductive senescence[J].PLoS Genet, 2014,10(12):e1004752.
[9]Canino C,Mori F,Cambria A,et al.SASP mediates chemoresistanceand tumor-initiating-activity of mesotheliomacells[J]. Oncogene,2012,31(26):3148-3163.
[10]Ruhland M K,Loza A J,Capietto A H,et al.Stromal senescence establishes an immunosuppressive microenvironmentthat drives tumorigenesis[J].Nat Commun,2016,7:11762.
[11]Endt H,Sprung C N,Keller U,et al.Detailed analysis of DNA repair and senescence marker kinetics over the life span of a human fibroblast cellline[J].J GerontolABiolSciMed Sci,2011,66 (4):367-375.
[12]Frith J E,Thomson B,Genever P G.Dynamic three-dimensional culture methods enhancemesenchymalstem cellproperties and increase therapeutic potential[J].Tissue Eng Part C Methods, 2010,16(4):735-749.
[13]Charwat V,Schutze K,Holnthoner W,et al.Potentialand limitations of microscopy and Raman spectroscopy for live-cell analysis of 3Dcellcultures[J].J Biotechnol,2015,205:70-81.
[14]汪春年,吴晓英,吕辉,等.VEGF通过影响CXCR4的表达调节卵巢癌细胞侵袭性的研究[J].浙江医学,2010,32(2):226-229.
[15]Laberge R M,Awad P,Campisi J,et al.Epithelial-mesenchymal transition induced by senescent fibroblasts[J].Cancer Microenviron,2012,5(1):39-44.
Senescent ovarian stromal fibroblasts promotes the proliferation and invasion ability of human ovarian cancer cells
GAO Wen,ZHU Tao.Department of Gynecological Oncology, Zhejiang Cancer Hospital,Hangzhou 310022,China
【 Abstract】 Objective To investigate the effect of senescent ovarian stromal fibroblasts on tumor growth and invasive ability of human ovarian cancer cells. Methods Normal human ovarian fibroblasts(NOF)were primarily cultured and senescence was induced by replicative exhaustion.Senescence associated beta-galactosidase staining was used to detect cell senescence of normal ovarian fibroblasts after serial subcultivation.Normal stromal fibroblasts conditioned mediums(CMn)and senescent stromal fibroblasts conditioned mediums(CMs)were collected.Ovarian cancer SKOV3 cells were treated with CMn or CMs.The cell proliferation and invasion were measured by cell counting kit 8(CCK8)and Transwell assay and three-dimensional cell culture,respectively. Results Replicative senescence was induced in NOF after serial subcultivation.Beta-galactosidase staining showed blue granules within cytoplasm of the senescent ovarian stromal fibroblasts.CCK8 assay showed that the proliferation of SKOV3 cells in CMs group was markedly increased compared to CMn group (OD value:2.067±0.058 vs 1.073± 0.056,t=21.19,P<0.01).Transwell assay that the migration and invasion of SKOV3 cells in CMs group were markedly increased compared with CMn group (235.00±29.68 vs 129.30±15.52,t=5.47,P<0.01).Three-dimensional culture showed that the clone spheres of SKOV3 cells in CMs group were larger and more aggressive than those in CMn group;and the number of clone spheres in CMS group were significantly increased compared with CMn group(27.00±2.16 vs 11.67±2.50,t=8.04,P<0.01). Conclusion Our results indicates that senescent ovarian stromal fibroblasts may enhance proliferation and invasion of human ovarian cancer cells.
Ovarian cancer Senescence Stromal fibroblasts Three-dimensional cell culture
2016-05-15)
(本文编辑:马雯娜)
310022 杭州,浙江省肿瘤医院妇瘤科

