神经胶质瘤细胞ATF5表达水平对HCMV复制的影响
张 雪, 钱冬萌, 胡 明, 陈 豪, 李 玲, 张 丽, 宋旭霞, 王 斌
(青岛大学医学院 病原生物学教研室,山东 青岛 266071)
神经胶质瘤细胞ATF5表达水平对HCMV复制的影响
张 雪, 钱冬萌, 胡 明, 陈 豪, 李 玲, 张 丽, 宋旭霞, 王 斌*
(青岛大学医学院 病原生物学教研室,山东 青岛 266071)
人巨细胞病毒(human cytomegalovirus,HCMV) 在神经胶质瘤细胞中的复制水平不一,其机制尚不清楚。本研究通过下调转录激活因子5(ATF5)在神经胶质瘤细胞中的表达,检测HCMV感染神经胶质瘤细胞后病毒复制水平的变化。首先用HCMV AD169 (MOI=5) 分别感染U87、SY5Y及A172细胞,观察细胞形态变化,分别在24、48、72、96、120 h取各时间点上清液检测病毒滴度;Real-time PCR检测HCMV即刻早期基因(IE2)、早期基因(UL44)、晚期基因(UL99)及ATF5的表达情况;Western-blot检测病毒基因编码蛋白及ATF5表达的情况。结果显示HCMV在U87、SY5Y细胞中复制水平与病毒在A172细胞中复制水平相比,U87、SY5Y细胞组明显高于A172细胞组(P<0.05),ATF5表达在U87、SY5Y细胞组与A172细胞组相比,U87、SY5Y细胞组ATF5表达明显高于A172组(P<0.05);利用慢病毒介导的RNA干扰技术下调ATF5在U87、SY5Y细胞的表达,用HCMV感染细胞检测病毒基因及蛋白的表达,结果ATF5表达下调可抑制HCMV的复制(P<0.05)。以上结果表明,在胶质瘤细胞中下调ATF5表达水平可以抑制HCMV的复制水平。
人巨细胞病毒;转录激活因子5;复制;人胶质瘤细胞;病毒基因
人巨细胞病毒(human cytomegalovirus,HCMV)属于β疱疹病毒亚科,是人类疱疹病毒中最大的一组病毒。在人群中,HCMV感染相当普遍,大多数感染呈临床隐性感染或潜伏感染;但在新生儿、免疫抑制或免疫功能低下的人群中则可引起临床显性感染,出现明显症状, 甚至发生致死性疾病。HCMV基因在宿主细胞内的转录、表达呈现一定时序性,即表达可分为即刻早期(immediately,early IE)、早期(early,E)和晚期(late,L),IE基因编码产生的即刻早期蛋白可激活E基因编码的蛋白参与病毒复制,L基因编码蛋白参与病毒颗粒的结构组成[1]。HCMV感染和恶性神经胶质瘤关系密切,Cobbs等[2]对27例不同级别的胶质瘤组织(Ⅱ~Ⅳ级)、脑膜瘤组织、正常脑组织进行免疫组化检测,结果显示,胶质瘤均可检测到HCMV基因的表达,且随恶性程度增高而增高,而脑膜瘤组织、正常脑组织均未检测到HCMV基因的表达。有研究表明CREB-A可以和IE蛋白相互作用,并可以激活HCMV UL112-113启动子,从而启动病毒基因表达[3-6]。有文献报道当机体感染HSV-1时,ATF5可以通过某些潜在的机制促进HSV-1病毒的复制[7]。而我们研究中的转录激活因子5(ATF5)是转录因子ATF/CREB家族成员之一,具有亮氨酸拉链(bZIP)的特征结构域,能与细胞内多种蛋白分子相互作用,共同调节基因的转录[8-9]。因此推测:神经胶质瘤细胞中ATF5的表达水平可影响HCMV在神经胶质瘤细胞中的复制水平。
1 材料与方法
1.1 材料
1.1.1 病毒与细胞 HCMV AD169毒株由法国巴斯德研究所赠送,按常规方法传代,滴定。人胚肺成纤维细胞(HELF)由本实验室保存,用于HCMV病毒的扩增。U87、SY5Y、A172细胞购自上海细胞库,按常规方法培养、传代后,第5代后用于本实验。
1.1.2 主要试剂与仪器 胎牛血清(FBS,Hyclone)、MEM(Hyclone)、DMEM(Hyclone)、DMEM/F12(Hyclone)、二甲基亚砜(DMSO,Sigma)、Trizol(Invitrogen)、Transcriptor First Strand cDNA Synthesis Kit(Roche)、Real-time PCR Master Mix(Roche)、RIPA 细胞裂解液(Solarbio)、PMSF(Solarbio) 、Anti-Cytomegalovirus IE(ViroStat)、anti-UL44 (Santa Cruz Biotechnology)、anti-UL99(Santa Cruz Biotechnology)、Anti-ATF5 antibody(abcom)、HRP山羊抗小鼠IgG及山羊抗兔IgG、BIO RAD Real-time PCR仪(My-iQ Optics Module)、蛋白凝胶电泳系统(韦伯)、激光共聚焦显微镜等。
1.2 方法
1.2.1 HCMV病毒增殖和滴度测定 取出冻存的HCMV AD169毒株(法国巴斯德研究所惠赠),在流水中迅速融化,将对数生长期的HELF更换2%血清培养基,加入200 μL病毒悬液,将其放入37 ℃、5% CO2的恒温箱中培养2 h,期间每隔15 min轻轻摇动培养瓶。弃掉培养液后,加入含有2%胎牛血清的DMEM/F12培养基维持培养,观察并记录细胞的变化,当细胞出现病变效应达80%以上时用细胞刮刀刮取细胞,收集细胞及培养液,-86 ℃反复冻融3次,使细胞破裂病毒颗粒被释放,1 000 r/min离心10 min,收集上清液为病毒储存液,分装于EP管放于-86 ℃冰箱保存。空斑定量检测病毒滴度为106pfu/mL。
1.2.2 HCMV感染胶质瘤细胞后收集上清检测病毒滴度 HCMV AD169 (MOI=5)分别感染U87、SY5Y、A172和HELF细胞,观察细胞形态变化,分别在24、48、72、96、120 h取各时间点上清液离心。将HELF接种于24孔板,细胞形成单层后弃掉培养液,分别取上清0.2 mL/孔加到24孔板内,每个样品设3个平行对照,并以不接种病毒的HELF作正常对照,于37 ℃、5% CO2的恒温箱中培养使病毒充分吸附后弃掉病毒液,加入1 mL含1%低熔点琼脂糖、2% FBS的培养液,室温下凝固后,置于恒温箱中倒置培养后加培养液继续培养,10 d后取出培养板,显微镜下计数空斑数。空斑形成单位:pfu/mL=每孔内空斑平均数×病毒稀释倍数/每孔接种的病毒量(mL)。
1.2.3 荧光定量PCR分别检测IE2、UL44、UL99 及ATF5 mRNA的表达水平变化 HCMV AD169 (MOI=5)分别感染U87、SY5Y及A172细胞,分别在0、12、24、48、72 h 用Trizol法提取RNA,紫外分光光度计定量后将RNA反转录成cDNA, 置于-20 ℃用于Real-time PCR的模板。Real-time PCR 采用β-actin作为内参基因,内参基因与目的基因各设3个平行反应管。引物由上海生工生物有限公司合成, β-actin上游引物5′-TCGTGGGCCGCTCTAGGCAC-3′,下游引物5′-TGGCCTTAGGGTTCAGGGGG-3′; IE2上游引物5′-TGACCGAGGATTGCAACGA-3′,下游引物5′-CGGCATGATTGACAGCCTG-3′; UL44上游引物5′-TACAACAGCGTGTCGTGCTCCGCG -3′,下游引物5′-GGCGTGAAAAACATGCGTATCAAC-3′; UL99上游引物5′-GTGTCCCATTCCCGACTCG-3′,下游引物5′-TTCACAACGTCCACCCACC-3′;ATF5上游引物5′-AAGTCGGCGGCTCTGAGGTA-3′,下游引物5′-GGACTCTGCCCGTTCCTTCA-3′。反应体系为20 μL,其中10 μL SYBR green mixture,上下游引物分别1 μL,cDNA 2μL,加水至20 μL。94 ℃ 3 min,94 ℃ 10 s,55 ℃ 30 s,循环40次。在55 ℃ 30 s时读取荧光值。
1.2.4 蛋白提取及Western-blot检测IE2、UL44、UL99 及ATF5蛋白的表达 HCMV AD169 (MOI=5)分别感染U87、SY5Y及A172细胞,分别在0、24、48、72、96 h提取总蛋白,将细胞培养皿放于冰上用预冷的PBS洗2遍,加入200 μL含有1 μmol/L PMSF的细胞裂解液,冰浴10 min后,用细胞刮刀刮下细胞后转移到EP管中,再放冰上20 min使其充分裂解,12 000 r/min 4 ℃离心6 min,上清液为总蛋白,BCA法检测蛋白浓度。进行SDS-PAGE将蛋白分离,湿法将蛋白转至PVDF膜上,用TBST清洗膜3次,每次10 min,5%脱脂奶粉室温封闭2 h,分别按要求稀释后加入β-actin,IE2、UL44、UL99及ATF5抗体4 ℃孵育过夜,用TBST清洗膜3次,每次10 min,再加入HRP标记的二抗,室温孵育1.5 h,TBST清洗膜3次,每次10 min,ECL发光。以β-actin作为内参,Quantity One软件进行灰度分析,计算目的蛋白相对表达含量。
1.2.5 慢病毒(LV-ATF5-RNAi)感染神经胶质瘤细胞 进行预实验对感染条件进行筛选,将细胞接种于96孔板,病毒感染时使细胞融合度达20%~30%保持细胞状态良好。设4个组分别为Complete Medium、Complete Medium+5 μg/mL Polybrene、Enhanced Infection Solution(Eni.S.)及Eni.S.+5 μg/mL Polybrene,每组设5个复感染指数(MOI=1、5、10、15、50),每个孔设3个复孔。培养8~12 h以后观察细胞形态,并更换新鲜培养液,感染3~4 d后,观察荧光表达情况,确认最佳感染条件和感染参数。在最佳感染状态下,将阴性对照慢病毒CON053及LV-ATF5-RNAi分别感染U87和SY5Y细胞,待细胞稳定转染后,提取蛋白,WB检测ATF5的表达。

2 结果与分析
2.1 HCMV感染胶质瘤细胞后收集上清检测病毒滴度
HCMV感染U87、SY5Y、A172后观察细胞形态变化, U87、SY5Y细胞形态出现明显的变化,细胞触角由细长变粗钝,细胞由瘦变粗圆(见图1),收集不同时间点上清,将上清加入接种HELF的24孔板中,空斑定量检测病毒滴度。加24、48 h收集的上清液的孔未出现变化,72 h的可检测到空斑且随时间延长空斑数量增多,120 h的空斑数量最多,病毒滴度最高(见图2);而A172细胞形态无明显变化(见图1),也未检测到空斑,对照HELF组在HCMV感染72 h时开始出现明显的细胞病变效应(见图1),收集上清检测病毒滴度,加72 h的可检测到空斑,120 h的空斑数量最多,病毒滴度最高(见图2)。
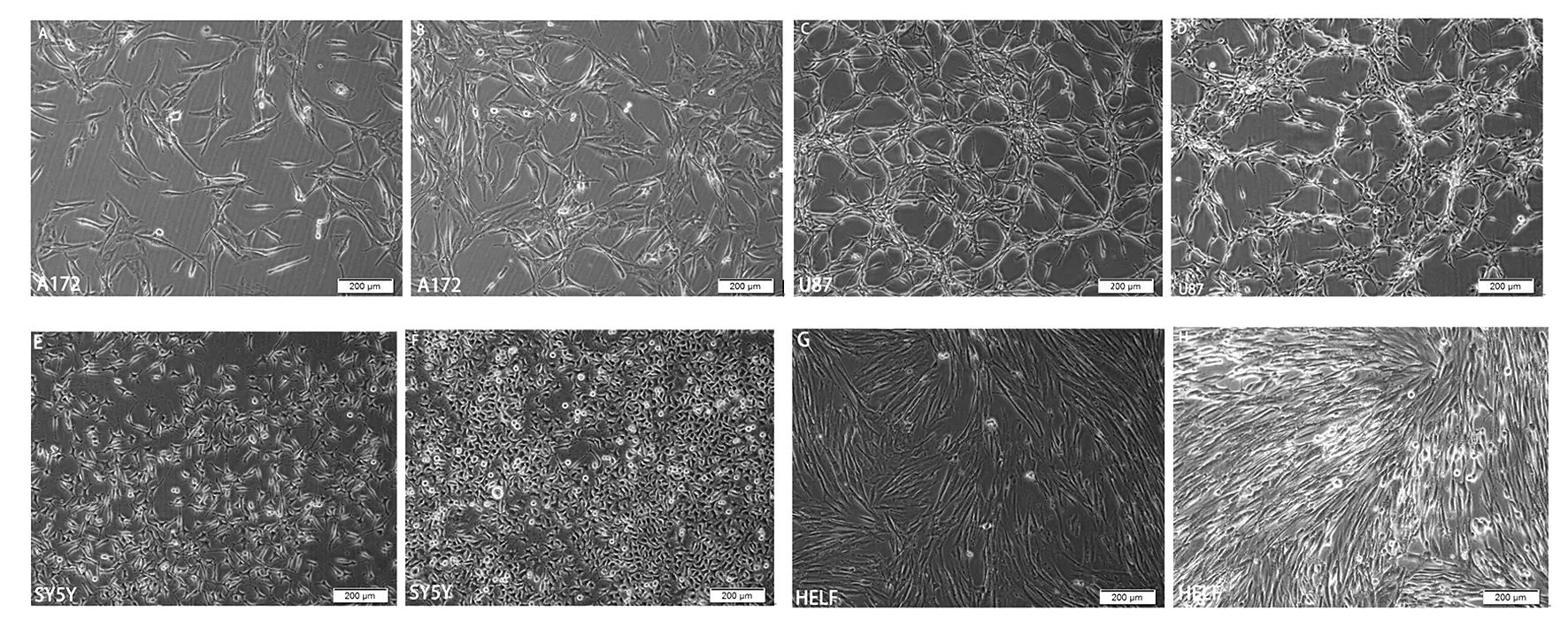
图1 A172、U87、SY5Y和HELF感染HCMV后形态变化Fig.1 The morphology changes of the A172、U87、SY5Y and HELF which were infected with HCMVA、C、E、G:未感染HVMV细胞;B、D、F、H:感染HVMC 72 h后细胞A,C,E,G:mock infected;B,D,F,H:infected with HCMV 72 h
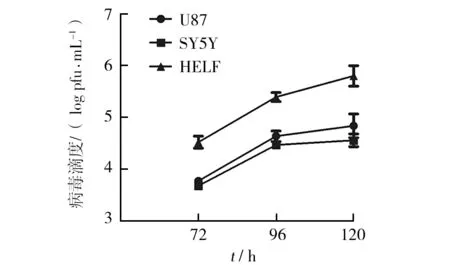
图2 HCMV感染胶质瘤和HELF收集上清检测病毒滴度Fig.2 HCMV infection HELF and glioma cells then the supernatant was collected to detect the virus titer
2.2 HCMV感染U87、SY5Y及A172后其IE2、UL44、UL99及ATF5基因mRNA表达
Real-time PCR检测显示,HCMV感染U87、SY5Y细胞在12 h IE2基因表达显著增高,UL44在12 h开始表达48 h达高峰,UL99在12 h开始有表达72 h达高峰,ATF5在72 h表达出现高峰;而HCMV感染A172细胞仅UL44在72 h有少量表达,ATF5的表达较低。U87、SY5Y及A172中IE2、UL44、UL99及ATF5 mRNA相对表达含量见图3。

图3 Real-time PCR检测A172、U87和SY5Y组IE、UL44、UL99、ATF5 mRNA的表达Fig.3 Expressions of IE、UL44、 UL99、ATF5 mRNA in A172、U87 and SY5Y cells infected with HCMV by Real-time PCRA:A172细胞;B:U87细胞;C:SY5Y细胞,图4同A:A172 cell;B:U87 cell;C:SY5Y cell,same figure 4
2.3 HCMV感染U87、A172后其IE2、UL44、UL99及ATF5蛋白表达
Western-blot检测显示,HCMV感染U87、SY5Y细胞,IE2蛋白在24 h显著表达,在96 h达高峰,UL44在24 h开始表达72 h明显增高,96 h达高峰,UL99在48 h开始有表达96 h达高峰,ATF5表达在72 h明显增高96 h出现高峰,IE2、UL44、UL99及ATF5四种蛋白相对表达含量均高于未感染组和A172组(P<0.05);而HCMV感染A172细胞仅UL44在96 h有少量表达, ATF5的表达低于U87、SY5Y细胞(见图4)。结果与Real-time PCR结果一致,A172、U87及SY5Y中IE2、UL44、UL99及ATF5 蛋白相对表达含量见表1。
HCMV感染U87、SY5Y两组细胞后,Pearson相关分析结果显示IE2与ATF5表达具有明显正相关性,U87(r=0.955,P<0.05),SY5Y(r=0.956,P<0.05)。而HCMV IE基因编码产生的即刻早期蛋白可激活E基因,E基因编码的蛋白参与病毒复制[1],IE基因编码两种重要的调控蛋白IE1(IE72)和IE2(IE86);有文献报道CREB-A可以和IE蛋白相互作用,并可以激活HCMV UL112-113启动子,从而启动病毒基因表达[3-6],而本研究的转录激活因子5(ATF5)隶属转录因子ATF/CREB家族,能与细胞内多种蛋白分子相互作用,共同调节基因的转录,因此下调ATF5在U87、SY5Y细胞表达,检测ATF5对HCMV复制水平的影响。
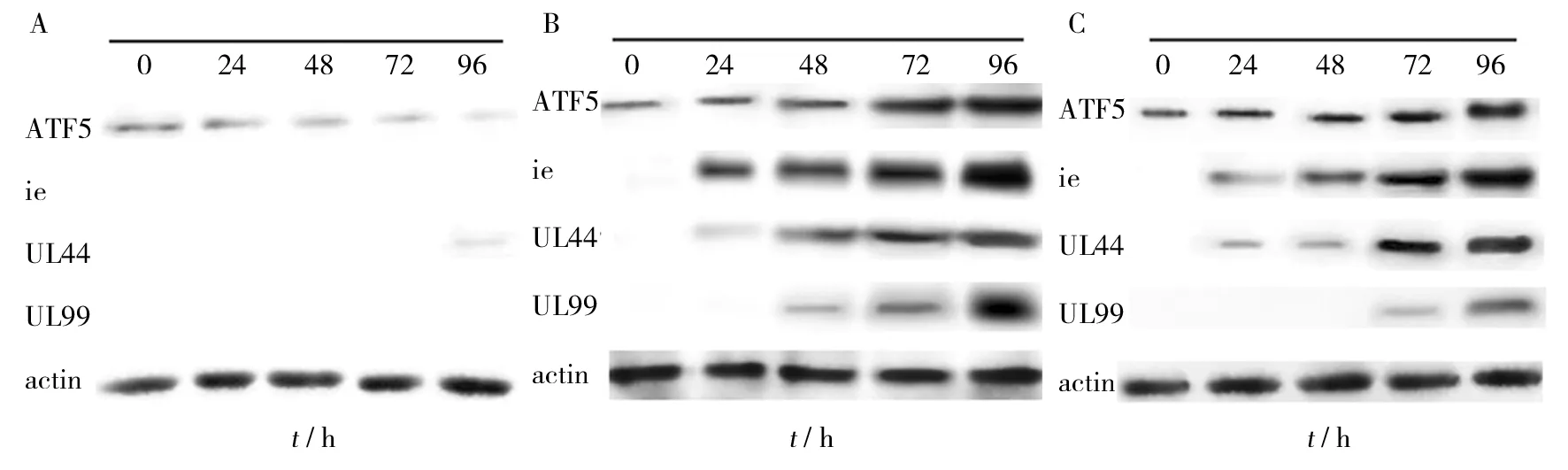
图4 Western-blot检测A172、U87和SY5Y组IE、UL44、UL99、ATF5蛋白的表达Fig.4 Expressions of IE,UL44, UL99 and ATF5 protein in A172,U87 and SY5Y cells infected with HCMV by Western-blot
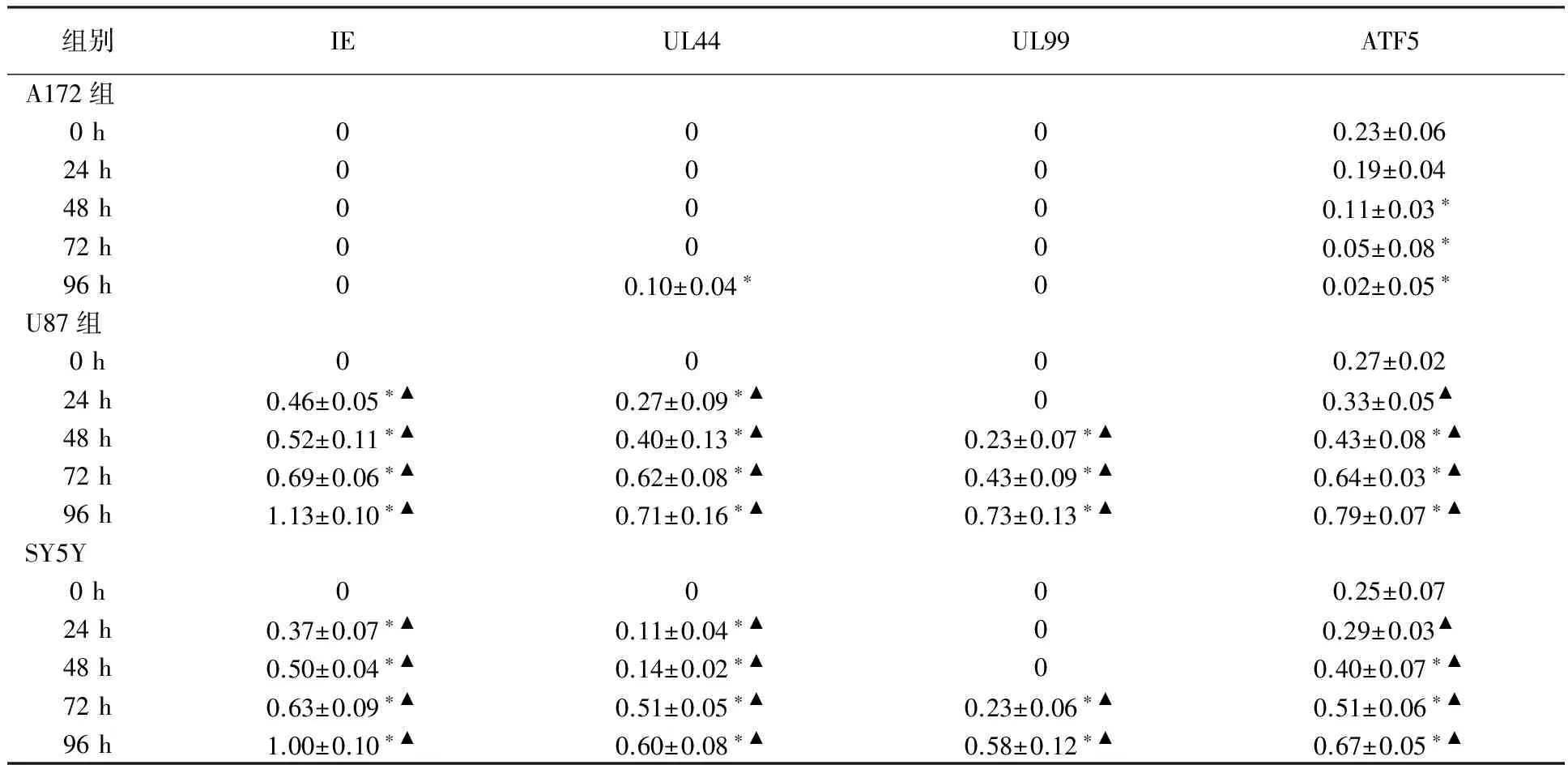
组别IEUL44UL99ATF5A172组0h0000.23±0.0624h0000.19±0.0448h0000.11±0.03∗72h0000.05±0.08∗96h00.10±0.04∗00.02±0.05∗U87组0h0000.27±0.0224h0.46±0.05∗▲0.27±0.09∗▲00.33±0.05▲48h0.52±0.11∗▲0.40±0.13∗▲0.23±0.07∗▲0.43±0.08∗▲72h0.69±0.06∗▲0.62±0.08∗▲0.43±0.09∗▲0.64±0.03∗▲96h1.13±0.10∗▲0.71±0.16∗▲0.73±0.13∗▲0.79±0.07∗▲SY5Y0h0000.25±0.0724h0.37±0.07∗▲0.11±0.04∗▲00.29±0.03▲48h0.50±0.04∗▲0.14±0.02∗▲00.40±0.07∗▲72h0.63±0.09∗▲0.51±0.05∗▲0.23±0.06∗▲0.51±0.06∗▲96h1.00±0.10∗▲0.60±0.08∗▲0.58±0.12∗▲0.67±0.05∗▲
注:A172、U87、SY5Y三组细胞与自身未感染病毒组细胞相比*P<0.05 ,在相同时间点U87、SY5Y分别与A172相比 ▲P<0.05
2.4 慢病毒感染U87、SY5Y细胞效率检测
在Complete Medium+5 μg/mL Polybrene条件下U87(MOI=1)、SY5Y(MOI=15)慢病毒感染效率最高(感染效率=每个高倍镜下荧光细胞数量/同一镜下普通显微镜计数)在感染72 h时转染效率可达95 %,激光共聚焦显微镜下可见红色荧光蛋白(图5)。

图5 荧光显微镜检测慢病毒感染效率Fig.5 Detect the lentivirus infection efficiency by fluorescence microscopyA:慢病毒感染的U87细胞(微分干涉显微镜(DIC));B:慢病毒感染的U87细胞(荧光显微镜);C:merge;D:慢病毒感染的SY5Y的细胞(微分干涉显微镜(DIC));E:慢病毒感染的SY5Y细胞(荧光显微镜);F:mergeA:U87 cell infected with lentivirus(differential interference contrast microscope (DIC));B:U87 cell infected with lentivirus(Fluorescence microscope);C:merge;D:SY5Y cell infected with lentivirus(differential interference contrast microscope (DIC));E: SY5Y cell infected with lentivirus(Fluorescence microscope);F:merge
2.5 慢病毒对ATF5沉默效率的检测
慢病毒稳定转染U87和SY5Y细胞后提取蛋白,Western-blot检测,结果显示LV-ATF5-RNAi组中ATF5表达明显减低,而正常组和阴性对照CON053组ATF5的表达无明显变化(图6),其中U87细胞正常组、阴性对照CON053组和LV-ATF5-RNAi组ATF5的相对表达量分别为0.31±0.02、0.29±0.02、0.07±0.03,SY5Y细胞正常组、阴性对照CON053组和LV-ATF5-RNAi组ATF5的相对表达量分别为0.29±0.01、0.28±0.04、0.06±0.03。

图6 Western-blot 检测慢病毒对ATF5的沉默效率Fig.6 Western-blot analyzes the efficiency of lentiviral silencing ATF51~3:U87细胞;4~6:SY5Y细胞;1、4正常细胞组;2、5:阴性对照CON053组;3、6:LV-ATF5-RNAi组1~3:U87 cell;4~6:SY5Y cell,1,4 the normal group;2,5:the CON053 group;3,6:LV-ATF5-RNAi group
2.6 沉默ATF5表达,病毒在胶质瘤细胞中mRNA表达水平的变化
Real-time PCR检测显示,沉默ATF5的U87、SY5Y细胞IE2在12 h开始表达72 h表达最多;UL44、UL99在24 h开始有表达72 h表达最多。IE2、UL44、UL99与相应时间点阴性对照CON053组相比其相对表达量均下降(见图7)。

图7 Real-time PCR检测ATF5 的U87和SY5Y细胞中 IE、UL44、UL99 mRNA的表达Fig.7 Expressions of IE,UL44, UL99 mRNA in U87,SY5Y cells after silencing ATF5 expression by Real-time PCRA:U87细胞CON053组;B:U87细胞LV-ATF5-RNAi组;C:SY5Y细胞CON053组;D:SY5Y细胞LV-ATF5-RNAi组,图8同 A:U87 cell CON053 group;B:U87 cell LV-ATF5-RNAi group;C:SY5Y cell CON053 group;D:SY5Y cell LV-ATF5-RNAi group,same figure 8
2.7 沉默ATF5表达,病毒在胶质瘤细胞中蛋白表达水平的变化
Western-blot检测显示, HCMV感染沉默ATF5的U87、SY5Y细胞后IE2蛋白在24 h开始有表达,在96 h达高峰;UL44蛋白U87细胞在24 h开始表达,SY5Y细胞在48 h有表达,两细胞在96 h达高峰;UL99蛋白在72 h开始有表达(见图8)。IE2、UL44、UL99与相应时间点阴性对照CON053组相比其表达量均下降(P<0.05),结果与Real-time PCR结果一致(见表2、3),结果表明下调ATF5的表达后,HCMV在U87、SY5Y细胞中复制水平下降。
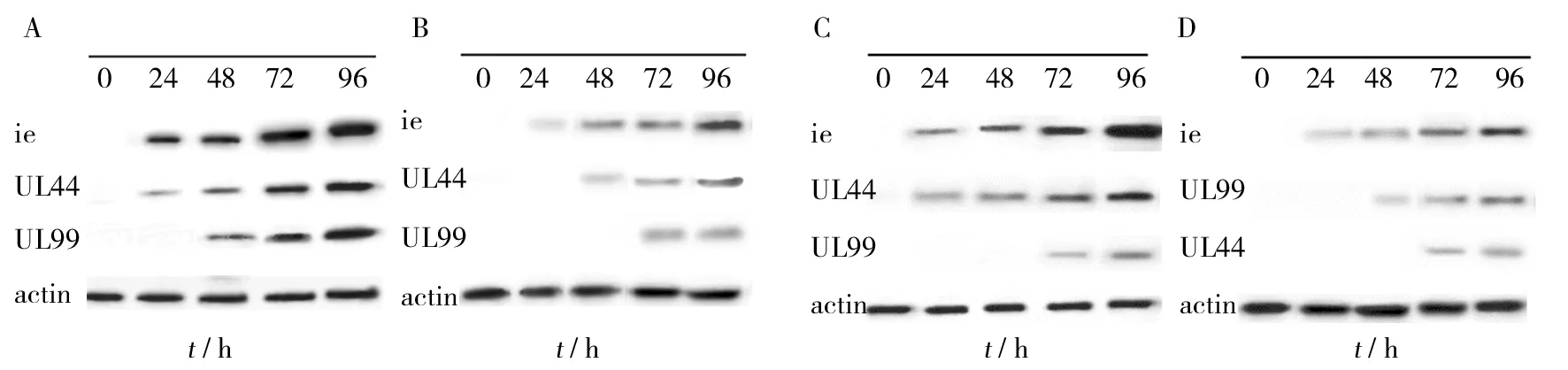
图8 Western-blot检测沉默ATF5 的U87和SY5Y 细胞中IE、UL44、UL99蛋白的表达Fig.8 Expressions of IE,UL44 and UL99 protein in U87 and SY5Y cells after silencing ATF5 expression by Western-blot
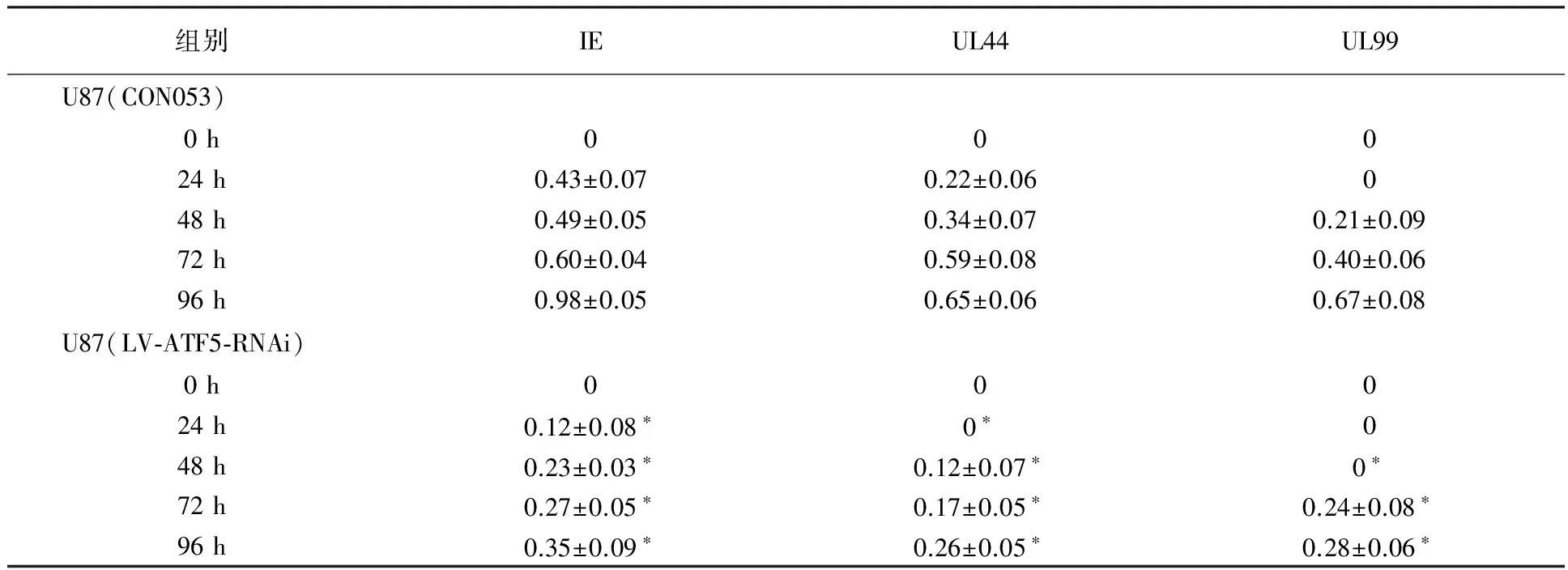
组别IEUL44UL99U87(CON053)0h00024h0.43±0.070.22±0.06048h0.49±0.050.34±0.070.21±0.0972h0.60±0.040.59±0.080.40±0.0696h0.98±0.050.65±0.060.67±0.08U87(LV⁃ATF5⁃RNAi)0h00024h0.12±0.08∗0∗048h0.23±0.03∗0.12±0.07∗0∗72h0.27±0.05∗0.17±0.05∗0.24±0.08∗96h0.35±0.09∗0.26±0.05∗0.28±0.06∗
注:相同时间点U87(LV-ATF5-RNAi)组与U87(CON053)组相比*P<0.05
表3 沉默ATF5的SY5Y细胞IE、UL44和UL99蛋白相对表达量比较
注:相同时间点SY5Y(LV-ATF5-RNAi)组与SY5Y(CON053)组相比*P<0.05
3 讨 论
人巨细胞病毒感染和神经胶质瘤关系密切, 调节HCMV复制和再激活的因素并不十分清楚,但细胞因子可能起到重要作用,在病毒基因激活时细胞转录因子和病毒反式激活因子是必不可少的[10-13]。病毒编码的主要即刻早期调控蛋白IE86可与宿主细胞中转录因子相互作用从而激活自身的表达,而在一些非允许细胞系中IE的表达受到抑制,有研究已证明IE基因编码产生的即刻早期蛋白可激活E基因编码的蛋白参与病毒复制[1]。
转录激活因子 5(ATF5)是神经胶质瘤的一个标志性转录因子,最近研究表明CREB-A可以和IE蛋白相互作用,并可以激活HCMV UL112-113启动子,从而启动病毒基因表达[3-6]。转录激活因子5(ATF5)隶属转录因子ATF/CREB家族,具有亮氨酸拉链(bZIP)的特征结构域,能与细胞内多种蛋白分子相互作用,共同调节基因的转录[8-9]。许多研究表明ATF5与细胞增殖分化凋亡有关[14-15]。然而有关ATF5的表达对HCMV复制水平的影响少见报道。
本研究发现,HCMV感染不同胶质瘤细胞后病毒复制水平不一,Real-time PCR 及Western-blot显示在不同胶质瘤细胞中ATF5的表达与IE2的表达具有明显正相关性,提示ATF5的表达可能促进HCMV病毒的复制。为进一步证明ATF5在HCMV感染中可能的作用,以慢病毒为载体构建ATF5小干扰RNA下调ATF5在U87、SY5Y细胞的表达。沉默U87、SY5Y细胞内源性ATF5后,观察HCMV感染胶质瘤细胞后IE表达水平的变化。结果显示,下调ATF5的表达,病毒蛋白表达显著下降(P<0.05)。结果表明,下调ATF5的表达可抑制HCMV病毒的复制。因此,预防HCMV感染或者下调细胞内源性ATF5表达,可作为治疗胶质瘤新的治疗靶点。本研究仅对ATF5表达和HCMV在神经胶质瘤复制水平表型作了初步研究,其具体分子机制还有待进一步研究。
[1] Luo MH,Fortunato EA.Long-Term Infection and Shedding of Human Cytomegalovirus in T98G Glioblastoma Cells[J].J Virol,2007,81(19): 10424-10436.
[2] Cobbs CS,Harkins L,Samanta M,et al.Human cytomegalovirus infection and expression in human malignant glioma[J].Cancer Res,2002,62(12):3347-3350.
[3] Kew VG,Yuan J,Meier J,et al.Mitogen and stress activated kinases act co-operatively with CREB during the induction of human cytomegalovirus immediate-early gene expression from latency[J]. PLoS Pathog,2014,10(6):e1004195.
[4] Philip Lashmit, Shuhui Wang, Hongmei Li, et al. The CREB Site in the Proximal Enhancer Is Critical for Cooperative Interaction with the Other Transcription Factor Binding Sites To Enhance Transcription of the Major Intermediate-Early Genes in Human Cytomegalovirus-Infected Cells[J].J Virol,2009,83(17):8893-904.
[5] Rodems SM,Clark CL,Spector DH.Separate DNA Elements Containing ATF/CREB and IE86 Binding Sites Differentially Regulate the Human Cytomegalovirus UL112-113 Promoter at Early and Late Times in the Infection[J].J Virol,1998,72(4):2687-2707.
[6] Lang D,Gebert S,Alt H,et al.Functional interaction between the human cytomegalovirus 86-kilodalton IE2 protein and the cellular transcription factor CREB[J].J Virol,1995,69(10):6030-6037.
[7] Wu L,Zhang X,Che Y,et al.A cellular response protein induced during HSV-1 infection inhibits viral replication by interacting with ATF5[J]. Sci China Life Sci,2013,56(12):1124-1133.
[8] Yuanyan Wei,Yuqing Ge,Fengbiao Zhou,et al.Identification and characterization of the promoter of human ATF5 gene[J]. J Biochem, 2010,148(2):171-178.
[9] 叶雄俊,张志文,张新军,等.ATF5与TCF4相互作用及其对Wnt信号通路的调控[J].科学通报,2003,48(6):582-588.
[10]Xiaoqiu Liu,Jinxiang Yuan,Allen W Wu,et al.Phorbol Ester-Induced Human Cytomegalovirus Major Immediate-Early(MIE)Enhancer Activation through PKC-Delta,CREB,and NF-κB Desilences MIE Gene Expression in Quiescently Infected Human Pluripotent NTera2 Cells[J].J Virol, 2010,84(17):8495-508.
[11]Colberg-Poley AM,Santomenna LD,Harlow PP,et al.Human cytomegalovirus US3 and UL36-38 immediate-early proteins regulate gene expression[J].J Virol,1992,66(1):95-105.
[12]Kerry JA,Priddy MA,Jervey TY,et al.Multiple regulatory events influence human cytomegalovirus DNA polymerase (UL54) expression during viral infection[J].J Virol,1996,70(1):373-382.
[13]Liu B,Stinski MF.Human cytomegalovirus contains a tegument protein that enhances transcription from promoters with upstream ATF and AP-1 cis-acting elements[J].J Virol,1992,66(7):4434-4444.
[14]王桐梅,钱冬萌,胡明,等.HCMV感染对恶性胶质瘤U87细胞增殖及ATF5表达的影响[J].微生物学杂志,2014,34(1):17-21.
[15]Angelastro JM,Canoll PD,Kuo J,et al.Selective destruction of glioblastoma cells by interference with the activity or expression of ATF5[J].Oncogene,2006,25(6):907-916.
The Effects of ATF5 Expression Level in Glioma Cells on HCMV Replication
ZHANG Xue, QIAN Dong-meng, HU Ming, CHEN Hao, LI Ling, ZHANG Li, SONG Xu-xia, WANG Bin
(Teach. &Res.Div.ofPatho.Microb.,Col1.ofMed.QingdaoUni.,Qingdao266071)
The replication levels of human cytomegalovirus (HCMV) in gliomata are different, and the mechanism is still unknown. In this study the changes of replication levels of the virus after its infection of gliomata were detected through down-regulation of the expression of activation transcription factor 5 (ATF5) in gliomata. Firstly, cells U87, SY5Y, and A172 were infected with HCMV respectively, and observe the changes of their cellular morphology, and collect each of their supernatants at the time points of 24, 48, 72, 96, and 120 h to test their viral titers, and detect the expression situation of incontinent incipient gene IE2, incipient gene UL44, terminal gene UL99, and ATF5 with real-time PCR, and detect the expression situation of the HCMV coded protein and ATF5 with Western-blot. The results showed that as compared the replication level of HCMV in cells A172 with the ones in cells U87 and SY5Y, the group of U87 and SY5Y cells were significantly higher than that of the replication level in the group of A172 cells (P<0.05); and as compared the expression of ATF5 in the groups of U87 cell and SY5Y cell were significantly higher than the group of A172 (P<0.05); Using lentivirus mediation RNA interfering technique to down-regulate the expression of ATF5 in U87 and SY5Y, using HCMV infected cells to detect the expression of viral gene and protein, the results showed that the down-regulation of the expression of ATF5 could inhibit the replication of HCMV (P<0.05). The above results showed that down-regulate the expression level of ATF5 in glioma cell could inhibit the replication level of HCMV.
human cytomegalovirus (HCMV); activation transcription factor 5 (ATF5); replication; human glioma cell; viral gene
国家自然科学基金项目(81471958);青岛大学创新团队青年教师培育项目;青岛市博士后应用研究项目资助(2015160)
张雪 女,硕士研究生。主要研究方向为病毒基因工程与蛋白质组学研究。E-mail:zhangxueqy701@163.com
* 通讯作者。男,博士,教授,博士生导师。主要研究方向为分子病毒学。Tel:0532-83780032,E-mail:wangbin532@126.com
2015-05-03;
2015-05-16
Q939.93; R 373.9
A
1005-7021(2016)02-0025-08
10.3969/j.issn.1005-7021.2016.02.005

