1株滩涂沉积物反硝化细菌的鉴定及其性能研究
沈 辉, 万夕和, 蒋 葛, 黎 慧, 乔 毅, 孙瑞健,王李宝, 凌 云, 史文军, 何培民*
(1.上海海洋大学 生命与水产学院,上海 201306;2.江苏省海洋水产研究所,江苏 南通 226007)
1株滩涂沉积物反硝化细菌的鉴定及其性能研究
沈 辉1,2, 万夕和2, 蒋 葛1, 黎 慧2, 乔 毅2, 孙瑞健2,王李宝2, 凌 云2, 史文军2, 何培民1*
(1.上海海洋大学 生命与水产学院,上海 201306;2.江苏省海洋水产研究所,江苏 南通 226007)
利用富集培养法从江苏沿海滩涂沉积物中分离筛选获得1株具有反硝化性能的细菌,命名为MD5。通过形态学观察、糖发酵及16S rDNA序列分析对其进行了分类鉴定、系统发育地位及反硝化性能等方面的研究。结果表明,该菌株能在厌氧条件下利用硝酸钠进行反硝化反应,在初始硝酸盐质量浓度为1 500 mg/L、30 ℃培养条件下,144 h后培养基中硝酸盐脱除率可达90.1%;在好氧培养条件下,该菌株可使能力测试管中硝酸盐质量浓度下降89.3%。菌株MD5的形态学、糖发酵结果与盐单胞菌一致,且基因序列与盐单胞属(Halomonas)细菌Halomonassp. IW11-1 (AB305262.1)的序列同源性达到99%,表明菌株MD5为1株盐单胞属细菌。本研究分离得到的菌株MD5在厌氧和好氧条件下均具有较强的反硝化能力,对海洋沉积物脱氮具有一定的意义。
反硝化细菌;盐单胞菌;脱氮
1 材料与方法
1.1 材料
1.1.1 培养基(g) ①富集培养基:参照张玉芹等[16]方法并做部分调整,成分如下:K2HPO40.4,MgSO40.1,Na2HPO40.6, CH3COONa 3,NH4Cl 1.0,KNO31.0,FeCl20.1,酵母膏0.5,葡萄糖10,陈海水1 L;②分离纯化培养基:蛋白胨10,酵母膏5,葡萄糖1,陈海水1 L;③能力测试液体培养基:蛋白胨10 g,牛肉膏5 g,葡萄糖1 g,KNO31.5,陈海水1 L。
1.1.2 主要试剂及仪器 蛋白胨、酵母膏等试剂购自上海国药公司;GeneScience AG25厌氧培养罐;Nikon E200生物光学显微镜;飞利浦CM100电子显微镜;ABI 9600核酸扩增仪;Lachat flow injection analyzer QC8500流动注射分析仪。
1.2 方法
1.2.1 采样与富集培养 取5 cm深度的亚表层海洋沉积物放入无菌采样袋,置于采样箱里带回实验室。取20 g沉积物置于1 L灭菌海水中振荡1 h后,将悬液加入到富集培养基中,取3 mL悬液加入300 mL富集培养基。培养7 d后,取1 mL培养液接种于200 mL新鲜的富集培养液中,反复3次后,将培养物在分离纯化固体培养基上进行稀释涂布,并在厌氧罐中进行厌氧培养。
1.2.2 菌株分离、筛选 将涂布得到的菌落在分离纯化培养基中进行再次纯化,直至菌落清晰、单一。将得到的纯化菌株接种到能力测试管中,并用石蜡覆盖液面,隔绝氧气。将能力测试管于30 ℃培养3 d,根据能力测试管中产气量的多少进行复筛,蘸取培养物在分离固体培养基上进行划线培养。
1.2.3 菌株鉴定 ①光学显微观察:对筛选得到的菌株进行革兰染色,显微观察并拍照。②糖发酵实验:按伯杰氏细菌鉴定手册(第8版)中方法,对菌株的半乳糖、山梨糖、蔗糖等进行发酵实验。③电子显微观察:将MD5滴加在覆有Formver膜的铜网上,约5 min后从铜网边缘吸去多余液体,室温风干,滴加浓度2%、pH 7.2的磷钨酸负染5 min,用滤纸吸去多余染液,室温风干,于透射电镜下观察摄片。④分子生物学鉴定:筛选菌株DNA提取采用上海生工生物工程公司的细菌DNA提取试剂盒(SK8225)。菌株的16S rDNA扩增上、下游引物为27F及1492R(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492r:5′-TACGGCTACCTTGTTACGACTT-3′)。PCR反应体系为25 μL,即DNA模板1.5 μL,Taq酶0.5 U,dNTP混合液(各2.5 mmol/L)2 μL,10×buffer 2.5 μL,正反向引物(10 pmol/L)各1 μL,超纯水补至25 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性60 s, 50 ℃退火60 s,72 ℃延伸90 s,循环30次;72 ℃延伸5 min。PCR产物直接测序,由上海生工生物工程有限公司完成。
2 结果与分析
2.1 滩涂反硝化细菌的筛选
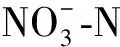
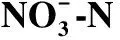
Table 1 The nitrate nitrogen concentration changes in different culture tube
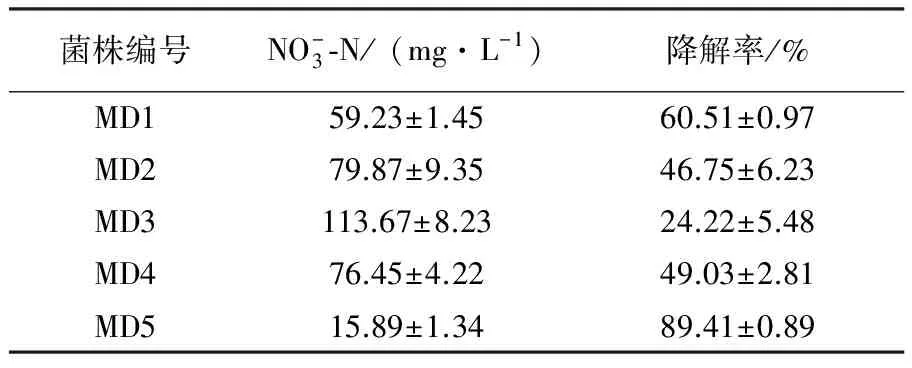
菌株编号NO-3⁃N/(mg·L-1)降解率/%MD159.23±1.4560.51±0.97MD279.87±9.3546.75±6.23MD3113.67±8.2324.22±5.48MD476.45±4.2249.03±2.81MD515.89±1.3489.41±0.89
2.2 菌株MD5的鉴定
2.2.1 形态特征 由图1可知,菌株MD5在分离纯化培养基上的菌落呈浅黄色,表面光滑,半透明,凸起呈圆形,革兰染色阴性,菌体呈短杆状,分散排列。由透射电镜负染照片可见,细胞形态为杆状,大小为(0.4~0.6) μm×(0.8~1.2) μm,有周生鞭毛。

图1 菌株MD5的形态观察Fig.1 Morphology of MD5
2.2.2 糖发酵实验 对菌株MD5进行糖发酵实验,半乳糖、山梨糖、蔗糖、阿拉伯糖、木糖及核糖反应阴性,菊糖反应阳性。
2.2.3 16S rDNA同源性比对及系统发育分析 对菌株MD5的16S rDNA序列进行PCR扩增,得到约1 500 bp的DNA片段,将目的片段的DNA胶回收后进行测序分析,测序结果提交GenBank进行Blast检索,与盐单胞菌属Halomonassp. IW11-1 (AB305262.1)菌株的同源性达到99%,得到序列编号为KM362826。另外将序列提交至http://rdp.cme.msu.edu/classifier/classifier.jsp比对发现,该菌株同样为盐单胞属细菌。系统发育树分析发现,菌株MD5与盐单胞属细菌聚类到一个分支,与反硝化细菌类的色杆菌属Chromobacterium细菌及盐芽胞杆菌属Halobacillus细菌分别聚类在不同的分支上(图2)。因此,结合形态学、糖发酵及分子比对结果,将菌株MD5鉴定为盐单胞菌属细菌。
2.3 菌株MD5的反硝化特征
厌氧条件下,120 h后MD5能力测试管中硝酸盐质量浓度下降可达90.1%,且在培养过程中,产生大量气泡,而对照管中未见气泡产生。经144 h能力测试后表明,菌株MD5在厌氧条件下具有很强的反硝化活性,能有效去除海水中的硝酸盐(图3)。另外,菌株MD5在0~3 h未出现明显的生长趋势为生长延滞期,培养基中硝酸盐质量浓度变化较小。24~72 h为菌落指数生长期,测试管中硝酸盐质量浓度下降显著。

图3 菌株MD5在厌氧条件下的生长情况及硝酸盐去除效果Fig.3 Growth of MD5 and removal of nitrate-N under the anaerobic conditions
在好氧条件下,菌株MD5测试管中同样有大量气泡产生,对照管中也未见气泡产生,144 h后测试管中硝酸盐质量浓度下降89.3%(图4)。结果表明,菌株MD5在好氧条件下同样能利用测试培养基中的硝酸盐,具有较强的反硝化活性。
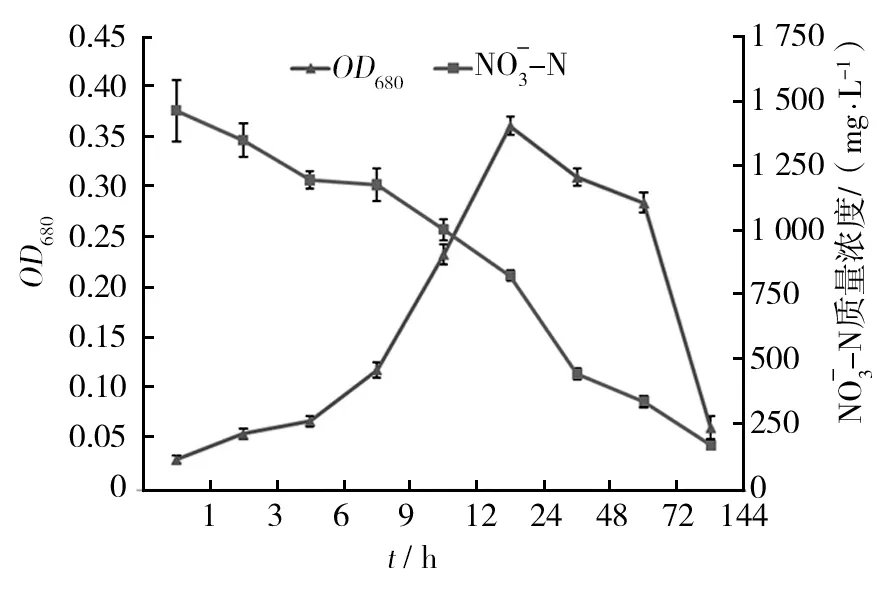
图4 菌株MD5在好氧条件下的生长情况及硝酸盐去除效果Fig.4 Growth of MD5 and removal of nitrate-N under the aerobic conditions
3 讨 论
早期理论认为,反硝化作用只能在严格厌氧条件下进行。自1984 年Robertson等[18]从反硝化系统中首次分离出好氧反硝化细菌以来,相继大量报道了好氧反硝化细菌, 主要属于红球菌属(Paracoccus)[19]、芽胞杆菌属(Bacillus)[20]、假单胞菌属(Pseudomonas)[21]、盐单胞菌属(Halomonas)等[22]。本研究中菌株MD5为盐单胞菌属细菌,属于γ变形菌纲盐单胞菌科(Halomonadaceae),同样在好氧条件下具有较强的反硝化能力。目前报道的盐单胞菌属细菌均生长在盐度较高的海洋环境中,如海水[23]、盐场[24]、盐碱地[25]、盐水湿地[26]等。
目前,对富营养化水体的生物修复报道较多,应用较为广泛的为日本琉球大学比嘉照夫发明的EM菌、美国Probiotic Solutions公司的Bio-energizer及美国Alken-Murry公司开发的Clear-flo等专利微生态制剂。利用微生物反硝化作用去除地下水中过量的硝酸盐也有一定的研究报道[28-29],但针对沉积物或土壤中硝酸盐的去除研究较少。近年来,针对沉积物环境修复仍处在研究探索阶段。刘咏等[30]从巢湖湿地土壤中分离筛选得到高效的异养反硝化细菌,结合蒲苇秸秆共同施用于硝酸盐污染的土壤中,其硝酸盐降解能力达到90%。全为民等[31]从长江沉积物中筛选分离出1株海洋反硝化细菌,模拟了该细菌对硝酸盐氮的去除效率,室内实验证实细菌具有较强的反硝化作用。本研究从滩涂沉积物中分离得到菌株MD5,具有较强的反硝化及耐盐能力,可应用于海洋沉积物环境中的去营养化研究。
[1] 刘海洋,戴志军. 中国近海污染现状分析及对策[J]. 环境保护科学,2001,27(6):6-9.
[2] 姜晟,李俊龙,李旭文,等.江苏近岸海域富营养化评价与成因分析[J].环境监测管理与技术,2012,24(4):26-29.
[3] Conley J, Stockenberg A, Carman R,et al.Sediment-water nutrient fluxes in the Gulf of Finland, Baltic Sea [J]. Estuarine, Coastal and Shelf Science,1997,45(5): 591-598.
[4] Wang D D, Sun Y, Shi X Y,et al. Distribution of different phosphorus forms in sediments of Eastern Rushan Bay[J].Acta Ecologica Sinica, 2008, 28(5): 2417-2423.
[5] Howarth RW. Comparative responses of aquatic ecosystems to toxic chemical stress [M]. In: Comparative analysis of ecosystems: patterns, mechanisms, and theories. Cole J.J., Findlay S., and Lovett G. (Ed.). Springer-Verlag, New York, USA,1991: 169-195.
[6] Cotner J B, Biddanda BA. Small players, large role: Microbial influence on biogeochemical processes in pelagic aquatic ecosystems[J].Ecosystems, 2002, 5(2): 105-121.
[7] Francis C A, Berman J M, Kuypers M M.New processes and players in the nitrogen cycle: the microbial ecology of anaerobic and archaeal ammonia oxidation[J].The ISME Journal, 2007,1(1): 19-27.
[8] 贺纪正,张丽梅.氨氧化微生物生态学与氮循环研究进展[J].生态学报,2009,29(1):706-715.
[9] 方芳,陈少华.功能基因在反硝化菌群生态学研究中的应用[J].生态学杂志,2010,29(9):1836-1845.
[10]Peng Y, Zhu G. Biological nitrogen removal with nitrification and denitrification via nitrite pathway [J]. Applied Microbiology and Biotechnology, 2006, 73 (1): 15-26.
[11]Hicks B N. Bioremediation: A natural solution [J].Pollution Engineering, 1993, 25(2):30-33.
[12]郑天凌,庄铁城,蔡立哲,等. 微生物在海洋污染环境中的生物修复作用[J]. 厦门大学学报(自然科学版),2001, 4 (2):524 -534.
[13]Nuhoglu A, Pekdemir T, Yildiz E, et al. Drinking water denitrification by a membrane bioreactor[J].Water Research, 2002, 36(5): 1155-1166.
[14]Ma Y, Peng Y Z, Wang X L. Improving nutrient removal of the AAO process by an influent bypass flow by denitrifying phosphorus removal[J].Desalination,2009,246(1-3):534-544.
[15]刘小英,林慧,马兆瑞,等. 同步脱氮除磷颗粒污泥硝化反硝化特性试验研究[J]. 环境科学,2014,35(1):214-221.
[16]张玉芹,刘开启,王革,等. 反硝化细菌的筛选及培养条件的研究[J]. 农业环境科学学报,2005,35(1):165-168.
[17]闫海,林毅雄,孙建新. 海水微生物菌群去除铵氮和亚硝酸氮研究[J]. 环境污染治理技术与设备,2003,11(4):44-47.
[18]Robertson L A, Kuenen J G. Aerobic Denitrification: A controversy Revised[J].Archives of Microbiology,1984,139(4): 351-354.
[19]张光亚,陈培钦.好氧反硝化菌的分离鉴定与特性研究[J].微生物学杂志,2005,25(6): 23-26.
[20]于爱茸,李尤,俞吉安.一株耐氧反硝化细菌的筛选及脱氮性研究[J].微生物学杂志,2005,25(3): 77-82.
[21]Bonin P, Gilewic M C. A direct demonstration of “co-respiration”of oxygen and nitrogen oxide by Pseudomonas nautical: some spectral and kinetic properties of the respiratory components [J]. FEMS Microbiology Letters, 1991, 80(2):183-188.
[22]Guo Y, Zhou X, Li Y, et al. Heterotrophic Nitrification and aerobic Denitrification by a NovelHalomonascampisalis[J]. Biotechnology. Letters., 2013, 35(12): 2045-2049.
[23]徐德强, 黄静娟, 张纪忠, 等. 盐单胞菌属一新种黄海盐单胞菌[J]. 微生物学报, 1995, 35(5):315-321.
[24]朱凤玲,曲凌云,洪旭光,等. 盐单胞菌属一新种的分离与鉴定[J]. 海洋科学进展,2011,29(2):221-228.
[25]Juan A M, Jose M C, Emilia Q, et al. A detailed Phenotypic Characterization of the Type Strains ofHalomonasSpecies [J]. Systemic and Applied Microbiology, 2002, 25(3): 360-375.
[26]Dobson S J, Franzmann P D. Unification of the genera Deleya (Baum an et al. 1993) ,Halomonas(Vreeland et al. 1980 ) , andHalovibrio(Fendrich 1988) and the speciesParacoccushalodenitrificans(Robinson and Gibbons 1952) in to a single genusHalomonas, and placement of the genusZymobacterin the familyHalomonadaceae[J]. International Journal of Systematic Bacteriology, 1996, 46(6):550-558.
[27]张培玉, 郭艳丽, 于德爽, 等. 一株轻度嗜盐反硝化细菌的分离鉴定和反硝化特性初探[J]. 微生学通报, 2009, 36(4): 581-586.
[28]Dahab M F, Sirigina S. Nitrate removal from water supplies using biodenitrification and GAG-S and filter system [J]. Water Science Technology, 1994,30(9): 133-139.
[29]Bandpi M A, Elliott D J, Momeny-Mazdeh A. Denitrification of ground water using acetic acid as a carbon source [J]. Water Science and Technology, 1999,40(2): 53-59.
[30]刘咏,毕井辉,陈干,等.巢湖芦苇湿地去除硝酸盐污染的调查与分析[J].合肥工业大学学报,2010,33(3):421-425.
[31]全为民,沈新强,甘居利,等.海洋沉积物中反硝化细菌的分离及去除硝酸盐氮的模拟试验[J].海洋渔业,2005,27(3):232-235.
Identification of a Denitro-Bacterium Strain from Low Beach Sediment
SHEN Hui1, 2, WAN Xi-he2, JIANG Ge1, LI Hui2, QIAO Yi2, SUN Rui-jian2, WANG Li-bao2, LING Yun2, SHI Wen-jun2, HE Pei-min1
(1.ShanghaiOceanUni.,Shanghai201306;2.JiangsuMarineFisheriesRes.Inst.,Nantong226007)
A denitrification-possessing bacterium strain was isolated and screened with enrichment culture method from low beach sediment in Jiangsu coastal area. Through morphological observation, sugar fermentation as well as 16S rDNA sequence analysis, the classification characterization, phylogenetic site, denitrifying performance, and other aspects of the strain was studied, and named it as MD5. The results showed that the isolated strain from oceanic sediment by enrichment, isolation, screening possessed fairly strong denitrification reaction, under the conditions of 30 ℃ with initial concentration of nitrate at 1 500 mg/L and after 144 h of cultivation, the nitrate in the medium could be removed by 90.1%; under the aerobic cultivation conditions the removal rate of concentration of nitrification acid mass declined to 89.3% in a ability test tube by the strain. The results of MD5 in morphology and sugar fermentation were in accord with that inHalomonas, in addition, the homology of its gene sequence was as high as 99% withHalomonassp. IW11-1(AB305262.1), suggested that was aHalomonasstrain. Strain MD5 obtained by isolation in this experiment had fairly strong denitrifying ability both under anaerobic and aerobic conditions, therefore, it could be applied in the oceanic sediment environment denitrification application study.
denitro-bacterium;Halomonas; nitrogen removal
国家科技支撑计划课题(2012BAC07B03);南通市农业科学创新项目(HL2014014);国家海洋局海洋生态环境科学与工程重点实验室开放基金(MESE-2012-03)
沈辉 男,博士,副研究员。主要从事海洋生态学研究。Tel:0513-85223180,E-mail:darkhui@163.com
* 通讯作者。男,博士,教授。研究方向为海洋生态环境修复。E-mail:pmhe@shou.edu.cn
2015-02-28;
2015-07-20
Q93-331
A
1005-7021(2016)02-0050-06
10.3969/j.issn.1005-7021.2016.02.009

