废弃钢厂耐Cr6+霉菌的分离鉴定及其生物学特性
徐天生, 欧 杰*, 马晨晨, 董 博,2
(1.上海海洋大学食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306;2.上海市食品药品检验所,上海 201203)
废弃钢厂耐Cr6+霉菌的分离鉴定及其生物学特性
徐天生1, 欧 杰1*, 马晨晨1, 董 博1,2
(1.上海海洋大学食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306;2.上海市食品药品检验所,上海 201203)
从废弃钢铁厂内土壤中分离出1株对Cr6+具有高去除性的微生物,对其生物学特性进行研究。采用马丁氏培养基对上海某废弃钢铁厂内重金属污染土壤中耐Cr6+真菌进行分离筛选纯化,用菌落形态及18S rRNA 序列分析鉴定菌株,研究菌株的Cr6+耐受性及还原率,分析不同影响因素对其修复Cr6+及总铬的影响。结果表明M-13为橘绿木霉(Trichodermacitrinoviride),可耐浓度为1.7 mmol/L的Cr6+,且每克菌丝修复20 mg以上的Cr6+,10 mg以上的总铬。菌株生长到72 h时菌丝干重达到最高。在pH约1.09,温度28 ℃,菌丝加入量0.25 g(干重),Cr6+初始质量浓度为100 mg/L时,Cr6+还原率最大为99.3%,几乎能将50 mL溶液中的Cr6+完全去除,可将55.3%的总铬吸附。橘绿木霉M-13能较好地去除Cr6+,可以作为试验材料应用于生物修复废水中Cr6+的研究。
耐Cr6+霉菌;分离鉴定;生物学特性
随着电镀、制革、印染等工业技术的快速发展,金属铬(Cr)被广泛用于工业生产中,未经处理的含Cr6+废液、废渣直接排到环境中,会给环境带来严重污染。同时,Cr6+对人体的代谢系统有很强的毒性,对生物体有致突变、致癌和致畸作用,属于一类污染物[1]。Cr6+化合物的毒性约为Cr3+的100倍,致突变率约为Cr3+的1 000倍[2]。因此,将毒性强、水溶性高的Cr6+转化为毒性较低、水溶性差的Cr3+进而被微生物吸附被认为是一种有效的恢复铬酸盐污染土壤和水系统的方法。现有的化学和电化学处理过程一般是将水溶液中的Cr6+还原为Cr3+,随后调整溶液的pH值至接近中性的条件下生成沉淀从而降低Cr6+的浓度[3]。通过微生物去除作用来降低或减缓重金属对生态的破坏在国内外已有很多相关研究[4],各种生物机制可转换重金属的可溶和不可溶的形态,改变环境中金属的活性和有效性,加速其被生物吸收的过程。因此,生物去除技术对环境中重金属的防治具有重要意义[5-6]。微生物修复在治理Cr6+污染上有广阔的应用前景,已经逐渐引起人们的重视,成为研究的热点。近年来,有学者在微生物修复重金属污染方面进行了研究,Ozer等[7]研究啤酒酵母S.cerevisiae发现,啤酒酵母对Cr6+的去除能力达到32.6 mg/g,黄顺红[8]研究了土著微生物对Cr6+的去除效果。本研究从上海某废弃钢铁厂附近土壤筛选出1株橘绿木霉,该霉菌对Cr6+具有较高的耐受性和较强的修复能力,对其进行形态学和分子系统学鉴定,同时对菌株的修复特性进行初步研究, 以期为微生物修复环境中水体Cr6+污染的相关研究提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株来源 土壤样品于2012年采自上海某废弃钢铁厂,采集量为5 kg,经分析该土壤样品中常见重金属含量依次为锰574 mg/kg,铁21 523 mg/kg,铜140 mg/kg,铅78.8 mg/kg,镉0.569 mg/kg,铬 88.1 mg/kg。
1.1.2 培养基 马丁氏培养基,马丁氏液体培养基。
1.2 方法
1.2.1 耐Cr6+真菌的分离、纯化 将5 g土壤样品加入至45 mL马丁氏培养基中,28 ℃、150 r/min培养24 h,取1 mL土壤悬液于含100 mg/L Cr6+的新鲜培养基中,待培养基浑浊后移1 mL培养液接种于含150 mg/L Cr6+的马丁氏液体培养基中,依此类推逐级提高Cr6+浓度,在100~500 mg/L Cr6+的培养基中培养。取0.2 mL 250 mg/L Cr6+的培养液涂布于500 mg/L Cr6+的马丁氏琼脂培养基上,于28 ℃培养箱中倒置培养120 h,分离出对Cr6+具较高耐性的霉菌。菌株形态及生理、生化特性鉴别参考《真菌鉴定手册》[9]、《普通真菌学》[10]。根据菌落形态鉴定M-13单菌落菌株为木霉属。
1.2.2 菌株生长曲线 将筛选所得菌株M-13接种于50 mL马丁氏液体培养基中活化24 h,取1 mL至装有150 mL马丁氏液体培养基的500 mL锥形瓶中,28 ℃、150 r/min震荡培养;每6 h取出三瓶抽滤,收集菌体,25 ℃烘干,称量其干重。绘制M-13的生长曲线。
1.2.3 pH和温度对M-13修复Cr6+及总铬的影响 利用HCl和NaOH 溶液将Cr6+溶液的pH分别调至0.30、0.61、0.81、1.11、1.42、2.41、3.63、4.28(实测pH值),称取0.25 g(干重)M-13菌丝,置于50 mL 100 mg/L上述不同pH的Cr6+溶液中,28 ℃、150 r/min震荡24 h。测定各pH值Cr6+及总铬的终浓度。称取0.25 g(干重)M-13菌丝,置于50 mL 100 mg/L Cr6+溶液中,在20、25、28、30、35、40 ℃下,150 r/min震荡24 h,测定各温度下Cr6+及总铬的终浓度。
1.2.4 不同Cr6+初始浓度对M-13去除Cr6+及总铬的影响 配制50、150、200、250、300、400 mg/L Cr6+水溶液,量取50 mL置于250 mL锥形瓶中,向各锥形瓶投入0.25 g(干重)M-13菌丝,28 ℃、150 r/min震荡24 h。测定不同Cr6+浓度下Cr6+及总铬的终浓度。
1.2.5 不同菌体投入量对Cr6+及总铬去除的影响 分别称量0.12、0.14、0.16、0.18、0.20、0.22、0.24、0.26、0.28、0.30 g(干重)M-13菌丝,置于50 mL 100 mg/L Cr6+溶液中,28 ℃、150 r/min震荡24 h,测定不同菌体投入量Cr6+及总铬的最终浓度。
1.2.6 菌株M-13对Cr6+及总铬的去除曲线 根据以上不同的条件制作修复曲线。该菌株对Cr6+及总铬的还原率及修复量按照下列公式计算:
(1)
q=(Ci-Cf)×V/W
(2)
式中:Q表示还原率(%),Ci和Cf 分别表示Cr6+及总铬的起始浓度和修复后浓度(mg/L);q表示修复量(mg/g),V表示溶液体积(L),W表示修复剂干重(g)。
1.2.7 Cr6+和总铬的检测 ① Cr6+检测方法:根据GB/T 5750.6-2006标准称取0.141 4 g重铬酸钾,105~110 ℃烘至恒量后溶于去离子水中,定容至500 mL容量瓶中,移取该溶液10.0 mL定容至1 000 mL容量瓶中。在50 mL比色管中分别加入上述六价铬溶液0、1.00、2.00、4.00、6.00、8.00 mL,加去离子水至刻度线,再加入2.5 mL硫酸溶液(7倍稀释)和2.5 mL二苯碳酰二肼溶液(显色剂),立即摇匀,放置10 min。利用分光光度计测定吸光度[11]。② 总铬检测方法:根据GB/T5009.123-2003标准分别吸取标准铬溶液(100 mg/mL)0、0.10、0.30、0.50、0.70、1.00、1.50 mL于10 mL容量瓶中,用1.0 mol/L硝酸稀释至刻度,混匀。条件调整为357.9 nm;干燥110 ℃,40 s;灰化1 000 ℃,30 s;原子化2 800 ℃,5 s[12]。
1.2.8 耐Cr6+真菌的形态学鉴定 将菌株M-13在察氏培养基上25 ℃培养5 d,观察菌落形态及显微形态。
1.2.9 耐Cr6+菌株的分子系统学鉴定 DNA提取方法:采用石英砂研磨CTAB(Hexadecyltrimethy Ammonium Bromide,十六烷基三甲基溴化铵)提取[13]。遗传标记:选用翻译延伸因子(tef 1-alpha)基因(tef),扩增引物:EF1T、EF2T[14]。PCR产物检测和测序:PCR产物与100 bp DNA用2.0%的琼脂糖凝胶在0.5×TBE电泳缓冲液中于80 V电压下电泳20 min,然后置于0.5 μg/mL 的溴乙锭溶液中染色15 min,在波长365和254 nm紫外光下检测为明显单一条带,纯化后用ABI3700进行双向直通测序[15]。
2 结果与分析
2.1 菌株M-13的生长曲线
M-13的生长曲线见图1。由图1可知,M-13的延滞期约24 h,此时菌丝量约为0.1 g;24 h后进入对数期,快速生长;在72 h达到稳定期,微生物量达到最大,质量约为1.2 g。图1还显示了M-13在不同浓度Cr6+中的生长曲线。
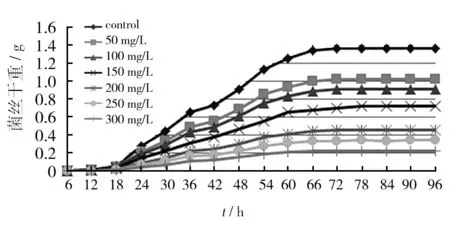
图1 菌株M-13生长曲线
2.2 不同pH对Cr6+及总铬还原率的影响
不同pH下M-13对Cr6+及总铬的修复结果见图2。由图2可知,pH值小于1.5时,M-13对Cr6+的去除可达到60%;pH值大于1.5后,Cr6+修复率处于较低水平。这一结果与相关文献基本吻合[16-18],对总铬的吸附由于在高浓度H+下菌丝会被质子化因而吸附率有所下降。
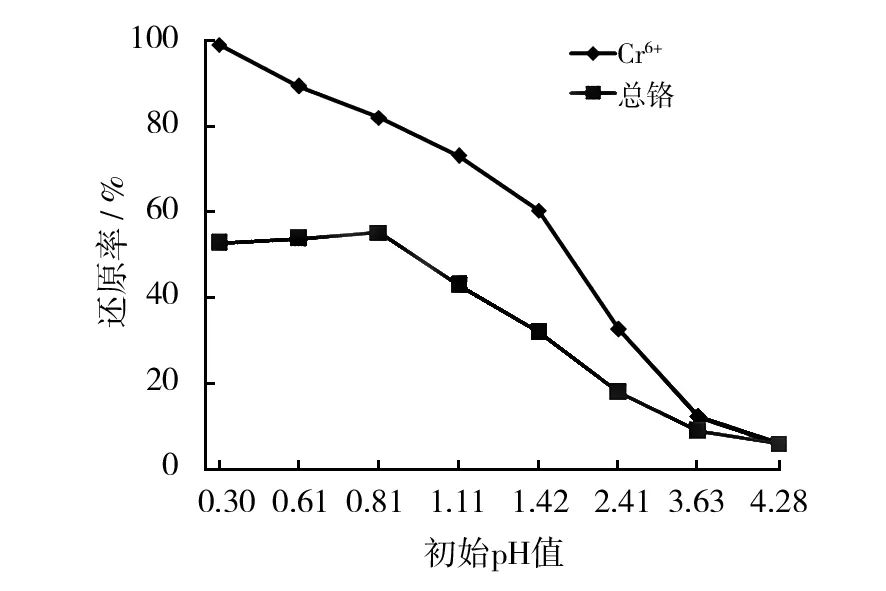
图2 pH对M-13修复Cr6+及总铬的影响Fig.2 Effect of different pH on removing Cr6+ and total chromium by M-13
2.3 不同温度对Cr6+及总铬还原率的影响
在不同温度条件下(10、15、20、28、32 ℃)测定M-13对Cr6+及总铬的修复率,由图3可以看出,温度对该菌株去除Cr6+及总铬影响不大,在20 ℃后修复能力仍较强。
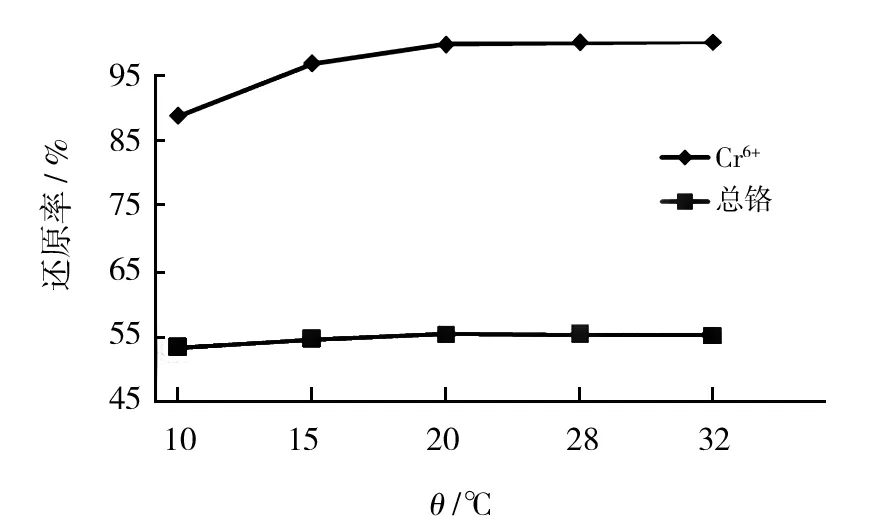
图3 温度对Cr6+及总铬还原率的影响Fig.3 Influence of different temperature on removing Cr6+ and total chromium
2.4 菌丝量对修复Cr6+及总铬的影响
菌株M-13的菌丝初始加入量不同,对Cr6+及总铬去除效果也不相同。M-13的初始添加量对Cr6+及总铬修复的影响见图4。由图4可知,Cr6+及总铬的还原率随着菌丝加入量的增多而逐渐增大,在0.25 g后达到饱和,对总铬的还原率大致趋势也类似。

图4 菌丝加入量对Cr6+及总铬修复的影响Fig.4 Effect of the mycelium quantity on removing Cr6+ and total chromium
2.5 Cr6+浓度对M-13修复Cr6+及总铬的影响
不同Cr6+初始浓度对M-13还原率的影响见图5。由图5可知,在80 mg/L后,随着Cr6+浓度的升高,M-13对Cr6+及总铬的还原率趋于下降,当Cr6+初始浓度100 mg/L时,M-13对Cr6+的还原率可达98.97%,对总铬的还原率可达58%;而当Cr6+浓度为350 mg/L时,Cr6+的还原率低于50.0%,总铬的还原率低于35%。在Cr6+浓度处于较低水平时,菌体表面与总铬量的比值较高,因而在低浓度下Cr6+及总铬更易被修复[19]。
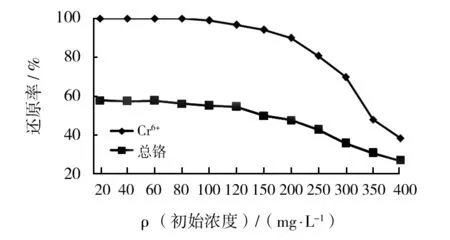
图5 不同Cr6+浓度对M-13修复Cr6+及总铬的影响Fig.5 Effect of removing efficiency at different concentrations

图6 基于tef 的NJ系统发育树Fig.6 Neighbor-Joining phylogenetic tree based on tef
2.6 耐Cr6+真菌的鉴定
2.6.1 形态特征 菌株M-13在察氏培养基 25 ℃培养5 d,菌落布满平皿,直径可达70 mm,稀疏但中央稍厚,近于水绿色,无渗出液,无可溶性色素,菌落反面呈黄色,分生孢子梗瓶型,直或稍弯曲,瓶梗颈明显,分生孢子胶囊型,壁光滑。
2.6.2 测序结果及系统发育分析 原始序列用生物软件Bioedit 7.0.9[20]编辑后得到准确无误的序列,与GenBank下载的模式和权威菌株序列组成序列数据矩阵。对于序列矩阵,在Bioedit 7.0.9下做必要的人工编辑和调整得到的新矩阵。将该矩阵用MEGA5.0[21]进行邻接法(neighbor-joining, NJ)分析,推断出系统发育树,并用自展法(bootstrap) 进行1 000次重复评估各分支的可靠性。图6显示了菌株M-13与其他木霉家族的关系(以M-13E表示),M-13与Trichodermacitrinoviride聚成一簇,相似性为99%,自举值为99%。鉴定结果显示,M-13初步可定为橘绿木霉(Trichodermacitrinoviride)。M-13菌株保藏号为CGMCC NO.8332。
3 讨 论
生物去除法可以有效去除溶液中的Cr6+及总铬,并且不同的条件会影响菌株的还原率。本研究从上海某废弃钢铁厂分离出1株能去除高浓度Cr6+霉菌,经形态学及分子生物学鉴定为橘绿木霉(TrichodermaM-13)。分别用分光光度法和原子吸收法测定滤液中的Cr6+和总铬,结果相差较大,推测该霉菌可以将Cr6+还原成Cr3+。pH和Cr6+初始浓度对M-13的还原能力影响最大,pH在1.09左右去除效率最佳,为99.3%,M-13几乎能将100 mg/L Cr6+全部去除,能将55%左右的总铬吸附,从高还原率角度来看,与Preeti研究相似[22];温度和初始投菌量对修复100 mg/L Cr6+及总铬的影响较小,虽然25 ℃是M-13修复Cr6+及总铬的最适温度,但在20~35 ℃还原率变化并不明显,因此温度不是影响还原率的主要条件;在初始投菌量为0.25 g(干重)时M-13可将超过99%的50 mL 100 mg/L Cr6+完全还原,可吸附55.3%的总铬。该霉菌还原Cr6+溶液需要24 h,比相关文献[23]中微生物需要8 h左右修复时间要长。虽然去除时间较长,但从去除高浓度Cr6+和最终效果来看,该霉菌对Cr6+及总铬有着较强的修复能力。
总之,该霉菌可作为较好的试验材料应用于生物修复Cr6+污染废水的研究中,今后可进一步研究去除Cr6+的机理,为研究微生物治理Cr6+污染废水提供必要的理论依据。
[1] 郝喜海,罗洁,衣潇鹏. 我国重金属污染现状与微生物修复技术[J]. 广州化工,2013,41(11): 42-44.
[2] Preeti Jain, Alina Amatullah, Samiul Alam Rajib, et al. Antibiotic resistance and chromium reduction pattern among actinomycetes[J]. American Journal of Biochemistry and Biotechnology,2012,8 (2):111-117.
[3] 马晓航, 贾小明, 赵宇华. 用硫酸盐还原菌处理重金属废水的研究[J].微生物学杂志, 2003, 23(1): 36-39.
[4] Das SK, Das AR, Guha AK.A study on the adsorption mechanism of mercury onAspergillusversicolorbiomass[J]. Environmental Science and Technology, 2007, 41(24): 8281-8287.
[5] 徐天生,欧杰,马晨晨.微生物还原Cr(Ⅵ)的机理研究进展[J].环境工程,2015,33(1):32-36.
[6] N.R. Bishnoi, Garima.Fungus-an alternative for bioremediation of heavy metal containing wastewater: a review[J].J. Sci. Ind. Res,2005, 64(2): 93-100.
[7] Ozer A, Ozer D. Comparative study of the biosorption of Pb (II), Ni(II) and Cr(VI) ions ontoS.cerevisiae: determination of biosorption heats[J]. Journal of Hazardous Materials B,2003, 100(1-3): 219-229.
[8] 黄顺红.土著微生物对土壤不同形态Cr(VI)修复效果研究[J].矿产与地质,2013,(z1):75-77.
[9] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979.
[10]邢来君,李明春. 普通真菌学[M]. 北京:高等教育出版,1999.
[11]GB/T 5750.6-2006 生活饮用水标准检查方法-金属指标[S].
[12]GB/T5009.123-2003 食品中铬的测定[S].
[13]Scott J, Malloch D, Wong B,et al. DNA heteroduplex fingerprinting inPenicillium. In: Samson RA, Pitt JI (eds). Integration of modern taxonomic methods forPenicilliumandAspergillusclassification[J]. Amsterdam: Harwood Academic Publishers,2000,29(1): 225-236.
[14]Bischoff JF, Rehner SA, Humber RA.Metarhiziumfrigidumsp. nov.: a cryptic species ofM.anisopliaeand a member of theM.flavoviridecomplex[J]. Mycologia, 2006, 98(5):737-745.
[15]Wang L. Four new records ofAspergillussectionUstifrom Shandong Provice, China[J]. Mycotaxon,2012, 120(1):373-384.
[16]V.K.Gupta,A.K.Shrivastava,Neeraj Jain.Biosorptionof Chromium (VI) from Aqueous Solutions by Green AlgaeSpirogyraSpecies[J]. Water Research,2001, 35(17): 4079-4085.
[17]R.S.Prakasham, J.Sheno Merrie, R.Sheela, et al. Biosorption of chromium (VI) by free and immobilizedRhizopusarrhizus[J]. Environmental Pollutio, 1999,104(3): 421-427.
[18]Handan Ucun,Y.Kemal Bayhan,Yusuf Kaya,et al. Biosorption of chromium (VI) from aqueous solution by cone biomass ofPinussylvestris[J]. Bioresource Technology, 2002, 85(2): 155-158.
[19]Preeti Jain, Alina Amatullah, Samiul Alam Rajib, et al.Antibitic resistance and chromium reduction pattern among actinomycetes[J]. American Journal of Biochemistry and biotechnology, 2012, 8(2): 111-117.
[20]Hall TA. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucl[J]. Acids Symp,1999, 41(41):95-98.
[21]Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Mol. Biol. Evol,2011, 28(10): 2731-2739.
[22]Preeti Jain, Hasan Mahmud Reza, Subrata Pal. Molecular phylogenetic analysis of bacterial community and characterization of Cr(VI) reducers from the sediments of Tantloi hot spring, India[J].Aquat Biosyst, 2014, 10(1):1-11.
[23]Narayani M, Vidya S K.Chromium resistant bacteria and their environmental condition for hexavalent chromium removal-a review[J]. Crit Rev Environ Sci Tech,2013, 43(9): 955-1009.
Isolation and Identification, and Biological Characteristics of Cr6+-Tolerant Fungi from Abandoned Steel Mill
XU Tian-sheng1, OU Jie1, MA Chen-chen1, DONG Bo1,2
(1.Coll.ofFoodSci. &Technol.,ShanghaiOceanUni.,ShanghaiEngin.Res.Ctr.ofAquatic-ProductProcess. &Preser’n,Shanghai201306; 2.ShanghaiInst.ofFoodandDrugInspection,Shanghai201203)
A microbial strain possessing high chromium-depletable was isolated and obtained from polluted soil in an abandoned steel mill in Shanghai and studied its biological characteristics. The chromium-tolerant microbe was isolated, screened, and purified from heavy metals polluted soil around the abandoned steel mill by Martin medium, and identified the strain by colony morphology and 18S rDNA sequence analysis, and studied its Cr6+tolerance and repairing rate, analyzed different affecting factors on its redemption and the influence of total Cr6+. The results showed the strain was identified asTrichodermacitrinovirideand named as M-13. The strain could tolerate 1.7 mmol/L of Cr6+, and it could repair above 20 mg of Cr6+per gram of mycelium, over 10 mg of total Cr6+. When the strain was cultured 72 h, its dried mycelium reached to the maximum. When pH was about 1.09, temperature at 28 ℃, mycelium adding amount at 0.25 g (dried weight), initial concentration of Cr6+at 100 mg/L, the removal rate of Cr6+reached to the maximum, it was at 99.3% and almost all Cr6+could be completely removed, and could adsorb 55.3% of total chromium.TrichodermacitrinovirideM-13 could comparatively well remove Cr6+, and the strain could be used as research material apply on bio-reparation Cr6+in wastewater.
chromium-tolerant fungus; isolation and identification; biological characteristics
上海市科委工程中心建设项目(11DZ2280300)
徐天生 男,硕士研究生。主要研究方向为生物技术。E-mail :757659553@qq.com
* 通讯作者。男,副教授,硕士生导师。主要从事生物技术及食品微生物研究。Tel:021-61900382,E-mail: jou@shou.edu.cn
2015-04-28;
2015-05-20
Q93-331
A
1005-7021(2016)02-0056-06
10.3969/j.issn.1005-7021.2016.02.010

