白念珠菌CaGDT1基因的功能研究
王军军, 王雅楠, 徐大勇, 蒋伶活
(江南大学 生物工程学院 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
白念珠菌CaGDT1基因的功能研究
王军军, 王雅楠, 徐大勇, 蒋伶活*
(江南大学 生物工程学院 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
人类跨膜蛋白TMEM165与酿酒酵母ScGdt1均属于阳离子/钙离子交换器家族的成员,在本研究中,通过序列比对在白念珠菌中发现了ScGDT1的同源基因CaGDT1,表型互补实验显示CaGDT1基因的表达能够抑制ScGDT1基因缺失所造成的钙离子敏感性,证明CaGDT1是ScGDT1的同功基因。此外,通过同源重组原理敲除了CaGDT1的2个等位基因。表型筛选结果表明gdt1/gdt1缺失株对钙离子、细胞壁和内质网3种胁迫均不敏感,而对酮康唑和特比萘芬2种抗真菌药物具有耐受性。
白念珠菌;CaGDT1;基因敲除;耐药性
白念珠菌是一种免疫力低下人群的条件致病菌,寄生于正常人体的皮肤黏膜,与其宿主免疫系统维持平衡的状态[1]。在免疫缺陷病人体内,它能够入侵组织,引起严重的组织感染[2]。它能以不同的形态生长,包括酵母态、假菌丝和真菌丝3种形态[3]。在有血清的条件下,白念珠菌细胞由酵母态转变成菌丝态细胞,这种转变提升了其入侵宿主细胞的能力[4]。在真核生物细胞中,钙离子是最普遍且最重要的信号传导分子。钙离子不仅参与细胞内多种基础代谢反应,而且作为一种多功能的信号载体,调节细胞内各种生命活动[5-6]。在酿酒酵母的细胞质中,通过细胞质膜以及细胞器膜上的钙转运蛋白和钙离子交换器将胞内钙离子含量调节在一个最佳的钙浓度,维持胞内钙稳态[7-9]。例如,应答内质网胁迫和信息素时,细胞通过质膜上的钙通道Cch1/Mid1/Ecm7,也称为高亲和性钙离子吸收系统(HACS,calcium-uptake system),来控制钙离子的摄入,而液泡通道蛋白Yvc1能够应答低渗休克,将钙离子从液泡中释放到胞质中[10-11]。 细胞质中过量的钙离子则通过液泡膜上的钙泵Pmc1和Ca2+/H+离子交换器 Vcx1被运输到液泡中储存,或者经高尔基体上的钙泵Pmr1和Ca2+/H+离子交换器Gdt1进入内质网/高尔基体分泌途径[7,9,12]。在白念珠菌中,许多与酿酒酵母功能相似的钙转运蛋白和钙通道已经被发现和鉴定,它们包括液泡膜上的钙泵CaPmc1,高尔基体膜上的钙泵CaPmr1,内质网膜上的钙泵CaSpf1,低亲和性钙离子吸收系统(LACS,low-affinity calcium-uptake system)CaFig1[13-17]。CDGs(Congenital Disorders of Glycosylation)是影响糖基化途径的先天性代谢疾病,由人体TMEM165基因的突变引起[18]。TMEM165属于高度保守的膜蛋白(UPF0016)家族成员,定位到高尔基体上,有阳离子/钙离子交换器的特征,通过影响高尔基体钙离子运输和pH平衡影响糖基化代谢。TMEM165的酿酒酵母同源蛋白ScG-dt1已被鉴定为高尔基体膜上的Ca2+/H+离子交换器,与高尔基体钙泵ScPmr1蛋白协同调节胞内钙离子稳态[19]。本研究通过序列比对在白念珠菌基因组中找到和鉴定了1个酿酒酵母ScGdt1的同功蛋白CaGdt1,它可以互补ScGdt1蛋白的钙离子敏感性功能。此外,通过敲除CaGDT1基因,对其在白念珠菌细胞中的功能进行初步探究。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和引物 本实验使用的菌株和质粒见表1,引物见表2。

表1 菌株和质粒

表2 实验所用引物
1.1.2 主要试剂 限制性内切酶、CIAP碱性磷酸酶、T4连接酶、TaqDNA聚合酶等购自宝生物大连有限责任公司;5-氟乳清酸(5-FOA)购自上海诺泰化工有限公司;表型筛选所用药物全部购自Sigma公司;醋酸锂、聚乙二醇3350购自Sigma公司;所有引物均由南京金斯瑞生物科技有限公司合成。
1.1.3 培养基(质量分数,%) LB培养基:蛋白胨1,酵母提取物0.5,NaCl 1,用NaOH调pH至7.0;YPD培养基:酵母浸出粉1,蛋白胨2,葡萄糖2;SD培养基:无氨基酵母氮源0.67,氨基酸混合物粉末0.2,葡萄糖2。
1.2 方法
1.2.1CaGDT1基因的敲除 采用NATR和Ura+两种筛选标记分别敲除CaGDT1的双等位基因,最后获得的正确转化子将会生长在SD-URA+200 μg/mL ClonNAT的平板上,并且在0.1% 5-FOA选择压力下能够将URA3标记基因弹出,用含有25 μg/mL ClonNAT的YPD平板筛选弹出NATR抗性基因的最终转化子。
1.2.2 白念珠菌CaGDT1基因回补质粒的构建 对于质粒pCR4-CaGDT1的克隆,以野生型菌株CAI4基因组为模版PCR 扩增出2.1 kb含CaGDT1基因全长的片段,通过BamHI单酶切连接到载体pCR4质粒上。同理,将含CaGDT1基因全长的片段,通过KpnI和SphI酶切位点连接到载体pHAC181上,克隆得到 pHAC181-CaGDT1。
1.2.3 平板敏感性实验 所有菌株均接种于YPD培养基中过夜培养至饱和,将菌液按1∶10依次梯度稀释至10-4,取不同梯度的菌液各2.5 μL依次点在YPD以及含有不同药物的YPD平板上,30 ℃培养2 d后拍照观察。
2 结果与分析
2.1CaGDT1是ScGDT1在应答钙胁迫方面的同功基因
利用白念珠菌基因组数据库(http://www.candidagenome.org),发现一个基因位点C2_04540C,编码350个氨基酸的蛋白质序列。序列比对分析结果表明,其与人类蛋白TMEM165和酿酒酵母ScGdt1的同源性分别为29.9%和39.9%(图1A)。用SMART软件(http://smart.embl-heidelberg.de)进行结构分析(图1B),结果表明CaGdt1与人类蛋白TMEM165和酿酒酵母ScGdt1结构相似,在C末端均有5个跨膜结构域。因此,进一步研究了CaGdt1能否在功能上互补ScGdt1。与之前的文献[12]报道一致,在酿酒酵母中,与野生型菌株BY4741相比,gdt1单基因缺失株对较低浓度(低于0.4 mol/L)的钙离子浓度不敏感,对于高浓度的CaCl2(0.6 mol/L 和 0.7 mol/L)敏感(图1C)。将完整的白念珠菌CaGDT1基因克隆到酿酒酵母过表达载体pHAC181中,获得质粒pHAC181-CaGDT1,并将其导入酿酒酵母gdt1细胞中。通过倍比稀释表型实验,发现CaGDT1基因的过表达能够抑制ScGDT1基因缺失所造成的高浓度钙的敏感性(图1C)。这些结果表明在应答高钙胁迫的条件下,CaGDT1是ScGDT1的同功基因。

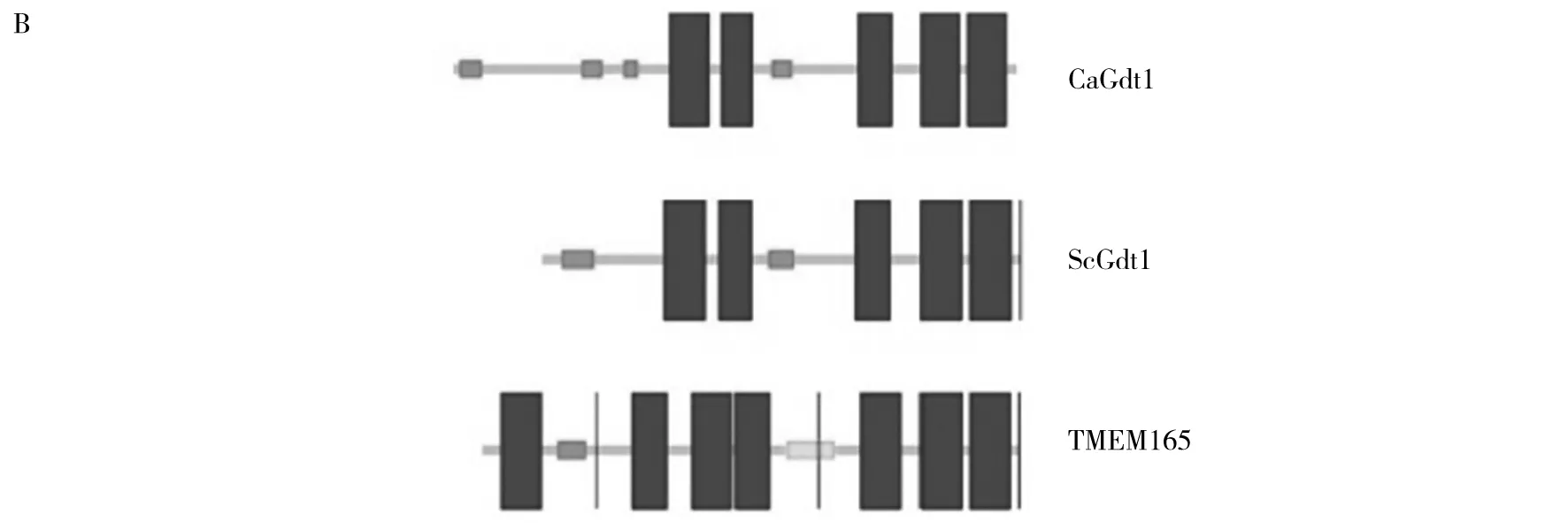

图1 CaGdt1的序列对比和功能互补分析Fig.1 Sequence alignment and functional complementation of CaGdt1A、B:CaGdt1、ScGdt1和TMEM165的氨基酸序列对比和结构分析;C:CaGDT1互补ScGDT1应答高钙胁迫的功能A and B:amino acid alignment between CaGdt1, ScGdt1 and TMEM165 and their structural analysis;C:functional complementation of ScGDT1 by CaGDT1 in the sensitivity of budding yeast cells to calcium stresses
2.2CaGDT1敲除质粒的构建
为敲除白念珠菌CaGDT1基因,分别从CaGDT1基因组上扩增ORF上下游各650 bp 左右的同源片段,分别连接到载体质粒p5921上hisG-URA3-hisG两侧相应酶切位点,构建了可以重复利用的敲除盒质粒pKC1。敲除盒构建示意图见图2A。
以野生型菌株CAI4 基因组DNA为模板,GDT 1-L-F、GDT 1-L-R为引物进行PCR反应,扩增CaGDT1基因上游的1个 683 bp 片段(同源片段L),扩增产物纯化后用SacI和KpnI双酶切,连接到用同样2种酶处理的 p5921 载体中,获得质粒pKCL1。同理,以GDT1-R-F、GDT1-R-R为引物进行PCR反应,扩增CaGDT1基因下游的1个642 bp片段(同源片段R)。通过BamHI和PstI酶切,连接到经相同酶切处理的载体pKCL1中。最后将所获得的阳性转化子用SacI和PstI进行酶切验证,结果如图2B,只有1、9、10三个质粒能够切出5.5 kb的敲除盒片段大小,即成功构建敲除质粒,命名为pKC1。
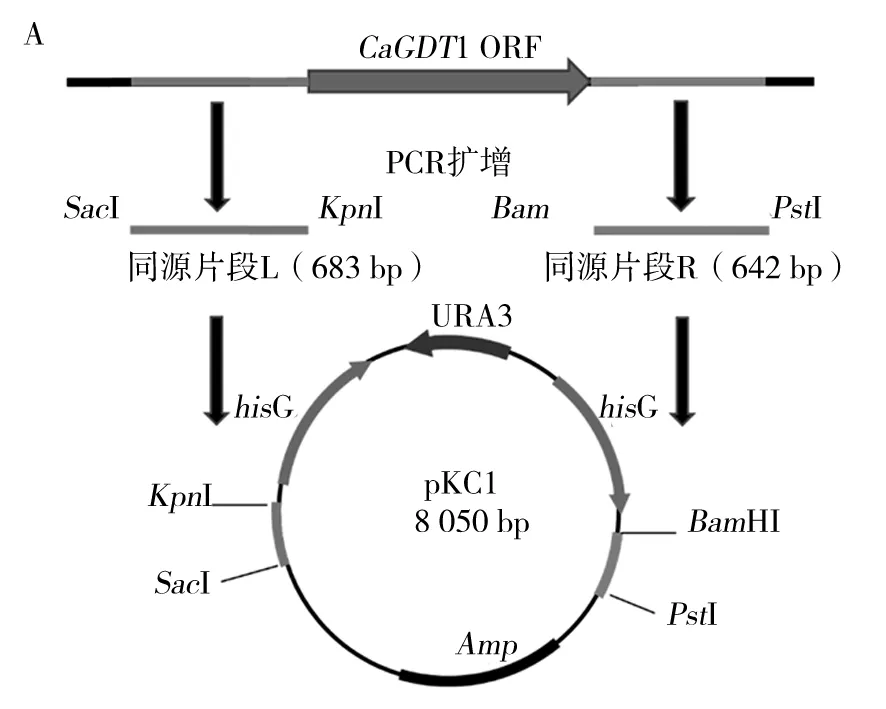
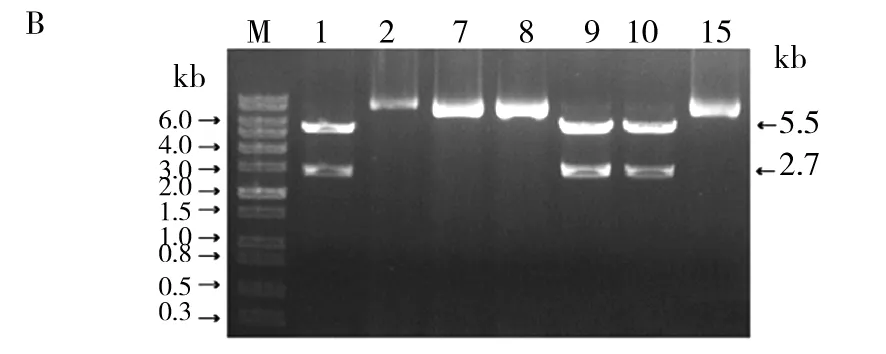
图2 CaGDT1敲除盒的构建策略(A)和酶切验证(B)Fig.2 Strategy (A) and restriction digestion confirmation (B) for constructing CaGDT1 gene knockout cassette
2.3gdt1/gdt1双等位基因缺失株的构建
以实验室已有的野生型菌株CAI4为出发菌株,来敲除CaGDT1基因。敲除策略见图3A。对于CaGDT1基因的第1个拷贝,采用SAT1flippe的敲除方法[20];对于CaGDT1的第2拷贝,用已构建好的CaURA3敲除质粒pKC1,用限制性内切酶SacI/PstI线性化后获得含有CaURA3筛选标记的CaGDT1敲除盒进行敲除。

图3 CaGDT1双等位基因的敲除原理(A)和基因型PCR验证(B)
Fig.3 Strategy of knocking-outCaGDT1 two alleles (A)and PCR Confirmation of Genotype (B)
最后,对所获得的双等位基因缺失菌株gdt1/gdt1进行最终的基因组验证,PCR检测结果见图3B,1~2泳道所用的引物为GDT1-DF和GDT1-DR,野生型扩增出2 038 bp的片段,gdt1/gdt1扩增出868 bp(gdt1::FRT)和2 147 bp (gdt1::hisG)的片段;3~4泳道所用的引物为GDT1-ORF-UP和GDT1-ORF-DOWN,野生型扩增出461 bp的片段,gdt1/gdt1没有扩增出任何片段。因此能够证明gdt1/gdt1基因型正确。
2.4gdt1/gdt1双等位基因缺失株表型筛选
为研究白念珠菌CaGDT1基因的功能,构建了CaGDT1双等位基因缺失株。通过倍比稀释表型筛选实验发现,相比于野生型菌株CAI4,gdt1/gdt1缺失株对于300 μg/mL 刚果红(Congo Red,CR)和150 μg/mL荧光白(Calcofluor white,CFW)等细胞壁干扰剂以及5 μg/mL 衣霉素(Tunicamycin,Tm)不敏感,对于不同浓度的钙离子胁迫也不敏感(图4)。然而,相比于野生型菌株,gdt1/gdt1缺失株对10 μg/mL的氟康唑(Fluconazole,Flu)不敏感,而对于10 μg/mL的酮康唑(Ketoconazole,KCZ)和特比萘芬(Terbinafine,Teb)则表现出耐受性。向gdt1/gdt1缺失株细胞中导入质粒 pCR4-CaGDT1又消除了其对酮康唑和特比萘芬的耐受性(图4)。

图4 白念珠菌gdt1/gdt1基因缺失株的生长表型Fig.4 Growth phenotypes of the C. albicans gdt1/gdt1 mutant
3 讨 论
本研究在白念珠菌中发现和鉴定了酿酒酵母ScGDT1的同功基因CaGDT1,为膜蛋白家族UPF0016增添了1个新的成员[18]。然而,虽然CaGDT1能够互补ScGDT1基因缺失所造成的酿酒酵母细胞对高钙胁迫的敏感性,但是CaGDT1基因的缺失并不造成白念珠菌细胞对高浓度钙离子敏感。分析原因存在两种可能性,其一是因为白念珠菌细胞高尔基体上的钙离子转运蛋白,CaPmr1能够弥补CaGdt1蛋白缺失的功能;另一原因可能是CaGdt1的缺失导致的胞内钙离子浓度升高程度不足以持续激活钙信号途径,因此不会对细胞生长产生毒害作用。因此,在以后的研究中,将进一步检测gdt1/gdt1缺失株细胞内钙离子浓度,以及在gdt1/gdt1缺失株的基础上构建CaGDT1和CaPMR1的双基因缺失株,进一步研究它们之间的相互作用。此外,表型实验发现缺失了CaGDT1基因的白念珠菌细胞对酮康唑和特比萘芬两种抗真菌药物具有耐受性。这种耐药表型可能与白念珠菌的抗真菌药物耐受性存在关联,因为许多研究证明钙离子信号途径的激活和白念珠菌的抗真菌药物耐受性存在关联[24-27]。
[2] Yu Q,Ding X,Li M,et al. The P-type ATPase Spf1 is required for endoplasmic reticulum function and cell wall integrity inCandidaalbicans[J]. Int J Med Microbiol,2013,303(5):257-266.
[3] Sudbery P,Gow N,Berman J. The distinct morphogenic states ofCandidaalbicans[J]. Trends Microbiol,2004,12(7):317-324.
[5] Tan AR,Cai AY,Rintoul GL,et al. Elevated intracellular calcium causes distinct mitochondrial remodeling and calcineurin-dependent fission in astrocytes[J]. Cell Calcium,2011,49(2):108-114.
[6] Kaufman RJ,Swaroop M,Murtha-Riel P. Depletion of manganese within the secretory pathway inhibits O-linked glycosylation in mammalian cells[J]. Biochemistry,1994,33(33):9813-9819.
[7] Cunningham KW. Acidic calcium stores ofSaccharomycescerevisiae[J]. Cell Calcium,2011,50(2):129-138.
[8] Cui J,Kaandorp JA,Filatov MV,et al. Calcium homeostasis and signaling in yeast cells and cardiac myocytes[J]. FEMS Yeast Res,2009,9(8):1137-1147.
[9] Cyert MS. Calcineurin signaling inSaccharomycescerevisiae:how yeast go crazy in response to stress[J]. Biochem Biophys Res Commun,2003,311(4):1143-1150.
[10]Denis V,Cyert MS. Internal Ca2+release in yeast is triggered by hypertonic shock and mediated by a TRP channel homologue[J]. J Cell Biol,2002,156(1):29-34.
[11]Martin DC,Kim H,Cunningham KW,et al. New regulators of a high affinity Ca2+influx system revealed through a genome-wide screen in yeast[J]. J Biol Chem,2011,286(12):10744-10754.
[12]Demaegd D,Foulquier F,Morsomme P,et al. Newly characterized Golgi-localized family of proteins is involved in calcium and pH homeostasis in yeast and human cells[J]. Proc Natl Acad Sci USA,2013,110(17):6859-6864.
[13]Ding X,Yu Q,Li M,et al. Ecm7,a regulator of HACS, functions in calcium homeostasis maintenance,oxidative stress response and hyphal development inCandidaalbicans[J]. Fungal Genet Biol,2013,57:23-32.
[14]Brand A,Lee K,Gow NA,et al. Calcium homeostasis is required for contact-dependent helical and sinusoidal tip growth inCandidaalbicanshyphae[J]. Mol Microbiol,2009,71(5):1155-1164.
[15]Bates S,MacCallum DM,Gow NA,et al.Candidaalbicanspmr1p,a secretory pathway P-type Ca2+/Mn2+-ATPase,is required for glycosylation and virulence[J]. J Biol Chem,2005,280(24):23408-23415.
[16]Sanglard D,Ischer F,Bille J,et al. Calcineurin A ofCandidaalbicans:involvement in antifungal tolerance,cell morphogenesis and virulence[J]. Mol Microbiol,2003,48(4):959-976.
[17]Yang M,Brand A,Gow LAR,et al. Fig1 facilitates calcium influx andlocalizes to membranes destined to undergo fusion during mating inCandidaalbicans[J]. Eukaryotic Cell,2011,10(3):435-444.
[18]Foulquier F,Amyere M ,Matthijs G,et al. TMEM165 deficiency causes a congenital disorder of glycosylation[J]. Am J Hum Genet,2012,91(1):15-26.
[19]Demaegd D,Foulquier F,Colinet AS,et al. Newly characterized Golgi-localized family of proteins is involved in calcium and pH homeostasis in yeast and human cells[J]. Proc Natl Acad Sci USA,2013,110(17):6859-6864.
[20]Reuss O, Vik A, Kolter R,et al. The SAT1 flipper, an optimized tool for gene disruption inCandidaalbicans[J].Gene,2004,341:119-127.
[21]Li X,Huang X,Jiang L,et al. The MAP kinase-activated protein kinase Rck2p plays a role in rapamycin sensitivity inSaccharomycescerevisiaeandCandidaalbicans[J]. FEMS Yeast Res.,2008,8(5):715-724.
[22]Jiang L,Alber J,Wang J,et al. TheCandidaalbicansplasma membrane protein Rch1p, a member of the vertebrate SLC10 carrier family, is a novel regulator of cytosolic Ca2+homoeostasis[J]. Biochem J,2012,444(3):497-502.
[23]Jiang L,Niu S,Sturgil TW,et al. Analyses of the effects of Rck2p mutants on Pbs2pDD-induced toxicity inSaccharomycescervisiaeidentify a MAP kinase docking motif, and unexpected functional inactivation due to acidic substitution of T379[J]. Mol Genet Genom,2004,271(2):208-219.
[24]Sanglard D,Ischer F,Bille J,et al. Calcineurin A ofCandidaalbicans: involvement in antifungal tolerance, cell morphogenesis and virulence[J]. Mol Microbiol,2003,48(4):959-976.
[25]Reedy J,Scott F,Heitman J,et al. Elucidating theCandidaalbicanscalcineurin signaling cascade controlling stress response and virulence[J]. Fungal Gen Biol,2010,47(2):107-116.
[26]Steinbach W,Reedy J,Heitman J,et al. Harnessing calcineurin as a novel anti-infective agent against invasive fungal infections[J]. Nat Rev Microbiol,2007,5(6):418-430.
[27]Edlind T,Smith L,Nickels J,et al. Antifungal activity inSaccharomycescerevisiaeis modulated by calcium signalling[J]. Mol Microbiol,2002,46(1):257-268.
Function ofCaGDT1 Gene inCandidaalbicans
WANG Jun-jun, WANG Ya-nan, XU Da-yong, JIANG Ling-huo
(Coll.ofBio-Engin.,JiangnanUni.,StateLab.ofGrainFerment.Technol. &Tech.,Wuxi2141222)
Human transmembrane protein 165 (TMEM165) andSaccharomycescerevisiaeScGdt1 belong to the members of cation/Ca2+exchanger family. In this study, homologous gene ofCaGDT1 of ScGDT1 was found inCandidaalbicansthrough sequence comparison. Phenotypic mutual complementary experiment showed that the expression ofCaGDT1 could suppress the calcium ion sensitivity caused byScGDT1 deletion, proved thatCaGDT1 andScGDT1 are analogous genes. In addition, two alleles ofCaGDT1 were knockout through homologous recombination principle. The results of phenotypic screening suggested that thegdt1/gdt1 deletion strain was all not sensitive to triple stresses of calcium ion, cell wall, ER, however, was tolerant against antifungal drugs, ketoconazole and terbinafine.
Candidaalbicans;CaGDT1; gene knockout; drug resistance
国家自然科学基金项目 (81371784);江南大学自主研究计划重点项目(JUSRP51313B)
王军军 男,硕士研究生。从事酵母遗传学与分子生物学研究。E-mail: wangjun317603088@qq.com
* 通讯作者。男,博士,教授,博士生导师。从事酵母和丝状真菌遗传学与分子生物学研究。E-mail: linghuojiang@hotmail.com
2015-04-07;
2015-04-30
Q933;R379.4
A
1005-7021(2016)02-0014-06
10.3969/j.issn.1005-7021.2016.02.003

