HBV+自噬小体疫苗治疗HBV急性感染的实验研究
王璐,薛萌,殷鹏飞,樊飞,曹萌,王立新
(东南大学医学院 病原生物学与免疫学系,江苏 南京 210009)
·论 著·
HBV+自噬小体疫苗治疗HBV急性感染的实验研究
王璐,薛萌,殷鹏飞,樊飞,曹萌,王立新
(东南大学医学院 病原生物学与免疫学系,江苏 南京 210009)
目的:探讨转染HBV基因组的HepG2.2.15细胞自噬小体(HBV+DRibbles)诱导HBV特异性免疫应答及其对HBV急性感染的治疗作用。方法:ELISA法检测HBV+DRibbles体外再刺激HBsAg特异性效应细胞产生IFN-γ的水平;对HBV急性感染模型小鼠实施HBV+DRibbles、HBV+DRibbles联合DC免疫,ELISA法检测HBV抗原及抗原肽刺激免疫小鼠淋巴细胞产生IFN-γ的含量;ELISA法、荧光定量PCR法和酶法分别检测小鼠血清HBeAg、HBV DNA、ALT和AST的水平;免疫组织化学法检测小鼠肝组织HBcAg表达及免疫病理损伤。结果:与培养液对照组和HBsAg蛋白刺激组相比,HBV+DRibbles刺激HBsAg特异性效应细胞能够产生更高水平的IFN-γ(P=0.004);与未负载抗原的DC细胞对照组和负载HBsAg的DC刺激组相比,DC负载HBV+DRibbles再刺激HBsAg特异性CD4+、CD8+T细胞均能产生更高水平的IFN-γ(P<0.001)。与PBS对照组相比,HBV+DRibbles疫苗组和HBV+DRibbles联合DC免疫组均能诱导HBV急性感染模型小鼠产生HBV特异性免疫应答,明显降低血清HBeAg、HBV DNA水平,减低HBcAg+肝细胞比例,而ALT及AST水平未见明显差异,肝组织结构基本正常;但HBV+DRibbles疫苗组与HBV+DRibbles联合DC免疫组之间差异无统计学意义。结论:HBV+DRibbles作为HBV抗原载体,能够有效诱导DC对HBV抗原的交叉递呈;HBV+DRibbles诱导的HBV特异性细胞免疫应答对HBV急性感染具有一定的治疗作用。
乙型肝炎;乙型肝炎病毒;自噬小体;治疗性疫苗;小鼠
乙型肝炎病毒(HBV)感染危及全球人类健康,面对2.4亿HBV慢性感染患者,目前尚无理想的治疗性疫苗[1-2]。我们前期研究[3-5]显示,肿瘤细胞来源自噬小体(DRibbles)是肿瘤抗原的有效载体,能刺激树状突细胞(DC)活化,交叉递呈肿瘤抗原,诱导具有治疗效果的抗肿瘤免疫应答;而转染HBV基因组的HepG2.2.15细胞自噬小体(HBV+DRibbles)中富含HBV抗原成分。本研究旨在进一步探讨HBV+DRibbles能否有效诱导DC交叉递呈HBV抗原,从而诱导HBV特异性细胞应答及其对HBV急性感染的治疗作用,以期为临床HBV感染治疗提供实验依据。
1 材料与方法
1.1 材料
SPF级C57BL/6小鼠,雌性,6~8周龄,购自扬州大学实验动物中心。HepG2.2.15细胞为转HBV全基因组人肝癌细胞,由本院张建琼教授惠赠,pAAV/HBV1.2质粒(1.2倍HBV基因组重组腺相关病毒载体质粒)由台湾大学陈培哲教授惠赠,Flt3-L质粒、GM-CSF质粒由美国波特兰医学中心胡红明教授惠赠,硼替佐米(bortizomib)由中大医院血液科丁家华主任惠赠,HBsAg纯蛋白由南京市第二医院周振先主任惠赠。雷帕霉素(rapamycin)购自广州宝柏生物公司,NH4Cl购自南京创瑞生物公司,HBsAg重组疫苗购自江苏省疾病控制中心,Dynabeads磁珠购自Dynal Biotech公司,HBcAg购自ProSpec公司,HBV肽由上海耀强生物有限公司合成,HBV DNA定量检测试剂盒及HBV ELISA检测试剂盒购自上海科华生物工程股份有限公司,RPMI-1640、DMEM培养基购自Invitrogen公司,胎牛血清(FCS)购自Hyclone公司,Bradford蛋白定量试剂盒购自碧云天公司,小鼠IFN-γ检测试剂盒购自eBioscience有限公司,兔抗人HBc-IgG抗体、辣根过氧化物酶标记羊抗兔多聚体、联苯二胺购自中山金桥生物公司。
1.2 方法
1.2.1 细胞培养 HepG2.2.15细胞用含100 ml·L-1FCS、100 U·ml-1青霉素和链霉素的DMEM培养基,置37 ℃、体积分数为5% CO2培养箱培养,2~3 d传代1次。
1.2.2 HBV+DRibbles制备 取对数生长期HepG2.2.15细胞,加入硼替佐米、雷帕霉素、NH4Cl共孵育16~24 h,胰酶消化,取细胞及培养上清,以1 200 r·min-1离心10 min;取上清,4 ℃以12 000 r·min-1离心30 min;取沉淀,PBS重悬,分装,-20 ℃冻存备用[3-5]。
1.2.3 HBV+DRibbles蛋白定量 按Bradford蛋白定量试剂盒说明书操作。
1.2.4 HBV+DRibbles中HBsAg定量 RIPA细胞裂解液裂解HBV+DRibbles,置冰上5~10 s,加等量PBS混匀,以10 000 r·min-1离心4 min,取上清。按“乙型肝炎表面抗原诊断试剂盒”说明书检测HBsAg,绘制标准曲线,计算样品蛋白含量。
1.2.5 小鼠血清HBV抗原及anti-HBs抗体检测 按“乙型肝炎表面抗原及表面抗体诊断试剂盒”说明书检测。
1.2.6 DC细胞的体内诱导 对小鼠于第1天尾静脉高压注射法注射Flt3-L质粒,5 μg·只-1;于第10天相同方法及剂量注射GM-CSF质粒;第15天收获小鼠脾细胞,以1 200 r·min-1离心10 min,取沉淀红细胞裂解液裂解5 min;加PBS以1 200 r·min-1离心10 min;无血清RPMI-1640培养液重悬,调整细胞至2×107ml-1,-196 ℃液氮冻存。
1.2.7 DC细胞交叉递呈HBV抗原 重组HBsAg疫苗免疫小鼠:左下肢外侧肌肉注射2 μg·只-1,隔天加强,共2次。免疫14 d后采血,分离血清,检测HBsAb。取抗体阳性小鼠脾脏及淋巴结来源的淋巴细胞作为HBsAg特异性细胞,加入48孔细胞培养板,终浓度2×106ml-1,分别用梯度稀释的HBV+DRibbles、HBsAg蛋白(HBsAg:100、30、0 ng·ml-1;DRibbles:30、3、0 ng·ml-1,DRibbles剂量为其所含HBsAg量)再刺激,ELISA法检测培养72 h后上清中IFN-γ含量。进一步磁珠分选CD4+和CD8+T细胞,加入48孔细胞培养板,终细胞浓度2×106ml-1;复苏DC细胞,加入1 μg·ml-1LPS,同时分别加入30 ng HBsAg蛋白及含30 ng HBsAg的HBV+DRibbles,37 ℃共孵育6 h,取出;加PBS洗涤,以1 200 r·min-1离心10 min,共3次;将DC加入分选细胞板孔中,终细胞浓度1×106ml-1,ELISA法检测培养72 h上清中IFN-γ的含量。
1.2.8 HBV+DRibbles单独或联合DC免疫诱导HBV特异性细胞应答 小鼠尾静脉高压注射pAAV/HBV1.2质粒[6],第3天按血清HBeAg水平配对分组,设PBS对照组、HBV+DRibbles疫苗组及HBV+DRibbles联合DC(DRibbles+DC)免疫组。HBV+DRibbles疫苗组:于质粒注射后第3天,HBV+DRibbles疫苗初次腹股沟淋巴结免疫,每只30 μg·(20 μl)-1,第5、7天分别皮下加强,每只30 μg·(200 μl)-1。DRibbles+DC免疫组:HBV+DRibbles腹股沟淋巴结初次免疫,每只30 μg·(20 μl)-1,第5、7天分别腹部皮下注射负载HBV+DRibbles的DC加强免疫,2×106只-1。于免疫后第8天处死小鼠,取脾脏与淋巴结来源的淋巴细胞,加入48孔板,终细胞浓度2×106ml-1;分别加入10 μg·ml-1HBsAg、HBcAg、HBc129-140(PPAYRPPNAPIL)、HBs190-197(VWLSVIWM),于37 ℃、体积分数5% CO2下培养72 h,ELISA法检测上清中IFN-γ水平。
1.2.9 负载HBV+DRibbles的DC制备 复苏DC,调整为2×106只-1,加HBV+DRibbles 30 μg·只-1,LPS 1 μg·ml-1,培养6 h;取出,加PBS洗涤,以1 200 r·min-1离心10 min,共3次;PBS重悬DC,置冰上备用。
1.2.10 HBV+DRibbles单独或联合DC治疗HBV急性感染 分组与免疫同方法1.2.8;于末次免疫后第14天采血,分别采用ELISA法、荧光定量PCR法、酶法检测小鼠血清HBeAg、HBV DNA、ALT及AST水平[7];处死小鼠,取肝组织,免疫组织化学法检测肝细胞内HBcAg表达,显微镜计数HBcAg+肝细胞比例,HE染色观察肝组织病理变化。
1.2.11 HBV DNA检测 按“乙肝病毒核酸定量试剂盒PCR荧光探针法”说明书操作。
1.2.12 HE染色及免疫组织化学染色检测 100 ml·L-1甲醛固定肝组织,石蜡包埋;切片脱蜡。HE染色:至水,苏木素染色,分化,伊红复染,干燥封片。免疫组织化学染色:抗原修复;PBST(5 ml·L-1吐温20 PBS)洗涤,加兔抗人HBcAg-IgG(1∶150),4 ℃过夜;PBST洗涤,加HRP标记羊抗兔多聚体,37 ℃ 30 min;PBST洗涤,加DAB显色;流水冲洗,苏木素复染;分化;干燥,脱水;透明;封片。
1.2.13 转氨酶检测 贝克曼库尔特LX20全自动生化仪酶法检测。
1.3 统计学处理
2 结 果
2.1 HBV+DRibbles刺激HBsAg特异性效应细胞的体外增殖
HBV+DRibbles、HBsAg体外再刺激HBsAg免疫小鼠淋巴细胞,ELISA法检测培养上清IFN-γ显示,与培养液对照组及HBsAg蛋白刺激组相比,HBV+DRibbles刺激组能够产生更高水平IFN-γ,差异具有统计学意义(P<0.05)(图1A)。分选获得HBsAg免疫小鼠的CD4+或CD8+T细胞,加入负载HBV+DRibbles或HBsAg的DC细胞体外再刺激结果显示,与未负载抗原对照组和负载HBsAg的DC组相比,负载HBV+DRibbles的DC组均能够再刺激CD4+或CD8+T细胞产生更高水平IFN-γ,差异具有统计学意义(P<0.001)(图1B、C)。提示:HBV+DRibbles是交叉递呈HBV抗原的有效载体。
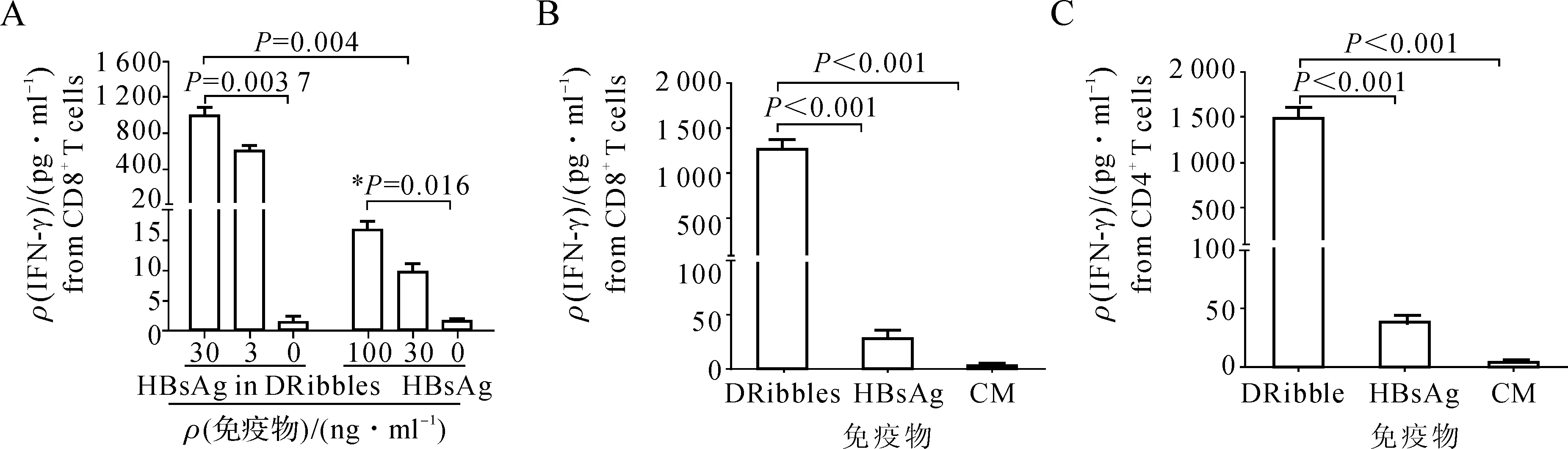
A.HBV+DRibbles、HBsAg体外刺激HBsAg特异性效应细胞72h,ELISA法检测培养上清IFN-γ含量(n=3);B、C.HBV+DRibbles、HBsAg负载DC细胞体外刺激HBsAg特异性CD4+、CD8+T细胞72h,ELISA法检测培养上清IFN-γ含量(n=3)
图1 HBV+DRibbles刺激HBsAg特异性效应细胞体外增殖
A.HBsAg-specific effector cells were re-stimulated with HBV+DRibbles or soluble HBsAg for 72 h,the levels of IFN-γ in supernatants were measured by ELISA(n=3); B,C.Immunomagnetic beads sorted CD4+or CD8+T cells were co-cultured with HBV+DRibbles or HBsAg preloaded DC for 72 h,the levels of IFN-γ in supernatants were determined by ELISA(n=3)
Fig 1 The proliferation of HBsAg-specific effector cells re-stimulated with HBV+DRibblesinvitro
2.2 HBV+DRibbles疫苗单独或联合DC免疫诱导HBV特异性细胞应答
分别采用HBV+DRibbles及DRibbles+DC疫苗免疫小鼠,收获小鼠脾细胞,加入HBsAg、HBs肽、HBcAg和HBc肽体外再刺激,ELISA法检测培养上清IFN-γ含量。与PBS对照组相比,HBV抗原及肽再刺激HBV+DRibbles疫苗免疫小鼠的淋巴细胞,均能够产生较高水平IFN-γ,差异具有统计学意义(P<0.05)。与HBV+DRibbles疫苗组相比,DRibbles+DC免疫组IFN-γ水平有一定程度升高,但差异无统计学意义(P>0.05)(图2)。提示:HBV+DRibbles疫苗单独或联合DC免疫均能够诱导多种HBV抗原及肽特异性的免疫应答。
2.3 HBV+DRibbles疫苗单独或联合DC免疫对HBV急性感染的治疗作用
以pAAV/HBV1.2质粒[6]尾静脉高压注射C57BL/6小鼠诱导的HBV感染初期模拟急性HBV感染阶段,对HBV急性感染模型小鼠实施HBV+DRibbles单独或联合DC治疗性免疫。与PBS对照组相比,HBV+DRibbles单独或联合DC免疫均能有效降低小鼠血清HBeAg水平(图3A)、HBV DNA水平(图3B)、肝细胞内HBcAg表达水平及HBcAg+肝细胞比例(图3C、D),差异具有统计学意义(P<0.05);同时,与HBV+DRibbles疫苗组相比,DRibbles+DC免疫组小鼠血清HBeAg(图3A)、HBV DNA水平(图3B)、肝细胞内HBcAg表达及HBcAg+肝细胞比例(图3C、D)的差异均无统计学意义(P>0.05)。提示:HBV+DRibbles疫苗单独或联合DC细胞免疫对HBV急性感染具有一定的治疗作用。
图2 HBV感染急性期不同方案免疫诱导HBV特异性细胞应答(n=3)
Fig 2 Cellular response induced in acute HBV infection(n=3)
为了观察疫苗治疗是否会造成小鼠肝组织损伤,我们检测了小鼠血清转氨酶水平及肝组织病理变化。与未免疫PBS对照组相比,HBV+DRibbles单独及联合DC免疫组小鼠血清ALT、AST水平未见明显变化(图4A、B),肝组织结构基本正常,仅见轻度小灶性坏死伴少量炎症细胞浸润(图4C)。提示:HBV+DRibbles单独或联合DC细胞疫苗治疗未造成明显的免疫病理损伤。

A、B.ELISA法及荧光定量PCR法检测血清HBeAg及HBV DNA水平; C.显微镜计数HBcAg+肝细胞数量; D.免疫组织化学法观察小鼠肝细胞内HBcAg表达(n=6 ×200)
图3 HBV+DRibbles疫苗对HBV急性感染治疗效果的检测
A,B.The levels of serum HBeAg and HBV DNA was determined by ELISA and real-time PCR.C.The percentage of HBcAg+hepatocytes was counted under microscope.D.Intrahepatic HBcAg was visualized by immunohistochemical staining(n=6 ×200)
Fig 3 Therapeutic efficacy of HBV+DRibbles vaccine in acute HBV infection
3 讨 论
HBV感染的控制和病毒的清除有赖于机体免疫系统,慢性HBV感染的机体产生HBV特异性免疫应答能力受损。HBV主要感染肝细胞,而肝细胞缺乏共刺激分子,直接递呈HBV抗原途径不能有效诱导CD8+T细胞活化,专职抗原递呈细胞的交叉递呈被普遍认为是诱导HBV特异性CD8+T细胞应答的重要途径[8-10]。本研究证实,HBV+DRibbles作为HBV抗原的有效载体,不仅能够诱导DC对HBV抗原的直接递呈,而且能够诱导DC对HBV抗原的交叉递呈,从而诱导有效的CD8+T细胞应答。
本研究中,HBV+DRibbles疫苗通过淋巴结注射途径免疫小鼠。与其他免疫途径相比,淋巴结组织富含DC等抗原递呈细胞,抗原直接注射能够靶向这些细胞,延长其接触抗原的时间,增强对抗原的摄取,使得更多DC接触T细胞,从而刺激大量T细胞活化,诱导产生高水平、特异性CTL应答[11-14]。我们前期抗肿瘤研究显示,将DRibbles疫苗直接注射腹股沟淋巴结,可以募集大量DC并促进T细胞活化与增殖,进一步促进DC对抗原的交叉递呈,引发强烈、特异性的CTL应答。本研究显示,在模拟HBV急性感染的模型小鼠中,采用HBV+DRibbles疫苗初次淋巴结免疫伴皮下加强的免疫策略,能够诱导产生HBV多特异性细胞免疫应答,有效抑制HBV复制、清除HBV感染的肝细胞。
为了进一步增强疫苗的免疫效果,我们在疫苗组分中增加DC。通过小鼠尾静脉高压注射法,联合输注FMS样酪氨酸激酶3配体(Flt3L)质粒和GM-CSF质粒,收获小鼠脾脏,制备DC[15]。通过流式细胞仪检测证实,小鼠联合输注Flt3L质粒和GM-CSF质粒后,脾脏细胞中CD11c+细胞比例达10%~30%,且DC具有多种亚群。
研究显示,与HBV+DRibbles疫苗单独免疫组相比,DRibbles+DC免疫组诱导的细胞应答水平有增强趋势,但细胞应答水平与治疗效果均无差异,分析可能与实验中所制备的DC有关。近来研究发现,采用Flt3L扩增人DC的同时也会导致CD4+FoxP3+Treg细胞增殖,降低人外周血中CD8+T细胞与Treg细胞比例[16]。GM-CSF来源的DC能够诱导T细胞无能及转换初始T细胞为FoxP3+Treg细胞[17];且我们在收获脾细胞时未能进一步纯化DC,其中CD11c+细胞只占10%~30%,含有非DC组分,而这些非DC组分亦可能发挥了免疫抑制作用;另外,疫苗的施用剂量、途径等亦可能影响治疗效果[18]。本研究为慢性HBV感染的治疗提供了新思路。
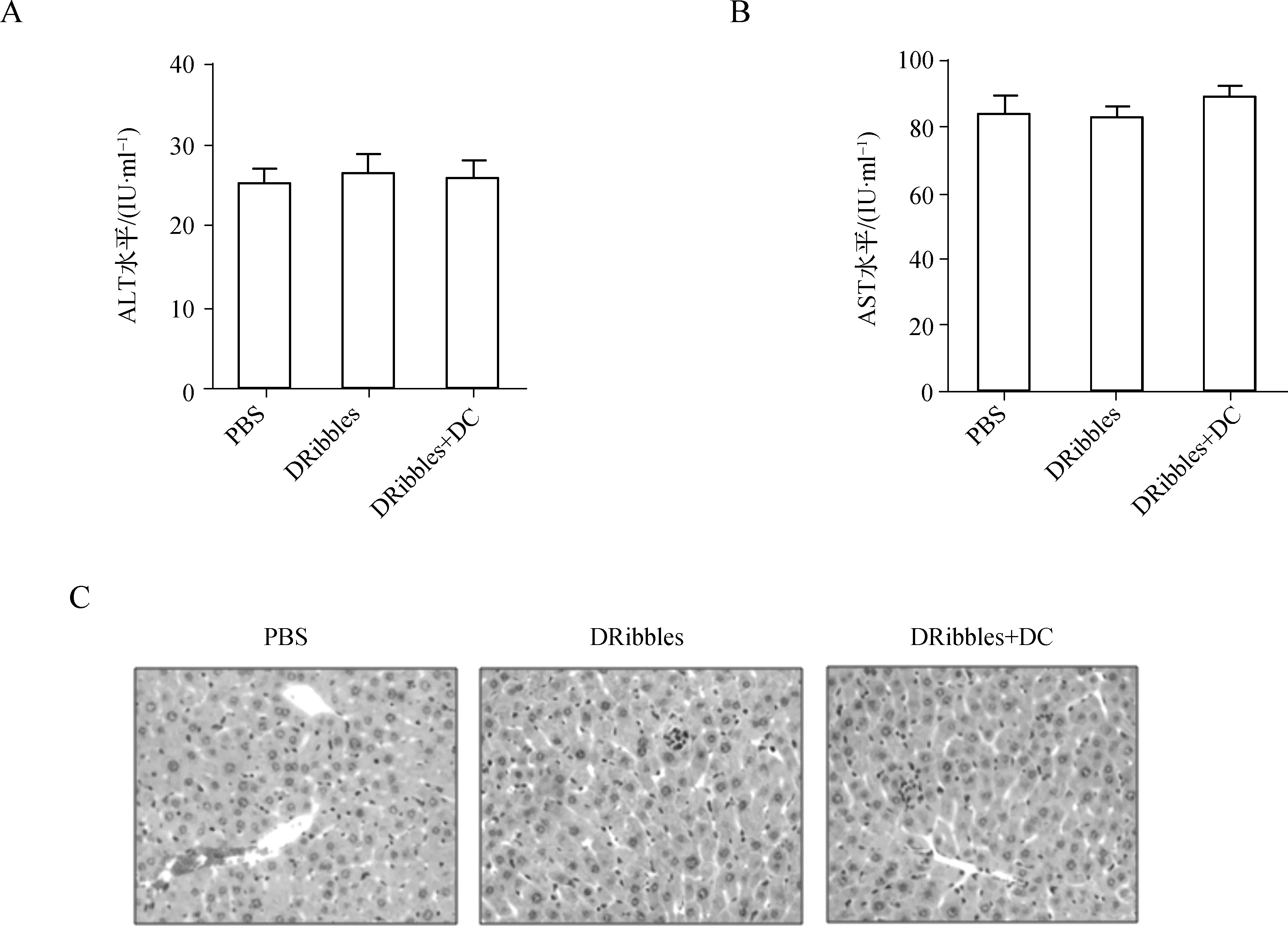
A、B.全自动生化仪酶法检测小鼠血清ALT、AST水平;C.HE染色观察肝组织结构(n=6 ×400)
图4 HBV+DRibbles疫苗治疗的免疫病理损伤观察
A,B.Serum ALT and AST levels were measured on automated clinical chemistry analyzer.C.The liver sections were stained with hematoxylin-Eosin(n=6 ×400)
Fig 4 Liver immunopathology mediated by HBV+DRibbles vaccination
[1] DENY P,ZOULIM F.Hepatitis B virus:from diagnosis to treatment[J].Pathol Biol(Paris),2010,58(4):245-253.
[2] MARTIN P,DUBOIS C,JACQUIER E,et al.TG1050,an immunotherapeutic to treat chronic hepatitis B,induces robust T cells and exerts an antiviral effect in HBV-persistent mice[J].Gut,2015,64(12):1961-1971.
[3] LI Y,WANG L X,PANG P,et al.Tumor-derived autophagosome vaccine:mechanism of cross-presentation and therapeutic efficacy[J].Clin Cancer Res,2011,17(22):7047-7057.
[4] LI Y,WANG L X,PANG P,et al.Crosspresentation of tumor associated antigens through tumor-derived autophagosomes[J].Autophagy,2009,5(4):576-577.
[5] TWITTY C G,JENSEN S M,HU H M,et al.Tumor-derived autophagosome vaccine:induction of cross-protective immune responses against short-lived proteins through a p62-dependent mechanism[J].Clin Cancer Res,2011,17(20):6467-6481.
[6] HUANG L R,WU H L,CHEN P J,et al.An immunocompetent mouse model for tolerance of human chronic hepatitis B virus infection[J].Proc Natl Acad Sci U S A,2006,103(47):17862-17867.
[7] 蒋自卫,刘霞.α-干扰素治疗慢性乙型肝炎的效果与患者HBV基因B、C型关系的研究[J].现代医学,2013,41(3):205-207.
[8] YANG P L,ALTHAGE A,CHUNG J,et al.Immune effectors required for hepatitis B virus clearance[J].Proc Natl Acad Sci U S A,2010,107(2):798-802.
[9] BERTOLETTI A,FERRARI C.Innate and adaptive immune responses in chronic hepatitis B virus infections:towards restoration of immune control of viral infection[J].Gut,2012,61(12):1754-1764.
[10] MAINI M K,SCHURICH A.The molecular basis of the failed immune response in chronic HBV:therapeutic implications[J].J Hepatol,2010,52(4):616-619.
[11] LAMBERT L A,GIBSON G R,MALONEY M,et al.Intranodal immunization with tumor lysate-pulsed dendritic cells enhances protective antitumor immunity[J].Cancer Res,2001,61(2):641-646.
[12] JOHANSEN P,MOHANAN D,MARTINEZ-GMEZ J M,et al.Lympho-geographical concepts in vaccine delivery[J].J Control Release,2010,148(1):56-62.
[13] SPANER D E,ASTSATUROV I,VOGEL T,et al.Enhanced viral and tumor immunity with intranodal injection of canary pox viruses expressing the melanoma antigen,gp100[J].Cancer,2006,106(4):890-899.
[14] ADAMINA M,ROSENTHAL R,WEBER W P,et al.Intranodal immunization with a vaccinia virus encoding multiple antigenic epitopes and costimulatory molecules in metastatic melanoma[J].Mol Ther-Nucl Acids,2010,18(3):651-659.
[15] SU S,ZHOU H,XUE M,et al.Anti-tumor efficacy of hepatocellular carcinoma based on dendritic cells combined with tumor-derived autophagosomes in murine models[J].Asian Pac J Cancer Prev,2013,14(5):3109-3116.
[16] KLEIN O,EBERT L M,ZANKER D,et al.Flt3 ligand expands CD4+FoxP3+regulatory T cells in human subjects[J].Eur J Immunol,2013,43(2):533-539.
[17] PLETINCKX K,LUTZ M B.Dendritic cells generated with Flt3L and exposed to apoptotic cells lack induction of T cell anergy and Foxp3+regulatory T cell conversioninvitro[J].Immunobiology,2014,219(3):230-240.
[18] KURIYAMA H,WATANABE S,KJAERGAARD J,et al.Mechanism of third signals provided by IL-12 and OX-40R ligation in eliciting therapeutic immunity following dendritic-tumor fusion vaccination[J].Cell Immunol,2006,243(1):30-40.
Study on therapeutic efficacy of autophagosome derived from HepG2.2.15 cells against acute HBV infection
WANG Lu,XUE Meng,YIN Peng-fei,FAN Fei,CAO Meng,WANG Li-xin
(DepartmentofMicrobiologyandImmunology,SchoolofMedicine,SoutheastUniversity,Nanjing210009,China)
Objective: To investigate the ability of HBV antigens inducing DC cross-presentation and to elicit HBV specific immune response by HepG2.2.15 cells(HBV+DRibbles)invitroand its effectiveness in acute HBV-infected mouse model.Methods: HBsAg-specific effector cells were re-stimulated with HBV+DRibbles or soluble HBsAg, then isolated CD4+or CD8+T cells were co-cultured with HBV+DRibbles or HBsAg preloaded DC.The levels of IFN-γ in supernatants were measured by ELISA.Lymphocytes from HBV+DRibbles alone or in combination with DC immunized acute HBV-infected mice or unvaccinated control mice were re-stimulated with HBV antigens and peptides, and the amounts of IFN-γ in supernatant were analyzed by ELISA.The levels of serum HBeAg, HBV DNA, ALT and AST were detected by ELISA, real-time PCR and enzyme method, respectively.The expression of HBcAg in hepatocytes was determined by immunohistochemical staining and the percentage of HBcAg+hepatocytes was counted under microscope.The liver sections were stained with hematoxylin-eosin.Results: The HBV+DRibbles stimulated HBsAg specific lymphocytes produced much higher IFN-γ than soluble HBsAg(P=0.004).Also, the CD4+or CD8+T cells re-stimulated by HBV+DRibbles preloaded dendritic cells generated significant higher IFN-γ(P<0.001).Levels of IFN-γ in supernatants of HBV antigens and peptides re-stimulated lymphocytes from the mice immunized with HBV+DRibbles alone or combined with DC were much higher than that of control group.While the differences were not significant between the mice vaccinated with HBV+DRibbles alone and in combination with DC.Compared with unvaccinated control group, both of the therapies could remarkably reduce the levels of HBeAg and HBV DNA and decrease HBcAg expression in hepatocytes and the percentage of HBcAg+hepatocytes, whereas the serum ALT and AST levels were not affected by vaccinations.The livers showed normal architecture and a mild inflammatory responses.No significant difference was observed between the mice treated with HBV+DRibbles alone and in combinationinvivo.Conclusion: HBV+DRibbles are efficient antigen carriers for effective cross-presentation.HBV+DRibbles can induce multiple HBV-specific T cell responses, effectively suppress HBV replication, clear the HBV-infected hepatocytes and do not cause severe liver damage.HBV+DRibbles in combination with DC do not further improve the therapeutic efficacy.
hepatitis B; hepatitis B rirus; autophagosome; therapeutic vaccine; mice
2016-02-25
2016-04-25
国家自然科学基金资助项目(31370895,31170857,30972783)
王璐(1983-),女,安徽合肥人,主管检验师,医学硕士。E-mail:joy83627@126.com
王立新 E-mail:lxwang@seu.edu.cn
王璐,薛萌,殷鹏飞,等.HBV+自噬小体疫苗治疗HBV急性感染的实验研究[J].东南大学学报:医学版,2016,35(5):647-653.
R392.11; R512.62
A
1671-6264(2016)05-0647-07
10.3969/j.issn.1671-6264.2016.05.001

