新型纳米银壳聚糖敷料的应用研究*
赵大川,黄宗海,林志群,郎 敏,柳学文
(南方医科大学珠江医院普外科,广州 510280)
·技术与方法·
新型纳米银壳聚糖敷料的应用研究*
赵大川,黄宗海△,林志群,郎 敏,柳学文
(南方医科大学珠江医院普外科,广州 510280)
目的 观察并评价新型纳米银壳聚糖敷料的物理特性、细胞毒性、抑菌性及其对伤口愈合的影响。方法 将纳米银材料添加到壳聚糖中制备新型复合生物抗菌敷料,并通过使用电子显微镜、CCK-8、抑菌圈及平板抑菌法、大鼠创伤动物模型愈合试验将壳聚糖敷料、纳米银壳聚糖敷料、银离子敷料及普通纱布敷料进行对比,以评价新型纳米银壳聚糖敷料的物理特性、细胞毒性、抑菌性及对伤口愈合的影响。结果 电子显微镜提示纳米银颗粒在壳聚糖敷料表面均匀分散,粒子直径约50nm;抑菌圈及平板抑菌法提示新型纳米银壳聚糖敷料对金黄色葡萄球菌、大肠杆菌及铜绿假单胞杆菌均有较强的抑菌能力;CCK-8实验提示其在0.5%及1.0%的纳米银浓度下无明显细胞毒性;动物愈合实验提示纳米银壳聚糖敷料可以促进伤口愈合。 结论 纳米银壳聚糖敷料符合现代新型生物敷料的基本要求,相较传统敷料有其优越性。
壳聚糖;纳米银;新型生物敷料;抗菌性
伤口愈合是一个复杂且精细的过程,是一系列不同类型细胞、蛋白激酶和生长因子等交互作用的结果,它们彼此之间相互协调,共同完成伤口修复[1]。1963 年Winter提出的湿性伤口愈合理论,发现保持伤口湿润,避免形成结痂可以促进伤口恢复,湿润的环境可以通过增加上皮再生,提高巨噬细胞及纤维母细胞活性,保持伤口清洁,减轻疼痛及减少敷料更换等方面促进伤口愈合[2-3]。为达到湿性愈合的效果,多种新兴材料制成的敷料孕育而生。其中,壳聚糖材料因其具有生物相容性、生物可降解性、无毒性及免疫原性,已经在生物领域有较为广泛的研究,且已经应用于血管支架、创伤修复等组织工程领域。在伤口修复领域,壳聚糖止血封堵敷料、壳聚糖创伤敷料已在我国批准使用[4]。
无机金属银具有抗菌谱广、抗菌性能强及不易产生抗药性等优点,近些年出现的含有纳米银的新型抗菌敷料在抗菌性及安全性上较以前的银离子敷料又有了进一步发展,而既往的研究也曾尝试将壳聚糖与纳米银结合,以制作一种具有更强抗菌性、生物相容性的材料[5-6];或将壳聚糖与纳米银整合到常规敷料中[7-8],使其可以在临床中进行使用。本课题组尝试制作基于普通壳聚糖敷料的新型纳米银壳聚糖(silver nanoparticles chitosan,SNC)敷料。并通过对其物理特性、细胞毒性、抗菌性及在实验动物中的应用,来评价该新型复合生物抗菌敷料的应用价值。
1 材料与方法
1.1 材料 动物: Wistar大鼠,体质量约250 g(由南方医科大学实验动物中心提供)。细胞:L-929(小鼠成纤维细胞)取自南方医科大学细胞生物学研究所细胞库。试剂:CCK-8试剂盒(日本同仁公司)。壳聚糖敷料:由湿法工艺将壳聚糖溶解后配制成一定浓度的纺丝原液,通过过滤、脱泡、凝固、拉伸、干燥等操作制成壳聚糖纤维,并用水刺法加工生产出医用壳聚糖敷料。银离子抗菌敷料购自百合公司(广东)。纳米银溶液购自耐尔纳米技术有限公司(张家港)。菌株:金黄色葡萄球菌(ATCC25923)、大肠杆菌(ATCC25922)及铜绿假单胞菌(ATCC27853)由南方医科大学珠江医院微生物实验室提供并常规保存。仪器:NanoDrop 2000光谱仪(Thermo公司);扫描电镜 (Jeol 公司);离子溅射仪(Jeol公司);酶标仪(molecular devices,美国)。
1.2 方法
1.2.1 SNC敷料的制备 采用自组装技术制造SNC敷料,先将纳米银溶液用无菌去离子水稀释,按照溶液与敷料质量比为50∶1的比例加入敷料所在容器中,使壳聚糖敷料浸入溶液中,溶液中所含纳米银质量分别为敷料质量的4.0%、2.0%、1.0%、0.5%,25 ℃在振荡器中以80 r/min震荡12 h。于65 ℃烘干敷料后分别用紫外照射敷料两侧各1 h。用分光光度计检测反应前及反应后纳米银溶液光密度(OD)值,判断纳米银离子是否与壳聚糖敷料组合。
1.2.2 SNC物理特性检测 (1)紫外-可见分光检测:用紫外-可见分光光度计(NanoDrop 2000)用于检测SNC敷料,波长扫描范围为200~800 nm。既往的研究提示417 nm处的紫外-可见光吸收峰是由于银微粒表面的电子云周期性变化集体激发产生的表面等离子共振带[8],由此推断纳米银是否已组合于壳聚糖敷料上。(2)壳聚糖敷料的扫描电镜:将SNC敷料裁剪成面积为8 mm×8 mm,厚度为5 mm的小片,60 ℃干燥2 h后将样品通过离子溅射镀膜法进行导电处理,并进行观察。
1.2.3 SNC敷料的细胞毒性实验 基于用于医疗器械(ISO 10993-12和ISO 10993-5)生物评估的国际标准,估计敷料的细胞毒性。分别将不同浓度的已紫外消毒的SNC敷料0.5 g浸入50 mL 1640PRMI(加入10%胎牛血清),并于37 ℃的条件下震荡24 h。通过0.2 mm的过滤器将SNC敷料浸提液过滤以除去不溶物残基,得到浸提液。选择经美国食品、药品监督管理局(FDA)认证的银离子敷料,及未结合纳米银的壳聚糖敷料,按上述方法制备,分为未添加敷料浸提液的空白对照组、壳聚糖敷料组、0.5%SNC敷料组、1.0%SNC敷料组,2.0%SNC敷料组、4.0%SNC敷料组及银离子敷料组。将小鼠L-929 成纤维细胞以1×104/孔分别加入96孔板中培养,培养条件为37 ℃、体积分数为5%CO2的环境下用加入10%小牛血清的RPMI 1640培养液培养,培养24 h。之后,将培养基替换为先前获得的浸提液(空白对照组更换为上述培养基),按上述条件继续培养24 h,移除培养基,按照CCK-8试剂盒说明书,将10 μL CCK-8及100 μL PRMI 1640试剂加入每个孔,并在37 ℃、5%CO2的环境下孵育30 min。由酶标仪在450 nm处检测每个孔的吸光度。相对增殖率(%)=(样品吸光度/空白对照组吸光度)×100%。根据相对增值率的大小,按表1评价不同敷料的细胞毒性。
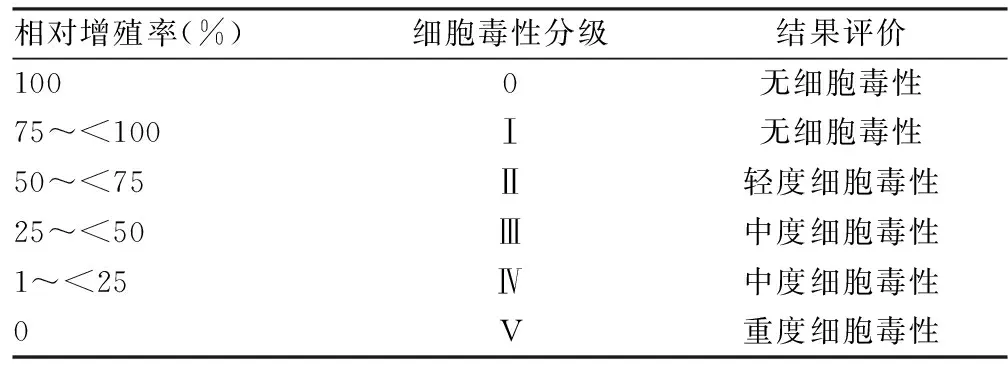
表1 细胞毒性分级
1.2.4 SNC的抗菌性 (1)抑菌圈实验:抑菌圈实验可以模拟本敷料在潮湿或有渗出的伤口时敷料控制微生物增长的能力,作为具有较强吸湿能力的SNC敷料,有必要探寻其扩散抑菌能力。每种细菌分别以1×108/mL的浓度接种到营养琼脂平板上,均匀涂抹3次,将不同浓度的SNC敷料、壳聚糖敷料及银离子敷料分别剪裁成直径为10 mm的圆形,湿润后放入已经接种细菌的培养皿上,并在37 ℃、5%CO2的条件下孵育18 h时,并测量抑菌环的范围。根据不同敷料的选择,本实验共分为壳聚糖敷料组、0.5%SNC敷料组、1.0%SNC敷料组、2.0% SNC敷料组、4.0%SNC敷料组及银离子敷料组。(2)震荡法测定SNC敷料抑菌能力:将不同浓度的SNC敷料分别剪成1 cm×1 cm的大小,置于无菌离心管中,作为实验组。选择经FDA认证的银离子敷料,及未结合纳米银的壳聚糖敷料,按上述方法制备,据置入敷料的不同,分为未添加敷料的空白对照组、壳聚糖敷料组、0.5%SNC敷料组、1.0%SNC敷料组、2.0%SNC敷料组、4.0%SNC敷料组及银离子敷料组。在每个离心管中加入4 mL 2XYT培养基。
分别在2XYT培养基中分别加入从琼脂平板上挑取的金黄色葡萄球菌、大肠杆菌及铜绿假单胞杆菌菌落过夜培养后,将菌液浓度稀释为(1.0~1.5)×105/mL的浓度,将1 mL菌液分别加入上述每个离心管中。将离心管在振荡器中以25 ℃、200 r/min震荡1 h,然后将其于37 ℃,5%CO2培养箱中继续培养。分别于0、1、6和24 h,稀释并涂布到琼脂平板进行细菌数量测定。
1.2.5 伤口愈合实验 将16只Wistar大鼠分为4组,即1%SNC敷料组、壳聚糖敷料组、银离子敷料组和普通纱布敷料组。研究方案符合中国准则实验动物。每只大鼠经腹腔注射水合氯醛麻醉,除去背毛后皮肤用75%乙醇和安尔碘Ⅲ消毒。在每一只大鼠背后去毛处切除出一个面积为 100 mm2大小的完整厚度伤口。将敷料分别固定于每一只大鼠身上,每天在伤口处局部换药。分别于第2、4、6、8、10天观察实验动物伤口愈合情况。创面愈合率=(术后伤口面积-第n天伤口面积)/术后伤口面积×100%。在术后第8天分别从各组取1只大鼠的皮肤样品。将组织用10%福尔马林溶液固定,并用乙醇梯度脱水,二甲苯透明、石蜡包埋,将组织切成5~7 mm宽的薄片,常规苏木素-伊红(HE)染色。观察上皮组织、皮脂腺、新生血管及肉芽组织情况。

2 结 果
2.1SNC敷料物理特性 紫外-可见吸收光谱见图1,结果提示纳米银已组合于壳聚糖敷料上。SNC敷料的电镜扫描结果见图2,纳米银颗粒在壳聚糖敷料表面均匀分散,粒子直径约50nm,但仍可见纳米银团聚现象。
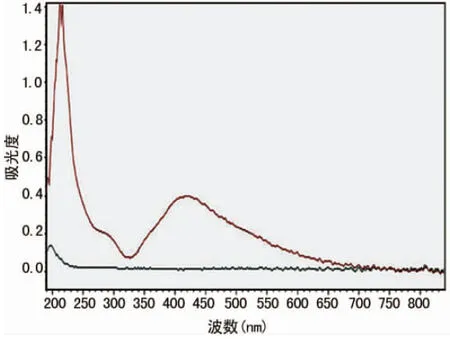
图1 SNC敷料的紫外-可见光谱
2.2SNC敷料的细胞毒性检测L929细胞用上述6种浸提液及空白对照组处理24h后,壳聚糖无细胞毒性,而银离子敷料具有中度细胞毒性,SNC敷料有一定细胞毒性,且其细胞毒性随纳米银含量增加而增加,见图3、表2。
2.3 抗菌性实验
2.3.1 抑菌圈实验 根据上述评价方法,发现单纯的壳聚糖敷料在3种细菌中均无抑菌圈出现,而添加了纳米银的壳聚糖敷料,在3种不同细菌中,其抑菌圈大小随着纳米银浓度的增加而逐步增加,见图4。

图2 SNC敷料的电镜扫描图
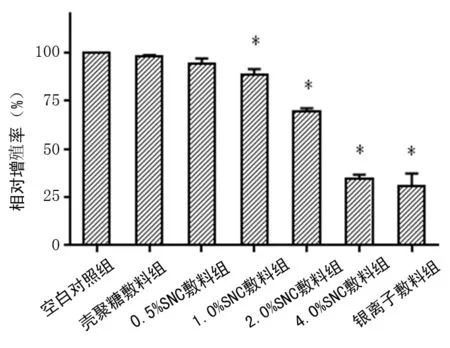
图3 细胞毒性实验
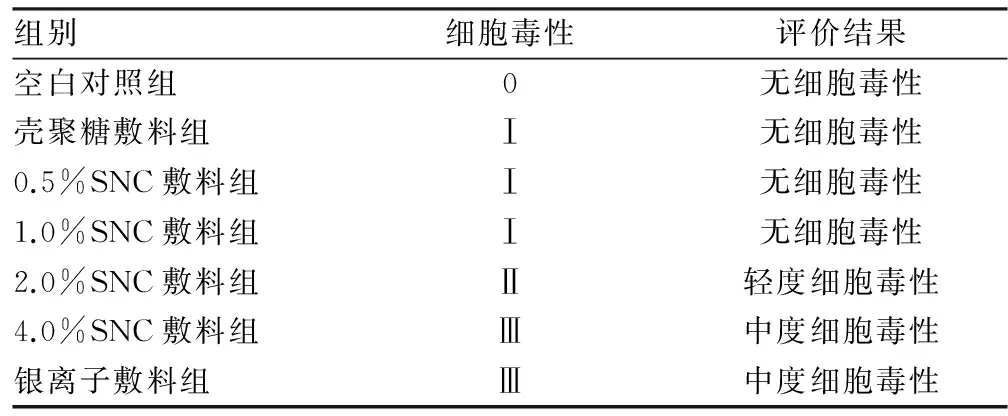
表2 不同敷料的细胞毒性评价
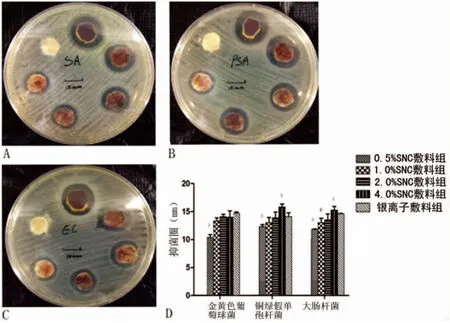
图4 不同敷料分别在金葡菌、大肠杆菌及铜绿假单胞菌的抑菌圈
2.3.2 震荡抑菌实验结果 分别在1、6及24h测量添加不同敷料的各个离心管中细菌浓度,制作抑菌曲线,结果未添加纳米银的壳聚糖敷料无明显抑菌性,而添加纳米银或具有银离子的敷料则有较为优秀的抑菌性能,见图5。
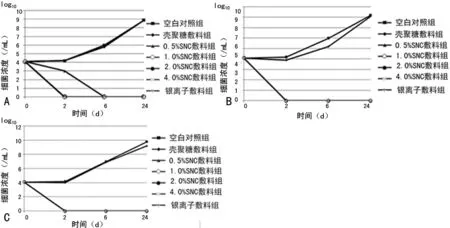
图5 震荡抑菌实验抑菌曲线
2.4 伤口愈合实验
2.4.1 伤口愈合程度测量 分别于第2、4、6、8、10天记录伤口愈合情况。第6天时,1.0%SNC敷料组伤口愈合情况明显优于其他组(P<0.05),第10天时相较不具有抗菌能力的壳聚糖敷料组及普通纱布敷料组,1.0%SNC敷料组及银离子敷料组的愈合率更高(P<0.05),见表3、图6。

表3 应用不同敷料小鼠伤口愈合情况
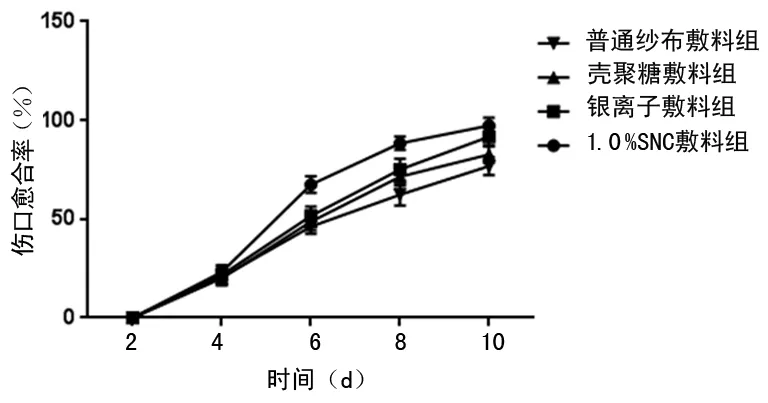
图6 伤口愈合情况趋势图
2.4.2 组织染色 在切口愈合的第10天,HE染色显示1.0%SNC敷料组中上皮组织增生良好,可见皮脂腺及新生血管,炎症反应较轻;而普通纱布敷料组则显示为不完全的上皮化形成,见图7。
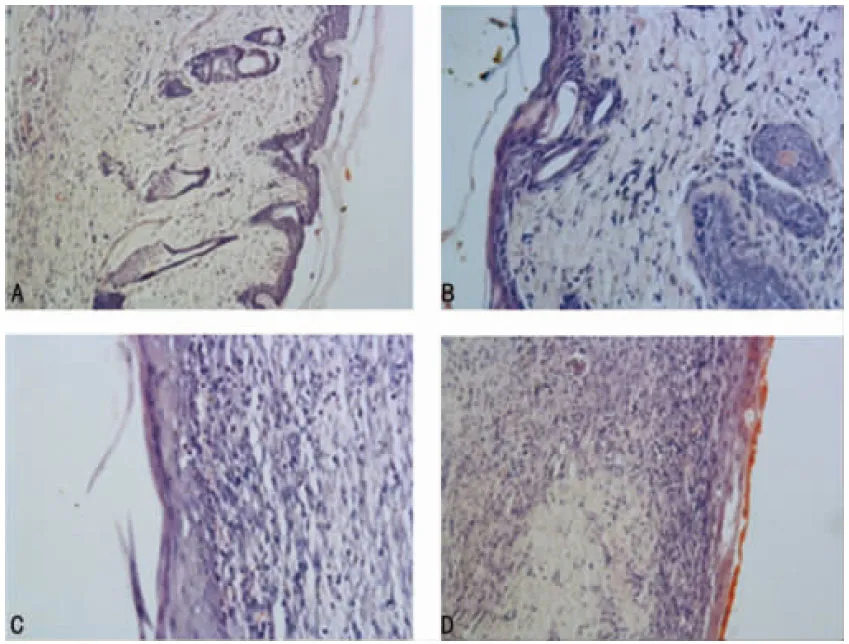
图7 第10天不同组别小鼠伤口病理切片(HE,×20)
3 讨 论
壳聚糖作为一种具有吸湿、抑菌、止血、调节炎症反应的天然材料,是当前研究的热点。然而壳聚糖的生物性能,又与多种因素相互关联,不同的脱乙酰程度及相对分子质量的大小,会对其止血性、抗菌性及与炎症反应产生极大影响。低脱乙酰度的壳聚糖甚至对耐甲氧西林金葡菌有很好的抑制性[9],而小相对分子质量的壳聚糖也会提高组织对其降解的速度[10]。
既往的研究显示,在一定范围内,生物材料的抗菌性能与纳米银浓度呈正相关,为达到较为优秀的抗菌性能,一般需要纳米银的添加比例不低于生物材料的1.5%[11],而在本实验中,0.5%的SNC敷料已经显示出优秀的抗菌能力,考虑其为纳米银与壳聚糖的协同作用所导致的抗菌性能提升。其协同作用表现为:(1)纳米银粒子尺寸小且比表面积大,容易与细菌发生接触反应,使纳米银粒子黏附到细胞膜上,并渗入到细菌内部,在细菌细胞内部纳米银粒子通过与酶蛋白中的硫和磷发生作用,使细菌丧失酶活性,同时也会破坏细菌的呼吸链,导致细菌死亡[12];(2)纳米银粒子在细菌细胞中可以释放银离子,从而进一步提高其抗菌能力;再次,壳聚糖上未反应的-NH2质子化生成-NH3+,能够吸附细菌表面带负电荷的分子基团而改变其细胞通透性,从而导致细菌细胞内组分如蛋白质与葡萄糖的泄露,致使细菌死亡;(3)壳聚糖复合物具有独特的网状结构,当与细菌接触时,其更易堆积在细菌细胞表面而造成细胞代谢减弱,从而抑制细菌繁殖[13]。
现代生物敷料应该是具有良好保湿能力,不粘连新生肉芽组织,减少更换时患者的痛苦;可以促进上皮细胞再生,提高巨噬细胞及纤维母细胞活性;保持伤口清洁,减少伤口可能的细菌感染,促进伤口愈合的新型敷料。本课题组所制作的敷料,除了其优异的抗菌性外,低于1%的SNC模型更是无明细的细胞毒性。且在动物实验中证明本敷料相较传统敷料可以促进伤口的愈合,也能够保持伤口的湿润。综上所述,本敷料符合现代生物敷料的要求。
但本实验依然有一些问题尚待解决:(1)尽管选择的纳米银材料是一种目前看来较为优秀的抗菌材料,相关的研究也证实在短期研究中,未见到银对生物体产生严重不良反应[14-15],但是其长期影响仍无定论。(2)现阶段并未完全理解SNC敷料是如何影响伤口愈合的,其具体机制是为何。有研究提示小相对分子质量的壳聚糖可以抑制基质金属蛋白酶2的活性及表达,当其相对应分子质量在(3~5)×103时,其可以达到最大的效应。而过量的基质金属蛋白酶2被认为是抑制伤口愈合的因素之一。但这只是其中一个假设,关于SNC敷料如何促进伤口愈合,还需要进一步研究。
总而言之,SNC敷料符合现代新型生物敷料的基本要求,相较传统敷料有其优越性,值得临床进一步研究。
[1]HengMC.Woundhealinginadultskin:aimingforperfectregeneration[J].IntJDermatol,2011,50(9):1058-1066.
[2]黄书鹏,刘林奇,李乐,等.湿性愈合敷料在皮片移植供区创面愈合中的应用[J].重庆医学,2014,21(8):2803-2805.
[3]CardinalM,EisenbudDE,ArmstrongDG,etal.Serialsurgicaldebridement:aretrospectivestudyonclinicaloutcomesinchroniclowerextremitywounds[J].WoundRepairRegen,2009,17(3):306-311.
[4]汤京龙,徐红,郭世富,等.医用敷料分类界定的初步研究[J].中国药事,2014(9):1009-1013.
[5]AhamedMI,SankarS,KashifPM,etal.Evaluationofbiomaterialcontainingregeneratedcelluloseandchitosanincorporatedwithsilvernanoparticles[J].IntJBiolMacromol,2015(72):680-686.
[6]ShahzadS,YarM,SiddiqiSA,etal.Chitosan-basedelectrospunnanofibrousmats,hydrogelsandcastfilms:novelanti-bacterialwounddressingmatrices[J].JMaterSciMaterMed,2015,26(3):136.
[7]彭俊军,张馨,吴毅明,等.壳聚糖改性织物中原位合成银纳米粒子[J].高等学校化学学报,2014,35(2):415-420.
[8]LiC,FuR,YuC,etal.Silvernanoparticle/chitosanoligosaccharide/poly(vinylalcohol)nanofibersaswounddressings:apreclinicalstudy[J].IntJNanomedicine,2013(8):4131-4145.
[9]LeeDS,JeongSY,KimYM,etal.Antibacterialactivityofaminoderivatizedchitosansagainstmethicillin-resistantStaphylococcusaureus(MRSA)[J].BioorgMedChem,2009,17(20):7108-7112.
[10]XieH,LucchesiL,TeachJS,etal.Long-termoutcomesofachitosanhemostaticdressinginlaparoscopicpartialnephrectomy[J].JBiomedMaterResBApplBiomater,2012,100(2):432-436.
[11]邹兆伟,史福军,黄宗海,等.纳米载银磷酸锆抗菌聚氨酯的抗菌性能[J].中国组织工程研究,2012,16(3):405-408.
[12]RaiM,YadavA,GadeA.Silvernanoparticlesasanewgenerationofantimicrobials[J].BiotechnolAdv,2009,27(1):76-83.
[13]ShiZ,NeohKG,KangET,etal.Antibacterialandmechanicalpropertiesofbonecementimpregnatedwithchitosannanoparticles[J].Biomaterials,2006,27(11):2440-2449.
[14]耿健,柳大烈,张阳,等.纳米银抗菌医用敷料创面外用后纳米银在体内的分布[J].中国组织工程研究与临床康复,2011,15 (16):2915-2919.
[15]程鹏,高萍,程琳,等.含银离子烧伤敷料的遗传毒性研究[J].天津药学,2014,26(2):1-3.
Application research of a novel silver nanoparticles chitosan dressing*
ZhaoDachuan,HuangZonghai△,LinZhiqun,LangMin,LiuXuewen
(DepartmentofGeneralSurgery,ZhujiangHospital,SouthernMedicalUniversity,Guangzhou,Guangdong510280,China)
Objective To evaluate the construction,cytotoxicity,antibacterial activity and wound healing application of a novel silver nanoparticles chitosan dressing.Methods Silver nanoparticles were added into chitosan to prepare a new compound biological antimicrobial dressing(silver nanoparticles chitosan dressing,SNC dressing).By using UV-Vis spectroscopy,scanning electron microscopy,CCK-8 test,zone of inhibition test,quantitative test and wound healing experiment,we evaluated the physical property of the new dressing and compared this new dressing with traditional dressing,chitosan dressing and silver ion-releasing chitosan dressing.Results UV-Vis Spectroscopy and SEM studies showed silver nanoparticles well dispersed in chitosan fiber with a particle size about 50 nm.In antimicrobial test,the SNC dressing showed a immense antimicrobial property for Staphylococcus aureus,escherichia coli and pseudomonas aeruginosa.In cytotoxicity test,the SNC dressing loading 0.5% and 1.0% silver nanoparticles was proved to behaved slight cytotoxicity.In wound healing experiments,healing promotion and improved reconstruction were observed in the SNC dressing compared with other dressings.Conclusion SNC dressing meets the basic requirements of the modern biological dressing and it might have more advantages comparing with traditional dressings.
chitosan;silver nanoparticles;novel biological dressings;antibacterial activity
广州市海珠区科技计划项目(2013-cg-27)。 作者简介:赵大川(1990-),在读博士,主要从事外科敷料对伤口愈合方面研究。△
E-mail:drhuangzh@163.com。
10.3969/j.issn.1671-8348.2016.23.024
R
A
1671-8348(2016)23-3237-04
2016-04-09
2016-06-29)

