肺结核潜伏期和活动期患者外周血miR-29a和IFN-γ水平变化*
詹 燏 刘水逸 吴唐维 石丽峰 刘怡雯 张红梅 汪 慧 卢忠心
肺结核潜伏期和活动期患者外周血miR-29a和IFN-γ水平变化*
詹 燏 刘水逸 吴唐维 石丽峰 刘怡雯 张红梅 汪 慧 卢忠心
目的:分析肺结核(TB)潜伏期和活动期患者血浆miR-29a、γ干扰素(IFN-γ)mRNA和血清IFN-γ水平变化及其相关性。方法:选择活动期TB患者(活动期TB组)27例、潜伏期TB患者(潜伏期TB组)22例及非TB患者(对照组)30例;采用逆转录荧光定量PCR(qRT-PCR)检测各组血浆miR-29a水平和单个核细胞IFN-γ mRNA水平,采用ELISA检测各组血清IFN-γ水平;比较各指标水平组间差异,分析两结核组miR-29a与IFN-γ mRNA的相关性。结果:活动期TB组miR-29a显著高于潜伏期TB组和对照组(P<0.01);与对照组比较,潜伏期TB组和活动期TB组单个核细胞IFN-γ mRNA水平和血清IFN-γ水平均降低(P<0.01),活动期TB组较潜伏期TB组更低(P<0.05)。活动期TB组和潜伏期TB组血浆miR-29a水平与单个核细胞IFN-γ mRNA水平均呈显著负相关(r分别为-0.697、-0.559,P<0.05)。结论:miR-29a可通过调控靶基因IFN-γ mRNA表达,参与TB的发生发展。
活动性肺结核;潜伏感染;miR-29a;干扰素-γ
结核病(Tuberculosis,TB)是结核分枝杆菌引起的慢性传染性疾病,其发病率近年有增加趋势,新发病例主要由潜伏性结核感染者(Latent Tuberculosis Infection,LTBI)进展而来。miRNA是一类高度保守的单链小分子RNA,通过转录后水平调控mRNA参与细胞发育、分化、增殖、凋亡,DNA甲基化,DNA修复及抗炎反应和促炎反应等病理生理活动,与人类多种疾病相关[1]。与之高度同源的miR-29a参与免疫反应,可通过抑制靶基因干扰素-γ(IFN-γ)的产生,下调机体对结核分枝杆菌的免疫应答,从而有利于结核分枝杆菌感染[2],被认为是TB发生的重要机制和诊断标志[3]。本文检测分析miR-29a及其靶基因IFN-γ mRNA在活动期TB和潜伏期TB患者外周血水平差异以及两者的相关性,进一步佐证miR-29a对TB发生发展的重要作用。
1 资料与方法
1.1 对象与分组
选择2013-09—2014-11本院呼吸科首次诊断的活动期TB患者27例(活动期TB组),年龄18—67岁,平均(37.90±10.20)岁,其中男14例,女13例;潜伏期TB患者22例(潜伏期TB组),年龄20—71岁,平均(38.15±10.31)岁,其中男12例,女10例。活动期TB的诊断依据国家卫生部《肺结核诊断标准(WS288-2008)》[4];潜伏期TB的诊断标准为仅结核菌IFN-γ释放试验阳性,无结核症状,胸部X光正常[5]。另选同期因咳嗽、咳痰、胸痛、咯血等症状来本院呼吸科就诊,经以下试验和检查排除结核菌感染者作为对照组:结核菌素试验(PPD)阴性或硬结小于15mm,结核菌IFN-γ释放试验阴性,胸部X光正常,共30例,男16例,女14例,年龄21—64岁,平均(37.5±9.85)岁。所有入选者均排除肿瘤、自身免疫性疾病和糖尿病等。各组性别(χ2=1.221)、年龄(F=2.78)分布差异无统计学意义(P>0.05),具有可比性。
1.2 检测试剂和仪器
RNA提取试剂盒(AM1556,批号:00324879)、miR逆转录试剂盒(批号:1302109)、miR-29a逆转录引物(批号:P131202-006 H04)、miR-29a PCR引物(批号:P130319-004 G02)、内参miR-39逆转录引物(批号:P130402-000 H01)、内参miR-39 PCR引物(批号:130806-000 A12)均购自美国ABI公司;Trizol 试剂(批号:80802)购自美国Invitrogen公司;荧光定量PCR试剂盒(批号:50115)购自北京康为公司;逆转录试剂盒购自日本TOYOBO公司(批号:255600);人淋巴细胞分离液购自天津美德太平洋科技有限公司(批号:171403D);IFN-γ ELISA检测试剂盒购于美国R&D公司(批号:886154);IFN-γ和内参β-actin引物均由武汉生工合成。各种引物序列见表1。StepOnePlus荧光定量PCR仪购自美国ABI公司;EnSpire全波长多功能酶标仪为美国PerkinElmer公司产品。
1.3 检测指标和方法
1.3.1 逆转录荧光定量PCR检测血浆miR-29a水平:采集三组对象清晨空腹外周静脉血3ml于EDTA抗凝管中,4h内以相对离心力2 000g离心20min,取血浆储存于-80℃冰箱备检。检测前取冻存血浆,按AM1556试剂盒说明书步骤提取总RNA(A260/A280为1.8-2.0)后进行逆转录。逆转录体系为20μl:1μl总RNA,4μl 5×Reaction Mix反应混合物,2μl 10×SuperScript Enzyme Mix酶混合物,用焦炭酸二乙酯(DEPC)水补足至20μl;反应条件:37℃ 60min,95℃ 5min。然后按照荧光定量PCR试剂盒说明书进行PCR,反应体系20μl:10μl EXPRESS SYBR Green ERTMqPCR Super Mix反应混合物,0.4μl 10μmol/L miR-29a引物或内参miR-39引物,0.4μl 10μmol/L通用荧光定量PCR引物,0.04μl ROX参比染料,2μl cDNA和7.16μl DEPC处理水,混匀,离心,每个样本设3个复孔;反应条件:50℃预孵育2min,95℃预变性2min,95℃变性15s,60℃退火延伸1min,40个循环扩增。60℃延伸时采集荧光信号。反应结束后直接得到样本的域值循环数,每个样本均计算平均值,通过平均值计算相对表达量。miR-29a的相对表达量=2-△CT,△CT=CT(miR-29a)-CT(miR-39)。
1.3.2 逆转录荧光定量PCR检测外周血单个核细胞IFN-γ mRNA水平:采集三组对象清晨空腹肘静脉血3ml于EDTA抗凝管中,4h内以相对离心力2 000g离心20min,弃上清,用淋巴细胞分离液按常规操作提取单个核细胞储存于-80℃冰箱备检。检测前取冻存单个核细胞,按Trizol试剂说明书步骤提取单个核细胞的总RNA(A260/A280为1.8-2.0)后进行逆转录PCR,反应体系15μl:1μl RNA,1.2μl逆转录引物,5×逆转录缓冲液3μl,逆转录酶0.75μl,DEPC水补足至15μl;混匀、离心;反应条件:37℃ 15min,98℃ 5min。最后依照荧光定量PCR试剂盒说明书进行PCR,反应体系20μl:4μl逆转录产物,IFN-γ上、下游引物各1μl或β-actin上、下游引物各1μl,10μl EXPRESS SYBR Green ERTMqPCR Super Mix反应混合物,双蒸水补足至20μl,混匀,离心;每个样本设3个复孔;反应条件:95℃预变性10min,95℃ 5s,60℃ 1min,40个循环扩增;72℃延伸10min。反应结束后直接得到样本的域值循环数,每个样本均计算平均值,通过平均值计算相对表达量。IFN-γ mRNA的相对表达量=2-△CT,△CT=CT(IFN-γ)-CT(β-actin)。
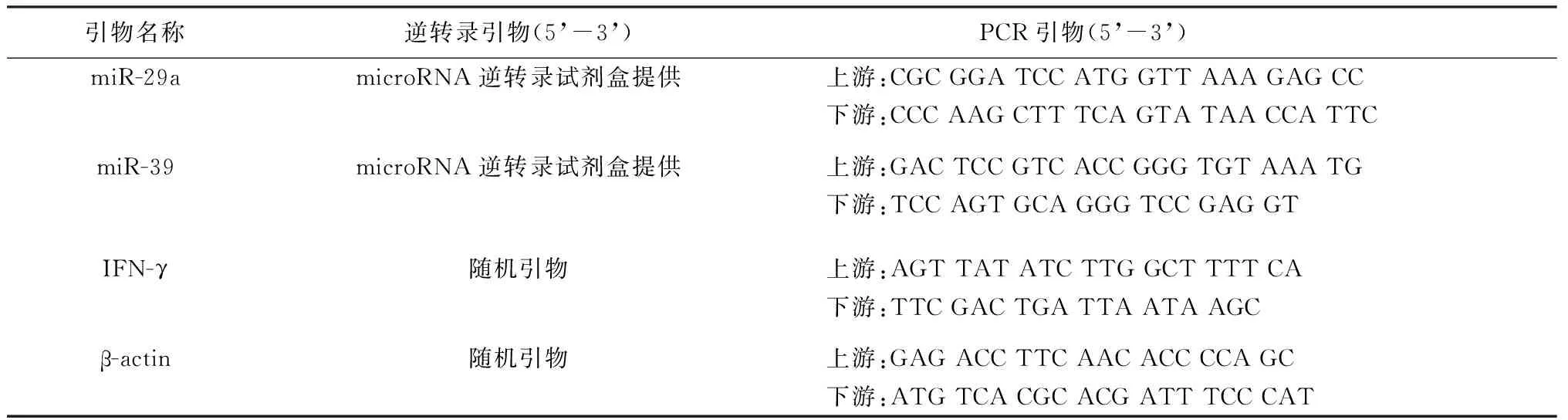
表1 引物序列
1.3.3 ELISA检测血清IFN-γ水平:采集三组对象清晨空腹外周静脉血3ml置于非抗凝管中,混匀后离心(3 000r/min)5min,取血清检测IFN-γ含量。严格按照IFN-γ试剂盒说明书操作,于酶标仪450nm测吸光度,建立标准曲线,计算各样本含量。
1.4 统计学处理

2 结 果
2.1 各组血浆miR-29a水平比较
各组血浆miR-29a水平差异有统计学意义(P<0.01);活动期TB组miR-29a显著高于潜伏期TB组和对照组(t=4.726、4.064,P<0.01),潜伏期TB组和对照组之间差异无统计学意义(t=1.851,P>0.05)。见表2。
2.2 各组外周血单个核细胞IFN-γ mRNA和血清IFN-γ水平比较

表2 各组血浆miR-29a水平比较
注:与对照组和潜伏期TB组比较,1)P<0.01
各组单个核细胞IFN-γ mRNA和血清IFN-γ水平差异均有统计学意义(P<0.01)。与对照组比较,潜伏期TB组和活动期TB组IFN-γ mRNA水平均降低(t=5.511、7.016,P<0.01);活动期TB组较潜伏期TB组更低(t=2.202,P<0.05)。与对照组血清IFN-γ水平比较,潜伏期TB组和活动期TB组均降低(t=20.267、15.082,P<0.01),活动期TB组较潜伏期TB组更低(t=6.736,P<0.01)。而且,IFN-γ mRNA水平和IFN-γ血清水平从对照组到活动期TB组的逐渐降低趋势都具有良好一致性(r=0.582,P<0.01)。见表3。

表3 各组单个核细胞IFN-γ mRNA和血清IFN-γ水平比较
注:与对照组比较,1)P<0.01;与潜伏期TB组比较,2)P<0.05,3)P<0.01
2.3 相关性分析
活动期TB组和潜伏期TB组血浆miR-29a水平与单个核细胞IFN-γ mRNA水平均呈显著负相关(r=-0.697、-0.559,P<0.01),见图1。
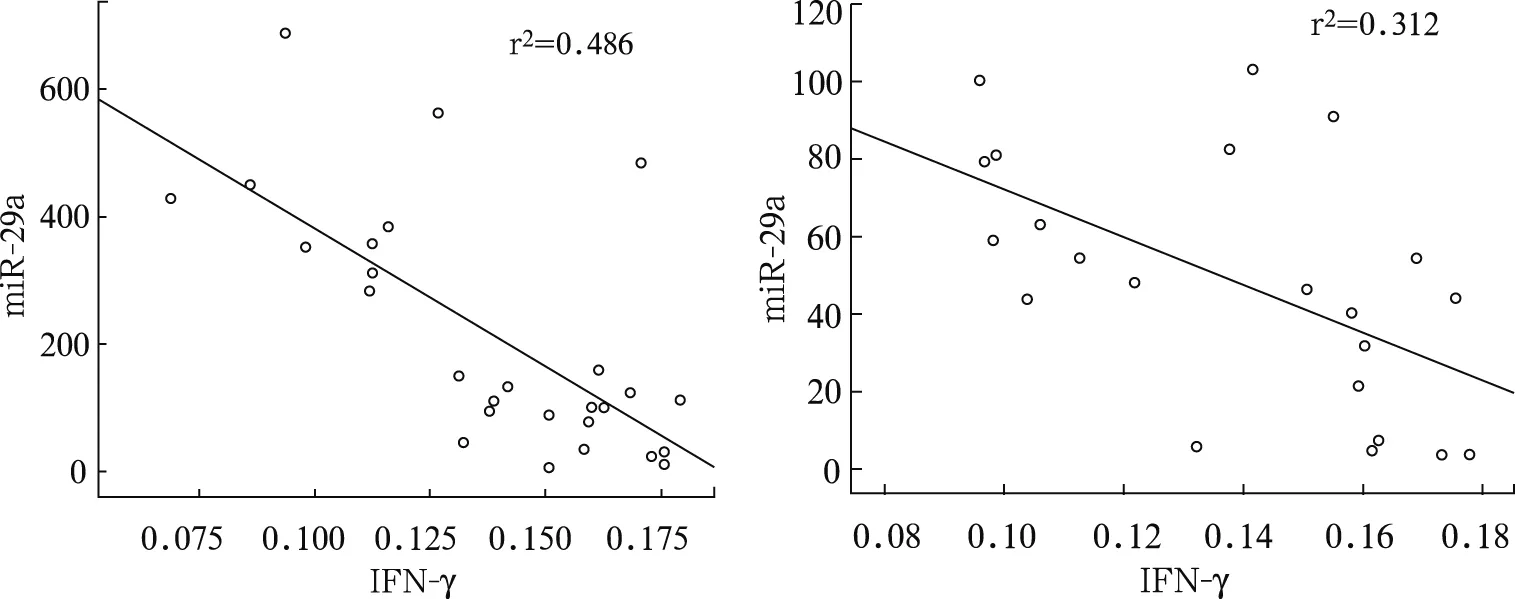
图1 活动期TB组(左)和潜伏期TB组(右)血浆miR-29a与单个核细胞IFN-γ mRNA水平的相关分析图
3 讨 论
结核分枝杆菌引起的TB是一种严重危害人类健康的慢性传染性疾病,被我国列为重大传染病之一。WHO 2012年报道,2011年全球新增TB 870万,死亡110万,其中中国新增患者90万—110万,占全球发病人数的14%,位居全球第二位[6]。新发TB病例主要由LTBI进展而来,其中5%—10%的LTBI进展为活动期肺结核[7],表明人类对结核分枝杆菌易感,且结核分枝杆菌容易躲避宿主免疫系统攻击,而在宿主体内长期潜伏,一旦机体免疫力下降,潜伏期人群即会进展为活动期TB。
miRNA是一类高度保守的单链小分子RNA,长度为18—25个核苷酸。成熟的miRNA可通过与靶mRNA的3’端非编码区结合而抑制靶mRNA的翻译或导致靶mRNA降解,发挥基因转录后的调节功能[8]。近年来研究证实,血液循环系统中miRNA广泛而稳定地存在,并随疾病的发生发展出现相应的特异性改变,成为疾病诊断的新型生物标志物[9-12]。已有研究表明,miR-29a在结核分枝杆菌感染不同时相有一定的表达差异,被认为是TB的诊断标志[13-15]。miR-29a可通过靶向IFN-γ,调控机体对结核分枝杆菌感染引起的免疫应答,从而对结核分枝杆菌感染发挥重要作用[2,16]。
本研究结果显示,活动期TB患者血浆miR-29a水平比潜伏感染者及对照者显著增高,与此同时,活动期TB患者和潜伏期TB患者单个核细胞IFN-γ mRNA水平明显降低,提示人体感染结核分枝杆菌后,miR-29a可能负向调控机体对病原体的免疫应答,降低机体抵抗力,诱发TB。血清中IFN-γ水平此时也明显降低,与IFN-γ mRNA表达下调呈良好一致性,因而检测血清IFN-γ水平也能反映miR-29a变化及辅助诊断TB。IFN-γ mRNA是miR-29a作用的靶基因,活动期TB患者外周血miR-29a升高,靶向IFN-γ mRNA,降解增加,存量减少,使机体抗结核能力降低,从而有利于结核分枝杆菌的体内增殖,是miR-29a调控IFN-γ致TB发生发展的可能机制。
综上所述,结核分枝杆菌感染可引起机体miR-29a表达上调,使其靶分子IFN-γ抗结核免疫作用下降,继而促进TB的发生发展。临床检测外周血miR-29a及其靶基因水平在结核分枝杆菌感染过程中的动态变化,对进一步分析、探讨miR-29a生物学作用和制定防治策略有重要意义。
◀
本文第一作者简介:
詹 燏(1975-),女,汉族,硕士,副主任技师,主要从事微生物检验工作
1 周 烨,向俊宇,侯 晋,等. 微小RNA作为疾病标志物的研究进展[J]. 中华检验医学杂志, 2011,34(10):871-876.
2 Ma F, Xu S, Liu X, et al. The microRNA miR-29 controls innate and adaptive immune responses to intracellular bacterial infection by targeting interferon-γ[J]. Nat Immunol, 2011,12(9):861-869.
3 Fu Y, Yi Z, Wu X, et al. Circulating microRNAs in patients with active pulmonary tuberculosis[J]. J Clin Microbiol, 2011,49(12):4 246-4 251.
4 中华人民共和国卫生部.WS288-2008肺结核诊断标准[M]. 北京:人民卫生出版社,2008:1-16.
5 Chen X, Yang Q, Zhang M, et al. Diagnosis of active tuberculosis in China using an in-house gamma interferon enzyme-linked immunospot assay [J]. Clin Vace Immunol, 2009,16(6):879-884.
6 World Health Organization. Global tuberculosis report 2012[S]. France:WHO Press, 2012: 23-24.
7 Qing LM, Fei Liu, Xing YY. Identification of latent tuberculosis infection related microRNAs in human U937 macrophages expressing Mycobacterium tuberculosis Hsp16.3[J].BMC Microbiology, 2014,14(21):37-45.
8 张玉芝, 尹正君, 付玉荣. MicroRNA与肺部感染的研究进展[J]. 细胞与分子免疫学杂志, 2012,28(11):1 223-1 225.
9 Chang PY, Chen CC, Chang YS, et al. MicroRNA-223 and microRNA-92a in stool and plasma samples act as complementary biomarkers to increase colorectal cancer detection[J]. Oncotarget, 2016,7(9):10 663-10 675.
10 Rezk NA, Sabbah NA, Saad MS. Role of microRNA 126 in screening, diagnosis, and prognosis of diabetic patients in Egypt [J] . IUBMB Life,2016,68(6):452-458.
11 Salamin O, Jaggi L, Baume N, et al. Circulating microRNA-122 as potential biomarker for detection of testosterone abuse [J].PLoS One, 2016,11(5):e0155 248.
12 Wang JX, Xu J, Han YF, et al. Diagnostic values of microRNA-31 in peripheral blood mononuclear cells for pediatric pulmonary tuberculosis in Chinese patients [J].Genetics and Molecular Research:GMR,2015,14(4):17 235-17 243.
13 Harapan H, Fitra F, Ichsan I, et al. The roles of microRNAson tuberculosis infection: meaning or myth[J].Tuberculosis,2013,93(6):596-605.
14 Yi Z, Fu Y, Ji R, et al. Altered microRNA signatures in sputum of patients with active pulmonary tuberculosis[J]. PloS One, 2012,7(8):e43 184.
15 Zhou M, Yu G, Yang X, et al. A circulating microRNAs as biomarkers for the early diagnosis of childhood tuberculosis infection [J]. Molecular Medicine Reports, 2016,13(6):4 620-4 626.
16 Hur YG, Chung WY, Kim A, et al. Host immune responses to antigens derived from a predominant strain of Mycobacterium tuberculosis[J]. The Journal of Infection, 2016,73(1):54-62.
Changes of the Expression of miR-29a and IFN-γ in Peripheral Blood Patients with Active Pulmonary Tuberculosis and Latent Tuberculosis
ZHAN Yu, LIU Shui-yi, WU Tang-wei, SHI Li-feng, LIU Yi-wen, ZHANG Hong-mei, WANG Hui, LU Zhong-xin
Department of Clinical Loboratory, The Central Hospital of Wuhan, Tongji Medical College, Huazhaong University of Science and Technology, Wuhan 430014,China
Objective: To analyze the changes and correlations of the expression of miR-29a and IFN-γ in peripheral blood with active pulmonary tuberculosis and latent tuberculosis patients.Method: 49 cases of tuberculosrs patients were divided into two groups:active pulmonary tuberculosis group(n=27), latent tuberculosis group(n=22). 30 cases of non tuberculosis patients (control group) were enrolled. The expression level of miR-29a in the peripheral blood and IFN-γ mRNA in the peripheral blood mononuclear cells were detected with qRT-PCR. The level of IFN-γ of the serum was detected with ELISA. Differences between groups were analyzed. Results: The expression level of miR-29a in active pulmonary tuberculosis was significantly higher than those of control group and latent infection group (P<0.01). The IFN-γ expression level of cells in patients with active pulmonary tuberculosis and latent infection group were significantly lower than those of control group (P<0.01), and compared with the latent infection group, the expression of the active pulmonary tuberculosis was more significantly (P<0.05). The correlation analysis showed the expression level of miR-29a was negative correlated with the IFN-γ mRNA expression level, r value were -0.697, -0.559, respectively (P<0.05). Conclusion: miR-29a may play an important role in the development of the pulmonary tuberculosis by targeting IFN-γ.
Active pulmonary tuberculosis; Latent infection; miR-29a; IFN-γ
武汉市卫生和计划生育委员会科研项目(WX14C14);武汉市中心医院院内科研基金(YQ13A04)
华中科技大学同济医学院附属武汉中心医院检验科,武汉 430014
本文2016-06-17收到,2016-08-02修回
R521
A
1005-1740(2016)04-0024-05