叶酸受体蛋白1对卵巢癌患者的临床应用价值
曾正莲 韩利蓉 曹伟伟
叶酸受体蛋白1对卵巢癌患者的临床应用价值
曾正莲 韩利蓉 曹伟伟
目的:探讨人卵巢组织叶酸受体蛋白1(FOLR1)表达量对卵巢癌患者诊断、疗效监测、化疗耐药和预后评估的临床应用价值。方法:93例卵巢癌患者(卵巢癌组)按照组织学分型分为黏液性癌组(n=37)、浆液性癌组(n=48)和内膜样癌组(n=8);根据临床分期分为Ⅰ—Ⅱ期组(n=39)和Ⅲ—Ⅳ期组(n=54);根据有无淋巴结或远处器官转移分为有转移组(n=21)和无转移组(n=72);根据临床疗效分为完全缓解组(CR组,n=31)、部分缓解组(PR组,n=29)、病情稳定组(SD组,n=14)和病情进展组(PD组,n=19);根据化疗耐药情况分为化疗耐药组(n=37)和化疗敏感组(n=56)。同期收治的卵巢良性肿瘤患者作为良性肿瘤组(n=60)。卵巢组织和功能正常妇女作为对照组(n=40)。采用Western Blotting技术检测各组卵巢组织FOLR1相对表达量,比较卵巢癌组、良性肿瘤组和对照组FOLR1水平差异,比较不同临床特征卵巢癌患者FOLR1水平差异,比较不同疗效和是否耐药卵巢癌患者FOLR1水平差异。通过FOLR1检测结果绘制ROC曲线,计算最佳临界值,并以此临界值评估卵巢癌患者60个月生存率。结果:与对照组比较,卵巢癌组和良性肿瘤组FOLR1相对表达量均显著升高(t=30.577、20.527,P<0.01),卵巢癌组较良性肿瘤组升高更明显(t=17.051,P<0.01)。与浆液性癌组比较,黏液性癌组和内膜样癌组FOLR1相对表达量均显著降低(t=13.515、13.902,P<0.01),黏液性癌组与内膜样癌组FOLR1比较差异无统计学意义(t=0.187,P>0.05)。Ⅲ—Ⅳ期组患者FOLR1表达水平显著高于Ⅰ—Ⅱ期组患者(t=10.834,P<0.01),有转移组FOLR1表达水平显著高于无转移组(t=10.335,P<0.01)。与CR组患者比较,PR组、SD组和PD组患者FOLR1表达水平均依次升高,PR组高于CR组(t=16.42,P<0.01),SD组高于PR组(t=5.349,P<0.01),PD组更高于SD组(t=9.732,P<0.01)。化疗敏感组患者FOLR1表达水平显著高于化疗耐药组(t=16.495,P<0.01)。FOLR1≥3.184癌症患者60个月生存率仅为19.14%,而FOLR1<3.184癌症患者60个月生存率达39.23%,两者差异有统计学意义(χ2=4.715,P<0.01)。结论:卵巢癌患者FOLR1表达量显著升高可以作为卵巢癌早期诊断、化疗耐药判断的生物标志物之一。
叶酸受体蛋白1;卵巢癌;耐药;诊断;预后
叶酸受体蛋白1(Folate Binding Protein1,FOLR1)是一种膜蛋白,通过与糖基磷脂酰肌醇(Glycosyl Phosphatidyl Inositol,GPI)特异性结合,介导叶酸进入细胞内;而叶酸对细胞的增殖、分裂和组织生长具有重要的调节作用[1,2]。国外研究表明,FOLR1的上述作用可同时使正常细胞和肿瘤细胞生长,其中对调节肿瘤细胞生长更明显[3];国内研究者报道卵巢癌、肺癌、肝癌、肾癌、乳腺癌等组织中FOLR1呈高表达,而正常组织FOLR1表达量较低,因而认为FOLR1可以作为某些肿瘤的诊断指标[4,5]。本文检测分析卵巢癌患者卵巢组织FOLR1表达水平及其与临床表现特征、临床疗效、临床耐药和患者生存率的关系,为FOLR1的临床诊断、化疗监测和疗效评估作用提供实验室依据。
1 资料与方法
1.1 对象和分组
2008-08─2011-02本院收治的93例卵巢癌患者(卵巢癌组),年龄19-82岁,平均43.7±6.9岁,按照WHO卵巢组织学分类法[6]分为黏液性癌组(n=37)、浆液性癌组(n=48)和内膜样癌组(n=8);按照国际妇产科联盟(International Federation of Gynecologyand Obstetrics,FIGO)分期标准[7]分为Ⅰ-Ⅱ期组(n=39)和Ⅲ-Ⅳ期组(n=54);根据有无淋巴结或远处器官转移分为有转移组(n=21)和无转移组(n=72)。所有患者均行癌瘤减灭术,并留取样本;术后均行顺铂联合紫杉醇或顺铂、博来霉素、长春新碱的化疗方案。根据临床疗效分为完全缓解组(CR组,n=31)、部分缓解组(PR组,n=29)、病情稳定组(SD组,n=14)和进展组(PD组,n=19);根据化疗耐药情况分为化疗耐药组(n=37)和化疗敏感组(n=56)。同期本院收治的卵巢良性肿瘤患者作为良性肿瘤组(n=60),年龄24-76岁,平均43.5±7.4岁,其中黏液性瘤27例,浆液性瘤33例,均行手术切除,并保留样本。另选卵巢正常妇女作为对照组(n=40),年龄21-82岁,平均43.8±6.5岁,其中子宫肌瘤36例,宫颈癌4例;经患者同意,手术切除肌瘤时切取少许卵巢组织样本。三组卵巢组织样本均送本院病理科行常规组织病理学HE染色确诊。对照组、良性肿瘤组和卵巢癌组三组年龄差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准,且患者均知情同意。
1.2 卵巢癌治疗方法及疗效
1.2.1 治疗方法:所有患者均于入院后接受卵巢肿瘤细胞减灭术,包括双附件、全子宫、转移瘤、大网膜以及腹、盆腔淋巴清扫术;术后患者进行化疗,化疗方案:顺铂联合紫杉醇或顺铂、博来霉素、长春新碱,3周为一个疗程,共进行6个疗程。
1.2.2 疗效和耐药标准:(1)疗效评价参考WHO实体肿瘤疗效标准[8],CR:所有病灶完全消失,维持4周以上;PR:病灶缩小50%以上,维持4周以上;SD:各病灶最大垂径乘积之和缩小不足50%,或增大未超过25%,维持4周以上;PD:一个或多个病灶增大超过25%,或出现新病灶。(2)耐药标准参考美国妇科肿瘤学会(Society of Gynecologic Oncology,SGO)标准[9],初次以铂类药物为基础的化疗达到临床缓解,但停止化疗6个月内出现复发为化疗耐药型;反之为化疗敏感型。
1.3 FOLR及检测方法
1.3.1 组织样本处理:三组患者所取卵巢组织,一部分置于4%中性甲醛中送病理诊断,余下部分立即保存于液氮罐中,嗣后充分研磨,加入蛋白裂解液(199μl RAPI+1μl PMSF)冰上充分裂解30min,4℃、3 000r/min(离心半径14.3cm)离心10min,留取上清液,置于—80℃冰箱保存待检。
1.3.2 主要检测试剂与仪器: 蛋白裂解液购自武汉博士德生物工程有限公司(批号:080121),兔抗人FOLR1多克隆抗体(批号:071209)、羊抗人GAPDH多克隆抗体(批号:191025)、聚偏二氟乙烯膜购自北京众益中和生物技术有限公司。高速离心机(德国Eppendorf公司5424型),Odyssey成像系统(美国LI-COR公司),图像分析软件为系统自带。
1.3.3 Western Blotting检测FOLR1表达: 向组织中加入蛋白提取液,匀浆器打成匀浆,4℃振荡孵育过夜;BCA蛋白浓度检测试剂盒检测总蛋白浓度。将20μg蛋白提取液置于SDS-PAGE电泳,分离蛋白,100mA、40min电转后将PVDF膜取出。5%脱脂牛奶封闭3h,PBS冲洗3次,5min/次,再分别加入兔抗人FOLR1多克隆抗体(1∶800稀释)和羊抗人GAPDH多克隆抗体(1∶1 000稀释),室温孵育1h,4℃过夜;PBS冲洗3次,5min/次;再分别加入荧光标记的羊抗兔二抗(1∶10 000稀释),室温下振摇3h,PBS冲洗3次,5min/次。荧光图像扫描及条带灰度值分析,FOLR1相对表达量以样本条带与GAPDH条带灰度比值表示。
1.4 随访5年生存率
卵巢癌患者生存率的随访采用门诊复查、电话询访等方式,起始于化疗开始第2天,截止于2016-02,历时60个月。
1.5 统计学处理

2 结 果
2.1 三组患者卵巢组织FOLR1水平
对照组、良性肿瘤组和卵巢癌组FOLR1相对表达量依次为1.774±0.138、3.084±0.387、4.795±0.617,差异有统计学意义(F=78.302,P<0.01)。与对照组比较,卵巢癌组和良性肿瘤组FOLR1相对表达量均显著升高(t=30.577、20.527,P<0.01),卵巢癌组较良性肿瘤组升高更明显(t=17.051,P<0.01)。
2.2 不同临床特征卵巢癌患者FOLR1表达水平比较
不同组织分型卵巢癌患者FOLR1表达水平差异有统计学意义(F=104.603,P<0.01)。与浆液性癌组比较,黏液性癌组和内膜样癌组FOLR1相对表达量均显著降低(t=13.515,13.902,P<0.01) ,黏液性癌组与内膜样癌组FOLR1表达差异无统计学意义(t=0.187,P>0.05);Ⅲ—Ⅳ期组患者FOLR1表达水平显著高于Ⅰ—Ⅱ期组患者(t=10.834,P<0.01);有转移组FOLR1表达显著高于无转移组(t=10.335,P<0.01)。见表1。
2.3 不同疗效及有无耐药患者FOLR1水平比较
CR、PR、SD、PD组患者FOLR1表达水平差异具有统计学意义(F=352.106,P<0.01);与CR组比较,PR、SD、PD组患者FOLR1表达水平依次升高(t=16.412、18.089、30.985,P<0.01);SD组较PR组升高(t=5.349,P<0.01);PD组更高于SD组(t=9.732,P<0.01)。化疗敏感组患者FOLR1表达水平显著高于耐药组(t=16.495,P<0.01)。见表2。

表1 不同特征卵巢癌患者FOLR1水平比较±s)
注:与黏液性癌组比较,1)P<0.01;与内膜样癌组比较,2)P<0.01;与Ⅰ—Ⅱ期组比较,3)P<0.01;与无转移组比较,4)P<0.01

表2 不同疗效及有无耐药卵巢癌患者FOLR1水平比较±s)
注:与CR组比较,1)P<0.01;与PR组比较,2)P<0.01;与SD组比较,3)P<0.01;与耐药组比较,4)P<0.01
2.4 卵巢癌患者随访率及FOLR1水平与其生存率的关系
93例卵巢癌患者失访7例,失访原因:住址或电话变更失联6例,转院治疗1例。成功随访86例(92.47%),随访时间7-60个月,平均(38.1±3.9)个月。通过绘制ROC曲线和计算约登指数获取FOLR1诊断卵巢癌的最佳临界点为3.184(图1)。以FOLR1表达≥3.184和<3.184计算生存率,绘制生存曲线,FOLR1表达≥3.184癌症患者60个月生存率仅为19.14%,而<3.184癌症患者60个月生存率达39.23%,两者差异具有统计学意义(χ2=4.715,P<0.01,图2)。
3 讨 论
FOLR属于人叶酸受体蛋白家族成员之一,目前已经发现三种亚型:FOLR1、FOLR2、FOLR3,其中FOLR1可介导叶酸进入细胞内发挥重要作用。Holm等[10]报道FOLR1蛋白完全暴露于细胞外膜(由GPI固定),通过细胞吞饮转移机制将叶酸及四氢叶酸转运至细胞内,参与细胞DNA,包括肿瘤细胞DNA的增殖与修复,因而认为FOLR1表达水平与恶性肿瘤细胞增殖等密切相关。 还有研究[11,12]发现人体正常组织中FOLR1表达水平较低,而在一些恶性实体瘤如肺癌、肝癌、结直肠癌、卵巢癌、宫颈癌组织中,FOLR1过度表达,其中90%以上卵巢癌组织呈FOLR1高表达,而且明显高于乳腺癌和恶性间皮瘤。因此建议将FOLR1作为卵巢癌诊断标志物。本研究结果显示,卵巢癌患者卵巢组织FOLR1表达量显著高于正常卵巢组织和良性卵巢肿瘤组织,与上述研究结果相一致,而且本研究发现Ⅲ-Ⅳ期卵巢癌患者FOLR1表达水平显著高于Ⅰ—Ⅱ期患者,发生淋巴结和远处转移患者FOLR1水平显著高于未发生转移者,表明FOLR1水平升高或可反映卵巢癌的发展和恶化程度。

图1 卵巢癌组织FOLR1表达水平的ROC曲线
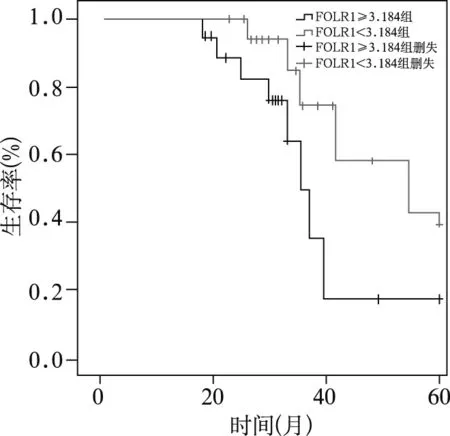
图2 卵巢癌患者生存曲线
肿瘤减灭术和化疗是治疗卵巢癌的主要方法,本文采用顺铂联合紫杉醇或顺铂、博来霉素、长春新碱治疗6个疗程后,完全缓解(CR)者仅33.33%(31/93),与其它文献报道结果相近,治疗机制可能是叶酸与CD3抗体形成偶联物,并与T细胞抗原受体(TCR)特异性结合成复合物,靶向作用于FOLR1而介导组织出现强烈免疫反应,诱导T细胞活化而使肿瘤细胞发生溶解。随着病情的好转,免疫反应逐渐减弱,FOLR1也随之降低[13],这种低CR的主要原因是化疗耐药。Desmoulin等[14]报道有12%的卵巢癌患者表现出原发性耐药,88%卵巢癌患者治疗初期对化疗敏感,但有75%的患者最终因耐药而导致化疗失败。这可能与患者内源性叶酸和FOLR1水平有关,因 FOLR1表达下调会抑制肿瘤细胞对铂类和甲氨蝶呤等化疗药物的摄取,从而使肿瘤细胞对化疗药物产生耐药[15,16]。本研究中化疗耐药型卵巢癌患者FOLR1表达水平显著低于化疗敏感型患者,符合以上推论。同时表明FOLR1表达水平亦可作为化疗耐药的评价指标之一。但肿瘤耐药机制十分复杂,有多种酶、蛋白、信号通路参与其中,FOLR1水平变化是原因还是结果,作用机制如何,均需深入研究。
对于采用FOLR1表达水平评价卵巢癌患者5年生存率,尚未见到相关报道。本文通过ROC曲线获取最佳诊断点为3.184,以此临界值统计分析93例卵巢癌患者5年生存率,结果显示FOLR1≥3.184患者5年生存率为19.14%,而<3.184患者5年生存率为39.23%,后者显著高于前者,说明FOLR1对卵巢癌远期预后评估亦有指导作用。
卵巢癌发病隐匿,多数患者确诊时已是中晚期[17],而Ⅲ-Ⅳ期卵巢癌患者5年生存率(35%)明显低于Ⅰ—Ⅱ期(60%)[18],因此,加强无症状患者的早期筛查和诊断对改善患者预后具有重要意义。已有报道早期卵巢癌患者血清FOLR1水平显著升高,可以作为卵巢癌早期诊断的敏感指标[19]。由于叶酸与FOLR1具有高度亲和力,可以利用叶酸与化疗药物偶联,并将药物靶向转运至肿瘤细胞内[20],作为化疗靶向治疗路径,这可能成为FOLR1对卵巢癌诊断作用的重要研究方向,为提高临床疗效和降低耐药性作出贡献。
◀
本文第一作者简介:
曾正莲(1970-)女,汉族,副主任技师,主要从事临床化学检验
1 Holm J, Babol LN, Markova N,et al.The interrelationship between ligand binding and thermal unfolding of the folate binding protein. the role of self-association and pH[J].Biochim Biophys Acta,2014,1 844(3):512-519.
2 Holm J, Lawaetz AJ, Hansen SI.Ligand binding induces a sharp decrease in hydrophobicity of folate binding protein assessed by 1-anilinonaphthalene-8-sulphonate which suppresses self-association of the hydrophobic apo-protein[J].Biochem Biophys Res Commun,2012,425(1):19-24.
3 Jaiswal N, Saraswat S, Ratnam M,et al.Analysis of folate binding protein N-linked glycans by mass spectrometry[J].J Proteome Res,2012,11(3):1 551-1 560.
4 黄明钜,王 琪,张 玮,等.卵巢恶性肿瘤组织叶酸结合蛋白表达检测及其临床意义[J].中国癌症杂志,2012,22(1):25-30.
5 任立新,王亚帝.紫杉醇联合洛铂或顺铂治疗晚期老年卵巢癌的疗效和安全性[J].中国老年学杂志,2013,33(10):2 284-2 286.
6 张建民.WHO卵巢肿瘤的组织学分类(2003)[J].临床与实验病理学杂志,2004,20(5):517-518.
7 Hegazy N, Potter R, Kirisits C,et al.High-risk clinical target volume delineation in CT-guided cervical cancer brachytherapy: Impact of information from FIGO stage with or without systematic inclusion of 3D documentation of clinical gynecological examination[J].Acta Oncol,2013,52(7):1 345-1 352.
8 任中海,张成辉,仝运科,等.WHO标准和RECIST标准评价食管癌化疗疗效的比较[J].肿瘤,2006,26(9):875-876.
9 Morice P, Denschlag D, Rodolakis A,et al.Recommendations of the fertility task force of the European society of gynecologic oncology about the conservative management of ovarian malignant tumors[J].Int J Gynecol Cancer,2011,21(5):951-963.
10 Holm J, Schou C, Babol LN,et al.The interrelationship between ligand binding and self-association of the folate binding protein. The role of detergent-tryptophan interaction.[J].Biochim Biophys Acta,2011,1 810(12):1 330-1 339.
11 Kamen BA, Smith AK.Farletuzumab, an anti-folate receptor α antibody, does not block binding of folate or anti-folates to receptor nor does it alter the potency of anti-folates in vitro[J].Cancer Chemother Pharmacol,2012,70(1):113-120.
12 白 兰,王金桃,丁 玲,等.叶酸对子宫颈癌细胞甲基-CpG-结合蛋白质2表达及细胞增殖抑制的作用[J].肿瘤研究与临床,2012,24(9):603-606,609.
13 Shin DS, Zhao R, Fiser A,et al.Functional roles of the A335 and G338 residues of the proton-coupled folate transporter (PCFT-SLC46A1) mutated in hereditary folate malabsorption[J].Am J Physiol Cell Physiol,2012,303(8):C834-C842.
14 Desmoulin SK, Wang L, Polin L,et al.Functional loss of the reduced folate carrier enhances the antitumor activities of novel antifolates with selective uptake by the proton-coupled folate transporter[J].Mol Pharmacol,2012,82(4):591-600.
15 Wani NA, Nada R, Khanduja KL,et al.Decreased activity of folate transporters in lipid rafts resulted in reduced hepatic folate uptake in chronic alcoholism in rats[J].Genes Nutr, 2013,8(2):209-219.
16 陈逸平,曹 倩,徐克前,等.宫颈癌患者血清 FOLR1、CA125和 Hcy 的测定及其意义[J].医学临床研究,2015,11(7):1 438-1 439.
17 黄明钜,张 玮,王 琪,等.顺铂对FOLR1基因表达上调的卵巢上皮性癌细胞生物学功能的影响[J].中华妇产科杂志,2013,48(9):676-682.
18 陶 洁,陈慧慧,吴悦茜,等.血小板增多与上皮性卵巢癌临床病理及生存预后的相关性研究[J].现代妇产科进展,2014,(6):463-467,472.
19 Luka Z, Pakhomova S, Loukachevitch LV,et al.Differences in folate-protein interactions result in differing inhibition of native rat liver and recombinant glycine N-methyltransferase by 5-methyltetrahydrofolate[J].Biochim Biophys Acta,2012,1 824(2):286-291.
20 Nygren-Babol L, Jagerstad M.Folate-binding protein in milk: a review of biochemistry, physiology, and analytical methods.[J].Crit Rev Food Sci Nutr,2012,52(5):410-425.
Clinical Value of Folate Binding Protein 1 in Diagnosis and Chemotherapy Resistance Detection on Ovarian Cancer Patients
ZENG Zheng-lian, HAN Li-rong, CAO Wei-wei
Department of Clinical Laboratory,The First People's Hospital of Tianmen City,Tianmen 431700,China
Objective: To explore the clinical value of folic acid-binding protein 1(FOLR1) in diagnosis, efficacy monitoring, chemotherapy resistance and prognosis assessment on ovarian cancer patients.Method: A total of 93 cases of ovarian cancer patients(malignant group)according to the histological classification were divided into the mucinous carcinoma group (n=37), serous cancer group (n=48), endometrial carcinoma group (n=8), according to clinical stage were divided into Ⅰ-Ⅱ Group (n=39) and Ⅲ-Ⅳ group (n=54), according to whether lymph node or distant organ metastasis were divided into two groups (n=21 andn=72),according to the clinical efficacy were divided into CR group (n=31), PR group (n=29), SD group (n=14) and PD group (n=19),according to
Folate binding protein 1; Ovarian cancer; Drug resistance; Diagnosis; Prognosis
R737.31
A
1005-1740(2016)04-0033-06
湖北省天门市第一人民医院检验科,天门 431700
本文2016-07-01收到,2016-08-17修回
the resistance of chemotherapy were divided into chemotherapy resistant group (n=37) and chemotherapy sensitivity (n=56).Another 60 cases of ovarian benign tumor patients were selected as benign group and 40 cases of normal ovarian women as control group.FOLR1 relative expression level in the ovarian tissues of each group were detected by Western blot, the level of FOLR1 in ovarian cancer group, benign tumor group and control group were compared,the level of FOLR1 in different clinical features of ovarian cancer patients were compared,the level of FOLR1 in different curative effect and drug resistant ovarian cancer were compared.The ROC curve was drawn by FOLR1 test, and the optimal critical value was calculated, and the survival rate of patients with ovarian cancer was evaluated by the critical value of 60 months.Results: FOLR1 relative expression level in control group was(1.774±0.138),benign group was(3.084±0.387),malignant group was(4.795±0.617),the relative expression of FOLR1 in malignant group was significantly higher than that in benign group and control group, the relative expression of FOLR1 in benign group was significantly higher than that in control group (P<0.01).Serous carcinoma FOLR1 expression level was significantly higher than that of mucinous carcinoma and endometrial cancer (P<0.01),Ⅲ-Ⅳ stage of varian cancer FOLR1 expression level was significantly higher than those in Ⅰ-Ⅱ stage(P<0.01), lymph node or distant organ metastasis FOLR1 expression level was significantly higher than those without metastasis (P<0.01).The curative effect of CR, PR, SD, PD patients with FOLR1 expression levels were increased, the differences between each groups with statistically significant (P<0.05).The level of FOLR1 expression in chemotherapeutic drug resistance ovarian cancer patients was significantly lower in chemotherapy sensitivity patients(P<0.01).With FOLR1 positive and negative as the observation index, the 5 year survival rate of FOLR1 positive group was 19.1%, and 39.2% in FOLR1 negative group,two group 5 year survival rate with statistically significant (χ2=4.715,P<0.01).Conclusion: FOLR1 in ovarian cancer were significantly increased which can be used as a biomarker for early diagnosis and chemotherapy resistance of ovarian cancer.