Lauren分型与胃癌临床病理特征及预后的相关性研究
袁倩倩,叶海主,徐礼鹏,赵文英
(皖南医学院第一附属医院 弋矶山医院 肿瘤内科,安徽 芜湖 241001)
·临床医学·
Lauren分型与胃癌临床病理特征及预后的相关性研究
袁倩倩,叶海主,徐礼鹏,赵文英
(皖南医学院第一附属医院 弋矶山医院 肿瘤内科,安徽 芜湖 241001)
目的:探讨Lauren分型与胃癌临床病理特征及预后的相关性。方法:收集2009年1月~2010年12月在皖南医学院弋矶山医院就诊的791例胃癌患者的病理资料,其中弥漫型胃癌(DGC)331例,肠型胃癌(IGC)355例,混合型(MGC)105例。分析DGC与IGC患者临床病理特征与预后的关系。结果:DGC与IGC患者在性别、年龄、肿瘤最大径、T分期、N分期、TNM分期上差异均有统计学意义(P<0.05)。单因素生存分析显示年龄、肿瘤最大径、肿瘤部位、T分期、N分期、TNM分期和Lauren分型是影响胃癌患者预后的相关因素。多因素生存分析显示:仅年龄、肿瘤部位、N分期、TNM分期和Lauren分型是影响胃癌患者预后的独立影响因素。生存函数显示:DGC的5年生存率低于IGC(32.4%vs.47.2%,P<0.001)。结论:Lauren分型与胃癌临床病理特征及预后关系密切。
胃肿瘤;Lauren分型;临床病理特征;预后
【DOI】10.3969/j.issn.1002-0217.2016.06.010
胃癌是消化系统常见的恶性肿瘤,居2012年全球统计的恶性肿瘤发病率排名第5位,病死率排名第3位[1]。2015年我国统计数据显示,胃癌已跃居恶性肿瘤发病率及病死率第2位[2],成为严重威胁人类健康的疾病。依照Lauren分型可将胃癌分为弥漫型胃癌(diffuse-type gastric carcinoma,DGC)、肠型胃癌(intestinal-type gastric carcinoma,IGC)和混合型胃癌(mixed-type gastric carcinoma,MGC)。近年来,多项研究[3-5]显示:Lauren分型与胃癌临床病理特征及预后关系密切。本研究旨在探讨Lauren分型与胃癌临床病理特征及预后的相关性。
1 资料与方法
1.1 研究对象 收集2009年1月~2010年12月皖南医学院第一附属医院术后病理检查确诊为原发性胃癌且围手术期存活,临床病理和随访资料完整的791例胃癌患者资料,其中IGC 355例,DGC 331例,MGC 105例。IGC和DGC患者的临床病理特征见表1。
1.2 研究方法
1.2.1 分组 胃癌分期采用第7版TNM分期。依照Lauren分型分为IGC、DGC和MGC。WHO与Lauren分型相互转化原则根据国家863重大项目胃癌分子分型与个体化诊疗课题组的胃癌病理分型和诊断标准的建议[6]:IGC是指有明显腺体形成的胃癌,包括高、中分化管状腺癌以及乳头状腺癌;DGC是指孤立或小条索状癌细胞在胃壁内散在浸润的胃癌,包含低分化腺癌和印戒细胞癌。黏液腺癌则根据其具体背景图像分为肠型或弥漫型,肠型以腺体形成为主,弥漫型以印戒细胞为主。
1.2.2 随访 以门诊和电话方式定期随访,若死亡或失访则记作随访终结,随访截止日期是2016年1月1日。失访20例,随访率为97.08%。
1.3 统计学分析 使用SPSS18.0统计软件分析数据,定量资料以及定性资料分别采用t检验和χ2检验,运用Kaplan-Meier法计算累计生存率,Log-Rank检验应用于生存曲线比较和单因素分析,预后的多因素分析采用Cox模型。P<0.05视为差异具有统计学意义。
2 结果
2.1 临床病理资料
2.1.1 一般情况 DGC、IGC两组患者平均发病年龄、男女性别比例差异均有统计学意义(P<0.05),见表1。
2.1.2 肿瘤发生部位 331例DGC中,96例患者肿瘤发生部位位于上部(近端1/3胃),108例位于中部(中段1/3胃),127例位于下部(远端1/3胃);而IGC中发生于上、中、下部分别为125例、91例、139例,两者均高发于下部,但差异无统计学意义(P>0.05)。见表1。
2.1.3 肿瘤最大径 DGC的平均肿瘤最大径为(4.94±3.71)cm,IGC的平均肿瘤最大径为(3.72±1.99)cm,差异有统计学意义(P<0.05)。见表1。
2.1.4 T分期 两组中T4期均占较高比例(68.6%vs. 40.6%),但IGC中T1期所占比例高于DGC(27.3%vs. 8.8%),差异有统计学意义(P<0.001)。见表1。
2.1.5 N分期 DGC组有252例为N2~N3期患者,IGC组有89例为N2~N3期患者,两组淋巴结转移情况的差异有统计学意义(P<0.001)。见表1。
2.1.6 TNM分期 DGC组Ⅰ~Ⅱ期患者比例明显低于IGC,而Ⅲ~Ⅳ期患者比例明显高于IGC,差异有统计学意义(P<0.001)。见表1。
表1 DGC与IGC临床病理特征比较
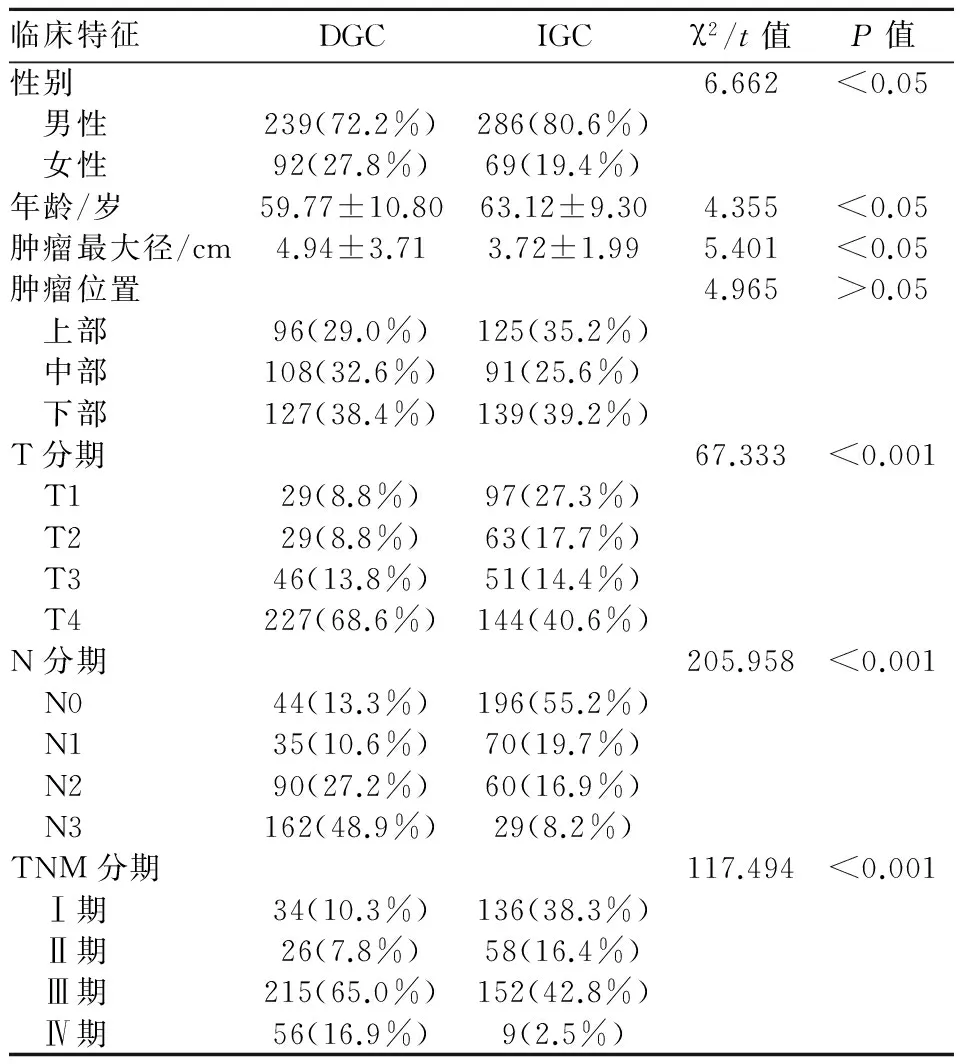
临床特征DGCIGCχ2/t值P值性别6.662<0.05 男性239(72.2%)286(80.6%) 女性92(27.8%)69(19.4%)年龄/岁59.77±10.8063.12±9.304.355<0.05肿瘤最大径/cm4.94±3.713.72±1.995.401<0.05肿瘤位置4.965>0.05 上部96(29.0%)125(35.2%) 中部108(32.6%)91(25.6%) 下部127(38.4%)139(39.2%)T分期67.333<0.001 T129(8.8%)97(27.3%) T229(8.8%)63(17.7%) T346(13.8%)51(14.4%) T4227(68.6%)144(40.6%)N分期205.958<0.001 N044(13.3%)196(55.2%) N135(10.6%)70(19.7%) N290(27.2%)60(16.9%) N3162(48.9%)29(8.2%)TNM分期117.494<0.001 Ⅰ期34(10.3%)136(38.3%) Ⅱ期26(7.8%)58(16.4%) Ⅲ期215(65.0%)152(42.8%) Ⅳ期56(16.9%)9(2.5%)
2.2 生存分析
2.2.1 单因素生存分析 年龄、肿瘤最大径、肿瘤部位、T分期、N分期、TNM分期及Lauren分型是影响胃癌患者预后的相关因素。见表2。
表2 686例胃癌患者的临床资料及单因素生存分析结果
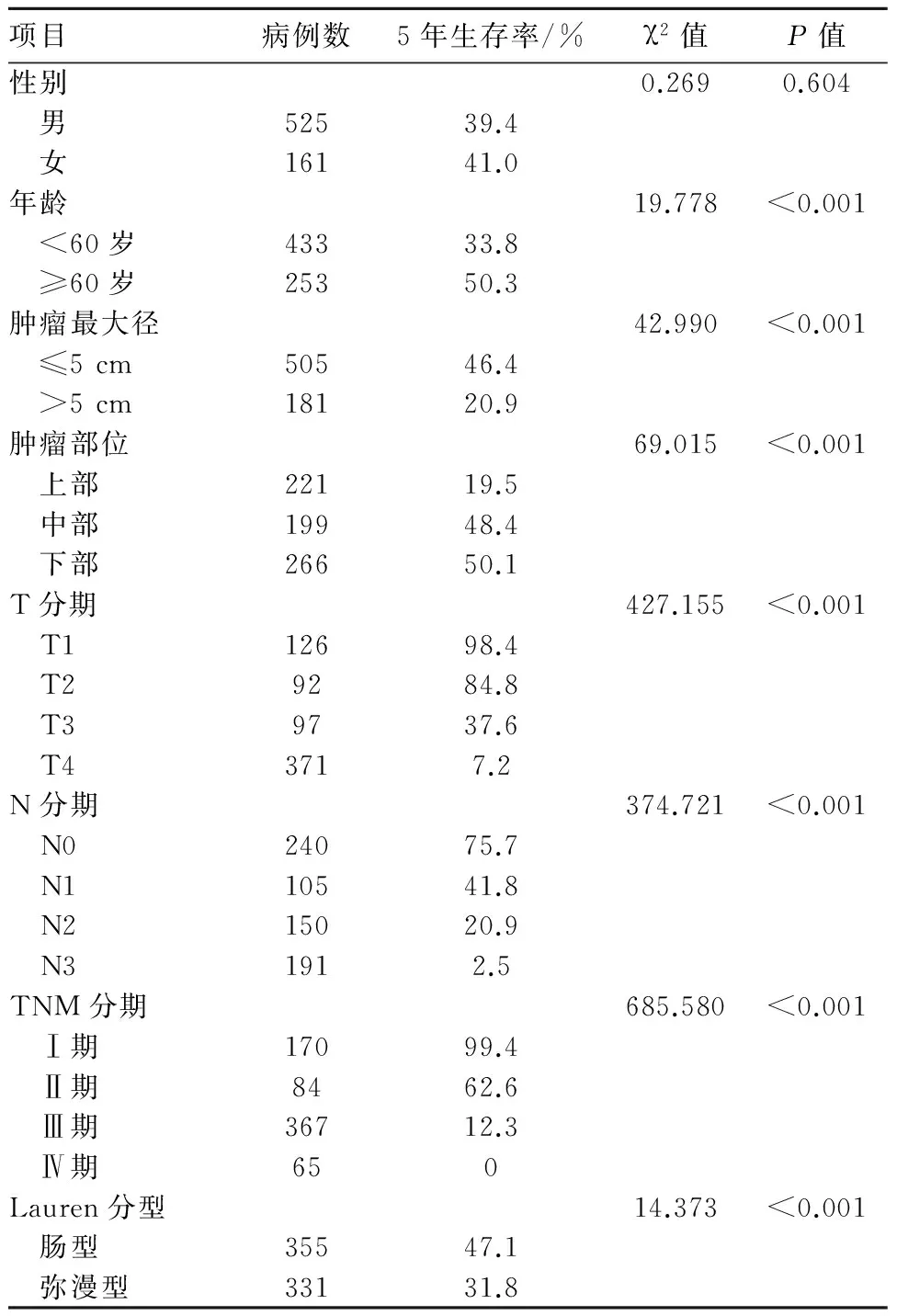
项目病例数5年生存率/%χ2值P值性别0.2690.604 男52539.4 女16141.0年龄19.778<0.001 <60岁43333.8 ≥60岁25350.3肿瘤最大径42.990<0.001 ≤5cm50546.4 >5cm18120.9肿瘤部位69.015<0.001 上部22119.5 中部19948.4 下部26650.1T分期427.155<0.001 T112698.4 T29284.8 T39737.6 T43717.2N分期374.721<0.001 N024075.7 N110541.8 N215020.9 N31912.5TNM分期685.580<0.001 Ⅰ期17099.4 Ⅱ期8462.6 Ⅲ期36712.3 Ⅳ期650Lauren分型14.373<0.001 肠型35547.1 弥漫型33131.8
2.2.2 多因素生存分析 除年龄、肿瘤发生部位、淋巴结转移外,Lauren分型亦是胃癌预后的独立影响因素。见表3。
表3 胃癌患者生存率的多因素分析结果
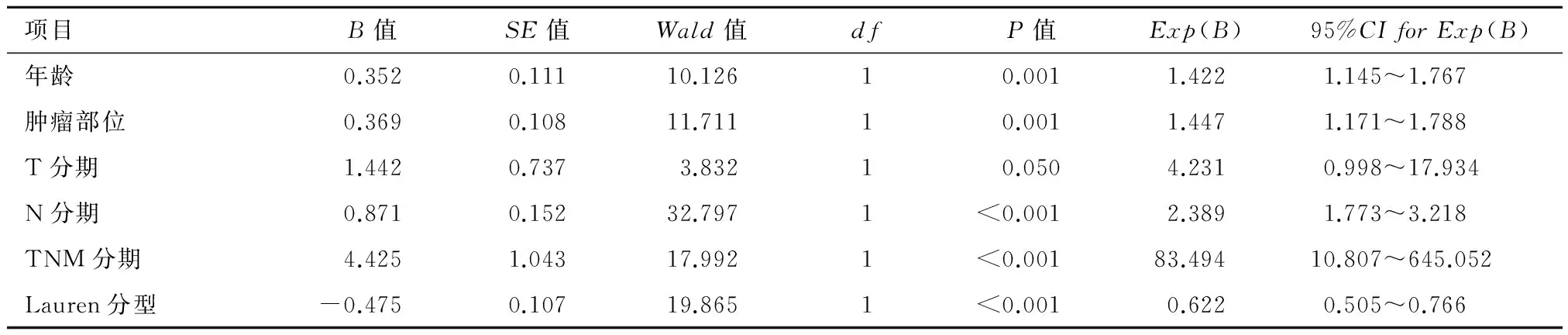
项目B值SE值Wald值dfP值Exp(B)95%CIforExp(B)年龄0.3520.11110.12610.0011.4221.145~1.767肿瘤部位0.3690.10811.71110.0011.4471.171~1.788T分期1.4420.7373.83210.0504.2310.998~17.934N分期0.8710.15232.7971<0.0012.3891.773~3.218TNM分期4.4251.04317.9921<0.00183.49410.807~645.052Lauren分型-0.4750.10719.8651<0.0010.6220.505~0.766
2.2.3 DGC与IGC的总生存率对比 DGC患者的1年、3年、5年生存率分别为74.2%、44.9%、32.4%;而IGC患者1、3、5年生存率分别为80.2%、57%、47.2%(见图1)。Log-Rank检验提示DGC与IGC患者5年生存率差异有统计学意义(χ2=14.921,P<0.001)。
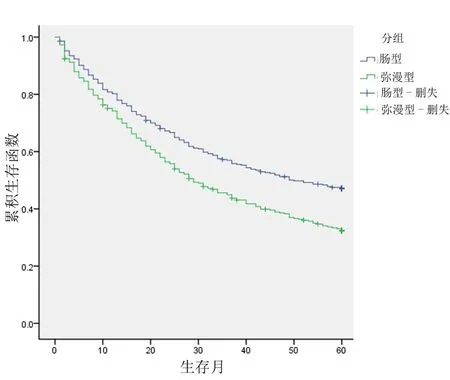
图1 DGC与IGC总生存率的比较
3 讨论
源于胃癌的组织学特征,Lauren于1965年将胃癌分为肠型和弥漫型胃癌[7]。胃癌病理分型研究显示[8],由散在于胃壁内、无或只有少量腺体形成的瘤细胞组成弥漫型胃癌,常呈小圆形,单细胞索状、不完整腺状或网状结构的癌细胞,偶可见少量间质黏液,偶可伴有明显间质纤维结缔组织增生。肠型胃癌则常产生于肠化生的基础之上,其主要特征为由大小不等的腺样结构组成,以高、中分化腺体为主,有时在其浸润前沿可见低分化腺体成分。混合型为两者成分相当时。该分型不但体现了胃癌的生物学行为,并且反映了胃癌的病因、发病机制及流行特征。
3.1 关于性别、年龄 本研究中,DGC多见于女性、年轻者,IGC多见于男性、老年者,与相关文献报道统一[3,9]。其原因可能与癌细胞表达雌、孕激素受体有关,其生长和发展依赖雌激素的存在,因此,年轻女性患者中较易发生雌激素靶器官包括卵巢等的转移。
3.2 关于肿瘤最大径及其发生部位 本研究显示,DGC组肿瘤最大径较IGC大(P<0.05),而在胃癌发生部位上无显著差异(P>0.05)。可能是由于DGC早期临床症状较隐匿,不易早期发现而使得肿瘤最大径较大。而有关DGC及IGC的发生部位的研究结果尚无定论。Sakitani等[10]研究显示:随年龄增长,肠上皮化生可从胃底向近端贲门移动,可导致DGC与IGC患者在肿瘤部位和切除方式上有所差异。
3.3 关于肿瘤的浸润深度、淋巴结转移、肿瘤分期 一般认为DGC侵袭性强,极易侵犯浆膜,早期即可出现淋巴结转移,TNM分期较晚[3,9,11]。多项研究[12-14]证实CDH1基因突变与DGC有关,且DGC与IGC患者CDH1表达水平存在明显差异,从而导致DGC表现出更强的侵袭性及发生淋巴结转移和远处转移的可能。此外,大多胃癌细胞都能产生黏蛋白,而DGC中主要包括印戒细胞癌和低分化腺癌,大多不能形成腺管,造成黏蛋白在细胞内汇聚,进而导致细胞和周围组织黏附能力较低;与之相反的是IGC多可形成腺管,可以将黏蛋白由细胞内分泌到细胞外,促进细胞和周围组织密切黏附,这可能是造成DGC比IGC更易发生局部淋巴结转移的原因之一[15]。Qiu等[11]的研究发现,DGC中Ⅲ~Ⅳ期患者比例明显高于IGC患者(61.6%vs.43.0%)。而在我们的研究中也得出了类似的结果(81.9%vs. 45.3%)。众所周知,胃镜在我国尚未被用作常规胃癌普查手段,因而晚期胃癌比例仍较高。
3.4 关于多因素分析 目前,年龄、性别、肿瘤部位及大小作为胃癌的独立影响因素仍存在较多争议,但T分期、N分期及TNM分期作为评估预后的独立影响因素已被广泛接受[16-18]。Chen等[4]的研究表明,年龄是胃癌预后的独立影响因素(HR=1.172,95%CI为1.048~1.311,P=0.005)。另有研究表明[4- 5]Lauren分型为弥漫型是胃癌预后的独立影响因素(B值=0.378,SE值=0.081,Wald值=21.839,HR值=1.460,95%CI值=1.246~1.711,P<0.01)。本组研究提示,胃癌患者的独立预后因素包括年龄、肿瘤部位、N分期、TNM分期以及Lauren分型。与文献报道结果相符。
3.5 关于生存分析 有研究显示[11,19],DGC患者多为进展期或晚期胃癌。而在我们的研究中,DGC患者中Ⅲ~Ⅳ期患者比例明显高于IGC患者(81.9%vs. 45.3%),这一比例的差异可能是导致DGC总生存率低于IGC的原因之一。一项Meta分析[20]纳入21项研究,共11 073例胃癌患者病例,结果发现IGC与DGC患者的5年生存率分别为61.7%和41.1%,DGC患者的5年生存率显著低于IGC患者。与本研究结果(47.1%vs. 31.8%)相近。
本研究显示,与IGC相比,DGC更易发生于年轻女性,发病时肿瘤体积较大、侵袭性更强、淋巴结转移发生率更常见、分期更晚、较IGC预后更差。因此有必要进一步研究DGC与IGC的临床病理特征及预后影响因素,从而进一步认识两者之间的差异,更好地指导临床实践。
[1] TORRE LA,BRAY F,SIEGEL RL,etal.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] CHEN W,ZHENG R,BAADE PD,etal.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3] STIEKEMA J,CATS A,KUIJPERS A,etal.Surgical treatment results of intestinal and diffuse type gastric cancer.Implications for a differentiated therapeutic approach[J].Eur J Surg Oncol,2013,39(7):686-693.
[4] CHEN YC,FANG WL,WANG RF,etal.Clinicopathological Variation of Lauren Classification in Gastric Cancer[J].Pathol Oncol Res,2016,22(1):197-202.
[5] 崔景利,梁寒,邓靖宇,等.Lauren分型在胃癌预后评估中的临床意义[J].中华消化杂志,2014,34(7):449-452.
[6] 国家“863”重大项目“胃癌分子分型与个体化诊疗”课题组.胃癌病理分型和诊断标准的建议[J].中华病理学杂志,2010,39(4):266-269.
[7] LAUREN P.The two histological main types of gastric carcinoma:diffuse and so-called intestinal-type carcinoma.An attempt at a histo-clinical classification[J].Acta Pathol Microbiol Scand,1965,64:31-49.
[8] 于颖彦.胃癌经典分型在分子分型时代的临床诊断价值[J].中华胃肠外科杂志,2014,17(1):18-20.
[9] QIU MZ,CAI MY,ZHANG DS,etal.Clinicopathological characteristics and prognostic analysis of Lauren classification in gastric adenocarcinoma in China[J].J Transl Med,2013,11:58.
[10] SAKITANI K,HIRATA Y,WATABE H,etal.Gastric cancer risk according to the distribution of intestinal metaplasia and neutrophil infiltration[J].J Gastroenterol Hepatol,2011,26(10):1570-1575.
[11] QIU M,ZHOU Y,ZHANG X,etal.Lauren classification combined with HER2 status is a better prognostic factor in Chinese gastric cancer patients[J].BMC Cancer,2014,14:823.
[12] YANJUN X,WENMING C,LISHA Y,etal.Detection of CDH1 gene variants in early-onset diffuse gastric cancer in Chinese patients[J].Clin Lab,2014,60(11):1823-1830.
[13] MIMATA A,FUKAMACHI H,EISHI Y,etal.Loss of E-cadherin in mouse gastric epithelial cells induces signet ring-like cells,a possible precursor lesion of diffuse gastric cancer[J].Cancer Sci,2011,102(5):942-950.
[14] SHIMADA S,MIMATA A,SEKINE M,etal.Synergistic tumour suppressor activity of E-cadherin and p53 in a conditional mouse model for metastatic diffuse-type gastric cancer[J].Gut,2012,61(3):344-353.
[15] BU Z,ZHENG Z,LI Z,etal.Clinicopathological and prognostic differences between mucinous gastric carcinoma and signet-ring cell carcinoma[J].Chin J Cancer Res,2013,25(1):32-38.
[16] DENG Q,HE B,LIU X,etal.Prognostic value of pre-operative inflammatory response biomarkers in gastric cancer patients and the construction of a predictive model[J].J Transl Med,2015,13:66.
[17] QIU MZ,WANG ZQ,ZHANG DS,etal.Comparison of 6th and 7th AJCC TNM staging classification for carcinoma of the stomach in China[J].Ann Surg Oncol,2011,18(7):1869-1876.
[18] DENG J,ZHANG R,PAN Y,etal.Tumor size as a recommendable variable for accuracy of the prognostic prediction of gastric cancer:a retrospective analysis of 1,521 patients[J].Ann Surg Oncol,2015,22(2):565-572.
[19] YAMASHITA K,SAKURAMOTO S,KATADA N,etal.Diffuse type advanced gastric cancer showing dismal prognosis is characterized by deeper invasion and emerging peritoneal cancer cell:the latest comparative study to intestinal advanced gastric cancer[J].Hepatogastroenterology,2009,56(89):276-281.
[20] LIU L,WANG ZW,JI J,etal.A cohort study and meta-analysis between histopathological classification and prognosis of gastric carcinoma[J].Anticancer Agents Med Chem,2013,13(2):227-234.
Clinicopathological characteristics and prognosis of gastric carcinoma by Lauren classification
YUAN Qianqian,YE Haizhu,XU Lipeng,ZHAO Wenying
Department of Medical Oncology,The first Affiliated Hospital of Wannan Medical College,Wuhu 241001,China
Objective:To explore the clinicopathological characteristics and prognosis of gastric carcinoma by Lauren classification.Methods:The pathological data were collected from 791 cases of gastric carcinoma admitted to our hospital between January 2009 and December 2010,including diffuse-type gastric carcinoma(DGC) in 331 cases,intestinal-type(IGC) in 355 and mixed-type(MGC) in 105,and analyzed pertaining to clinicopathological characteristics and prognosis.Results:DGC type was significantly different from IGC type concerning the patient′s age,gender,tumor size,T-staging,N-staging and INM-staging by Lauren classification(P<0.05).Univariate survival analysis revealed that prognostic factors for gastric carcinoma patients were associated with age,tumor size,tumor location,T-staging,N-staging,TNM-staging and Lauren classification.Contrarily,multivariate analysis indicated that only age,tumor location,N-staging,TNM-staging and Lauren classification were independent factors for patients′ prognosis.Survival function showed that DGC type had lower rate of 5-year survival than IGC patients(32.4%vs.47.2%,P<0.001).Conclusion:Lauren classification is closely related with clinicopathlogical characteristics and prognosis of gastric carcinoma.
gastric carcinoma;lauren classification;clinicopathological characteristics;prognosis
1002-0217(2016)06-0544-04
2016-03-23
袁倩倩(1991-),女,2014级硕士研究生,(电话)18895300030,(电子信箱)y1150224362@163.com; 赵文英,女,主任医师,副教授,硕士生导师,(电子信箱)zwy815@126.com,通信作者.
R 735.2
A

