大脑中动脉高密度征与大面积脑梗死预后的相关性研究
侯 洁, 段 阳, 徐志华, 张梦知, 夏 程, 杨本强
大脑中动脉高密度征与大面积脑梗死预后的相关性研究
侯 洁, 段 阳, 徐志华, 张梦知, 夏 程, 杨本强
目的 探讨大脑中动脉高密度征(HMCAS)与大面积脑梗死预后的关系。方法 回顾性分析我院139例大面积脑梗死患者的影像学及临床资料。结果 根据OCSP分型:98例(98/139)完全前循环梗死(TACI),41例(41/139)部分前循环梗死(PACI)。据首次CT检查中是否出现HMCAS分两组,HMCAS组58例(58/139);非HMCAS组81例(81/139);所有患者因不符合溶栓指征未行溶栓治疗,其中34例(34/139)患者发生梗死后出血。HMCAS组伴出血者21例(21/58),死亡者11例(11/58),非HMCAS组伴出血者13例(13/81),死亡者5例(5/81)。HMCAS组的出血率、死亡率明显高于非HMCAS组。差异具有统计学意义(χ2出血率=7.43,χ2死亡率=5.43,P<0.05)。大面积脑梗死患者出现HMCAS,其伴梗死后出血的发生率和死亡率均高于无HMCAS患者。结论 HMCAS出现可以作为脑梗死预测梗死后出血的指标之一,并可提示大面积脑梗死预后不佳。
大脑中动脉高密度征; 大面积脑梗死; 梗死后出血
大脑中动脉高密度征(hyperdense middle cerebral artery sign,HMCAS)是指在CT平扫时由于颅内大动脉主干闭塞引起大脑中动脉走行区域X线吸收值增高而呈高密度表现[1],该征象也是颅内大动脉主干闭塞造成其供血区域大面积脑梗死之前的早期CT表现[2],其特异性为85%~100%[3]。临床上脑内大面积梗死易伴发梗死后出血(又称出血性梗死),当出血时间较早且出血量大时往往提示病情严重,预后不佳[4]。本文通过对大脑中动脉高密度征与大面积脑梗死后出血之间的关系及其预后进行研究分析,旨在探讨大脑中动脉高密度征能否作为大面积脑梗死后出血的一个预测及预后指标,评价其在临床诊疗中的意义和价值。
1 资料与方法
1.1 一般资料 2013年2月-2016年4月收治入我院神经内科的大面积脑梗死患者。纳入标准:(1)卒中样起病,符合中华医学会神经科制定的急性缺血性脑卒中诊断标准[5],发病12 h内入院,所有患者不符合溶栓条件,均未行溶栓治疗;(2)首次CT检查未见明确梗死病灶;(3)CT检查后(发病24 h内)行MRI检查(包括常规平扫、DWI、MRA)出现大面积梗死灶,梗死面积≥20 cm2或病灶累及两个脑叶以上[6];(4)发病24 h~3 w内复查CT、MRI。梗死灶内伴或不伴出血。排除标准:(1)除外脑外伤、脑肿瘤等非血管源性因素;(2)既往无大面积脑梗死病史;(3)CT诊断HMCAS时,要除外红细胞比容增高及动脉粥样硬化引起的动脉壁钙化。
1.2 检查方法 (1)CT检查:采用GE1600CT扫描仪常规OM线平扫,层厚5 mm,层距5 mm,扫描参数:120 KV,264 mAs,FOV 240×240,矩阵512×512;(2)磁共振检查:采用Discover 750 3.0T MRI进行检查,扫描参数:①T1WI序列,TR1625 ms,TE 24 ms;FSE T2WI序列,TR 4160 ms,TE 88 ms,FOV24 cm×24 cm,层厚5 mm;FLAIR序列,TR 8500 ms,TE 140 ms,TI 2100 ms,FOV 24 cm×24 cm,矩阵 256×192,层厚 5 mm,层间距 1 mm;②DWI自旋回波序列,TR 6700 ms,TE 132 ms,FOV24 cm×24 cm,矩阵128×130,层厚5 mm,层间距1 mm,激励次数两次; ③3D TOF MRA序列,TR 28 ms,TE 3.9 ms,FOV 24 cm×24 cm,矩阵288×192,层厚 1.4 mm。由两名有经验的影像诊断医师进行诊断,包括HMCAS出现情况、脑梗死的诊断及梗死灶内是否伴发出血。

2 结 果
2.1 临床表现 符合标准的患者有139例,其中男96例,女43例,年龄29~89岁。患者入院时,根据临床表现迅速进行美国牛津郡社区卒中项目(OCSP)分型[7]。其中完全前循环梗死(TACI)患者有98例(98/139),部分前循环梗死(PACI)患者41例(41/139)。该临床分型由一名神经内科医师完成。临床表现:患者均呈急性卒中样起病,多以不同程度意识障碍、单或双侧肢体运动或感觉障碍、言语不清、视物模糊为首发症状。
2.2 影像学表现 所有患者首次CT检查(发病<12 h)均未见明确梗死病灶。CT检查后(发病24 h内)行MRI检查:139例患者均表现为大片长T1、长T2异常信号,呈楔形或扇形,DWI上大片高信号。MRA显示脑内相应大血管异常(动脉狭窄、闭塞)。颈内动脉异常者77例(含双侧颈内动脉),大脑前动脉82例(含双侧),大脑中动脉147例(含双侧),大脑后动脉108例(含双侧),椎基底动脉63例。动脉粥样硬化31例,单侧或双侧胚胎型大脑后动脉13例,椎动脉变异5例,烟雾病2例。1例未见明显狭窄或闭塞。发病24 h~3 w复查CT、MRI,其中发生梗死后出血者34例。CT表现为大片不规则低密度梗死区域内出现斑点、斑片状、团块状、不规则高密度灶,可有占位效应。因血红蛋白代谢变化MRI上梗死区域不同时期出血有不同表现。急性期梗死区域出现短T1、短T2信号,亚急性期短T1、长T2信号,慢性期长T1、短T2信号。梗死后出血DWI上表现为大面积高信号梗死灶内出现不同程度的低信号。如图1~9所示:男,67岁,患者于2015年8月18日因“言语不清,右侧肢体活动不灵”入院。双侧大脑中动脉呈现高密度征象(2015年8月18日,22:49)(见图1);分别为T1WI、T2WI、T2WI Flair(2015年8月19日,12:08)(见图2~图4),表现为右侧丘脑呈现出血信号;DWI双侧大脑半球大片高信号,相应ADC低值,右侧丘脑异常信号结合SWAN序列:右侧丘脑出血灶(急性期)(见图5~图7);MRA显示双侧大脑中动脉闭塞,左侧颈内动脉颅内段重度狭窄,双侧大脑前动脉局限性狭窄(见图8、图9)。临床结局:2015年8月24日因急性脑梗死导致的呼吸循环衰竭死亡。
2.3 临床治疗 139例患者早期临床症状符合脑卒中诊断标准,均无溶栓适应证[8],未予以溶栓治疗。给予药物进行抗血小板聚集、改善循环、稳定斑块、调节血脂、抗自由基、保护线粒体、活化神经细胞等对症治疗。
2.4 统计学结果 根据CT平扫中是否出现大脑中动脉高密度征分为HMCAS组和非HMCAS组。HMCAS组58例(41.7%,58/139);非HMCAS组81例(58.3%,81/139)。大面积脑梗死发生梗死后出血者有34例。将出血组(24.5%,34/139)与非出血组(75.5%,105/139)临床资料进行统计学分析,两组年龄、性别、高血压、糖尿病、房颤、冠心病、高同型半胱氨酸进行对比,差异无统计学意义(P>0.05)(见表1)。
HMCAS组与非HMCAS组这两组患者临床构成(年龄、性别、高血压、糖尿病、房颤、冠心病、高同型半胱氨酸)差异无统计学意义(P>0.05)。但HMCAS组发生梗死后出血、一个月随访死亡率均高于非HMCAS组,差异具有统计学意义(P<0.05)(见表2)。

表1 出血组和非出血组两组临床统计资料对比
出血组与非出血组比较P>0.05,差异无统计学意义
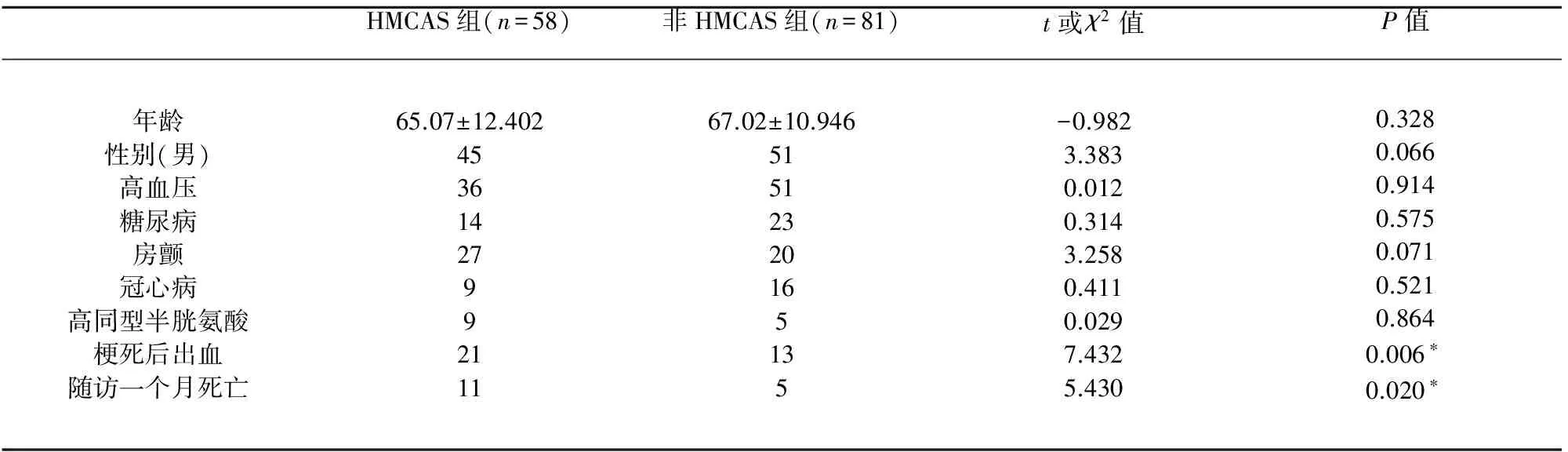
表2 HMCAS组和非HMCAS组两组临床统计资料对比
HMCAS组与非HMCAS组比较*P<0.05,差异有统计学意义
3 讨 论
众所周知早期CT检查缺乏明显的脑梗死表现,一般于发病24 h后才出现相应梗死灶,而HMCAS的出现具有提示意义,预示发生脑内大面积梗死可能性较大,HMCAS的显示可能与血液呈现高凝状态或栓子形成有关,当超过6 h溶栓时间窗,只能进行其他相应治疗。MRI检查对早期梗死的显示具有优势,其可以显示CT尚未明确的脑梗死病灶,尤其是DWI序列对出血性病变和脑组织细胞间水分子的弥散系数测量,更具有敏感性,结合其他序列更有助于明确早期大面积脑梗死病变范围及梗死灶内是否伴发出血。同时使用MRA可直接显示大面积脑梗死病变血管及其狭窄程度甚至或闭塞,为临床的进一步治疗提供依据。
本研究结果显示HMCAS组出血率及死亡率均高于非HMCAS组,大脑中动脉高密度征的出现提示发生大面积脑梗死结局差于未出现大脑中动脉高密度征者,表明HMCAS预示大面积脑梗死预后不佳。大脑中动脉高密度征最早于1983年由Gacs提出,是指在鞍上池层面大脑额颞叶分界处大脑中动脉走行区域呈分节状或长条状高密度征象[1]。既往文献中指出脑梗死患者中大脑中动脉高密度征的发生率约占21%~60%[9,10]。本文研究HMCAS发生率占41.7%(58/139),与文献报道一致。脑内大面积梗死因病灶范围较广,常累及高级功能区域,可引起不同程度意识障碍,多种神经功能缺损症状,如运动及感觉障碍、失语、视觉障碍等多种复杂的临床表现。脑内大面积梗死常并发梗死后出血,其发生率约15%~43%[4],相关研究指出大面积脑梗死以及梗死后发生的大面积脑水肿是梗死后出血的独立危险因素[11],脑组织大面积缺血缺氧致脑细胞水肿,伴梗死后出血且出血量较大时,病情可呈进行性加重,颅内压增高引发脑疝,致死率较高[12,13]。梗死后出血的发病机制多认为与梗死后血管损伤与再灌注有关,尤其是栓塞机制造成动脉闭塞有更高机率自发再灌注。动脉栓塞后,栓塞远端的血管因缺血缺氧导致渗透性改变,血管壁受损。当血管内的栓子发生自溶或经溶栓治疗后,血管部分再通,或者侧枝循环建立,使得远端受损血管在血流压力作用下导致破裂出血[14]。本组患者因不符合溶栓条件,均未行溶栓。所有患者使用抗血小板聚集、改善循环、稳定斑块、调节血脂、活化神经细胞等对症治疗。有研究指出年龄、心房颤动、大面积脑梗死、高血压、糖尿病、发病后药物(抗凝及抗血小板聚集药物)的使用可能是出血转化的危险因素[15]。在出血组和非出血组相关统计学资料比较研究中发现,年龄、性别、高血压、糖尿病、房颤、冠心病和高同型半胱氨酸均未见统计学差异,该研究结果说明这些与脑梗死出血关系不大。本文研究样本量不足,一方面尚需大样本进行研究和分析;另一方面需要细化相关指标或分类进行比较(见表1)。
对于抗栓药物的使用是否易引起大面积脑梗死患者发生出血转化目前存在较多争议。Bravo[16]和Diedler[17]等认为使用抗血小板聚集药物对出血转化无关。本研究所有患者均使用抗栓治疗,出血率占24.5%(34/139),我们认为出血转化可能与微小血管硬化、再灌注或血压变化有关,因抗血小板聚集、改善循环等治疗势必带来脑内微循环改变,尤其是再灌注改变和局部血容量增加,提高了出血可能或梗死脑组织损伤的进一步加重。但由于目前相关文献较少,需要进一步研究和探索。
本研究在HMCAS组发生梗死后出血的发生率为36.2%(21/58),明显高于非HMCAS组16.0%(13/81),差异具有统计学意义,说明HMCAS是潜在预测出血的指标之一,须予以重视和研究,其可能与血液成分等自身原因有关。临床OCSP分型:完全前循环梗死者多为大脑中动脉近段主干或者颈内动脉虹吸段的闭塞引起的大面积脑梗死,部分前循环梗死多为大脑中动脉远段主干、其各级分支或者大脑前动脉分支闭塞引起的中小梗死[18]。本组脑内大面积梗死主要以颅内大动脉严重狭窄、闭塞为主,与文献报道一致。OCSP分型法在影像学检查未发现病灶或不能判断卒中类型时,即可根据临床表现早期做出诊断,提示闭塞血管和梗死灶大小及部位,简单易行,可重复性高。本组大面积脑梗死好发于中老年患者(50岁以上,134/139)。多有高血压、糖尿病、动脉硬化等脑血管病相关高危因素[19]。本组中30岁以下患者有2例,既往体健,均有吸烟饮酒史。由此可见脑内大面积梗死的发病有年轻化趋势。故要加强各年龄段人群对脑梗死的防治意识及筛查工作,及时干预和控制相关高危因素。
本文研究结果显示HMCAS可作为大面积脑梗死发生梗死后出血且预后不佳的一个指标。由于大面积脑梗死病情迅猛,我们认为结合OCSP分型、CT早期出现的HMCAS及MRI相关序列检查有助于对大面积脑梗死的诊断和监测,选择合理方案,可有效改善预后。
[1]Gacs G,Fox AJ,Barnett HJ,et al.CT visualization of intracranial arterial thromboembolism[J].Stroke,1983,14(5):756-762.
[2]Marsman JWP,Feenstra-Holtkamp M.Dense middle cerebral artery computed tomography sign:confirmation by magnetic resonance (MR) imaging and MR angiography[J].Australasian Radiol,1996,40(3):257-260.
[3]von Kummer R,Meyding-Lamade U,Forsting M,et al.Sensitivity and prognostic value of early CT in occlusion of the middle cerebral artery trunk[J].Am J Neuroradiol,1994,15(1):9-15.
[4]Jickling GC,Liu DZ,Stamova B,et al.Hemorrhagic transformation after ischemic stroke in animals and humans[J].J Cerebral Blood Flow Metabolism,2014,34(2):185-199.
[5]中华医学会神经病学分会脑血管病病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经内科杂志,2014,48(4):246-257.
[6]谢启约,耿俊山,谢佳固,等.增强 CT 扫描对大面积脑梗死后出血性转化的预测价值分析[J].中国CT和MRI杂志,2015,13(4):8-10.
[7]Bamford J,Sandercock P,Dennis M,et al.Classification and natural history of clinically identifiable subtypes of cerebral infarction[J].The Lancet,1991,337(8756):1521-1526.
[8]李 江,励 勇,陈芙庭,等.急性缺血性脑卒中溶栓后脑出血[J].中华神经医学杂志,2014,13(7):746-748.
[9]Molina CA,Montaner J,Abilleira S,et al.Timing of spontaneous recanalization and risk of hemorrhagic transformation in acute cardioembolic stroke[J].Stroke,2001,32(5):1079-1084.
[10]Barber M,Langhorne P,Rumley A,et al.Hemostatic function and progressing ischemic stroke D-dimer predicts early clinical progression[J].Stroke,2004,35(6):1421-1425.
[11]Hornig CR,Bauer T,Simon C,et al.Hemorrhagic transformation in cardioembolic cerebral infarction[J].Stroke,1993,24(3):465-468.
[12]Steiner T,Ringleb P,Hacke W.Treatment options for large hemispheric stroke[J].Neurology,2001,57(Suppl 2):61-68.
[13]张 亚,刘 艺,王珊珊,等.脑梗死后脑水肿的研究进展[J].中华老年心脑血管病杂志,2015,17(3):331-333.
[14]Larrue V,von Kummer R,Maller A,et al.Risk factors for severe hemorrhagic transformation in ischemic stroke patients treated with recombinant tissue plasminogen activator a secondary analysis of the European-Australasian Acute Stroke Study (ECASSⅡ)[J].Stroke,2001,32(2):438-441.
[15]Alvarez-Sabin J,Maisterra O,Santamarina E,et al.Factors influencing haemorrhagic transformation in ischaemic stroke[J].Lancet Neurol,2013,12(7):689-705.
[16]Bravo Y,Marti-Fabregas J,Cocho D,et al.Influence of antiplatelet pre-treatment on the risk of symptomatic intracranial haemorrhage after intravenous thrombolysis[J].Cerebrovasc Dis,2008,26(2):126-133.
[17]Diedler J,Ahmed N,Sykora M,et al.Safety of intravenous thrombolysis for acute ischemic stroke in patients receiving antiplatelet therapy at stroke onset[J].Stroke,2010,41(2):288-294.
[18]黄渊炳.脑梗死急性期OCSP分型和磁共振成像分型对应关系研究[J].当代医学,2012,18(17):38-39.
[19]中华医学会神经病学分会.中国脑血管病一级预防指南2015[J].中华神经科杂志,2015,48(8):629-643.
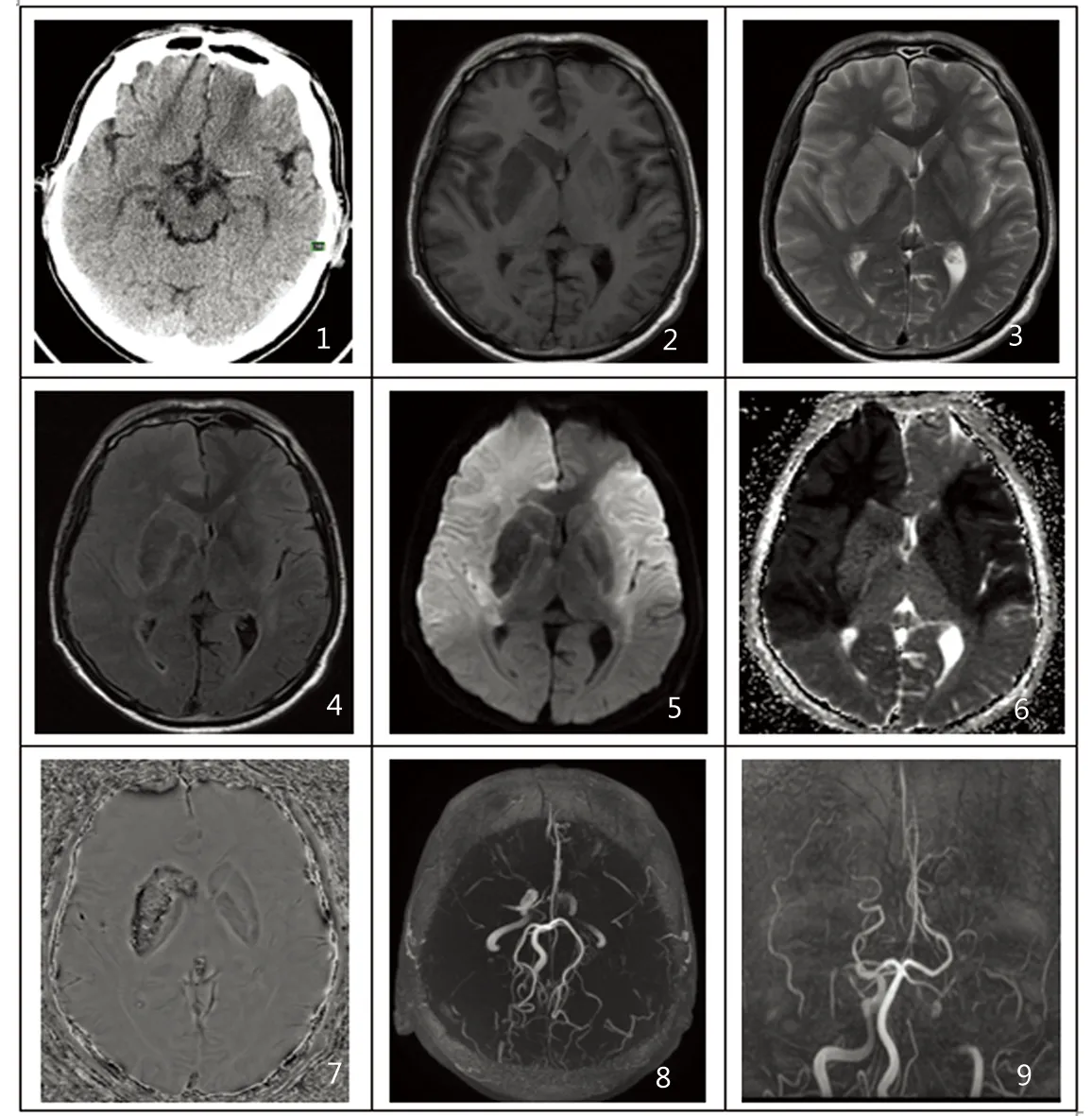
图1:双侧大脑中动脉呈现高密度征象(2015-08-18,2:49);图2~图4:分别为T1WI、T2WI、T2WI Flair(2015-08-19,12:08),表现为右侧丘脑呈现出血信号;图5~图7:DWI双侧大脑半球大片高信号,相应ADC低值,右侧丘脑异常信号结合SWAN序列:右侧丘脑出血灶(急性期);图8~图9:MRA显示双侧大脑中动脉闭塞,左侧颈內动脉颅内段重度狭窄,双侧大脑前动脉局限性狭窄
The correlation study between the hyperdense middle cerebral artery sign and Large area cerebral infarction prognosis
HOU Jie,DUAN Yang,XU Zhihua,et al.
(Department of Radiology,the General Hospital of Shenyang Military Region,Shenyang 110016,China)
ObjectiveTo explore the correlation between the hyperdense middle cerebral artery sign and prognosis of large area cerebral infarction.Methods One hundred and thirty-nine patients were diagnosed as large area cerebral infarction in our hospital,and the clincal and imaging data were retrospectively analyzed.Results According to the OCSP(Oxfordshire Community Stroke Project) classification,ninety-eight cases were classified to total anterior circulation infarcts(TACI),and 41 cases were partial anterior circulation infarcts (PACI).We divided those cases into two groups according to the first CT examination whether the HMCAS appeared in two groups:58 cases of HMCAS group,81 cases of no-HMCAS group.All of them did not fit with the thrombolysis indications,and did not treated with thrombolytic therapy,including 34 cases with hemorrhagic transformation.In HMCAS group (58),twenty-one cases with hemorrhagic transformation were found,and 11 cases of HMCAS group were dead.In no-HMCAS group,hemorrhagic transformation were 13 cases,and 5 cases were in death.The hemorrhage rates and mortality rates of HMCAS group were higher than that of no-HMCAS group.There was statistical significance between them (P<0.05).HMCAS appeared in large area cerebral infarction,the hemorrhagic transformation and mortality rates were higher than the patients without HMCAS.Conclusion HMCAS in cerebral infarction can be one prediction index of hemorrhagic transformation,and prompt the poor prognosis.
Hyperdense middle cerebral artery sign; Large area cerebral infarction; Hemorrhagic transformation
1003-2754(2016)10-0878-04
2016-08-25;
2016-09-29
辽宁省自然科学基金指导计划项目(No.20162768)
(沈阳军区总医院放射科,辽宁 沈阳 110016)
杨本强,E-mail:bqyang888@sina.com
R743.3
A

