GCs对慢性低灌注大鼠海马脑组织IL-2及KRT 6A蛋白表达影响的实验研究
张艳梅, 李 攀, 朱润秀
GCs对慢性低灌注大鼠海马脑组织IL-2及KRT 6A蛋白表达影响的实验研究
张艳梅, 李 攀, 朱润秀
目的 采用免疫组化及蛋白质组学技术观察慢性脑缺血大鼠海马脑组织IL-2及蛋白表达产物变化。方法 BCAO建立慢性脑缺血大鼠模型,随机分为假手术组、模型组,GCs低中高剂量组及阳性药物(奥拉西坦)对照组。免疫组化ABC法检测海马脑组织IL-2表达改变;蛋白质组学技术分析鉴定慢性脑缺血大鼠模型及GCs干预后差异蛋白表达改变。结果 (1)模型组大鼠海马脑区IL-2表达量显著上升(2.15±0.45),与假手术组相比差异显著,差异有统计学意义(P<0.05),GCs低中高剂量干预后IL-2表达水平出现显著上升,分别是(2.01±0.54、1.76±0.61、1.56±0.31)(P<0.01,P<0.05);(2)研究发现,慢性脑缺血大鼠海马脑组织Ⅱ型细胞骨架蛋白(typeⅡ cytoskeletal 6A,KRT 6A)表达发生显著下降。结论 慢性脑缺血病理过程中存在炎性相关蛋白的活化,推测其病理生理机制与炎症反应及细胞活化密切相关。
慢性脑缺血; IL-2; Ⅱ型细胞骨架蛋白
慢性脑缺血是指机体脑组织血流长期处于低灌注病理状态,这一病理状态在众多神经系统变性病的病理过程中扮演重要的作用。大量临床证据表明认知功能障碍(VCI)乃至痴呆(dementia)患者发病过程中都存在脑组织低灌注的特征性病理改变;但是长期以来,对慢性低灌注所致脑组织损害的分子病理改变认识较为局限。文献查证显示在机体慢性低灌注状态时普遍存在免疫炎症反应[1];前期研究表明肉苁蓉苷(GCs)显著改善痴呆大鼠学习记忆缺陷,然而GCs是否能够对脑组织低灌注状态的免疫炎症反应发挥调节作用仍需进一步研究探讨。基于以上研究背景,我们采用BCAO诱发慢性脑缺血大鼠模型并给予GCs干预,观察炎性相关蛋白IL-2表达,通过比较蛋白质组学技术手段对大鼠海马脑组织进行分析,从而探讨慢性脑组织低灌注发生发展过程中可能的关键蛋白,为阐明慢性脑缺血在神经系统退行性疾病发病机制中的作用提供理论依据,同时旨在寻找GCs调节免疫炎症反应过程的依据,并寻找防治的关键靶点。
1 材料与方法
1.1 实验动物及分组 老龄Wistar大鼠,实验动物使用许可证号:SYXK(鄂)2008-030,随机数字表法分为6组:假手术组10只、模型组12只、GCS低中高干预组各10只、阳性药物对照组10只。所有实验过程严格遵循科技部《关于善待实验动物的指导性意见》[2]。
1.2 方法
1.2.1 模型建立及GCs干预 根据文献采用BCAO(永久性结扎双侧颈总动脉)制作慢性脑缺血模型[3]:术前禁食12 h,禁水4 h,大鼠腹腔注射10%水合氯醛进行麻醉;永久性结扎双侧颈总动脉(common carotid arteries,CCA)制备慢性脑缺血模型。假手术组仅暴露双侧颈动脉后缝合。造模过程中及之后死亡者予以剔除并立即补充。
将大鼠随机分为对照组、BCAO模型组、GCs治疗组(高剂量治疗组10 mg/kg/d、中剂量治疗组5 mg/kg/d、低剂量治疗组2.5 mg/kg/d),给药方式腹腔注射,调整药物浓度为给药1 ml/只。模型组动物腹腔注射等体积生理盐水。连续治疗14 d后,进行Morris水迷宫试验及免疫组化实验。
1.2.2 Morris水迷宫定位航行实验 Morris水迷宫由圆形有机玻璃水池、平台、自动记录系统、供水系统4部分组成。水池被等分成4个象限,其中1个象限正中放置1个玻璃平台。上方装有摄像机并与计算机连接,实时动态记录大鼠游泳轨迹。定位航行试验每天两次,历时5 d,跟踪记录大鼠游泳轨迹。将大鼠面向池壁,分别从4个入水点下水,记录逃避潜伏期;2 min 以上未找到平台,潜伏期记为120 s。训练时实验者可以帮助大鼠找到平台,并停留10 s。
1.2.3 大鼠海马脑组织IL-2的表达 术后2 w断头处死大鼠并完整剥离镰状海马脑组织,冰浴操作。免疫组化ABC法操作步骤如下[4]:(1)取材、切片常规脱腊至水;(2)湿盒37 ℃一抗孵育2~3 h;(3)二抗孵育;(4)DAB显色;(5)染色后脱水风干。Olympus显微镜观察,拍照。灰度检测软件计算灰度表达。
1.2.4 大鼠海马脑组织蛋白样本制备 同免疫组化实验条件取大鼠海马脑组织,液氮研磨、4 ℃,12000×g,20 min,收集上清。超声破碎核酸,加入裂解液振荡混匀。同前离心条件,弃上清取蛋白质团块;Bradford法蛋白定量。
1.2.5 双向电泳分离蛋白质 固相pH等电聚焦电泳(isoelectric focusing,IEF):大鼠海马脑区总蛋白1200 μg与水化液(8 mol尿素、2%CHAPS、2%IPG Buffer、20mmol DTT)及IPG缓冲液混合。加入相应IPG胶槽中于EttanIPGphorⅡ等电聚焦电泳仪进行等电分离;垂直SDS-PAGE:IPG胶条经在平衡液Ⅰ、Ⅱ中分别平衡15 min,转移至12.5%SDS-PAGE凝胶上端琼脂糖封胶后,进行垂直电泳,直至溴酚蓝到达胶的底端(垂直电泳条件2 W 45 min、17 W 4 h)。分析胶进行硝酸银染色,制备胶进行考马斯亮蓝染色。2-DE图像扫描系统扫描凝胶成像,Image Master 2D platinum5.0软件对凝胶图像进行比较分析。
1.2.6 质谱分析及鉴定 凝胶上切割差异表达蛋白质点、脱色、酶解,将蛋白质分解为短链肽段。除盐肽段与基质混合后点样于钢靶上,ABI4700 MALDI-TOF-TOF质谱仪进行肽段质谱信息分析并获得肽质量指纹图谱(PMF)。Mascot公司软件(http://www.matrixscience.com)搜索IPI_mouse数据库,寻找相匹配的蛋白质。

2 结 果
2.1 Morris水迷宫逃避潜伏期的检测 大鼠逃避潜伏期是代表学习记忆能力的主要指标,潜伏期越长,记忆功能越差。本项研究结果显示模型组大鼠潜伏期明显延长,差异有统计学意义(P<0.01) 。而经过GCs干预后平均潜伏期均明显缩短。说明GCs具有显著的改善大鼠学习记忆的作用(见图1)。
2.2 IL-2半定量分析 各组IL-2免疫组化图(见图2),并应用灰度计算软件对每个标本进行检测。以假手术组灰度值记为(1.00±0.18),各组IL-2灰度值分别是模型组(2.15±0.45)、GCs低剂量(2.01±0.54)、GCs中剂量(1.76±0.61)、GCs高剂量(1.56±0.31)。经t检验分析发现差异显著(P<0.05或P<0.01)。5 cells/5个视野,取平均值代表1例标本灰度值。统计学分析发现模型组IL-2高表达,与对照组相比有统计学意义(P<0.05);而经过GCs干预后,IL-2表达随GCs梯度浓度上升依次发生表达下降。提示在慢性低灌注状态时炎症反应参与其中;GCs能显著改善上述病理过程中的炎症反应。
2.3 海马脑区蛋白双向电泳结果 Image Master 2D platinum5.0图像分析软件扫描凝胶并获得双向凝胶电泳图,研究表明Ⅱ型细胞骨架蛋白(keratin,type Ⅱ cytoskeletal 6A KRT 6A)表达显著下降,下图绿线圈出的蛋白点即为KRT6A(见图3)。
2.4 差异蛋白质谱分析鉴定结果 分析胶与制备胶上蛋白点进行匹配分析,发现差异蛋白点后再切取该蛋白点进行质谱信息的鉴定,Mascot distiller过滤基线峰、识别信号峰。Mascot软件搜索IPI_mouse数据库,寻找相匹配的蛋白质。质谱鉴定的蛋白质信息如下:MALDI-TOF MS鉴定出的蛋白质名称为Ⅱ型细胞骨架蛋白(type Ⅱ cytoskeletal 6A,KRT 6A),其在NCBI中的标号为gi|155369696,在电泳凝胶上的编号为114。研究发现与对照组相比,经GCs干预后KRT 6A表达值下降1.58倍。

图1 上图为大鼠Morris水迷宫游泳路线图;下图为逃避潜伏期统计图
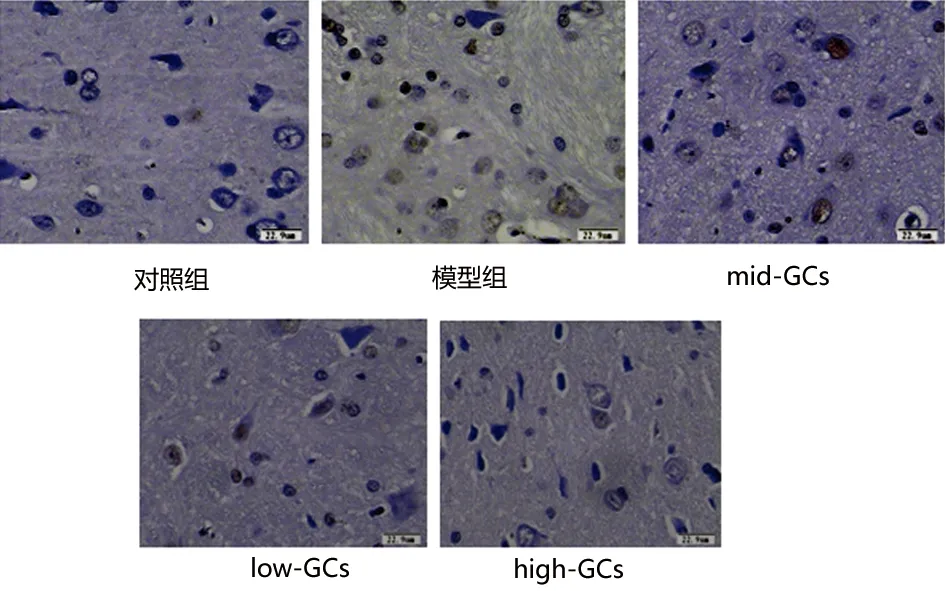
图2 对照组、模型组及GCs各干预组IL-2免疫组化图;标尺:22.9 mm胞浆呈棕黄染色为IL-2蛋白

图3 左图为KRT6A凝胶上的截图,绿线圈出的既是差异蛋白点。黄色图标表示GCs干预-组,红色图标表示模型组
3 讨 论
众所周知,脑组织低灌注是以认知功能障碍为主要临床表现的一大类神经系统退行性疾病的特征性病理改变;文献检索查证表明脑组织慢性低灌注状态时存在免疫炎症反应的病理生理过程[1,5],但其确切机制仍不清楚。因此本研究拟采用蛋白质组学(proteomics)技术这一高通量分析技术手段对慢性脑缺血大鼠海马脑组织凋亡差异蛋白深入探讨,为阐明慢性脑缺血在神经系统退行性疾病发病机制中的作用提供理论依据。研究中我们发现IL-2在海马脑组织中表达异常升高,经过GCs干预后,IL-2表达水平出现不同程度的下降,提示免疫炎症反应参与脑组织慢性低灌注状态。GCs具有显著提高大鼠水迷宫实验逃避潜伏期的作用,推测其脑组织保护作用可能涉及抑制机体免疫炎症反应。
KRT家族包括一大类细胞支架蛋白,且不同细胞表达不同类型KRT[6,7],主要分为I型与Ⅱ型KRT,KRT 6A蛋白为其中一种Ⅱ 型骨架蛋白。KRT 6A蛋白可以和其他角蛋白相互作用形成角蛋白细丝,这些细丝可以形成稠密的网络,从而可以给组织提供支撑[8,9]。此外,KRT6A蛋白与其他一些角蛋白还参与创伤修复[10]。而在本研究中通过蛋白质组学技术发现经GCs干预后,Ⅱ型细胞骨架蛋白(type Ⅱ cytoskeletal 6A,KRT 6A)表达显著下降1.58倍,差异具有统计学意义,据此我们推测GCs可能通过抑制免疫炎症反应,抑制炎症增生从而达到修复保护神经元的作用,然而关于其改善认知功能详尽的分子机制仍有待进一步深入研究。
[1]Patel FJ,Volkmann DT,Taylor GW,et al.IL-37 reduces inflammatory response after cerebral ischemiaand reperfusion injury through down-regulation of proinflammatory cytokines[J].Cytokine,2014,69(2):234-239.
[2]《关于善待实验动物的指导性意见》.中华人民共和国科学技术部,2006,9:30.
[3]Jia H,Zhang XM,Zhang BA,et al.Dendritic morphology of neuronsin medial prefrontal cortex and hippocampus in 2VO rats[J].Neurolsci,2012,33(5):1063-1070.
[4]张艳梅,邬 伟.GCs对VD 大鼠行为学及海马脑区tau 蛋白P-tau 蛋白、Aβ 淀粉样蛋白表达影响的实验研究[J].中风与神经疾病杂志,2015,32(6):494-496.
[5]Chen S,Yin ZJ,Jiang C,et al.Asiaticoside attenuates memory impairment induced by transient cerebral ischemia reperfusion in mice through antiinflammatory mechanism[J].Pharmacol Biochem Behav,2014,122:7-15.
[6]Lessard JC,Pina-Paz S,Rotty JD,et al.Keratin 16 regulates innate immunity in response to epidermal barrier breach[J].Proc Natl Acad Sci USA,2013,110(48):19537-19542.
[7]Chen J,Jaeger K,Den Z,et al.Mice expressing a mutantKrt75 (K6hf) allele develop hair and nail defects resembling pachyonychia congenital[J].Invest Dermatol,2008,128(2):270-279.
[8]Nobusawa A,Sano T,Negishi A,et al.Immunohistochemical staining patterns of cytokeratins 13,14,and 17 in oral epithelial dysplasia including orthokeratotic dysplasia[J].Pathol Int,2014,64(1):20-27.
[9]Alam H,Sehgal L,Kundu S T,et al.Novel function of keratins 5 and 14 in proliferation and differentiation of stratified epithelial cells[J].Mol Biol Cell,2011,22(21):4068-4078.
[10]Wilson NJ,Leachman SA,Hansen CD,et al.A large mutational study in pachyonychia congenita[J].Invest Dermatol,2011,131(5):1018-1024.
Experimental research between IL-2 and KRT6A protein expression in rats after chronic cerebral hypoperfusion
ZHANG Yanmei,LI Pan,ZHU Runxiu.
(Department of Neurology,The people’s Hospital of Inner Monogolia,Hohhot 014000,China)
Objective To observe the IL-2 and the protein expression of the hippocampal tissue in chronic cerebral ischemia rats by immunohistochemical and proteomics techniques.Methods Establishing the model of chronic cerebral ischemia rats by BCAO,and were randomly divided into control group,model group,GCs low、middle、high dosage group.IL-2 expression was detected using immunohistochemical method.Proteomics technology identified the difference expression protein of chronic cerebral ischemia rats and the intervention rats by GCs.Results (1)The expression of IL-2 in hippocampal brain of model rats markedly increased (2.15±0.45);however,IL-2 expression level significantly rise after intervention by GCs,respectively (2.01±0.54、1.76±0.61、1.56±0.31)(P<0.01,P<0.05).(2)The typeⅡ cytoskeleton protein (typeⅡ cytoskeletal 6A) was founded significantly decreased after intervention by GCs.Conclusion Immuno-inflammatory may be exist in chronic ischemic.Speculated that the pathophysiological mechanism is closely related to inflammatory reaction and cell activation.
Chronic cerebral ischemia; IL-2; Type Ⅱ cytoskeletal 6A
1003-2754(2016)10-0909-03
2016-06-14;
2016-09-29
国家自然科学基金(30960520),内蒙自然科学基金(20080404MS1114、2016MS0837)
(内蒙古自治区人民医院神经内科,内蒙古 呼和浩特 010000)
朱润秀,E-mail:zhurunxiu@163.com
R743.3
A

