尿液线粒体DNA突变检测筛查线粒体脑肌病方法研究
陈 蕊, 漆学良, 张 明, 丁卫江
尿液线粒体DNA突变检测筛查线粒体脑肌病方法研究
陈 蕊, 漆学良, 张 明, 丁卫江
目的 分析线粒体脑肌病患者血液及尿液中线粒体DNA突变情况,提供无创基因检测方法的证据支持。 方法 采用聚合酶链式反应(PCR),限制性内切酶酶切等方法对患者进行线粒体基因分析,对患者血液、尿液标本中线粒体DNA突变情况进行检测,筛查并确诊线粒体脑肌病。结果 7例患者被确诊为A3243G杂合突变,血、尿标本中突变负荷分别为17.80%和60.16%、20.88%和73.96%、29.62%和92.58%、36.01%和91.29%、5.14%和48.78%、5.74%和58.57%、0.57%和5.99%。结论 线粒体脑肌病患者尿液中线粒体DNA突变率明显高于血液中的突变率,且尿液标本为无创取得,可作为基因检测的首选标本。
尿液; 基因; 线粒体脑肌病
线粒体脑肌病(mitochondrial encephalomyopathy)是由线粒体基因(mtDNA)和/或核基因(nDNA)突变,致使线粒体功能障碍,不能正常供能,进而产生一系列临床表现的一组疾病。儿童起病的线粒体脑肌病多由nDNA突变所致,而常见的成人线粒体脑肌病大多由mtDNA突变引起[1],本研究主要针对后者。自1988年首次将mtDNA的突变与人类疾病相联系以来,线粒体医学不断的被深入研究,基因检测为确诊该疾病的金标准,但由于线粒体疾病异质性的特点,对基因检测所用标本的选择十分重要。本研究采用尿液mtDNA突变检测来筛查线粒体脑肌病,同时用常用的血液标本做对照,并对阳性标本的mtDNA突变量进行分析。
1 资料及方法
1.1 入选标准 (1)母系遗传伴身材矮小的不明原因糖尿病、耳聋、心肌病或癫痫患者;(2)小于45岁反复卒中样发作患者;(3)严重多器官系统受累,或2个以上器官系统受累而缓慢恶化者;(4)怀疑线粒体脑肌病但肌肉活检阴性者;(5)波动性与活动明显相关的肌无力患者;(6)肌肉活检证实但未行基因检测的患者;(7)确诊线粒体病患者的直系亲属。本研究为筛查实验,正常人群无突变位点,故无排除标准以及健康对照组。
1.2 检测方法 对所有入选者进行A3243G、A8344G、T8993C、T8993G、G13513A突变检测。对同一患者留取抗凝全血3 ml,晨尿100 ml,根据基因提取试剂盒步骤进行血、尿标本的DNA提取,采用聚合酶链式反应(PCR)进行3243、8344、8993、13513位点扩增,引物及退火温度(见表1),PCR 反应体积为25 μl ,含25~50 ng 样品DNA,0.4 mol/L 引物,0.2 mmol/L 三磷酸脱氧核糖核苷(dNTP),1 mmol/L Mg2+,1单位Taq 酶,反应条件:94 ℃预变性3 min,94 ℃ 变性30 s,适宜退火温度 30 s,72 ℃延伸 30 s,共35 个循环,末次循环结束后以72 ℃延伸5 min。PCR产物进行酶切,反应体积为20 μl,依次加入三蒸水5 μl,酶切缓冲液2 μl,乙酰化牛血清蛋白2 μl,PCR产物10 μl,限制性内切酶1 μl,37 ℃反应8 h,酶切后2%琼脂糖凝胶进行电泳,紫外光下观察有无上述位点突变, ApaⅠ可将A3243G突变的产物切割为366 bp+128 bp,无突变时不被切割;BglⅠ可将A8344G突变产物切割为73 bp+35 bp,无突变时不被切割;smaⅠ可将T8993G突变产物切割为306 bp+97 bp,无突变时不被切割;MspⅠ可将无突变的8993扩增片段切割为396 bp+7 bp,发生T8993C/G突变后将396片段切割为300 bp+96 bp;MboⅠ可将无突变的13513片段切割为144 bp+26 bp,发生G13513A突变后,切割位点消失,不发生片段切割。用凝胶分析软件对电泳条带进行吸光度分析,计算突变负荷(突变负荷=突变条带吸光度/总条带吸光度之和×100%)。
2 结 果
2014年6月-2015年9月期间共筛查疑似病例14例,男性7例,女性7例。其中共7例患者发现了mtDNA突变(分别编号1-7),均为A3243G点突变,男性3例,女性4例,平均年龄32岁,平均起病年龄20岁,其中1例为既往确诊,6例新确诊,临床表现癫痫发作3例,糖尿病或糖耐量异常3例,听力损害2例,记忆力减退2例,偏头痛1例,无症状患者1例。7例患者包括了2例散发(1号、2号),2个家系(5号为3号、4号的母亲,7号为6号母亲)。
7例患者血、尿标本mtDNA的PCR产物中至少有一种被ApaⅠ部分切割为两条带(见图1),证实存在A3243G点突变,即线粒体脑肌病伴乳酸血症及卒中样发作(MELAS),突变负荷计算结果(见表2),同一患者尿液标本中mtDNA突变负荷明显高于血液,增加酶量和延长反应时间结果无变化。

表2 1-7号患者血液、尿液标本中突变量
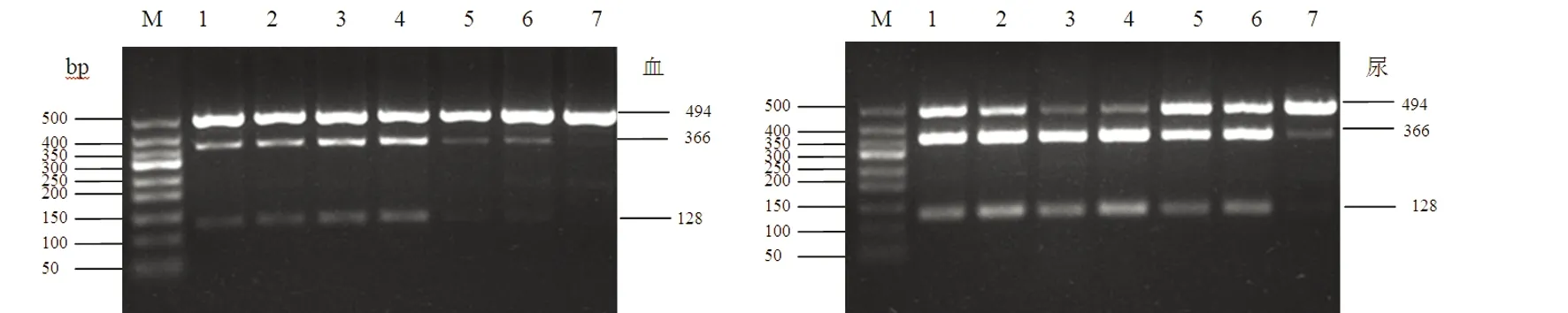
图1 7例患者血液、尿液标本3243位点扩增后片段大小494 bp,用限制性内切酶ApaⅠ进行酶切后,至少一种样本中产物部分被切割为366 bp+128 bp
3 讨 论
线粒体是一种供能细胞器,生成ATP并维持细胞正常功能,线粒体含有自身DNA,编码了13种蛋白,2种rRNA,22种tRNA,mtDNA的复制、转录、翻译、修复由核基因编码的蛋白控制[2]。任何可以导致线粒体功能障碍的突变均可以引起线粒体疾病,由于mtDNA裸露而无蛋白保护,且缺少自我修复功能,使其较nDNA更易受到损伤。线粒体疾病具有特殊的遗传学特征:(1)异质性和阈值效应;(2)有丝分裂分离引起同一个体表型改变;(3)母系遗传。
线粒体的致病突变包括点突变、片段的缺失或重复,根据mtDNA不同突变类型以及临床表现,线粒体脑肌病的临床分类较多,包括:MELAS、肌阵挛癫痫伴破碎样红纤维(MERRF)、Leigh综合征(LS)、Kearns-Sayer综合征(KSS)、慢性进行性眼外肌瘫痪(CPEO)等[3],MELAS与mtDNA的A3243G突变有关;MERRF与A8344G突变有关;LS与T8993G/C突变有关;KSS及CPEO与大片段缺失有关;G13513A突变既可以导致MELAS,也可表现为LS[4]。线粒体疾病中,一个基因突变可引起多种临床症状,一种临床表现可由多种基因突变引起,MELAS为最常见的线粒体脑肌病类型,目前已知有20多种mtDNA的突变类型可以引起MELAS,MT-TL1基因3243位点发生A-G突变是最常见突变类型[5],突变后tRNALeu(UUR)合成受阻,蛋白合成障碍,线粒体氧化磷酸化功能受阻,继而影响供能[6]。与报道一致,本研究中大多诊断为MELAS,且为A3243G突变。
线粒体疾病是一组进行性发展且累及多个系统的疾病,线粒体功能障碍主要影响能量代谢旺盛的组织器官,例如心脏、骨骼肌、肾脏、内分泌器官、中枢神经系统、视网膜、消化道黏膜等均为易受累器官,多系统疾病应高度怀疑线粒体疾病。随着病情进展,细胞内突变线粒体载量的改变,细胞表型发生改变,有些患者会随着疾病的进展出现多种临床表型,MELAS患者主要表现为青年卒中样发作、癫痫、耳聋、糖尿病等[7,8]。本研究中未发现MELAS典型的青年卒中样发作患者,可能与样本量较少有关。大约1/3的MELAS患者会出现癫痫发作,以强直阵挛发作和复杂部分性发作多件,脑电图的特异性需要大样本量进一步研究[9]。本研究中42.86%的患者出现癫痫发作。研究显示[10],mtDNA突变载量越高,起病越早,且症状越重。本研究中,7号患者为无症状患者,其血尿中的mtDNA突变量均明显低于有症状患者。
线粒体脑疾病的临床表现多样,造成诊断困难,常用的检测手段有血乳酸丙酮酸最小运动量试验,肌肉活检病理检测,影像学检查,基因检测。血乳酸丙酮酸最小运动量试验受到患者基础体质、操作方法等多种因素影响,应用较局限[11],血和脑脊液中的乳酸水平升高可以提示线粒体脑肌病,但特异性及敏感性有限。MRI的应用对诊断起到一定作用,与血管分布不一致的类梗死病灶是特征性改变,MRS见病灶区异常乳酸峰,不论急性期还是间歇期,MELAS患者脑组织摄氧分数均降低,包括病灶区域未受累区域[12],虽然MRI可高度提示诊断,但并不能确诊。肌肉活检发现破碎红纤维及COX阴性染色纤维,或者SDH深染血管,电镜下见膜下异常的线粒体聚集及结构排列异常可以诊断线粒体肌病[13],但肌肉出现明显的病理改变多见于临床表现较重时,不利于早期筛查。基因检测发现突变位点是诊断线粒体病的金标准,肌肉组织是较为可靠的检测标本,但需有创操作获取,患者不易接受,血液标本临床上较易获得,血液中的线粒体DNA主要来自于白细胞,白细胞是一种快速分裂细胞,在体内的生存周期仅为数天,线粒体突变水平较低,易出现假阴性。尿液中的线粒体DNA 来自于肾盂、输尿管、膀胱、尿道脱落的移行上皮细胞,突变载量高,尿液可能是较为适宜的基因检测标本[14]。
患者不同组织中mtDNA突变载量不同,可能与以下原因有关:(1)尿路上皮在发生上来源于胚胎内胚层,骨骼肌和血液系统来源于中胚层,内胚层细胞较大,含卵黄较多,在没有临床症状表现时,内胚层的突变负荷高于中胚层及外胚层,与之相一致的是,由于形成肌肉的体节在发育过程中的移动,使得上肢成肌细胞的突变载量高于下肢[15];(2)组织的突变负荷和能量需求影响表型,神经元及肌细胞是不分裂且高耗能细胞,使得突变的线粒体易于积攒,根据达尔文的进化论,在分裂后的子细胞中,机体倾向于保留正常的子细胞,而淘汰突变线粒体含量高、功能受损的细胞,特别是在高耗能细胞中更明显,而低耗能细胞中,这种淘汰竞争倾向并不明显,使得有缺陷的线粒体得以存在并积累[16],血液细胞为高耗能,分裂迅速,细胞寿命短,使突变线粒体积累少,而尿路上皮细胞分裂活跃,但耗能少,使得突变的线粒体更易积累[17];(3)随着年龄的增长,血液中的突变载量下降明显,而肌肉和尿路上皮相对稳定。但是肌肉活检不能完全被代替,因为血尿标本无法进行免疫组化检查,而且,线粒体片段缺失,目前只从肌肉标本中检测到[18]。本研究中筛查诊断的病例均为A3243G突变,未发现所测位点突变的患者可能为少见突变位点,阳性标本中,尿液线粒体突变负荷明显高于血液标本中,电泳条带中,尿中的突变条带亮度明显高于血液中的条带,而且,尿液标本易于获取,对于症状较轻及无症状的患者家属,无创操作更易被接受,可作为检测的理想标本。
目前对于线粒体疾病的治疗方法,仍以对症治疗为主,主要有药物、输血、血液透析、侵入性治疗、手术、饮食、理疗等,其中药物治疗仍为基础治疗,药物治疗可分为针对各种临床表现使用的特异性药物,针对改善线粒体功能、清除有毒代谢产物的非特异性药物,同时需要避免使用对线粒体功能有影响的药物[19]。研究显示[20],3243突变携带的孕妇易伴有胚胎发育异常,更易出现高血压、子痫、糖尿病等产科并发症,需要更密切的关注,及时发现并予以指导、干预,如何使这些患者孕育出健康胎儿,是具有重要意义的研究方向。有人用运动试验和31P-MRS技术,证实L-精氨酸的可以提高MELAS患者全身有氧工作能力及改善肌肉代谢,并提出,低镁血症可能是引起MELAS卒中样发作的新机制,而补充镁剂可作为新的预防、治疗MELAS的方法[21]。随着分子生物学的进展,采用诱导多能干细胞技术,成功建立体外线粒体脑肌病细胞模型,有助于深入了解线粒体脑肌病的病理生理机制,为发现新的治疗靶点提供了研究基础,更预示着细胞替代疗法及基因治疗的潜在价值[22]。
4 结 论
线粒体脑肌病是一种母系遗传疾病,部分散发,临床上以A3243G位点突变的MELAS最为多见,诊断依靠多种手段,基因检测为确诊标准,选择合适基因检测标本,可提高诊断率,尿液中mtDNA的突变负荷高于血液,与肌肉标本相比为无创操作,易于接受,检出率高,可作为筛查、早起诊断的首选检测标本,对于不易诊断的,可进一步行肌肉检测、全基因测序。目前仍需要进一步的研究来寻找合适的治疗方法。
[1]Haas RH,Parikh S,Falk MJ,et al.Mitochondrial disease:a practical approach for primary care physicians[J].Pediatrics,2007,120(6):1326-1333.
[2]Koopman WJ,Willems PH,Smeitink JA.Monogenic mitochondrial disorders[J].N Engl J Med,2012,366(12):1132-1141.
[3]Andreu AL,DiMauro S.Current classification of mitochondrial disorders[J].J Neurol,2003,250(12):1403-1406.
[4]魏晓琼,孔庆鹏,张 尧,等.线粒体基因13513G>A突变导致呼吸链酶复合物I缺陷Leigh综合征[J].中国当代儿科杂志,2009,05:333-336.
[5]Tuppen HA,Blakely EL,Turnbull DM,et al.Mitochondrial DNA mutations and human disease[J].Biochim Biophys Acta,2010,1797(2):113-128.
[6]DiMauro S,Schon EA.Mitochondrial respiratory-chain diseases[J].N Engl J Med,2003,348(26):2656-2668.
[7]Schinwelski M,Kierdaszuk B,Dulski J,et al.Changing phenotypic expression in a patient with a mitochondrial encephalopathy due to 13042G>A de novo mutation-a 5 year follow up[J].Metab Brain Dis,2015,30(4):1083-1085.
[8]Picard M,Zhang J,Hancock S,et al.Progressive increase in mtDNA 3243A>G heteroplasmy causes abrupt transcriptional reprogramming[J].Proc Natl Acad Sci USA,2014,111(38):4033-4042.
[9]Chevallier JA,Von Allmen GK,Koenig MK.Seizure semiology and EEG findings in mitochondrial diseases[J].Epilepsia,2014,55(5):707-712.
[10]Li W,Zhang W,Li F,et al.Mitochondrial genetic analysis in a Chinese family suffering from both mitochondrial encephalomyopathy with lactic acidosis and stroke-like episodes and diabetes[J].Int J Clin Exp Pathol,2015,8(6):7022-7027.
[11]孙永安,褚文正,谢安木,等.乳酸丙酮酸最小运动量试验在线粒体肌病临床检查中的应用[J].中国神经精神疾病杂志,2010,1:47-49.
[12]Yu L,Xie S,Xiao J,et al.Quantitative measurement of cerebral oxygen extraction fraction using MRI in patients with MELAS[J].PLoS One,2013,8(11):e79859-79866.
[13]Lorenzoni PJ,Scola RH,Kay CS,et al.MELAS:clinical features,muscle biopsy and molecular genetics[J].Arq Neuropsiquiatr,2009,67(3A):668-676.
[14]de Laat P,Koene S,van den Heuvel LP,et al.Clinical features and heteroplasmy in blood,urine and saliva in 34 Dutch families carrying the m.3243A>G mutation[J].J Inherit Metab Dis,2012,35(6):1059- 1069.
[15]Marotta R,Reardon K,McKelvie PA,et al.Association of the MELAS m.3243A>G mutation with myositis and the superiority of urine over muscle,blood and hair for mutation detection[J].J Clin Neurosci,2009,16(9):1223-1225.
[16]Sue CM,Quigley A,Katsabanis S,et al.Detection of MELAS A3243G point mutation in muscle,blood and hair follicles[J].J Neurol Sci,1998,161(1):36-39.
[17]Ma Y,Fang F,Yang Y,et al.The study of mitochondrial A3243G mutation in different samples[J].Mitochondrion,2009,9(2):139-143.
[18]Frederiksen AL,Andersen PH,Kyvik KO,et al.Tissue specific distribution of the 3243A->G mtDNA mutation[J].J Med Genet,2006,43(8):671-677.
[19]Finsterer J.Treatment of mitochondrial disorders[J].European Journal of Paediatric Neurology,2010,14(1):29-44.
[20]de Laat P,Fleuren LH,Bekker MN,et al.Obstetric complications in carriers of the m.3243A>G mutation,a retrospective cohort study on maternal and fetal outcome[J].Mitochondrion,2015,5:98-103.
[21]Rodan LH,Wells GD,Banks L,et al.L-arginine affects aerobic capacity and muscle metabolism in MELAS (mitochondrial encephalomyopathy,lactic acidosis and stroke-like episodes) syndrome[J].PLoS One,2015,10(5):e0127066.
[22]Kodaira M,Hatakeyama H,Yuasa S,et al.Impaired respiratory function in MELAS-induced pluripotent stem cells with high heteroplasmy levels[J].FEBS Open Bio,2015,5:219-525.
Study of screening for mitochondrial encephalomyopathy by mtDNA mutation detection of urine
CHEN Rui,QI Xueliang,ZHANG Ming,et al.
(Department of Neurology,The Second Affiliated Hospital to Nanchang University,Nanchang 330006,China)
Objective To analyze the mtDNA mutation of blood and urine from mitochondrial encephalomyopathy patients and supply the evidentiary support of noninvasive gene tests.Methods Using polymerase chain reaction(PCR) and restriction enzyme reaction to test the mtDNA mutation in urine and blood.Screening and diagnosis of mitochondrial encephalomyopathy.Results Seven patients were diagnosised as m.3243A>G heterozygous mutation.Mutation ratio in blood and urine were 17.80% and 60.16%、20.88% and 73.96%、29.62% and 92.58%、36.01% and 91.29%、5.14% and 48.78%、5.74% and 58.57%、0.57% and 5.99%.Conclusion The mutation ratio of mtDNA was significantly higher in urine than in blood in mitochondrial encephalomyopathy patients.Measurement of mt DNA mutation ratio in urine is a non-invasive method and could be preferred sample.
Urine; Gene; Mitochondrial encephalomyopathy
1003-2754(2016)06-0500-04
2016-02-03;
2016-03-29
江西省科技计划项目(No.20132BBG70077)
(南昌大学第二附属医院神经内科,江西 南昌 330006)
漆学良,E-mail:qixueliang766@163.com
745.1
A

