探析高考中热重曲线题的考查角度与解题方法
江苏省响水中学(224600)
李宗来●
探析高考中热重曲线题的考查角度与解题方法
江苏省响水中学(224600)
李宗来●
热重曲线类试题能综合考察学生分析图像的能力、获取信息的能力、数据处理的等能力,具有一定的信度与区分度,因此在近几年高考中已悄然兴起.本文就热重曲线的考查角度总结归纳了常见的解题方法和技巧,希望能有助于提高这类试题的解题能力.
一、考查某温度范围内的成分(化学式)

①(CH3COO)2Pb·nH2O中结晶水数目n=____ (填数字).
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为 ____ (写结构简式).
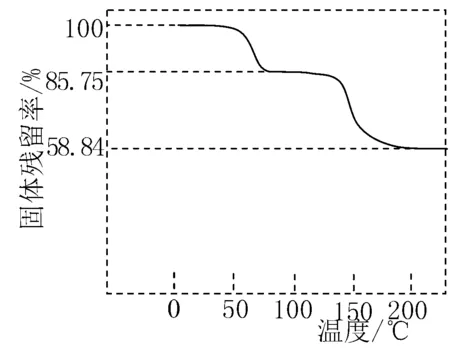
解析 ①样品在75℃时已完全失去结晶水,则残留固体为(CH3COO)2Pb,由图数值可得:(325+18n)∶325=100∶85.75,所以n=3;②100~200℃铅的氧化物(PbOa)的相对分子质量=379×58.84%=223,223=207+18a,a=1,故氧化物为PbO;(CH3COO)2Pb失去PbO,则剩余有机物为(CH3CO)2O.
方法总结:1.含有结晶水的样品在受热过程中,首先考虑的是失去结晶水,对于含多个结晶水的随着温度的升高,可能会分步失去.当完全失去结晶水样品才会进一步分解释放气体;2.在受热过程中,金属元素会残留在最终的固体中而且质量守恒.
二、考查某温度范围内的化学反应
例2 Co(OH)2在空气中加热时,固体残留率随温度的变化如下图所示.已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 ____ .(填化学式);则从120℃开始分解到290℃这段过程所发生的总反应化学方程式为 ____.
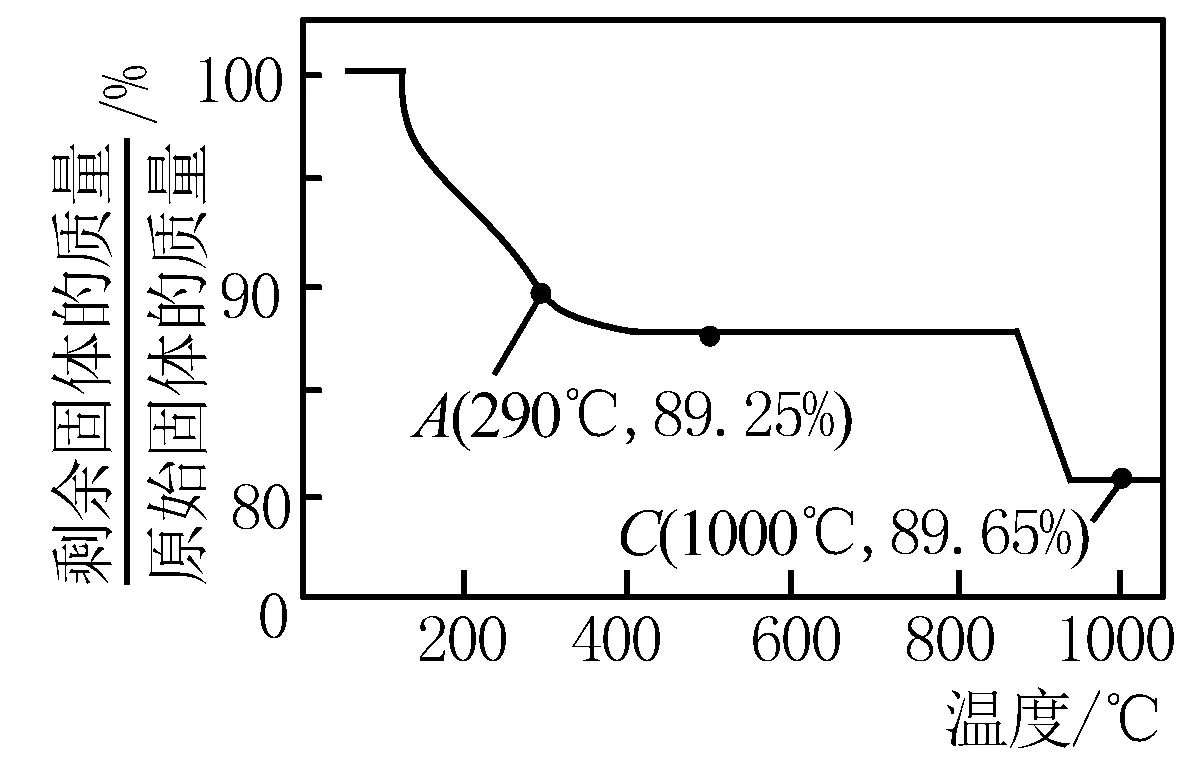
解析 设起始时为1mol Co(OH)2加热,则n(Co)=1mol,根据质量的变化,在变化过程中,Co的质量没有变,通过题给数据看,在10000C时,m(氧化物)=93g×80.65%=75g,则m(O)=m(氧化物)-m(Co)=75 g-1 mol×59g/mol=16 g,n(Co)∶n(O)=1∶1,则产物CoO;
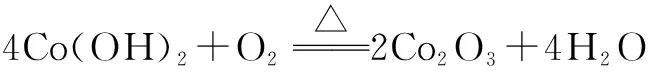
方法总结:由热重曲线考查方程式的书写,首先要确定温度变化前的物质(反应物)和温度变化后的物质(生成物).通过曲线中变化的数值计算出生成物与反应物的式量差,结合元素守恒推测出挥发出的物质(另外的生成物);有时还要结合氧化还原反应的知识对方程式进行补充与配平.
三、考查确定某样品的组成
例3 碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂.为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下).②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示(样品在270℃时已完全失去结晶水,600℃以上残留固体为金属氧化物的混合物).
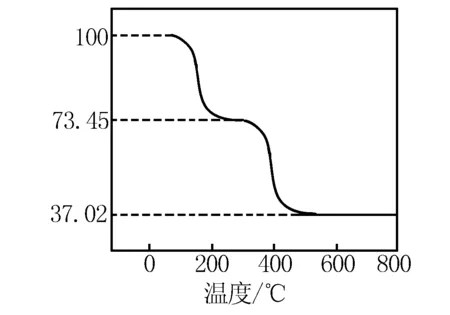
根据以上实验数据计算碱式碳酸铝镁样品中的化学式(写出计算过程).
解析 由曲线图可得样品中结晶水n(H2O)=(3.390g×73.45%)÷18 g/mol=0.05 mol
由物质的组成可得在270~600℃时,已失去结晶水,放出的是CO2和H2O,根据曲线质量分数变化可得:m(CO2)+m(H2O)=3.390g×(0.7345-0.3702)=1.225g,m(H2O)=1.235g-1.10g=0.135g,n(H2O)=0.135 g÷18 g/mol=0.0075mol,这部分H2O来自OH-,因此n(OH-)=2n(H2O)=0.0075mol×2=0.015mol, 600℃以上残留固体为MgO,Al2O3,设n(MgO)为x,n(Al2O3)为y,由曲线残留的质量可得:40x+102y=3.390×37.02%
▶
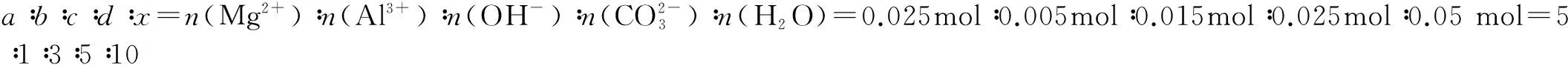
方法总结:对于由热重曲线确定样品的组成,首先根据曲线求出结晶水的物质的量(结晶水先失去),然后再根据曲线数值变化计算所含非金属元素基团的量(分解时非金属元素往往以氧化物的形式释放),最后根据曲线信息得出最终残留固体的量(一般为金属氧化物).同时结合元素守恒、电荷守恒、质量守恒求出各微粒的物质的量最简整数比,得出样品的组成.
四、考查计算样品中某成份的质量分数
例4 过氧化银(Ag2O2)作为活性物质,广泛应用于抗菌消毒和化学能源等领域.
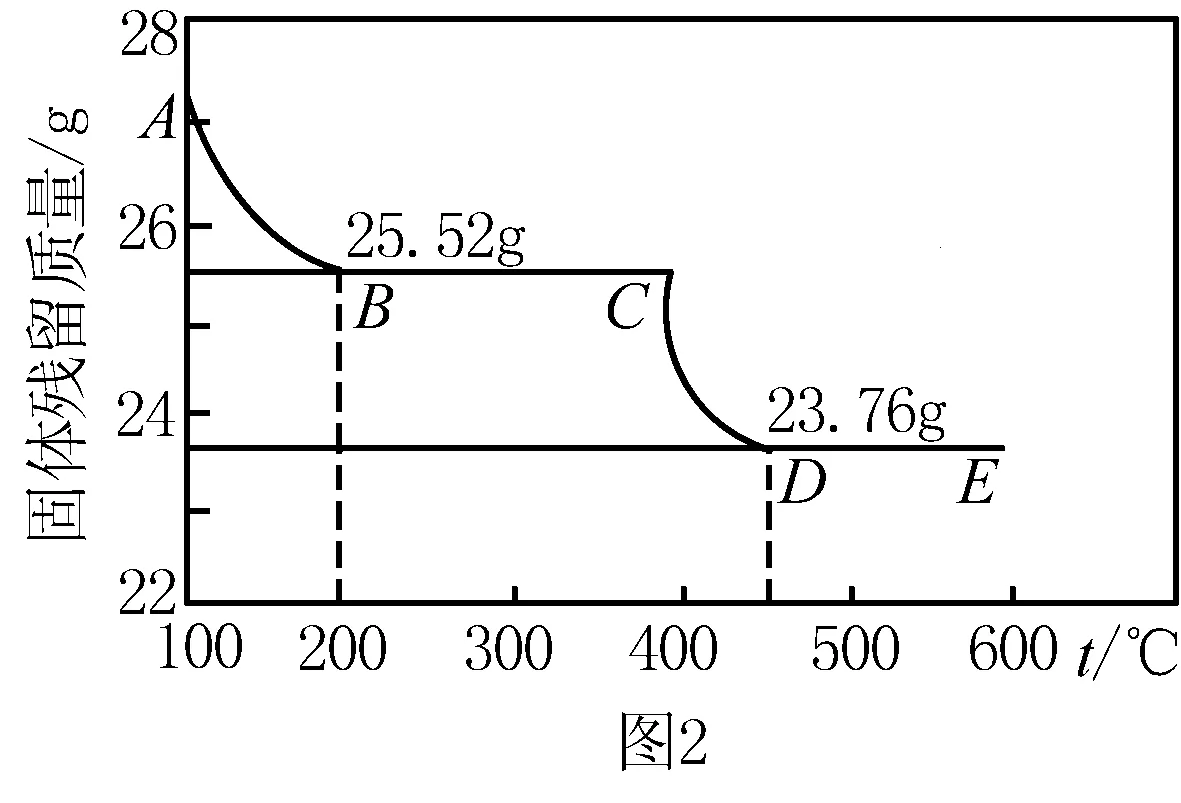
用上述方法制得的Ag2O2会含有少量的Ag2O,可用热重分析法测定Ag2O2的纯度.其步骤如下:取某样品27.12g在N2气氛下加热,测得不同温度下对应的剩余固体的质量与温度的关系曲线(即失重曲线)如上图所示.
①CD段发生反应的化学方程式是 ____.
②计算样品中Ag2O2的质量分数 (写出计算过程).
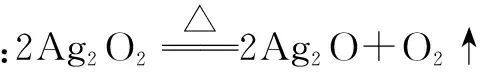
n(Ag2O2)=2n(O2)=2×0.0500mol=0.1000mol
故答案为:91.45%.
方法总结:由热重曲线求某成分的质量分数(纯度),首先要根据组分物质的性质确定引起质量减小的原因,由曲线中减少的量结合化学方程式,运用差量法求出分解组分的质量,运用元素守恒、质量守恒确定样品的质量组成,并求出各组分的质量分数.
G632
B
1008-0333(2016)22-0074-02

