突破高考必考四种热点题型
内蒙古赤峰市林东一中(025450)
王晓波●
突破高考必考四种热点题型
内蒙古赤峰市林东一中(025450)
王晓波●
题型1 元素化合物的综合应用
以元素化合物为载体,根据题干中的化学知识——氧化还原反应、离子反应、电化学等主干知识进行设问,结合元素的性质、反应原理,试题常以简答形式呈现在高考试卷中.
例1 酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是炭棒,其周围是有炭粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下表所示:溶解度/(g/100g水)
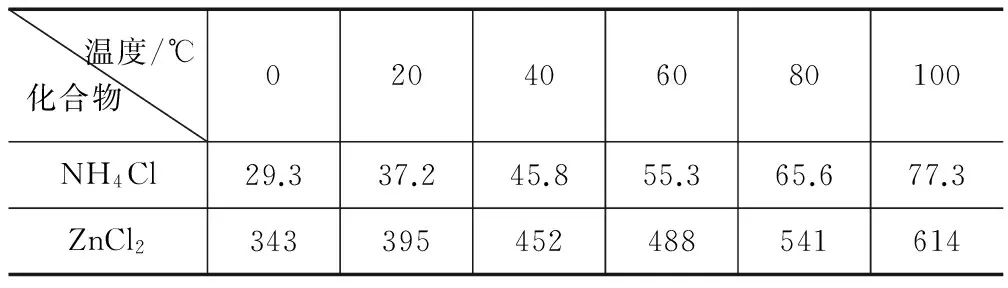
温度/℃化合物 020406080100NH4Cl29.337.245.855.365.677.3ZnCl2343395452488541614
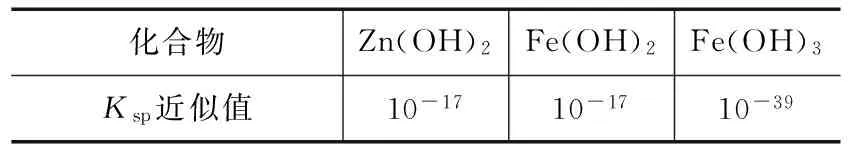
化合物Zn(OH)2Fe(OH)2Fe(OH)3Ksp近似值10-1710-1710-39
回答下列问题:
(1)该电池的正极反应式为____ ,电池反应的离子方程式为: ____ .
(2)维持电流强度为0.5A,电池工作五分钟,理论消耗Zn____ g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过____分离回收,滤渣的主要成分是二氧化锰、____和____ ,欲从中得到较纯的二氧化锰,最简便的方法是 ____ ,其原理是 ____.
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入新硫酸和双氧水,溶解,铁变为 ____ 加碱调节pH为 ____ ,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全).继续加碱调节pH为____ ,锌开始沉淀(假定Zn2+浓度为0.1mol/L).若上述过程不加双氧水的后果是____ ,原因是 ____ .
本题涉及的信息知识和迁移
3.滤渣的主要成分是二氧化锰、碳粉、MnOOH,在空气中加热,C燃烧生成二氧化碳,MnOOH被氧化为二氧化锰.
4.双氧水具有强氧化性,能把铁氧化为三价铁离子.
5.不加双氧水,则在沉淀Zn2+的同时Fe2+也沉淀.
题型2 化学原理的综合应用
以真实的化学生产实际为背景,根据表格、图表中涉及的知识——化学反应与能量、化学反应速率和化学平衡、水溶液中的离子平衡、电化学等主干知识进行设问,结合表格、图表提供的相关信息,以熟悉的物质,新颖的情景呈现在高考试题中.
例2 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
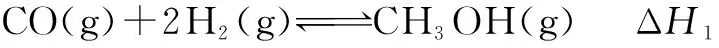
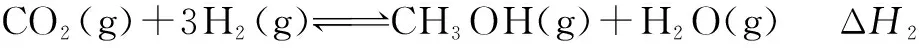
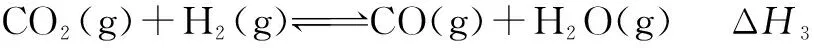
回答下列问题:
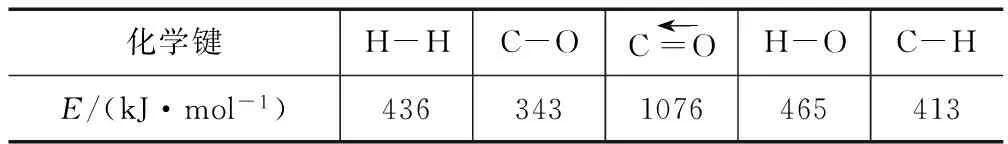
化学键H-HC-OC=←OH-OC-HE/(kJ·mol-1)4363431076465413
(1)已知反应①中的相关的化学键键能数据如下:由此计算ΔH1= ____ kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=____ kJ·mol-1
(2)反应①的化学平衡常数K的表达式为 ____ ;图1中能正确反映平衡常数K随温度变化关系的曲线为____ (填曲线标记字母),其判断理由是 ____.
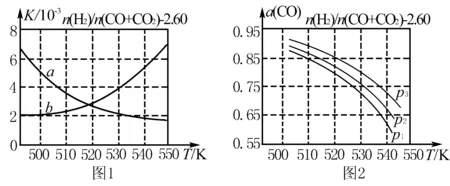
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.α(CO)值随温度升高而 ____ (填“增大”或“减小”),其原因是 ____ .图2中的压强由大到小为____,其判断理由是____.
(3)减小;升高温度时,反应①为放热反应,平衡向向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又产生CO的量增大;总结果,随温度升高,使CO的转化率降低;p3>p2>p1;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高
本题涉及的信息知识和迁移
1.根据反应热等于反应物键能减去生成物键能和盖斯定律分析.
2.将化学方程式中各物质(除固体、纯液体外)浓度代入.
3.正反应是放热反应,升高温度平衡向逆反应方向移动,所以平衡常数减小.
4.升高温度时,反应Ⅰ为放热反应,平衡向左移动,使得体系中CO的量增大.
5.反应Ⅲ为吸热反应,平衡向右移动,产生CO的量增大.
6.随温度升高,CO的转化率的变化与平衡移动有关.
7.同温度时反应Ⅰ加压右移,反应Ⅲ平衡不移动,故加压,CO的转化率升高.
题型3 无机化工生产流程
介绍化学化工工艺的原料、目的、原理,根据流程中的化学知识——物质制备、检验、分离提纯等基本理论和化学原理等主干知识进行设问.以框图或工艺生产线形式表示从原料到产品的操作步骤,试题以物质转化、分离提纯等主要生产流程形式呈现在高考题型中.
例3 硼及其化合物在工业上有许多用途.以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
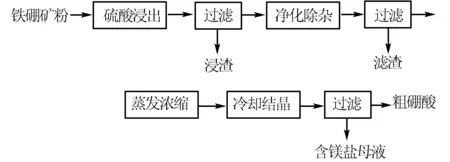
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式____.为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有____(写出两条).
(2)利用 ____ 的磁性,可将其从“浸渣”中分离.“浸渣”中还剩余的物质是____(写化学式).
(3)“净化除杂”需先加H2O2溶液,作用是____.然后再调节溶液的pH约为5,目的是____.
(4)“粗硼酸”中的主要杂质是 ____(填名称).
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为____.
(6)单质硼可用于生成具有优良抗冲击性能硼钢.以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程____.
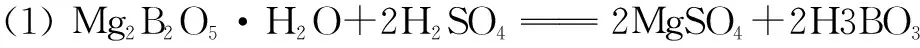
本题涉及的信息知识和迁移
1.通过原料粗略了解流程.
2.为增大反应速率,可采取粉碎矿石,加速搅拌或升高温度等方法.
3.用H2O2把亚铁离子氧化为铁离子.
4.调节pH约为5,使铁离子和铝离子转化为氢氧化物沉淀除去.
5.硼酸和镁反应生成硼单质,由元素守恒可知镁转化为氧化镁,同时还有水生成,依据守恒配平即可.
题型4 化学实验评价与探究
介绍实验的目的、原理及具体操作等,结合实验过程中的化学知识——物质制备、检验、分离提纯等基本理论和化学原理设计.通过文字叙述、流程图、实验装置图等形式展示实验过程或探究思路,设计高考试题.实验中提倡绿色化学思想,防止有毒气体污染环境,提高原料利用率;实验中还要注意防爆炸、防中毒、防倒吸等操作;制备过程中物质的转化率的计算,滴定实验中溶液浓度的计算等.考查了学生运用基础知识的能力,运用新信息的自学能力,在新情境下设计实验的能力等.
例4 草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:
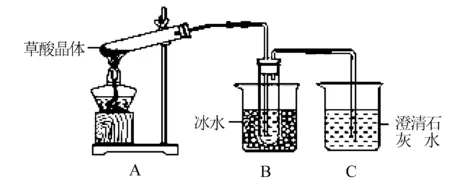
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是 ____ ,由此可知草酸晶体分解的产物中有 ____ .装置B的主要作用是 ____ .
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验.
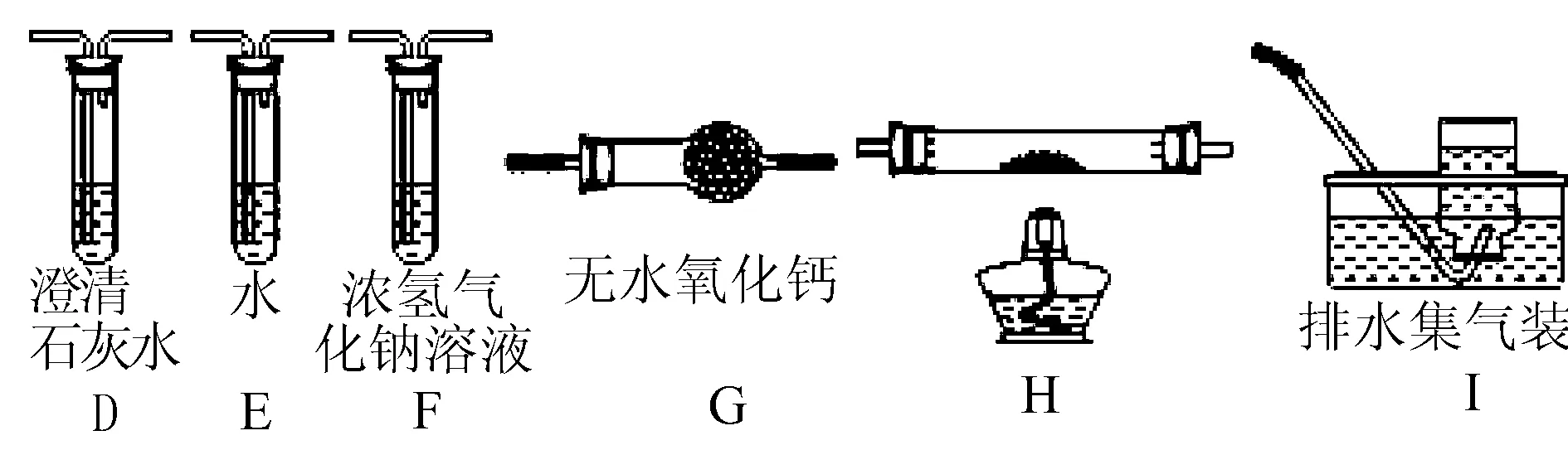
①乙组同学的实验装置中,依次连接的合理顺序为A、B、 ____ 装置H反应管中盛有的物质是 ____ .
②能证明草酸晶体分解产物中有CO的现象是____.
(3)①设计实验证明:
①草酸的酸性比碳酸的强
②草酸为二元酸 ____
答案 (1)有气泡逸出,澄清石灰水变浑浊 CO2冷凝(水蒸气、草酸等),防止草酸进入装置C反应生成沉淀,干扰CO2的检验
(2)①F、D、G、H、D、I CuO(氧化铜)
②前面澄清石灰水无现象,H中黑色粉末变红色,其后的D中澄清石灰水变浑浊
(3)①向盛有少量NaHCO3的试管里滴加草酸溶液,有气泡产生
②用NaOH标准溶液滴定草酸,消耗NaOH的物质的量为草酸的2倍
本题涉及的信息知识和迁移
1.草酸钙难溶于水,因此验证草酸的酸性比碳酸强,不能让其与碳酸钙反应.
2.草酸的熔点较低,加热容易熔化,因此加热草酸晶体的试管管口不是向下倾斜.
3.草酸受热脱水剩余部分为C2O3可能得到CO和CO2.
4.检验CO可选用坐热氧化铜,并用澄清石灰水检验生成的CO2,则实验中应首先除去CO2,并保证CO2完全除去再验证CO的存在,反应后的气体含有CO可收集处理.
G632
B
1008-0333(2016)22-0077-02

