鞣酸在玻碳电极上的电化学行为与检测
熊 健,李 伟,李 容
(1.西藏大学理学院,西藏 拉萨 850000;2.西华师范大学化学化工学院,四川 南充 637002)
鞣酸在玻碳电极上的电化学行为与检测
熊 健1,李 伟1,李 容2
(1.西藏大学理学院,西藏 拉萨 850000;2.西华师范大学化学化工学院,四川 南充 637002)
本文采用循环伏安法研究了鞣酸在玻碳电极上的电化学行为,并讨论了电解质溶液、溶液pH、扫描速率等因素的影响。测定了电极反应的部分动力学参数。结果表明,该电极过程受吸附-扩散混合控制,反应转移的电子数与质子数相等即m=n=1,电极有效面积A=10.60mm2,扩散系数D=4.315×10-5cm2·s-1。其氧化峰电流在1.0×10-4~2.0×10-6mol·L-1范围内呈线性关系,检测限为1.0×10-6mol·L-1,加标回收率为98.92%~103.0%。
鞣酸;玻碳电极;循环伏安法;电化学行为
鞣酸又称为单宁酸,属于典型的葡萄糖棓酰基化合物,是广泛存在于植物中的一类复杂的多元酚类衍生物,其结构如图1所示。这种多酚羟基的结构赋予了它一系列独特的化学性质和生理活性,在医药、食品、日化等方面具有广泛的应用,因此,对鞣酸(单宁酸)电化学性质的研究具有一定的现实意义。目前报道的单宁酸的分析方法有光度法[1-2]、滴定法[3]、流动注射法[4]、高效液相色谱法[5-8]等,但都有处理样品操作复杂繁琐、仪器要求高档且灵敏度不高等缺点,因此本实验采用迅速、简便、可靠、成本低的电化学方法对其进行检测。
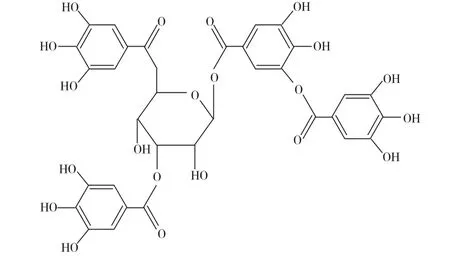
图1 鞣酸的化学结构式Fig.1 The chemical structure of Tannic Acid
玻碳电极具有廉价、方便及重现性好等优点,本实验以玻碳电极为工作电极,运用循环伏安法在PBS缓冲溶液中对鞣酸进行了定量分析,测定了其加标回收率,取得了满意的结果。
1 实验部分
1.1 仪器与试剂
CHI618b电化学工作站,PHS-3C型数字式酸度计,KQ-400DB型数控超声波清洗器,FA1004上皿电子天平,恒温恒湿试验箱,微量进样器(50μL),三电极系统:玻碳电极(φ=4.0mm)为工作电极,饱和甘汞电极(SCE)为参比电极,铂片电极为辅助电极。
鞣酸用水溶解定容于100mL的容量瓶中,配制成1×10-3mol·L-1的标准液,PBS缓冲溶液(0.1mol·L-1Na2HPO4和0.1mol·L-1KH2PO4溶 液调配)。所用试剂均为分析纯,实验用水均为三次蒸馏水。
1.2 玻碳电极的处理
将玻碳电极在0.05μm Al2O3及3000#金相砂纸上打磨成镜面,分别用1∶1的硝酸溶液、10% NaOH溶液、无水乙醇和三次蒸馏水超声清洗2min。三次蒸馏水洗净,室温下自然晾干备用。
1.3 实验方法
本实验主要采用循环伏安法对鞣酸进行了电化学检测,在pH=6.06的PBS电解质溶液中,鞣酸浓度为1.0×10-4mol·L-1,讨论了电解质溶液、pH值、扫描速度的影响,并进行了线性范围测定、干扰测定及加标回收率测定。用计时电量法测定了鞣酸在PBS电解质溶液中的扩散系数。
2 结果与讨论
2.1 鞣酸在玻碳电极上的电化学行为
图2为玻碳电极在1.0×10-4mol·L-1鞣酸的PBS(pH=6.06)电解质溶液中和空白溶液(pH=6.06 PBS)中的循环伏安曲线(电位范围为0.0~0.6V,扫描速率为0.1V·s-1)。通过对比可知,玻碳电极在空白溶液中不出峰,鞣酸在玻碳电极上只出现一个氧化峰,说明它是一个完全不可逆过程。我们以鞣酸的这个氧化峰为研究对象。
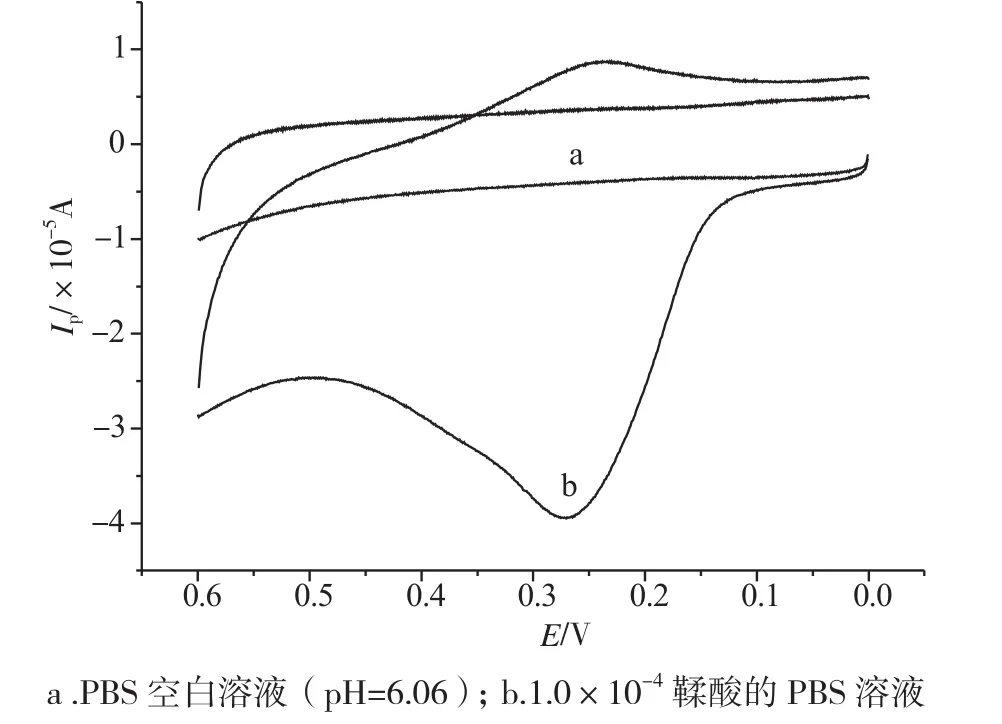
图2 鞣酸在玻碳电极上的循环伏安图Fig.2 The cyclic voltammogram of Tannic Acid a.in PBS(pH=6.06), b. in 1×10-4mol·L-1Tannic Acid
2.2 溶液pH值的影响
实验对比了鞣酸在BR、PBS、HAc-NaAc和1mol·L-1Na2SO4这4种电解质溶液中的循环伏安行为。结果表明,鞣酸在PBS电解质溶液中的峰电流最大,峰形最好。又研究了鞣酸在pH为5.46~8.32的PBS中的电流响应,结果表明,在pH=6.06的PBS电解质溶液中,氧化峰电流最大,因此选择pH=6.06的PBS作为鞣酸的支持电解质溶液。且鞣酸的氧化峰电位与pH值呈线性关系(Epa=0.688~0.069pH,r=0.997),说明H+参加了反应,反应转移的电子数等于质子数(m=n)。
2.3 扫描速率的影响
图3为鞣酸在pH为6.06的PBS缓冲溶液中且扫速范围为50~450mV·s-1时的循环伏安图。由图3可知,随扫速增加,氧化峰电位正移,氧化峰电流随扫速的增加而增加。氧化峰电流与扫速的平方根呈线性关系(图4),线性方程为:Ipa(×10-5A)= -3.187+20.987v1/2,r = 0.993,且氧化峰电流与扫速的自然对数也呈线性关系(图5),线性方程为:lnIpa= -8.459+0.794lnv,r=0.995,说明鞣酸在GCE上受吸附-扩散混合控制[9-11]。
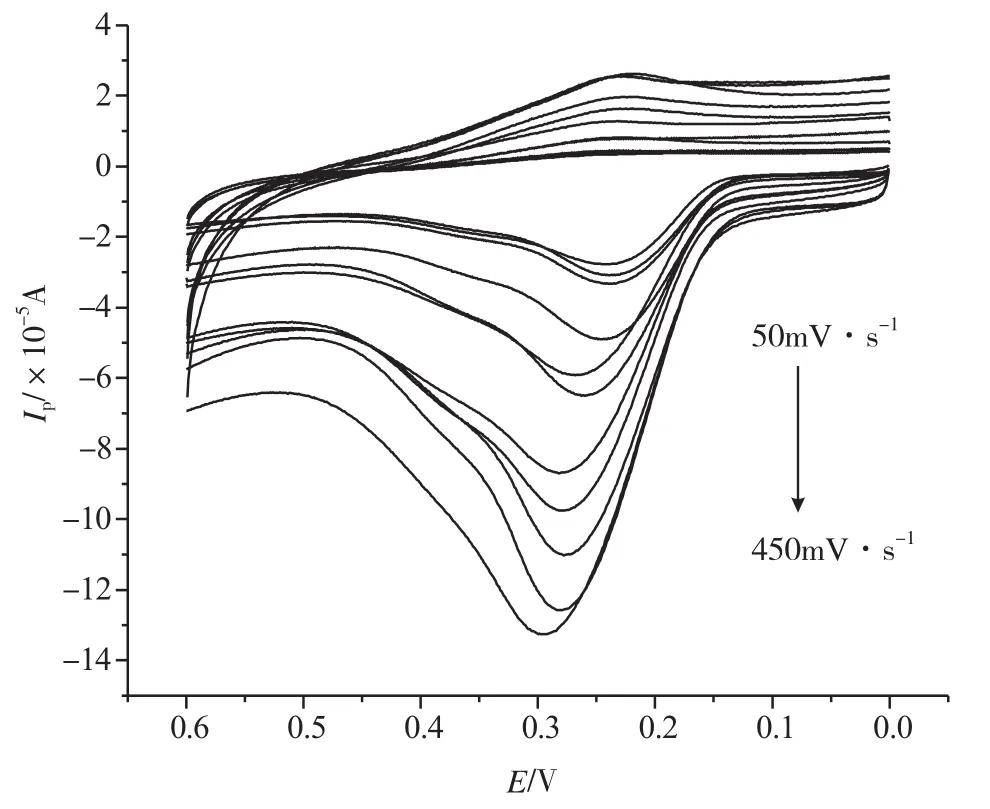
图3 鞣酸在不同扫速下的循环伏安图Fig.3 The voltammograms of Tannic Acid with different scan rate
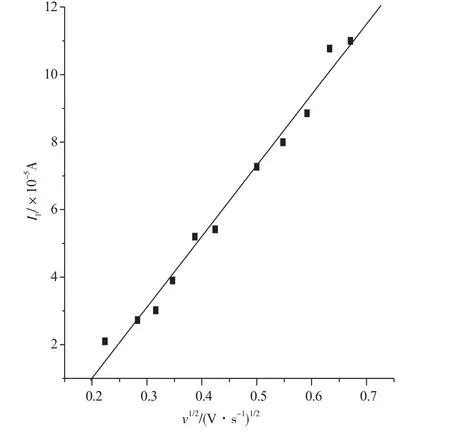
图4 鞣酸氧化峰电流与扫速的关系Fig.4 The relationship between oxidation peak current of Tannic Acid and scan rate
2.4 动力学参数的测定
根据Laviron[10]公式Ip=nFQv/4RT,在T=283K,v=0.15V·s-1时,计算出电子转移数n=1.39≈1。由前面已知,反应转移的电子数等于质子数,故m=n=1。
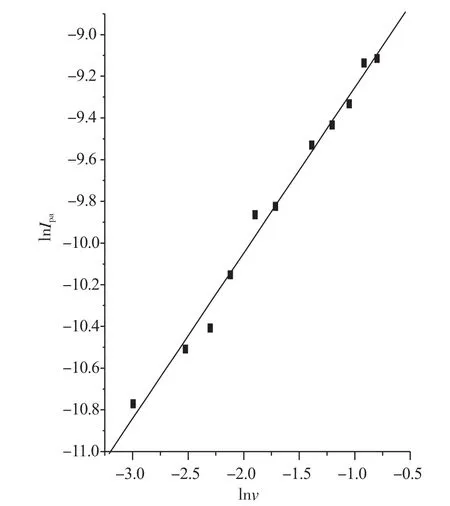
图5 鞣酸氧化峰电流与扫速自然对数的关系Fig.5 The relationship between lnIpaof Tannic Acid and lnv
在1×10-3mol·L-1的铁氰化钾和0.1mol·L-1的KCl混合溶液中,以不同的扫速对其进行循环伏安分析,得到氧化峰电流与扫速的关系为:ip=2.364×10-6+ 7.096×10-5v1/2,r =-0.999。根据Randles-Seveik方程[11]:ip=2.69×105n2/3Adv1/2c0,计算出电极有效面积A=0.106cm2=10.60mm2。
283K时,在1×10-4mol·L-1的鞣酸PBS溶液中作计时电量法,得一计时电量曲线(图6),在曲线上均匀取点,得方程:Q=-1.785×10-7+9.369×10-6t1/2,r=0.999。根据公式可计算出鞣酸在pH=6.06的PBS缓冲溶液中的扩散系数D=4.315×10-5cm2·s-1。
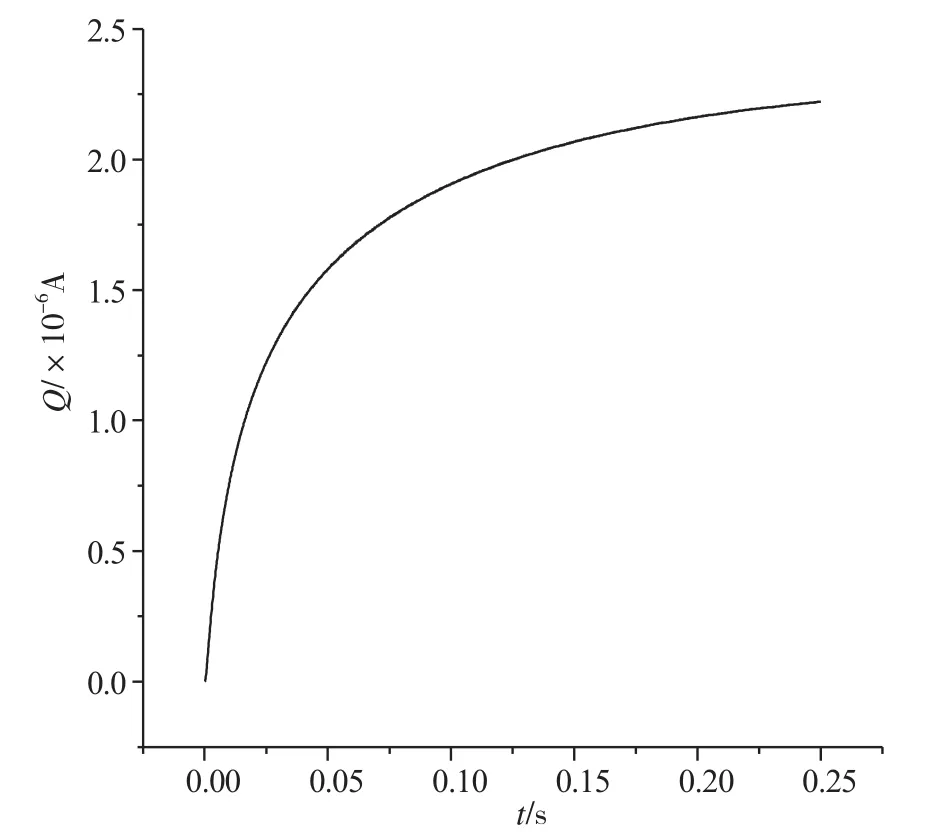
图6 鞣酸在玻碳电极上的计时电量图Fig.6 The chronocoulometry map of Tannic Acid on GCE
2.5 线性范围与检出限
在优化的实验条件下,扫描电位范围为0.0~ 0.6V、0.1V·s-1扫速下,测定不同浓度的鞣酸的氧化峰电流。结果表明,鞣酸氧化峰电流与浓度在2.0×10-6~1.0×10-4mol·L-1范围内呈良好的线性关系(图7),其线性方程为Ipa(×10-5A)=0.3251-0.50c(10-5M),r=0.995,检出限为1.0×10-6mol·L-1,可以作为鞣酸检测的定量依据。
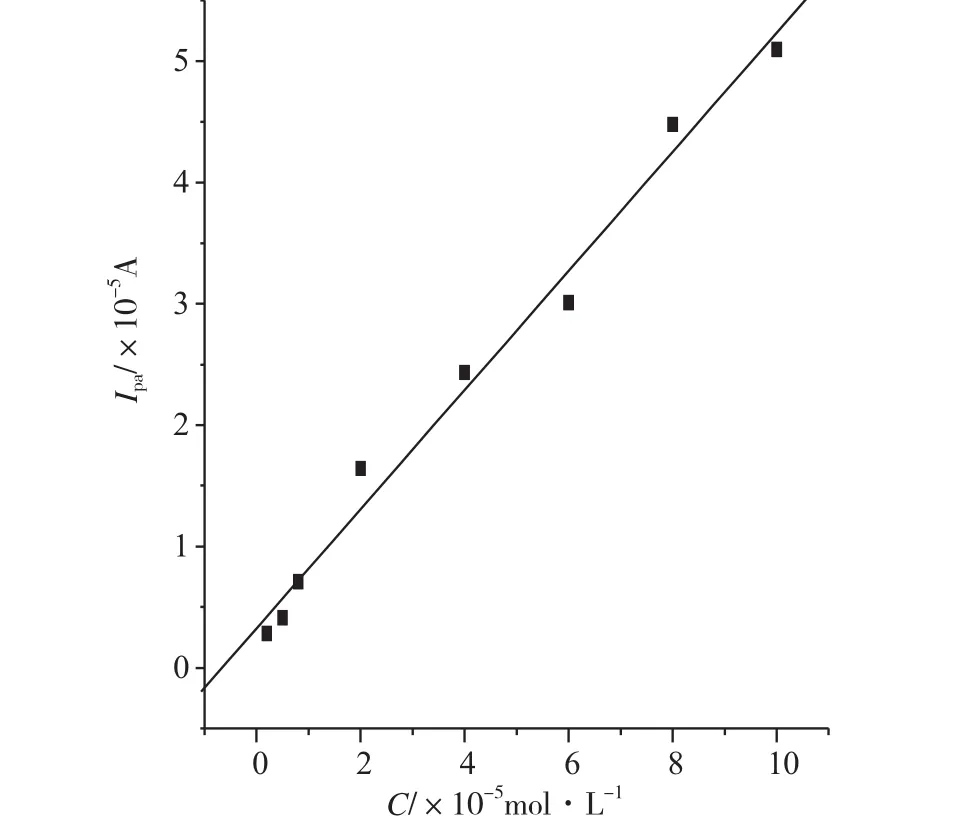
图7 鞣酸氧化峰电流与浓度的关系Fig.7 The relationship between oxidation peak current and concentration of Tannic Acid
2.6 干扰实验
在pH=6.06的PBS电解质溶液中,鞣酸的浓度为1×10-4mol·L-1,考察了一些常见的无机离子及物质对测定鞣酸的影响。结果表明,1000倍的Na+、K+、Mg2+、NH4+、NO3-、SO42-、CO32-、Cl-和1倍的苯甲酸、乳酸和抗坏血酸均不干扰测定。
2.7 回收率实验
以GCE为工作电极,用循环伏安法对鞣酸进行加标回收率测定,结果见表1。

表1 鞣酸回收率的测定
[1] 胡耀星.紫外法测定柿子和柿酱中单宁酸的含量[J].食品科学,1991(6):51-54.
[2] 杨伟,曲祥金.六氰合铁(Ⅲ)酸亚铁钾吸光光度法测定啤酒花中单宁[J].山东农业大学学报,1989(2):36-40.
[3] 杨伟,曲祥金.啤酒花中单宁含量的EDTA滴定法测定[J].山东农业大学学报,1990,21(3):75-78.
[4] Carla M.Bossu, Edilene C. Ferreire, Fernanda S.Chaves, et al. Fow injection system for hydrolysable tannin determination[J]. Microchemical, 2006(84): 88-92.
[5] A chili G, Gellerino G. Identification and Determination of Phenolic Constituents in Nutural Beverages and plant Extracts by Means of a Coulmetric Elctrode Array System[J]. Chromatogr, 1993(632): 111-117.
[6] Zhu J, Ng J, Filippih L J. Determination of Tannic Acid and Its Phenolic Metabolites in Biological Fluids by High Performance Liquid Chromatography[J].Chromatogr, 1992, 577: 77-85.
[7] Haruo Kawamoto, Fumiaki Nakatsubo and Koji Murakami. Quantitative determination of tannin andproteininthepr ecipitatesbyhigh-Performanceliquidchromatography[J]. Phytochemistry, 1995, 40: 1503-1505.
[8] Vire J C, Kauffmann J M, Braun J. Analusis, 1985, 13(3): 134-140.
[9] 艾珍,廖钫,朱林,等.酵母核糖核酸在碳纳米管修饰电极上的电化学行为及其分析测定[J].分析测试学报,2005,24 (9):56-58.
[10] Zhao Y D, Bi Y H, Zhang W D. Talanta, 2005,65: 489-494.
[11] B.RAJESH, K.R.THAMPI, J. M. BONARD, et al. Carbon Nanotubes Generated form Template Carbonization of Polyphenyl Acetylene as the Suppport for Electrooxidation of Methano [J]. Phys. Chem., 2003,107: 2701-2708.
[12] 孙伟,高瑞芳,毕瑞峰,等.室温离子液体六氟磷酸正丁基吡啶修饰碳糊电极制备和表征[J].分析化学,2007,35(4):567-570.
Electrochemical Behavior and Determination of Tannic Acid on Glassy Carbon Electrode
XIONG Jian1, LI Wei1, LI Rong2
(1. Science School, Tibet University, Lhasa 850000, China; 2. Institute of Chemical Engineering, China West Normal Un iversity, Nanchong 637002, China )
The electrochemical behaviors of tannic acid on a glassy carbon electrode with cyclic voltammetry was studied, the effect of electrolyte solution, solution pH, scan rate and other factors, was discussed, some kinetic parameters of the electrode reaction were determined. The results showed that the electrode process was controlled by diffusion, the reaction transferred the same number of electrons and protons that m=n=1, the electrode effective area A=10.60mm2, the diffusion coefficent D=4.315×10-5cm2/s. The oxidation peak current was linear within 1.0×10-4~2.0×10-6mol/L while the detection limit was 1.0×10-6mol/L, and the standardized recovery rate was 98.92%~103.0%.
tannic acid; glassy carbon electrode; cyclic voltammetry; electrochemical behavior
O 657.1
A
1671-9905(2016)11-0030-04
熊健(1987-),女,讲师,主要从事材料化学的科研和有机化学教学
李容(1976-),女,副教授,主要从事材料化学和电化学科研及物理化学教学
2016-09-07

