牛源性成分LAMP检测方法的建立
徐淑菲,孔繁德,苗 丽,蔡振鸿,林振基,赵 冉(. 厦门出入境检验检疫局,福建厦门 606;. 河南出入境检验检疫局,河南郑州 5000;. 厦门市思明区市政管理中心,福建厦门 600;. 厦门市农产品质量安全检验测试中心,福建厦门 6009)
牛源性成分LAMP检测方法的建立
徐淑菲1,孔繁德1,苗丽2,蔡振鸿3,林振基1,赵冉4
(1. 厦门出入境检验检疫局,福建厦门361026;2. 河南出入境检验检疫局,河南郑州450003;3. 厦门市思明区市政管理中心,福建厦门361010;4. 厦门市农产品质量安全检验测试中心,福建厦门361009)
根据牛cytB基因设计3对特异性引物,运用GenieⅡ等温扩增荧光检测系统,以环介导等温扩增(LAMP)荧光检测方法为基础,建立了牛源性成分LAMP检测方法,并对该方法进行了反应体系和条件的优化。试验结果表明:该方法操作简单、特异性好;灵敏度比普通PCR方法高100倍,达到5.408×10-2µg/µL;反应时间短,最快的10分钟内即可完成反应。
牛源性成分;环介导等温扩增法;特异性引物;等温扩增荧光检测系统
为有效防止动物疫病通过进入食物链发生传播,2000年欧盟禁止生产和使用动物源性饲料。我国也先后颁布了《关于禁止用反刍动物源性饲料饲喂反刍动物的通知》《关于加强肉骨粉等动物性饲料产品管理的通知》和《动物源性饲料产品安全卫生管理办法》[1-5]。市场上的牛肉制品,经常出现掺杂猪肉等其他便宜的肉类。如何检出牛源性成分关系着动物、人类生命安全及社会的安定团结,如何检出及如何提高检出率,将可能存在的风险降至最低,是对检验人员提出的更高要求。分子生物学是常用的检测方法,PCR、荧光定量PCR、LAMP方法更为常用。与普通PCR、荧光定量PCR想比,LAMP具有效率高、特异性高、肉眼可观察结果等优点。
等温扩增荧光检测系统已在疫病检测中得到应用[6-8]。侯东君等选定了一套可在牛羊肉中特异并灵敏地检测出掺杂肉成分的引物对,以动物细胞色素b基因组为模板,在恒温63 ℃可特异性扩增出猪等基因片段而无其他扩增片段影响[9]。本文基于等温扩增荧光检测系统,根据牛线粒体cytB基因,设计了3对引物,建立了检测牛源性成分的LAMP方法。
1 材料与方法
1.1材料
1.1.1样品采集和处理。本试验所用的猪肉、牛肉、犬血液、鸡肉、鸭肉全部是来自实验室检验项目的样品;山羊肉、绵羊肉购自厦门市市场;鼠肉来自实验用动物;狐狸肉由河南出入境检验检疫局提供;马核酸、Takara羊核酸、兔核酸为宝生物工程(大连)有限公司产品。
1.1.2主要试剂和仪器。组织DNA提取试剂盒为LabServ公司产品;IMM试剂为北京晟泰勃科技有限公司产品;2×Taq PCR MasterMix、100 bp DNA ladder为厦门泰京生物技术有限公司产品。PCR仪:ABI公司,型号Veriti 96孔型;等温扩增荧光检测系统:OptiGene公司,型号Genie II系统;核酸蛋白测定仪:Eppendorf公司,型号Biophotometer plus。
1.1.3引物
1.1.3.1LAMP引物。对不同动物的线粒体基因序列进行比对,选择牛cytB基因作为牛源性成分的检测基因(表1)。引物浓度CowFIP和CowBIP均 为20 µmol/L;CowF3、CowB3、CowLoopB和CowloopF均为10 µmol/L。

表1 LAMP引物序列
1.1.3.2PCR引物。根据《饲料中牛羊源性成分的定性检测定性聚合酶链式反应(PCR)法》(GB/ T 20190—2006)合成引物(表2)。

表2 PCR牛源成分引物序列
1.2方法
1.2.1DNA提取。按照LabServ公司生产的组织DNA提取试剂盒说明书,提取各样品DNA。
1.2.2LAMP方法的建立及优化
1.2.2.1LAMP方法的初建立。取2个Eppendorf管,反应体系25 µL:IMM 15 µL、FIP 2 µL、BIP 2 µL、F3 1 µL、B3 1 µL,第1个反应管加入牛源性成分核酸1 µL,第2个反应管为对照,加入水1 µL,不足25 µL的用水补足。扩增 65 ℃,30 min;退火从98 ℃到80 ℃,0.05 ℃/s。
1.2.2.2内外引物工作浓度比的优化。取7个反应管,每管反应体系25 µL。各管加入IMM 15 µL、F3 1 µL、B3 1 µL、1 µL牛源性成分核酸,然后加入FIP 和BIP。这两种的量从第1个反应管到第7个反应管依次均为0.5、1、1.5、2、2.5、3和 3.5 µL,各管补充水至25 µL。扩增 65 ℃,30 min;退火从98 ℃到80 ℃,0.05 ℃/s。
1.2.2.3引物工作浓度的优化。取6个反应管,每管反应体系25µL。各管反应内外引物工作浓度比采用1.2.2.3中的最佳浓度比。各管加入IMM 15 µL、牛源性成分核酸1 µL。然后各管均加入FIP、BIP、F3、B3,第1至7个反应管中依次加入 0.5、0.5、0.25、0.25 µL;1、1、0.5、0.5 µL;1.5、1.5、0.75、0.75 µL;2、2、1、1;2.5、2.5、1.25、1.25 µL和3、3、1.5、1.5 µL。反应体系不足25 µL的用水补足。扩增 65 ℃,30 min;退火从98 ℃到80 ℃,0.05 ℃/s。
1.2.2.4LoopF、LoopB的优化结果。取4个反应管,每管反应体系25 µL。各管加入IMM 15 µL、牛源性成分核酸1 µL、FIP 1.5 µL、BIP 1.5 µL、F3 0.75 µL、B3 0.75 µL。然后加入LoopF和LoopB,第1~4管依次加入1.5、1.5 µL;1、1 µL;0.5、0.5 µL和0、0 µL;第5个反应管以水代替牛源性成分核酸作为空白对照,反应体系不足25µL的用水补足。扩增 65 ℃,30 min;退火从98 ℃到80 ℃,0.05 ℃/s。
1.2.2.5反应条件优化。取8个反应管,每管反应体系25 µL。各管分别加入IMM 15 µL、牛源性成分核酸1 µL、FIP 1.5 µL、BIP 1.5 µL、F3 0.75 µL、B3 0.75 µL,补充水至25 µL。第1~8管扩增温度分别为59、60、61、62、63、64、65和66 ℃,时间30 min;退火从98 ℃到80 ℃,0.05 ℃/s。
1.2.2.6敏感性试验。将牛源性成分核酸10倍连续梯度稀释,稀释倍数依次为10-1、10-2、10-3、10-4、10-5。取5个反应管,每管反应体系25 µL。各管加入IMM 15 µL、FIP 1.5 µL、BIP 1.5 µL、F3 0.75 µL、B3 0.75 µL,第1~5管依次加入10-1、10-2、10-3、10-4、10-5倍稀释的牛源性成分核酸1 µL,牛源性成分核酸终浓度分别为5.408、5.408×10-1、5.408×10-2、5.408×10-3和5.408×10-4µg/µL,补充水至25 µL。扩增 65 ℃,30 min;退火从98 ℃到80 ℃,0.05 ℃/s。
1.2.2.7特异性试验。取15个反应管,每管反应体系25 µL。各管加入IMM 15 µL、FIP 1.5 µL、BIP 1.5 µL、F3 0.75 µL、B3 0.75 µL,第1~15管依次加入牛源性成分核酸1 µL、猪源性成分核酸1 µL、山羊核酸1 µL、绵羊核酸0.5 µL、鼠核酸1 µL、马核酸1 µL、狐狸核酸1 µL、H2O 1 µL、牛源性成分核酸1 µL、驴核酸1 µL、狗核酸1 µL、鸭核酸1 µL、鸡核酸1 µL、兔核酸1 µL、H2O 1 µL。各管补充水至25 µL。扩增 65 ℃,30 min;退火从98 ℃到80 ℃,0.05 ℃/s。
1.2.3PCR方法的敏感性试验。取5个反应管,每管反应体系25 µL。各管加入2×Taq PCR MasterMix 12.5 µL、牛PF 1 µL、牛PR 1 µL,第1~5管依次加入10-1、10-2、10-3、10-4、10-5倍稀释的牛源性成分核酸1 µL,补充水至25 µL。反应条件为:94 ℃ 3 min;94 ℃ 30 sec、55 ℃ 30 sec、72 ℃ 1 min,30个循环;72 ℃ 5 min。
2 结果与分析
2.1LAMP方法的初建立
试验对照没有出现扩增曲线(图1),牛源性成分核酸被成功扩增并被仪器检测到荧光信号-S型扩增曲线,检测牛源性成分的LAMP方法初步建立。
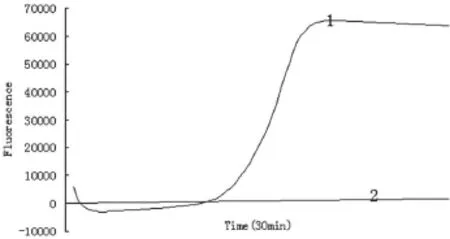
图1 LAMP方法的初建立扩增曲线
2.2LAMP方法的优化
2.2.1内外引物工作浓度比的优化。试验结果如图2、表3所示。第1~7个反应均出现典型的S型扩增曲线,对应的Ct值(mm:ss)分别为24:30、17:30、15:15、14:45、14:30、15:00、15:00,对应的Tm值分别为84.2、85.2、84.6、84.6、84.4、84.4和84.3 ℃。依据扩增曲线结合Ct值,判定本试验最佳反应为第4、第5管,最佳内外引物(FIP、BIP为内引物,F3、B3为外引物)工作浓度比为4:1或5:1,考虑到经济因素,在后续反应中均采用4:1的比例。产物溶解曲线分析(Tm值)最大值与最小值差1℃,认为是同一种成分,进一步确认和鉴定了本试验的准确性。
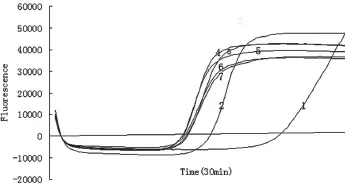
图2 内外引物工作浓度比的优化
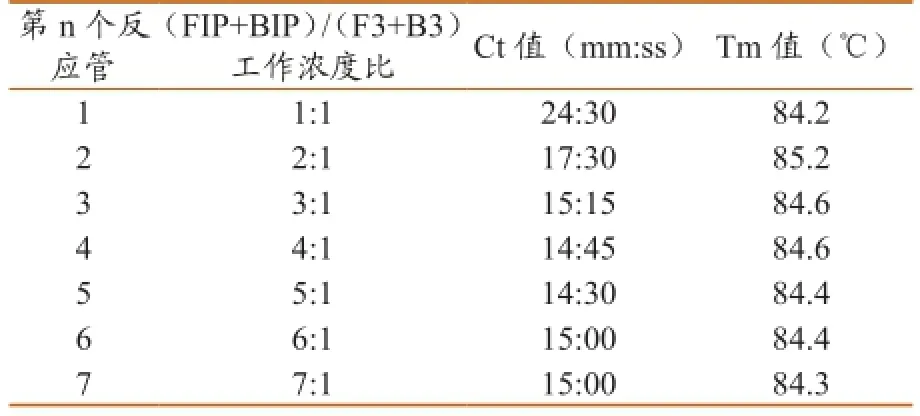
表3 内外引物工作浓度比的优化
2.2.2引物工作浓度的优化。试验结果如图3、表4所示,均能出现S型扩增曲线,第1~6个反应的Ct值(mm:ss)分别为24:00、15:45、14:30、15:00、15:00、15:00,对应的Tm值分别为84.2、84.3、84.5、85.4、84.4和84.3 ℃。随着各引物工作浓度的增加,出现扩增曲线的时间逐渐缩短,第3个反应达到最短,继续增加引物工作浓度,反应时间已无明显变化,达到平台期。依据扩增曲线结合Ct值,判定第3~6个反应较好,第3个反应引物用量最少、最经济,因此FIP、BIP、F3和B3的最佳工作浓度分别为1.6、1.6、0.4和0.4 µmol/L。产物溶解曲线分析(Tm值)最大与最小值差0.3 ℃,认为是同一种成分。
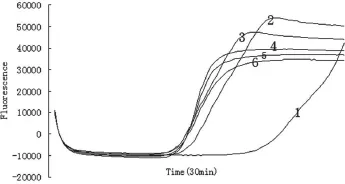
图3 引物工作浓度的优化
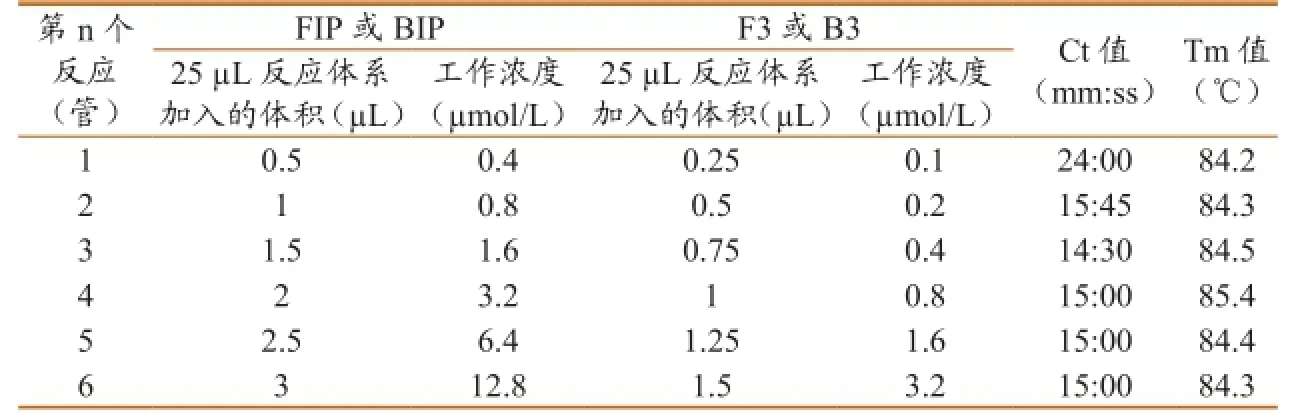
表4 引物工作浓度的优化结果
2.2.3LoopF、LoopB的优化结果。试验结果如图4、表5所示,均能出现S型扩增曲线,第1~4个反应的Ct值(mm:ss)分别为8:00、8:00、8:45、14:45,Tm值 分 别 为84.4、84.3、84.6和84.6 ℃。当加入LoopF、LoopB后,大大加快了LAMP反应速度,随着LoopF、LoopB浓度的增加,LAMP反应速度减弱。结合扩增曲线和Ct值,判定最佳反应为第2管,LoopF、LoopB最佳反应浓度均为0.4 µmol/L。产物溶解曲线分析(Tm值)最大值与最小值差0.3 ℃,认为是同一种成分。
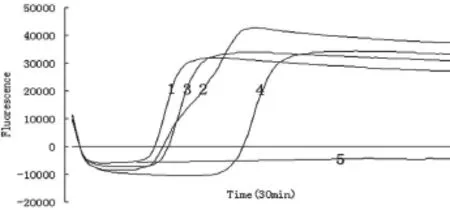
图4 LoopF、LoopB的优化
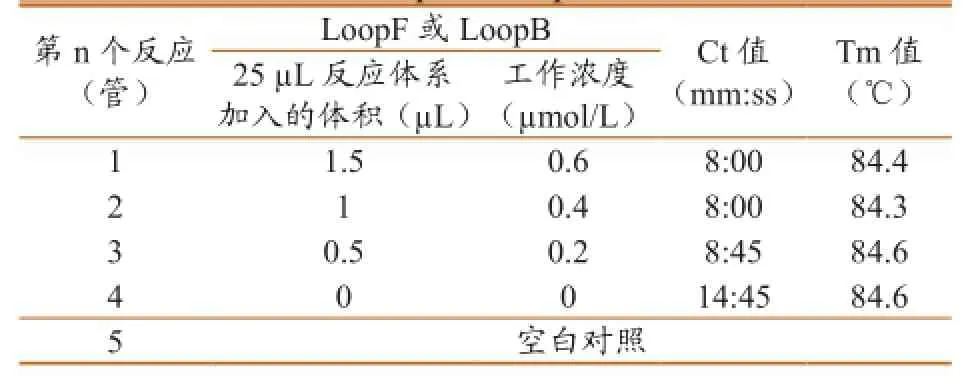
表5 LoopF、LoopB的优化
2.2.4反应条件优化。试验结果如图5、表6所示。各反应均能出现S型扩增曲线,第1~8个反应的Ct值(mm:ss)分别为16:45、16:15、16:15、14:30、13:30、12:30、12:30、12:30,Tm值分别为84.4、84.3、84.5、84.5、84.7、84.3、84.4和84.5 ℃。随着等温扩增温度的升高,扩增曲线出现的时间逐渐缩短,64 ℃达到平台期。扩增曲线结合Ct值,综合判定第6~8管的反应温度均优于其他反应温度,均可采用。LAMP常用的反应温度为65 ℃,因此选择65 ℃为最佳反应温度。产物溶解曲线分析(Tm值)最大与最小值差0.4 ℃,认为是同一种成分。
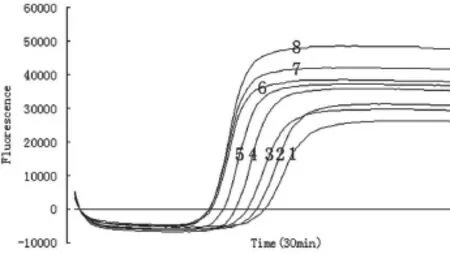
图5 反应条件优化
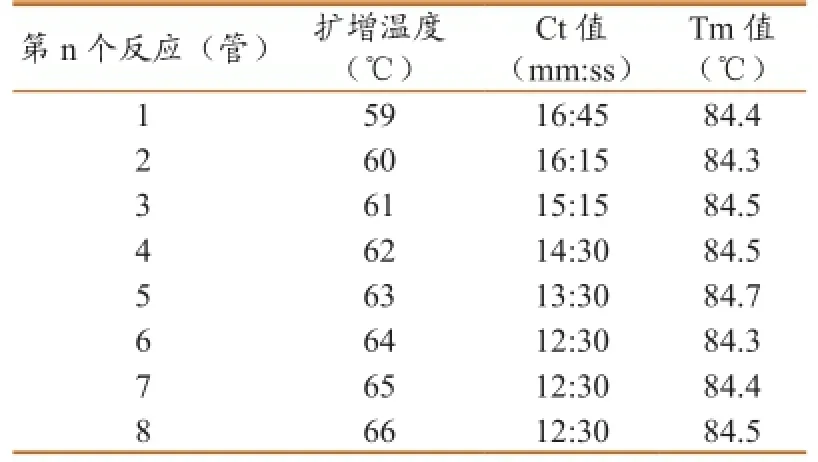
表6 反应条件优化结果
2.2.IMM 15 µL、FIP 1.5 µL、BIP 1.5 µL、F3 0.75 µL、B3 0.75 µL,模板1 µL,水4.5 µL。扩增 65 ℃,30 min;退火从98 ℃到80 ℃,0.05 ℃/s。反应体系25 µL:IMM 15 µL、FIP 1.5 µL、BIP 1.5 µL、F3 0.75 µL、B3 0.75 µL、LoopF 1 µL、LoopB 1 µL,模板1 µL,水2.5 µL。扩增 65 ℃,20 min;退火从98 ℃到80 ℃,0.05 ℃/s。反应时间过长容易出现假阳性。
2.3灵敏度分析
试验结果如图6、表7所示。LAMP反应均能出现S型扩增曲线,第1~3管的反应Ct值(mm:ss)分别为15:45、19:45、23:30,Tm值分别为84.3、84.2和84.4 ℃。第4、5管30 min内无Ct值。LAMP方法检测牛源性成分最低限量为5.408×10-2µg/µL。PCR反应只有第1管反应出现扩增条带,检测牛源性成分最低限量为5.408 µg/µL。LAMP反应比PCR反应灵敏度高100倍。

图6 灵敏度试验

表7 灵敏度试验
2.4特异性分析
试验结果如图7所示。只有牛源性成分核酸出现S型扩增曲线,空白对照、其余动物成分核酸均无扩增曲线,表明本试验具有特异性。

图7 特异性分析
3 讨论
等温扩增荧光检测系统是一套开放式系统,以IAT(核酸等温扩增技术)为基础,结合荧光检测技术,在恒温条件下,通过添加双链结合荧光染料,实时监控扩增过程,快速完成核酸扩增,通过实时扩增曲线和产物溶解曲线判定阴阳性并分析实验结果,无需开盖或其他扩增后处理。
随着人口的增长,食物紧缺等问题的出现,有科学家试图在实验室培养出牛肉或牛奶,代替用动物生产,未来的食品可能更加人工化。2013年美国推出的试管汉堡就已经将政府应如何规范新兴的细胞农业领域这一问题放在了聚光灯下,这种试管汉堡使用生物技术替代了动物生产的肉、牛奶和蛋清。
到目前为止,虽然这些合成食品还未进入市场,但在美国和其他地方的少数新兴公司正在努力扩大生产规模。在加利福尼亚旧金山湾地区Memphis Meats的企业家希望在五年内超市的货架上能出现他们生产的细胞培养肉丸、热狗和香肠;Perfect Day公司则希望2017年底能把人造牛奶制品上市。这个领域存在的一个未知因素是仍然不清楚政府监管机构如何监管、检验检测这类新食品,这对实验室的检验检测提出了新的挑战。
LAMP方法已被广泛应用于肿瘤筛选、植物病毒检测、转基因食品检测、动物胚胎性别鉴定、水生陆生动物的细菌性及病毒性疫病检测等[10]。GenieⅡ是开放的检测平台,应用“等温扩增技术”原理,结合荧光检测技术,提高了检测速度,简化了实验操作,为核酸检测提供了完整的解决方案。
本文建立的基于等温扩增荧光检测系统检测牛源性成分的LAMP方法,除了有普通LAMP方法的特点外,还有以下优点:①反应时间更短,无加速引物LoopF、LoopB时,30 min内即可完成反应;加入加速引物LoopF、LoopB时20 min内即可完成反应;②可进行实时动态扩增曲线及产物溶解曲线鉴定,无加速引物LoopF、LoopB时,12~20 min内即可进行实时初判;加入加速引物LoopF、LoopB时,10 min内即可进行实时初判;③可根据产物溶解曲线(Tm)分析进一步确认和鉴定实验准确性,只要Tm不偏离太多(通常1 ℃以内),可认为方法准确;④反应完毕,不需二次打开反应管,不需染色、电泳等后续处理,可大大减少污染的概率,提高准确性;⑤灵敏度比PCR高100倍。
本文建立的LAMP方法,弥补了PCR等方法的不足,更适用于在基层应用和推广。本方法相对于传统的LAMP方法,有了改进,克服了感官判定的不确定因素,使得结果更加准确可信。
[1] 张春扬,赵宏坤. 牛海绵状脑病[J]. 预防兽医学进展,2001(1):34-36.
[2] Wells G A H,Scott A C,Johnson C T,et a1. A novel progressive spongiform encephalopathy in cattle[J].Vet Rec,1987,121:419-420.
[3] Anderson R M,Donnelly C A,Ferguson N M,et a1. Transmission dynamics and epidemiology of BSE in British cattle[J].Nature,1996,382(6594):779-788.
[4] Will R G,Ironside M,Zeidler S N,et a1. A new variant of Creutzfeldt Jakob diseaseinthe UK [J]. Lancet,1996,347:921-925.
[5] 毕道荣,高宏伟,孙敏,等. PCR方法扩增种属特异性片段检测猪源成分[J]. 中国动物检疫,2008,25(8):34-36.
[6] 史秀杰,于力,王津津,等. 传染性鲑鱼贫血症病毒实时荧光环介导等温扩增检测方法的建立[J]. 渔业科学进展,2014,35(4):51-58.
[7] 何俊强,史秀杰,卢体康,等. 传染性造血器官坏死病毒的新型环介导等温扩增(LAMP)荧光检测技术[J]. 中国动物检疫,2014,31(6):68-73.
[8] 安元龙,吴斌,林长军,等. 荧光环介导逆转录等温扩增(RT-LAMP)技术在病毒性出血性败血症(VHS)诊断中的应用[J]. 中国动物检疫,2012,29(12):23-25.
[9] 侯东君,杨红菊,于雷,等. 环介导恒温扩增法鉴定牛羊肉中搀杂肉[EB/OL].(2012-08-15)[2016-07-15]. http:// www.cnki.net/kcms/detail/11.1759.TS.20120815.1438.001.html.
[10] Fu S J,Qu G G,Guo S J,et al. Applications of Loop-Mediated Isothermal DNA Amplification[J]. Appl Biochem Biotechnol,2011,163:845-850.
(责任编辑:朱迪国)
Establishment of the Loop-mediated Isothermal Amplification for the Detection of Bovine-derived Materials
Xu Shufei1,Kong Fande1,Miao Li2,Cai Zhenhong3,Lin Zhenji1,Zhao Ran4
(1. Xiamen Entry-exit Inspection and Quarantine Bureau,Xiamen,Fujian361026;2. Henan Entry-exit Inspection and Quarantine Bureau,Zhengzhou,Henan450003;3. Siming District Municipal Administration Center,Xiamen,Fujian361010;4. Xiamen Agricultural Product Quality and Safety Test Center,Xiamen,Fujian361009)
In this article,three pairs of specific primers were designed according to the bovine-derived cytB gene. Then based on the loop-mediated isothermal amplification(LAMP)fluorescence detection,a LAMP assay for detecting bovine-derived materials was established by using GenieⅡ real-time fluorescence isothermal amplification detection system. Subsequently the optimizations of the reaction system and conditions were conducted. Results showed that the method was simple to operate and presented good specificity. Meanwhile,compared with the normal level of general PCR,its sensitivity was 100-fold higher,and its detection limit was found to reach 5.408×10-2µg/µL. The method also showed short reaction period,by which the fastest total reaction time could be less than 10 minutes.
bovine-derived materials;LAMP;specific primer;real-time fluorescence isothermal amplification detection system
1005-944X(2016)12-0094-06
10.3969/j.issn.1005-944X.2016.12.025
国家质检总局科技计划项目(2014IK089);福建省科技计划引导项目(2015Y0031);厦门市科技计划项目(3502Z20154079)

