液相芯片技术同时检测六种猪繁殖障碍病毒的方法研究
杨显超,吴秀娟,李凯航,杨德全,鞠厚斌,葛菲菲,王 建(上海市动物疫病预防控制中心,上海 201103)
液相芯片技术同时检测六种猪繁殖障碍病毒的方法研究
杨显超,吴秀娟,李凯航,杨德全,鞠厚斌,葛菲菲,王建
(上海市动物疫病预防控制中心,上海201103)
在GenBank中收集猪细小病毒(PPV)结构蛋白VP2基因、猪圆环病毒2型(PCV2)的ORF2序列、猪伪狂犬病毒(PRV)的gB基因、猪繁殖与呼吸综合征病毒(PRRSV)的NSP2基因、猪瘟病毒(CSFV)的E2基因和乙型脑炎病毒(JEV)的M基因,利用Primer 5.0等分子生物学软件对收集的序列分析比较,筛选出上述基因的特异保守序列并设计引物和探针,将设计好的探针与相应的微球偶联,优化条件,建立检测方法。结果表明:建立的检测PPV、PCV2、PRV、PRRSV、CSFV、JEV 6种病毒核酸的多重液相芯片技术具有较好的特异性、敏感性和稳定性,对PPV、PCV2、PRV、PRRSV、CSFV、JEV 6种病毒核酸的最低检出量分别为8.50×102copies/µL、2.87×102copies /µL、2.07×102copies /µL、2.61×102copies/µL、2.34×102copies/µL、2.05×102copies /µL,与相应病毒 PCR/RT-PCR 检测方法相比,敏感性提高了 100~1 000倍;对临床388份样品同步进行荧光PCR与液相芯片检测,结果99.87%相符。本方法为液相芯片技术在动物多病毒快速高通量检测、鉴别诊断等应用方面奠定了基础。
液相芯片技术;猪繁殖障碍病毒;检测方法
随着养猪业规模化和集约化发展,猪繁殖障碍疫病已成为大中型猪场最重要的疫病之一。在引起猪繁殖障碍的诸多病原中,猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)和日本脑炎病毒(JEV)是较为常见的RNA病毒,猪圆环病毒 2 型(PCV-2)、猪细小病毒(PPV)和猪伪狂犬病毒(PRV)被认为是引起母猪繁殖障碍性疾病的重要DNA病毒。而且近年来猪繁殖障碍病呈现混合感染的特点,给养猪业造成了巨大的经济损失。
目前疾病病原检测主要以 PCR 和免疫学方法为基础,但往往其样本检测通量和并行处理能力有限,且在临床鉴别中需要快速、高通量的检测技术。液相芯片技术(xMAP)是一种被用于高通量临床诊断的新型生物芯片技术。它是一项突破性的生物芯片分子检测新技术,具有高通量、灵敏度高、重复性好、灵活性大的特点[1-2]。美国食品药品管理局(FDA)已批准其用于临床的高通量检测。它在各种应用中的检测结果与传统的ELISA结果基本一致,但有着ELISA无法比拟的优越性。
鉴于 PPV、PCV-2、PRV、CSFV、PRRSV、JEV均可直接或间接引起猪群的繁殖障碍及呼吸系统疾病且具有较为相似的临床症状,同时6种病毒中的2~3 种混合感染的病例较为常见。本研究以 PPV、PCV2、PRRSV、CSFV、PRV、JEV 为研究对象,针对这6种病毒保守性基因设计特异性引物,通过优化条件,构建同时检测这6种病毒的两组三重xMAP 检测方法,并初步应用于临床实践,为猪群病毒感染的实验室诊断提供技术支持,为猪病的快速高通量鉴别诊断搭建新技术平台,并为 xMAP技术在多种动物病毒快速高通量检测、鉴别诊断等应用方面奠定基础[3]。
1 材料与方法
1.1材料
1.1.1毒株来源。本研究中所使用的猪瘟病毒HCV-2012-03、猪繁殖与呼吸综合征病毒PRRSV-2010-04、猪细小病毒NADL-2、猪乙脑病毒SA14-14-2 、猪伪狂犬病毒PRV-2013-01和猪圆环病毒PCV-2013-03毒株均由本实验室保存,并通过纯化、测序进行鉴定和分型。试验中用来验证该方法的样本均来自本实验室采集的实际样本,并且经过Real-Time PCR方法验证。
1.1.2仪器设备。Luminex®200TM液态悬浮芯片系统(Luminex公司,美国);精密电子天平BP221S(梅特勒-托利多公司);电热培养箱MIR162型(三洋公司);漩涡震荡器IKA® MS 3 basic(购自IKA公司);离心浓缩机GenespeedX1(Gene公司);超声波清洗机BRANSON(BRANSON公司)。
1.1.3 主 要 试 剂。Micro AMP® Fast Reaction Tubes、藻红蛋白标记的链霉亲和素(SAPE)购自美国Life公司;Magplex-TAG微球#19、#43、#53和#67(2.5×106beads/mL) 由Luminex公司 提供;MagPure Viral RNA Kit for MagMax ExPRVess核酸提取试剂盒由美吉公司提供;Gel Extraction Kit、Plasmid Mini Kit 由Takara公司提供;Premix Taq™ Version 2.0、DL2000 DNA Maker、pMD-19-T Simple Vector 、一步法RT-PCR试剂盒、特异引物由宝生物(大连)工程公司合成。实验用去离子水和其它化学试剂均为国产分析纯试剂。
1.2方法
1.2.1引物与探针的设计与合成。在GenBank中收集PPV 结构蛋白VP2 基因、PCV2的ORF2序列、PRV的gB基因、PRRSV 的 NSP2基因、CSFV 的E2基因序列和JEV的M基因,利用Primer 5.0等分子生物学软件对收集的序列分析比较,筛选出上述基因的特异保守序列并设计引物和探针。由于这部分工作申请了专利,所以引物和探针序列暂不在本论文中公布,申请号或专利号为:201610578516.3。引物和探针送Takara公司合成,下游引物的 5´端标记生物素,探针 5´C12 端用氨基标记,探针的反向互补序列的 5´端标记生物素,全部 HPLC 纯化。寡核苷酸探针用超纯水稀释成工作浓度 20 pmol/L,引物用超纯水稀释成 20 pmol/L贮存液,均-20 ℃保存。
1.2.2核酸 DNA/RNA 制备。对单一的 PPV、PCV2、PRV、CSFV、PRRSV和JEV细胞培养物,PPV、PCV2、PRV、CSFV、PRRSV和JEV混合物(等体积的 PPV、PCV2、PRV、CSFV、PRRSV和JEV细胞培养物的混合),以及处理的临床样品上清液中未知病毒的核酸,采用 MagPure Viral RNA Kit for MagMax ExPRVess核酸提取试剂盒(美吉公司)提取核酸,然后用Nano-drop 微量分光光度计对其进行浓度测定。样本在96孔板A孔中加入5 µL蛋白酶K溶液、5 µL磁珠、90 µL裂解液和50 µL待检样品或对照;在孔B中加入150 µL洗液,在孔C和D中各加入150 µL去盐液,孔H中加入50 µL灭菌去离子水;把装好样品和试剂的96孔板和洗脱条放到仪器中,启动程序;程序结束后,取出洗脱条,贴上封口膜,直接用于检测,或置-70 ℃保存。
1.2.3两组三重PCR扩增
1.2.3.1PPV、PCV2、PRV三重PCR检测方法的建立。按照PRVemix Taq™ Version2.0试剂盒推荐的反应体系和程序,建立PPV、PCV2、PRV三重PCR检测方法。通过退火温度及循环条件的优化,使PPV、PCV2和PRV均得到最大量的扩增,初步建立三重扩增体系。反应结束后,留5 µL产物用于xMAP杂交。三重PCR按以下反应程序进行:94 ℃预变性5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,循环30次;72 ℃ 10 min。用优化了的三重 PCR 反应体系和条件,对PPV、PCV2、PRV、AIV(禽流感病毒)、NDV(新城疫病毒)、TGEV(传染性胃肠炎病毒)、SIV(猪流感病毒)、PEDV(猪流行性腹泻病毒)核酸及 PPV、 PCV2、PRV混合核酸等模板进行三重 PCR 特异性试验,同时用 PPV、PCV2、PRV不同浓度稀释的核酸做三重 PCR 敏感性试验。
1.2.3.2PRRSV、CSFV、JEV三重RT-PCR 检测方法的建立。按照 PRVimeScript™One Step RTPCR Kit Ver.2 试剂盒推荐的反应体系和程序,参照1.2.3.1建立 PRRSV、CSFV和JEV三重RTPCR 检测方法。三重PCR按以下反应程序进行:94 ℃预变性5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃45 s,循环30次;72 ℃ 10 min。优化三重 RTPCR 反应体系和条件,并对 PRRSV、CSFV(猪瘟病毒)、JEV、AIV、NDV、FMDV(口蹄疫病毒)、SIV、PEDV及PRRSV、CSFV、JEV 混合核酸等模板进行三重 RT-PCR 特异性试验,同时用PRRSV、CSFV及JEV不同浓度稀释的核酸做三重 RT-PCR 敏感性试验。
1.2.4液相芯片的杂交及Luminex检测。选择探针偶联的微球组合(P1-PPV-#19、P2-PCV2-#43、P3-PRV-#53、P4-CSFV-#43、P5-PRRSV-#67、P6-JEV-#53),以漩涡振荡器涡旋偶联好的 beads 40 s。杂交操作步骤如下:在100 µL PCR反应管中加23 µL 1×TMAC 杂交 buffer,加每种 beads mix 各1 µL,冰上保存备用(不可冷冻)。再加5 µL 的三重 PCR 产物,向孔中加入70 µL SAPE报告混合液(溶剂为 1×TMAC,浓度为 8 µg/mL),充分混匀后再用塑封膜盖上反应板,40 ℃杂交温度孵育 40 min。孵育完后直接上Luminex 200 System(仪器 Heater 提前预热至杂交温度)检测,读取检测结果并分析。液相芯片杂交结果定性判定标准:样品检测时,当阳性与阴性的 MFI比值≥3 时,试验成立,QC等于MFI样本与阴性对照(N-control)的比值,即QC=MFI样本/ N-control。当 MFI 样本≥300,且 QC≥3,判为阳性样本;否则,皆为阴性样本[4]。
1.2.5液相芯片体系的优化
1.2.5.1杂交温度的优化。杂交反应时间在40 min条件下,根据探针的Tm值,选定34 ℃、36 ℃、38 ℃、40 ℃、42 ℃、44 ℃等6个温度梯度为研究对象,考察不同杂交温度下液相芯片的检测效果。
1.2.5.2液相芯片检测体系灵敏度。将病毒质粒核酸作梯度稀释,稀释倍数为101、102、103、104、105、106、107和108。稀释后作为PCR扩增模板,用PCR体系进行扩增后于建立的液相芯片检测体系中进行检测,
1.2.5.3液相芯片检测体系特异性。提取已知的AIV、NDV、TGEV、SIV、PEDV病毒核酸样品(诊断中心保存),样品的基因组DNA(提取RNA转化为cDNA)作为PCR扩增模板,用PCR体系进行扩增后,于建立的液相芯片检测体系中进行检测。
1.2.5.4液相芯片检测体系重复性。将提取的临床样品核酸,作为PCR扩增模板,用PCR体系进行扩增后,于建立的液相芯片检测体系中进行检测3次,观察检测体系的重复性。
1.2.5.5液相芯片检测方法对临床样品的检测。临床样品来自上海市嘉定2个猪场、浦东6个猪场和上海光明某猪场共计9个猪场388份母猪脐带血样品,由本单位疫情测报科提供。用建立的两组三重液相芯片体系对提取的388份临床样品核酸进行检测,并同时用Real-time 荧光PCR方法和普通PCR进行检测,来对方法进行比较评估。参照1.2.2的方法,对 388头份临床样本在96孔板A孔中加入5 µL蛋白酶K溶液、5 µL磁珠、90 µL裂解液和50 µL待检样品或对照;在孔B中加入150 µL洗液,在孔C和D中各加入150 µL去盐液,孔H中加入50 µL灭菌去离子水;把装好样品和试剂的96孔板和洗脱条放到仪器中,启动程序;程序结束后,取出洗脱条,贴上封口膜,直接用于检测,或置-70 ℃保存。
2 结果与分析
2.1PCR扩增结果
6种病毒核酸均扩增出预期大小(PPV,254 bp;PCV2,506 bp;PRV,843 bp;CSFV,627 bp;PRRSV,404 bp;JEV,375 bp)的特异性条带,引物与各模板之间不存在非特异性扩增(图1)。
25 µL 体系中采用不同的退火温度(52~60 ℃)进行多重PCR反应,琼脂糖凝胶电泳结果表明,多重PCR在不同的退火温度下都可以有较好的扩增效果(图2~3),试验最终选择DNA扩增体系退火温度56 ℃,RNA扩增体系退火温度52 ℃。
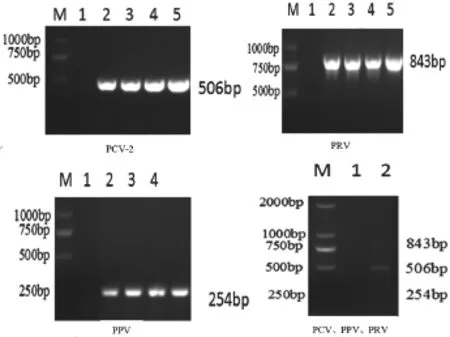
图1 PCV、PPV、PRV电泳结果
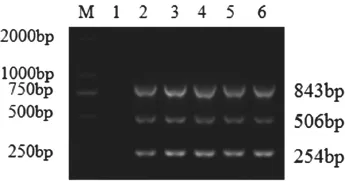
图2 PCV、PPV、PRV三重PCR退火温度的确定
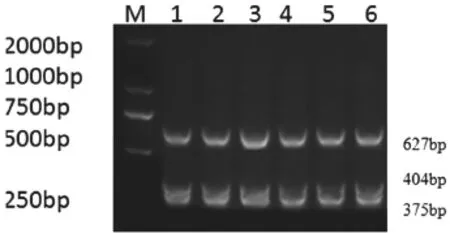
图3 PRRSV、JEV、CSFV多重PCR退火温度的确定
核酸初始浓度测定结果:PPV模板为7 ng/µL,PCV2模板为7.04 ng/µL,PRV模板为2.5 ng/µL,CSFV模板为6.02 ng/µL,PRRSV模板为5.04 ng/µL,JEV模板为1.5 ng/µL。将其进行10-1~10-8稀释后,在25 µL体系中进行三重PCR扩增,PCR电泳结果如图4所示。
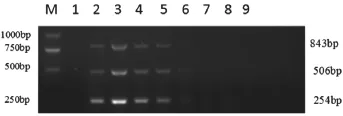
图4 多重PCR灵敏度的确定
以上结果表明:在25 µL体系中,能同时检测出PPV、PCV2、PRV、CSFV、PRRSV、JEV的浓度为10-5ng/µL,其最低检测浓度分别为4.25×10-6ng/µL、4.5×10-6ng/µL、1.3×10-6ng/µL、3.5×10-6ng/ µL、3.1×10-6ng/µL和8.23×10-5ng/µL。据浓度基因拷贝数换算公式计算得最低检测基因拷贝数分别为1.53×106copies/µL、1.58×106copies/µL、4×105copies/µL、1.73×106copies/µL、1.68×106copies/µL和6.4×105copies/µL。
2.2杂交温度的优化
杂交反应时间在40 min条件下,选定6个温度梯度为研究对象,考察不同杂交温度下液相芯片的检测效果(表1)。平均荧光强度随着温度的升高平缓上升;当温度达到40 ℃时,平均荧光强度达到最大值;当孵育温度达到44 ℃时,平均荧光强度下降。参考相关文献,将40 ℃作为最佳反应温度进行后期实验。

表1 液相芯片检测体系的梯度杂交温度优化试验
2.3液相芯片检测体系灵敏度
PPV、PCV2、PRV、PRRSV、CSFV和 JEV两组三重 xMAP 敏感性检测结果见表2。按照 MFI样本≥300,QC≥3 的标准,在25 µL 体系中,PPV、PCV2、PRV、CSFV、PRRSV和JEV检测的敏感性分别到10-6,PN值均大于3。根据浓度基因拷贝数换算公式计算得PPV、PCV2、PRV、PRRSV、CSFV、JEV等6种病毒核酸的最低检出量分别为8.50×102copies/µL、2.87×102copies/ µL、2.07×102copies/µL、2.61×102copies /µL、2.34×102copies /µL、2.05×102copies /µL。
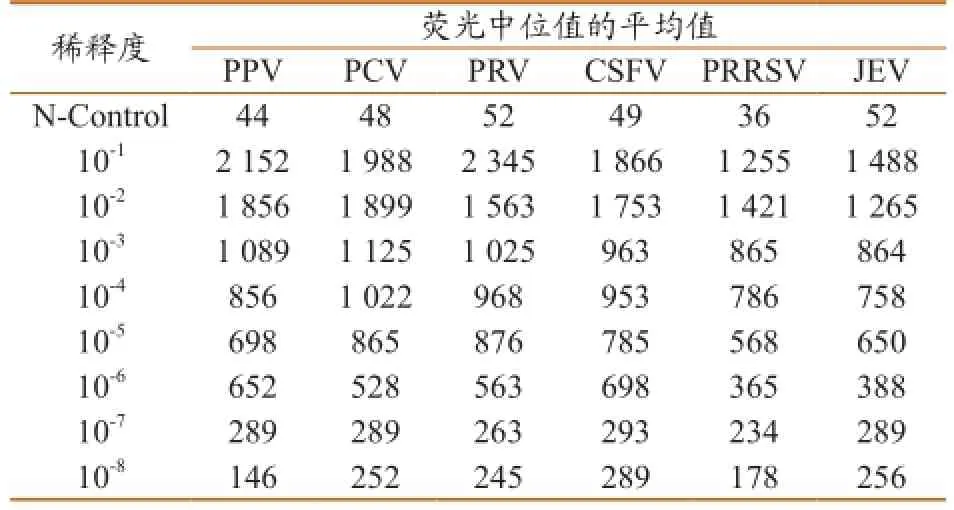
表2 液相芯片体系的敏感性结果
2.4液相芯片检测体系特异性
PPV、PCV2、PRV、PRRSV、CSFV和JEV两组三重 xMAP 特异性检测结果见表3。由PPV、PCV2、PRV、PRRSV、CSFV和JEV两 组 三 重xMAP 特异性检测结果可知:PN PPV=1 752/45≈39,PN PCV2=1 985/45≈44,PN PRV=2 263/35≈65,PN PRRSV=2 014/34≈59,PN CSFV=1 878/35≈54,PN JEV=1 765/44≈40,MFI N-control、AIV、NDV、TGEV和PEDV均小于 300,PN 值均大于 3,故该xMAP 检测体系特异性良好。
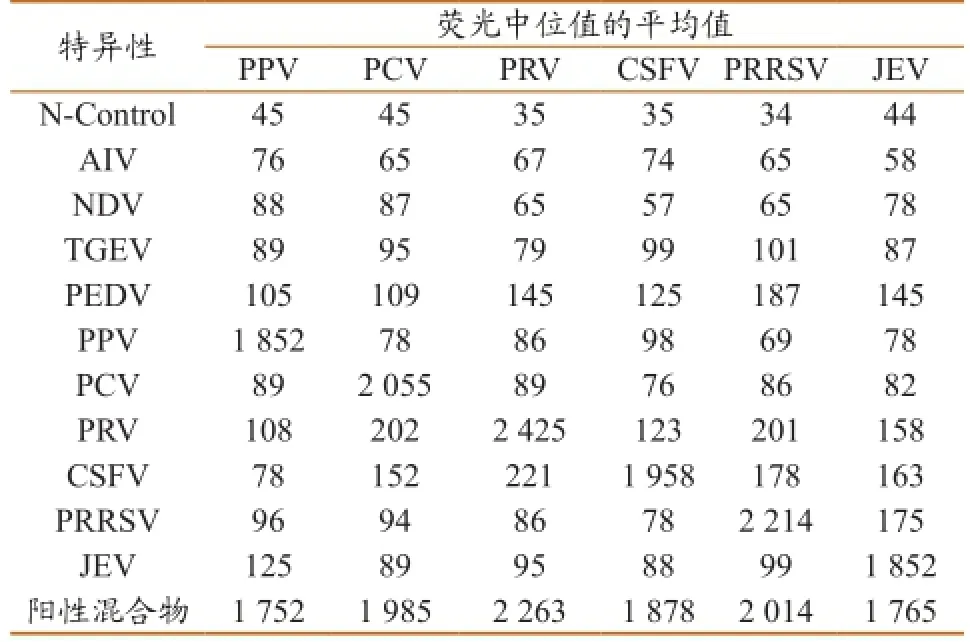
表3 液相芯片的特异性结果
2.5液相芯片检测体系重复性
对 PPV、PCV2、PRRSV、CSFV、JEV等 两组PCR 特异性产物进行的 3 次重复试验表明,3次检测报告判定的定性结果100%一致,说明该检测方法的重复稳定性良好。
2.6临床样品的检测结果
本实验用建立的液相芯片检测体系检测临床样品388份,共计2 328份次,检测出阳性样品10份,并同时用Real-time 荧光PCR方法和普通PCR方法进行检测,阳性样品7份,重复率为99.87%(2 325/2 328),详细情况见表4。

表4 临床样品检测详细结果
3 讨论
PCV2、PPV、PRV、CSFV、PRRSV 和 JEV是常见的引起猪呼吸与繁殖障碍的病毒,常呈混合感染。本研究针对6种病毒的保守基因设计特异性引物,建立了同时检测这6种病毒的多重 PCR 方法。Ogawa等建立了检测 PCV2、PPV、PRV DNA病毒的多重 PCR 方法及 PRRSV、JEV、PEDV、PoRV-A、TGEV、GETV等6种 RNA 病毒的多重RT-PCR 方法,但用于临床检测时,需将待检病料分为两份提取 DNA 和 RNA。本实验所建立的方法,可同时提取病毒DNA 和 RNA进行快速检测,弥补了前者的不足。
设计出最优的引物探针是xMAP技术成功的关键之一。引物设计时,首先应该避免生物素化的特异性下游引物与特异性寡核苷酸探针之间二聚体的存在。因为探针与目标靶核酸杂交检测过程中,该二聚体一定程度上相当于杂交体,当加入SAPE,也会激发荧光信号,产生很高的阴性背景荧光,直接影响杂交结果的判定,甚至致使杂交检测失败。
设计最佳的引物探针组合时,选择合适的软件很重要。Tim等[5]建议使用Beacon Designer软件。该软件传统上被用来为实时荧光定量PCR设计引物和探针,使用该软件设计出的多重引物探针组合,最大程度地减少特异性探针与非特异性引物(体系中的其他扩增引物)之间的二聚体,提高多重PCR和多重xMAP的成功率。Tim还指出,筛选出的引物探针组合中,探针比引物的Tm最好高4~6 ℃。对设计出的引物探针,最后还需进行PRVimer blast或nucleotide blast,在理论上保证PCR扩增出来特异性的目标杂交序列和探针靶向杂交序列的特异性。
目前对 xMAP 结果的判定缺少统一的标准。不同研究者使用的检测系统可能略有不同,但都是基于 Luminex xMAP 技术的检测系统。本研究参照以上研究者的研究经验,约定本实验研究的可信标准为:当MFI样本≥300,且QC≥(3QC=MFI样本/N-control),同时满足这两个条件时,判为阳性样本;否则,皆为阴性样本。
与其他研究者的经验探讨。Seok等[6]在多基因分型试验中应用的杂交缓冲液是1×Tm Hybridization Buffer [0.2 mol/L NaCl,0.1 mol/L Tris(pH8.0),0.08% Triton X-100],而研究者Ashley等在xMAP核酸定量建模分析中指出,杂交缓冲液用TMAC最好。在探针靶核酸杂交后,TMAC可以使之持续产生较强的荧光信号,并且一定程度上能降低杂交的背景荧光值。所以,本研究直接采用了TMAC作为杂交缓冲液。
Douglas等[7]在其细菌标记溯源研究中,并没有使用生物素标记引物来使靶核酸生物素化,而是在PCR扩增完后,通过乙醇沉淀DNA再进行的靶核酸的生物素标记。该法的优点在于能降低试验花费,还能去除掉可能对杂交信号有影响的引物序列。但是,通过沉淀DNA再进行标记PCR产物,存在DNA沉淀率低、沉淀不完全、靶核酸损失的问题,还在一定程度上影响了液相芯片检测的敏感性,甚至造成假阴性的检测结果。多数研究者采用引物标记生物素法来标记PCR产物。
Johanna[8]的研究暗示,随着芯片检测通量的提高,检测敏感性会有不同程度的下降。液相蛋白芯片如此,液相核酸芯片也存在此类问题。为了提高敏感性,建议以后的研究者可以参考 Seok等对 ATP 结合盒转运蛋白的 SNP 进行分型研究,对多重 PCR进行分组,最后在一起杂交(Seok对22 个突变点进行了分析,一共使用 44 种编码的微球,其多重 PCR 的解决采用分组进行,分别做多重 PCR,然后混合,再用Bio-Plex液相芯片进行检测)。
[1] Lipatov A S,Govorkova E A,Webby R J,et al. Influenza:Emergence and Control[J]. J Virol, 2004,78(17):8951-8959.
[2] Li K S,Guan Y,Wang J,et al. Genesis of a highly pathogenic and potentially pandemic H5N1 influenza virus in eastern Asia[J]. Nature,2004,430(6996):209-213.
[3]陈光达. 猪六种病毒多重PCR检测方法的建立及初步应用[D] . 杨凌:西北农林科技大学,2012.
[4]朱向博. 四种猪病病原的液相芯片检测方法的建立[D].杨凌:西北农林科技大学,2012.
[5] Tim J D,John S,Vanessa G,et al. Multiplex detection of bacteria associated with normal microbiota and with bacterial vaginosis in vaginal swabs by use of oligonucleotidecoupled fluorescent microspheres[J]. American Society for Microbiology,2009,47(12):4067-4077.
[6]Seok H K,Tan C O,Kok T C. Multiplexed genotyping of ABC transporter polymorphisms with the Bioplex suspension array[J]. Biological Procedures Online,2006,9(1):27-42.
[7]Douglas R C,Dennis M S,Marilyn S. Using DNA suspension arrays to identify library-independent markers for bacterial source tracking[J]. Water Research,2007,41:3740-3746.
[8]Johanna D,Karin P W,Anders J. The xMAP™ technique can be used for detection of the inflammatory cytokines IL-1β,IL-6 and TNF-α in bovine samples[J]. Veterinary Immunology and Immunopathology,2007,118:40-49.
(责任编辑:朱迪国)
Establishment of a Multiplex Supension Array for Simultaneous Detection of Six Kinds of Porcine Reproductive Failure Virus
Yang Xianchao,Wu Xiujuan,Li Kaihang,Yang Dequan,Ju Houbin,Ge Feifei,Wang Jian
(Shanghai Center for Animal Disease Control and Prevention,Shanghai201103)
From more than 20 articles published in GenBank,structural protein VP2 gene sequence of porcine parvovirus(PPV),open reading frame 2 sequence of porcine circovirus 2(PCV2),gB genome sequence of pseudorabies virus(PRV),NSP2 genome sequence of swine reproductive and respiratory syndrome virus (PRRSV),E2 genome sequence of classical swine fever virus(CSFV)and M genome sequence of Japanese encephalitis virus(JEV),were downloaded and multi-sequence analysis for filtering out the conserved region by DNAman V6 were done. Then the sequences were inputted into Primer 5.0 software to design out combinations of the specific probes and primers of PPV,PCV2,PRV,PRRSV,CSFV and JEV. Next,the probes and microspheres were coupled,reverse primers and probes’ reverse complementary sequence were tagged with biotin. Through the optimization of the annealing hybridization temperature and other reaction conditions,the xMAP instrument system was established for detection of PPV,PCV2,PRV,PRRSV,CSFV and JEV. The results showed that the specificity of combinations of each pair primers and probes was good,and there was no cross-reaction with each other. This method also could be sensitive to detect the six viruses,the limit of detection for each nucleic acid were 8.50×102copies/µL,2.87×102copies/µL,2.07×102copies/µL,2.61×102copies/µL,2.34×102copies/µL,2.05×102copies /µL,respectively,its sensitivityincreased 100~1 000 times compared with PCR/RT-PCR of each corresponding virus. 388 clinical samples were tested by the xMAP methods and ordinary PCR/RT-PCR methods respectively at same time,and the results showed that consistent test results were obtained by this two methods. The xMAP methods laid foundation for application of xMAP technology in fast,high-throughput detection of multi-virus of animals and differential diagnosis.
xMAP array;porcine reproductive failure virus;detection methods
S851.3
B
1005-944X(2016)12-0078-07
10.3969/j.issn.1005-944X.2016.12.022
上海市市级农口系统青年人才成长计划(沪农青字〔2014〕第2-11号);上海市生猪产业技术体系(沪农科产字〔2016〕第6号)
王 建

