案例分析——美国西尼罗河热疫情的暴发与防控
史雪萍,樊晓旭,吴晓东,张永强,李 林,李金明,戈胜强,王志亮,马洪超(.青岛农业大学,山东青岛 6609;.中国动物卫生与流行病学中心,山东青岛 6603)
案例分析——美国西尼罗河热疫情的暴发与防控
史雪萍1,樊晓旭2,吴晓东2,张永强2,李林2,李金明2,戈胜强2,王志亮2,马洪超2
(1.青岛农业大学,山东青岛266109;2.中国动物卫生与流行病学中心,山东青岛266032)
自1999年美国报道首例人西尼罗河病毒(WNV)感染以来,已出现了41 000多例临床感染病例和1 700多例死亡病例。1999年至2012年间,美国因人感染WNV住院造成的花费累计约7.78亿美元。同时,马属动物的治疗和免疫接种及WNV的监控也给美国带来了更严重的经济负担。针对WNV感染,美国采取了一系列防控措施,如建立国家虫媒病毒监测系统(ArboNET)、控制流行地区蚊虫、开发新型诊断方法、实施疫苗免疫等。但是,由于美国至少有65种蚊子能够传播WNV,感染WNV的候鸟可长距离传播病毒,加之季节、气候、人类活动等因素,导致WNV在美国难以根除。本案例提示我国应注重完善国家外来人兽共患病监测系统和实验室诊断方法;加强公共卫生实验室能力建设;利用大数据,建立WNV长期预警模型;确定理想的哨兵动物;加强政府与企业的合作以及疫苗、驱蚊剂的研发;加强宣传,突出防控重点。
案例分析;人兽共患病;西尼罗河病毒;美国;防控措施
西尼罗河热(West Nile fever,WNF)是由西尼罗河病毒(West Nile Virus,WNV)引起的,以蚊子为媒介传播的病毒性疾病[1]。该病除感染人外,还可感染鸟类和马等多种动物。WNV属于黄病毒科、黄病毒属,通过蚊子-鸟类(雀形目)-蚊子传播,人和马是WNV的终末宿主。WNV分布广泛,在欧洲、亚洲、非洲、大洋洲、北美洲和南美洲都有感染的报道。人感染后,表现出的临床症状轻重各异,主要呈现隐性感染,表现轻微发热、头痛、乏力、腹泻、呕吐等。WNV能够穿过血脑屏障,严重的可导致出现脑膜炎、脑炎、弛缓性瘫痪,甚至死亡(较少),许多患者长期遭受神经系统紊乱的困扰[2]。马感染后,出现发热、乏力、运动障碍、共济失调和失明等症状,多数情况下,截瘫出现后5~10天内死亡[3]。
1 WNF在美国的流行情况
1.1人间流行情况
WNV起源于一千多年前的非洲大陆,后随迁徙的候鸟传至欧洲和亚洲。1937年,在乌干达西尼罗河地区,人们首次从轻度发热的妇女身上分离到该病毒。直到二十世纪五十年代,该病在以色列和埃及流行时,才确定了病毒感染引起的主要临床症状。1999年,美国纽约首次报道了人感染WNV病例,其中感染62例,死亡7例[4];2000年,康涅尼格州和新泽西州报道了该病;2001年,该病蔓延至宾夕法尼亚、马塞诸塞、马里兰、佛罗里达、佐治亚、阿拉巴马和路易斯安那等地;2002年,该病已基本覆盖了落基山脉以东各州。随后该病继续在北美洲大陆自东向西、自北向南传播,到2003年,WNF几乎覆盖了美国本土48个州(除阿拉斯加和夏威夷),共报道人感染9862例,死亡284例(死亡率7%)[5]。2004年起,WNV流行得到了初步控制;2008—2011年,WNV病例报道数进一步下降(图1)。而在2012年,德克萨斯州的达拉斯到沃思堡地区暴发了严重的WNF疫情,全年报告人间病例5 674例,死亡率5%[6]。2013年和2014年,美国人感染病例共约2 200~2 400例左右;2015年1—8月,美国44个州及哥伦比亚特区共报道人感染病例303例,其中57%出现了“神经系统障碍”症状。迄今美国已有约300万人感染WMV,其中临床发病41 000余例,死亡1 700多例[7]。1999年以来美国的人间病例数量及变化趋势见图1。
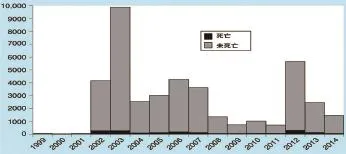
图1 1999—2014年美国CDC ArboNet报告的人感染WNV病例数[7]
1.2动物间流行情况
据美国农业部(USDA)关于马感染WNV的病例记录显示(图2):2001年马感染738例,2002年马感染WNV病例数最多,为15 257例,随后逐年递减。由于使用了疫苗防控,自2007年以后,美国每年报道的马感染病例在87~276例之间。但在2012年,WNF疫情在美国境内突然加重,报告的病例数由前一年的87例骤升至627例,人和马在2012年的病例数量均高于前几年。2013—2014年,马感染数有所回落,来自42个州报告的马感染病例数为:2013年377例,2014年141例。
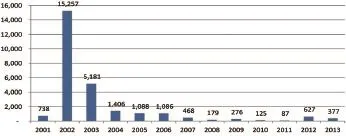
图2 2001—2013年美国马感染WNV病例数[8]
1.3WNV在美国的遗传进化情况
WNV主要分为两个遗传谱系:谱系I分离自欧洲、中东、南亚(印度)、非洲、澳洲(澳大利亚)和西半球国家;而谱系II毒株来自非洲南部,包括岛国马达加斯加,其毒力低于谱系I。1999年在纽约流行的WNV(NY99)属于I系,系统进化分析表明NY99与以色列分离到高度神经系统障碍毒株关系密切。但是,尚无法确定病毒如何传入美国。随着时间推移,又出现以NA/WN02、SW/WN03为代表的新基因型毒株。2012年德克萨斯州流行的WNV属于NA/WN02基因型,2006—2011年在爱达荷州和北达科他州流行的MW/WN06毒株属于SW/WN03基因型。根据美国ArboNET数据库信息,从1999年首次暴发WNF至今,WNF病死率为8%~12%,16年间人感染死亡率并未出现明显变化。但从病毒基因谱系看,北美的WNV仍在持续进化[9]。
2 防控措施
2.1建立国家虫媒病毒监测系统(ArboNET)
为应对1999年暴发的WNV,美国疾病预防控制中心(CDC)联合地方卫生部门、食品药品管理局、其他政府部门和私人企业,于2000年启动了多州参与的监控网络ArboNET。该网络由CDC的媒介传播疾病处(DVBD)负责管理,每周更新信息一次,监控病毒的流行传播[10]。其中包括:人感染WNV临床病例报告,马感染WNV临床病例报告;蚊子样品检测结果;哨兵鸟类(鸡)常规抗体检测结果;死鸟发现报告及检测结果。另外还应用地理信息系统(GIS)和遥感(RS)工具建立了CDC-USGS疫病动态地图,实时更新各地区感染病例信息[8]。各州政府卫生部门收集数据后,每周通过网络提交至CDC。CDC将数据经汇总、分析后分发至用户端,供各州共享。到2003年,ArboNET涵盖范围扩展至其他本土和外来的其他虫媒病。这些疾病都是可能对社会公众健康造成严重损害的重大传染病。同时,CDC要求,除了WNF脑炎和脑膜炎病例外,还要上报单纯发热病例,确保信息收集的全面性。根据监测结果,CDC将WNF风险分为0、1、2、3等级,分别对应暴发无风险、暴发低风险、暴发高风险和正在暴发阶段,并相应推荐不同的应对措施[8]。
2.2加强监测,开发新型诊断方法
WNF暴发后,美国政府加强了对脑炎病例的监测,并研发了更快、更灵敏的WNV诊断方法(实时定量RT-PCR、NASBA),检测鸟类和蚊子中的病毒抗原,通过灵敏、快速的血清学检测方法(ELISA、PRNT)检测、确认人、马和野鸟体内阳性抗体[11]。同样,从2003年起,美国开始利用核酸扩增技术对献血人员的WNV携带情况进行快速检测,并规定如果人员被诊断出携带WNV,在120天之内禁止献血。当献血后不久确诊感染WNV,本人要及时通知当地血站。由此基本杜绝了病毒经血液传播的可能。与普查献血人员是否感染WNV不同,由于器官提供的时效性,美国目前尚未在所有单位实施器官移植供体的WNV检测。但总体上,只有少数患者由于器官移植感染WNV[12]。
2.3在流行地区开展蚊虫控制,切断传播途径
为减少人类在WNF流行季节被蚊虫叮咬的机会,美国政府加强了对公众的宣传教育,号召人们在户外时使用驱蚊剂,平日在蚊子活动密集地区穿长衣长袖,在蚊虫活跃期间(黄昏、夜晚、黎明)减少外出。同时,防止蚊虫在家中滋生,及时清空花盆、宠物食盘、游泳池、水桶等容器中的积水。基于上述资料,美国根据“虫害综合治理方案”(IPM)实施了“虫媒综合治理方案”(IVM),针对性地采取措施,减少蚊子栖息地[13]。
2.4实施疫苗免疫
尽管目前尚无人用WNV疫苗投入市场,但自2005年起,美国USDA陆续批准了马WNV疫苗的使用。目前已有马用WNV全病毒灭活疫苗、重组病毒灭活疫苗、金丝雀痘病毒载体疫苗在美国、加拿大和欧洲获得审批。其中,金丝雀痘病毒载体疫苗L1对WNV L2也有较好的交叉保护效果。USDA报告称,通过疫苗免疫,马感染WNV病例数量大幅下降,而在未广泛使用疫苗的地区,马感染WNV仍时有发生[11,14]。
3 WNF在美国难以根除的原因
WNV在北美大范围传播流行并难以有效根除的主要影响因素为:蚊子、鸟类、气候、人类活动(图3)
3.1蚊子因素
目前,在美国至少有65种蚊子能够传播WNV。其中,在美国北部大平原地区主要是跗斑库蚊,在中西部地区主要是尖音库蚊,而在中南部地区主要是致倦库蚊。病毒通过感染不同种类的蚊子进行复制传播,以克服、适应不同地区的气候条件[15]。在冬季酷寒条件下,病毒在处于适应性滞育阶段的蚊子(能够“冬眠”的蚊子)中存活,熬过冬季后在第二年春季“复发”。
3.2鸟类因素
WNV能够感染多种鸟类,特别是乌鸦和松鸡。候鸟迁徙距离长,极易将病毒携带到远方,造成WNV难以控制和根除。
3.3季节、气候因素
通常在夏季感染WNV的几率高。气候因素,特别是温度和降雨,决定了蚊子群体的数量和分布,进而影响着WNV暴发的时间和分布[15-16]。温度升高可加速病毒的复制,使病毒能够更快速地感染蚊子,缩短病毒繁殖周期。充足的降水量为蚊子大量滋生提供了更适宜的环境。而暴雨和洪水却可以冲毁蚊子原有的栖息地,减少蚊子数量。另外,干旱导致鸟类与蚊子竞争水源,使其更近距离的接触蚊子,也能提高WNV传播几率,这是2012年美国WNF重新暴发的重要原因之一。
3.4人类活动因素
WNF的暴发也与当地社会发展、人类居住环境特点、农业生产有关。居住地附近有死水、自家有游泳池、附近农场拥有大量马匹的区域,WNF流行的风险较高。新流行地区的易感宿主往往对WNV缺乏免疫抵抗力,尤其是婴儿、免疫缺陷、患病人群(癌症、糖尿病、肾病)及老年人群(60岁以上),其对WNV更易感,感染后更易出现神经症状甚至死亡[17]。
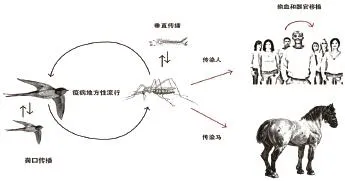
图3 WNV传播途径[18]
4 美国WNF防控策略给我们的启示
4.1完善国家外来人兽共患病监测系统和实验室诊断方法
人兽共患病一旦传入某个国家,将产生巨大的经济损失和社会影响。目前,最经济、有效的外来人兽共患病防控方法是防止其传入,以及传入后尽早的发现并根除。所以,应健全外来人兽共患病监测体系,提高监测体系的敏感性,尽早发现疫情。同时,建立和优化诊断方法,为疫情确诊做好物质和技术储备。
4.2加强公共卫生实验室能力建设
国家CDC应与农业部合作,培训省级实验室人员,提高其实验室活动和操作能力,同时提供试剂,开展实验室监测活动,使每个省级实验室均具备基本的监测WNV感染和应对的能力,努力将人医与兽医结合起来,提高全国公共卫生健康水平。
4.3利用大数据,建立WNF长期预警模型
目前疫病监测和防控耗费较大,应加强与公共搜索引擎合作,共享大数据,更全面、快速地收集流行病学资料(季节、地理、人口信息)和环境监测资料(传播媒介),研究气候变化与蚊子、鸟类、WNV的相关性,做到准确、快速评估风险,并做出疫病流行和暴发预警。同时,对WNF曾流行区域重点监控,防止疫情复发。
4.4确定理想的哨兵动物
在北美,通过对死亡鸟监测,人们发现鸦(Corvids)在WNF监测中发挥重要作用,提示应该重点监测湿地地区,及时报告附近出现异常死亡的野鸟,并对野鸟和留鸟进行调查[19]。但是,由于各地区气候、地理条件不同,导致野鸟种类各异。在适于WNV传播的地区,需要确定用于常规监测的哨兵宿主种类[16]。理想情况下,该物种要满足以下条件:数量大,易被蚊虫叮咬,能产生强效、长期的免疫应答,感染后存活。目前通过实验证实,可对死亡的麻雀、美洲家朱雀、日本白眼雀和爪哇雀进行WNV监测,同时可对感染后存活的家八哥、条纹鸽、斑点鸽进行血清学监测。
4.5政府与企业合作,加强疫苗、驱蚊剂的研发
目前无人用WNV疫苗及抗病毒药物正式获批。通过杆状病毒系统表达衣壳病毒样粒子有望制成疫苗。以登革热病毒DEN4和黄热病毒YF17D为载体制备的嵌合疫苗rWN/DEN4Delta30 和ChimeriVax-WN分别通过了一期和二期临床试验。DNA疫苗、通过合成肽技术制备登革热和WNFNS2B-NS3蛋白酶抑制剂正在研究之中[20-21]。腺苷酸抑制剂NITD008和组蛋白脱乙酰酶抑制剂Vorinostat联合使用可有效治疗WNV引起的脑炎[22]。目前美国推荐使用的驱蚊剂成分包括柠檬和桉树油、羟乙基哌啶羧酸异丁酯、DEET、IR3535等。因此,鉴于上述研究进展,仍需要利用分子生物学技术进一步加强新型疫苗的研发,同时推动新型高效、持久、对人体无害驱蚊剂的研制。
4.6加强宣传,突出防控重点
加强公众教育,既不制造过度紧张气氛,又要进一步提高人们对WNF风险的认识和自我保护意识。公开政府信息、鼓励人们上报异常情况,这有助于疫情、案例早发现、早报告、早防控。由于在WNF流行季节的高发地区,易感人群(婴儿、免疫缺陷、老年人群)感染后预后效果差,在易感人群感染WNV后,应对其重点治疗,提高预后效果。
[1] ColpittsT M,Conway M J,Montgomery R R,et al. West Nile Virus:biology,transmission,and human infection[J]. Clin Microbiol Rev,2012,25(4):635-48.
[2] Patel H,Sander B,Nelder M P. Long-term sequelae of West Nile virus-related illness: a systematic review[J]. Lancet Infect Dis,2015,15(8):951-959.
[3] Murray K O,Mertens E ,Despres P. West Nile virus and its emergence in the United States of America[J]. Vet Res,2010,41(6):67.
[4] Nash D,Mostashari F,Fine A,et al. The outbreak of West Nile virus infection in the New York City area in 1999[J]. N Engl J Med,2001,344(24):1807-1814.
[5] Reisen W K. Ecology of West Nile virus in North America[J]. Viruses,2013,5(9):2079-2105.
[6] Kleinschmidt-DeMasters B K,Beckham J D. West Nile Virus Encephalitis 16 Years Later[J]. Brain Pathol, 2015,25(5):625-33.
[7] Montgomery R R,Murray K O. Risk factors for West Nile virus infection and disease in populations and individuals[J]. Expert Rev Anti Infect Ther,2015,13(3):317-25.
[8] Centers for Disease Control and Prevention. West Nile Virus in the United States:Guidelines for Surveillance,Preventionand Control[EB/OL].(2013-08-12)[2016-07-15]. http://www.cdc.gov/westnile/resources/pdfs/wnvGuidelines.pdf.
[9] Mann B R,McMullen A R,Swetnam D M,et al. Molecular epidemiology and evolution of West Nile virus in North America[J]. Int J Environ Res Public Health,2013,10(10):5111-5129.
[10] Centers for Disease Control& Prevention. West Nile virus activity--eastern United States,2001[J]. MMWR Morb Mortal Wkly Rep,2001,50(29):617-619.
[11] De Filette M,Ulbert S,Diamond M,et al. Recent progress in West Nile virus diagnosis and vaccination[J]. Vet Res,2012,43:16.
[12] Centers for DiseaseControl& Prevention. Update:Detection of West Nile virus in blood donations--United States,2003[J]. MMWR Morb Mortal Wkly Rep,2003,52(38):916-919.
[13] Dalovisio J R. West nile virus infection in the United States:overview as a public health issue[J]. Ochsner J, 2003,5(3):11-12.
[14] USDA-APHIS. 2014 Summary of West Nile Virus Equine Cases in the United States[EB/OL].(2015-08-15)[2016-07-15].https://http://www.aphis.usda.gov/animal_health/downloads/ animal_diseases/2014_wnv_annual_final.pdf.
[15] Hahn M B,Monaghan A J,Hayden M H,et al. Meteorological conditions associated with increased incidence of West Nile virus disease in the United States,2004-2012[J]. Am J Trop Med Hyg,2015,92(5):1013-1022.
[16] Jutla A,Huq A,Colwell R R. Diagnostic approach for monitoring hydroclimatic conditions related to emergence of west nile virus in west virginia[J]. Front Public Health,2015,3:10.
[17] Qian F,Wang X,Zhang L,et al. Impaired interferon signaling in dendritic cells from older donors infected in vitro with West Nile virus[J]. J Infect Dis,2011,203(10):1415-1424.
[18] Chancey C,Grinev A,Volkova E,et al. The global ecology and epidemiology of West Nile virus[J]. Biomed Res Int,2015:376230.DOI:10.1155/2015/376230.
[19] Healy J M,Reisen W K,Kramer V L,et al. Comparison of the efficiency and cost of West Nile virus surveillance methods in California[J]. Vector Borne Zoonotic Dis,2015,15(2):147-155.
[20] Bastos L A,Behnam M A,El Sherif Y,et al. Dual inhibitors of the dengue and West Nile virus NS2B-NS3 proteases:Synthesis,biological evaluation and docking studies of novel peptide-hybrids[J]. Bioorg Med Chem, 2015,23(17):5748-5755.
[21] Yamshchikov V,Manuvakhova M,Rodriguez E. Development of a human live attenuated West Nile infectious DNA vaccine:Suitability of attenuating mutations found in SA14-14-2 for WN vaccine design[J]. Virology,2015,487:198-206.
[22] Nelson J,Roe K,Orillo B,et al. Combined treatment of adenosine nucleoside inhibitor NITD008 and histone deacetylase inhibitor vorinostat represents an immunotherapy strategy to ameliorate West Nile virus infection[J]. Antiviral Res,2015,122:39-45.
Case Analysis on the Outbreak,Prevention and Control of West Nile Virus in the United States
Shi Xueping1,Fan Xiaoxu2,Wu Xiaodong2,Zhang Yongqiang2,Li Lin2,Li Jinming2,Ge Shengqiang2,Wangzhiliang2,Ma Hongchao2
(1. Qingdao Agricultural University,Qingdao,Shandong266109;2. China Animal Health and Epidemiology Center,Qingdao,Shandong266032)
Since the West Nile virus(WNV)was reported in American for the first time,41 000 cases of clinical infection and 1 700 death cases have been found. During 1999 to 2012,the cumulative cost caused by reported hospitalized cases of West Nile disease(WND)in the whole country was about $778 million. Meanwhile,the economic burden was further aggravated because of the cost of the WND treatment and vaccination towards equine animals,as well as its surveillance. Aiming at the infection status,a series of prevention and control measures were adopted,such as establishing the national arbovirus monitoring system(ArboNET),controlling mosquitoes in the epidemic area,developing new diagnostic methods and implementing the vaccination program. However,there are more than 65 kinds of mosquitoes in the USA that can spread WNV. In addition,the WND transmission can also be caused by long-distance migration of migratory birds. These factors in combination with the seasons,climate and human factors,lead to difficulty of eradication of WND. Based on this case,some recommendations were given for its prevention and control in China,which included paying attention to the improvement of the surveillance system and laboratory testing methods towards exotic zoonosis,strengthening the capacity building of public health laboratory,establishing a long-term early warming model for WND by big data platform,identifying ideal sentinel animals,strengthening cooperation between governments and enterprises,strengthening the research and development of vaccine and vermifuge,strengthening the advocacy campaign so as to emphasize the key point of its control.
case analysis;zoonosis;West Nile virus;the United States;control measures
S851.3
A
1005-944X(2016)12-0007-05
10.3969/j.issn.1005-944X.2016.12.003
“十三五”国家重点研发计划“潜在入侵的畜禽疫病口岸监测技术研究”(2016YFD0501104)
并列第一作者:史雪萍、樊晓旭
王志亮、马洪超
(责任编辑:朱迪国)

