A型猪流感病毒TaqMan探针荧光RT-PCR检测方法的建立
王建华,陈小金,肖 妍,王玉玲,谭旭菲,赵 丹,张俊哲,陈本龙,王乃福,董志珍,赵祥平(天津出入境检验检疫局动植物与食品检测中心,天津 300456)
A型猪流感病毒TaqMan探针荧光RT-PCR检测方法的建立
王建华,陈小金,肖妍,王玉玲,谭旭菲,赵丹,张俊哲,陈本龙,王乃福,董志珍,赵祥平
(天津出入境检验检疫局动植物与食品检测中心,天津300456)
根据A型猪流感病毒(SIV)的基质蛋白(M)编码基因保守序列设计合成一对特异性引物和一条TaqMan探针,建立了一种检测A型SIV的荧光RT-PCR方法。结果显示,该方法对H1N1、H3N2和H9N2亚型SIV均呈特异性扩增,对猪瘟病毒、猪繁殖与呼吸综合征病毒、猪流行性腹泻病毒和猪传染性胃肠炎病毒等猪的其他常见病毒无交叉扩增反应;该方法对M基因RNA对照(SIV-M-RNA)的最适线性检测范围为3.8×101~3.8×108拷贝数/反应,标准曲线方程为Y= -3.4365X+40.091,相关系数(R2)为0. 999 8,最低检出限为38个拷贝数的SIV-M-RNA。对3个不同浓度(3.8×103~3.8×105copies /µL)的SIV-M-RNA进行组间和组内重复试验,每个浓度的Ct值变异系数均小于1.5%,具有良好的重现性。用该方法对860份进口猪的鼻拭子样本和78份国内猪场猪鼻拭子样本进行SIV检测,结果进口猪鼻拭子样本的SIV检测均为阴性,17份国内猪场猪鼻拭子样本SIV检测为阳性。本研究提供了一种快速、敏感和特异的A型猪流感病毒检测方法。
A型猪流感病毒;TaqMan探针;荧光RT-PCR
猪流感(Swine Influenza,SI)是由正粘病毒科A型流感病毒(SIV)引起的一种急性、高度传染性的猪呼吸道疾病[1]。猪群单一发病时,发病率高,但死亡率低,通常5~7天后快速康复但如果与猪繁殖与呼吸综合征(PRRS)、猪圆环病毒病(PCV)、猪传染性胸膜肺炎(APP)和猪支原体肺炎(MH)等病原混合或继发感染时,死亡率就会升高,导致经济损失增大[2]。目前SI为我国规模化养猪场普遍存在且难以根除的群发性疾病[3-5]。近年来SIV引发的流感病毒进化与公共卫生安全问题已受到国内外研究者的普遍关注,猪作为流感病毒的“混合器”在流感病毒新毒株的产生及跨种属障碍感染新宿主的过程中起着重要作用[6]。对SIV要做出准确诊断,需要借助实验室方法。由于目前诊断SIV的常规方法存在操作繁琐和诊断周期长等不足[7],近年来实时荧光定量PCR技术已用于SIV核酸的检测[8-9]。本研究基于保守的M基因建立了一种检测A型猪流感病毒的通用型TaqMan探针荧光RTPCR检测方法。
1 材料与方法
1.1材料
1.1.1病毒核酸及临床样本。H1N1、H3N2和H9N2亚型猪流感病毒核酸,H5N1禽流感病毒核酸,猪呼吸与繁殖综合征病毒、猪瘟病毒、猪流行性腹泻病毒和猪传染性胃肠炎病毒核酸,由天津出入境检验检疫局动植物与食品检测中心动物检疫实验室保存。938份猪鼻拭子样本,2012—2015年保存,其中860份鼻拭子样品来自美国和丹麦进口猪,78份鼻拭子样品来自国内疑似发病猪。
1.1.2主要仪器与试剂。Light Cycler® 480荧光PCR(Rochi)、5417R EPPENDORF冷冻离心机、ESCO CLASS ⅡBSC生物安全柜、TRIzol® LS Reagent,购自Invetrogent公司;TaKaRa ExTaqRDNA 聚合酶、PstI限制性内切酶、One Step PrimeScript™ RT-PCR Kit(Perfect Real Time),购自大连宝生物工程(大连)有限公司;质粒快速提取试剂盒,购自北京庄盟国际生物基因科技有限公司;Wizard SV Gel and PCR Clean-Up System、RiboMAXTMLarge Scale RNA Production System T7,购自Promega公司。其他试剂均为国内或进口分析纯试剂。
1.2方法
1.2.1设计合成引物及探针。从GenBank数据库(http://www.ncbi.nlm.nih.gov/)下载SIVM基因序列,进行生物学信息分析,选出高度保守且特异的区域,用Beacon Designer7.0软件设计特异引物和TaqMan探针,由上海百力格生物技术有限公司合成。5′端用HEX标记,3′端用BHQ1标记,引物和探针序列见表1,预期扩增片段长度为74 bp。
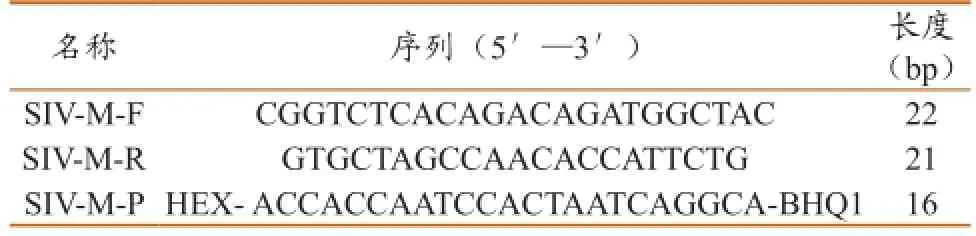
表1 引物与探针序列
1.2.2制备RNA标准对照。根据SIV M基因序列(KM028202 )设计4条引物,序列见表2。以SIVM1/SIVM2为模板,SIVMF/SIVMR为引物,按常规PCR方法扩增。将扩增产物用胶回收试剂盒回收后与PMD18-T克隆载体连接,转化至E. coli DH5α感受态细胞,挑选阳性重组克隆。以经PstI酶切线性化的插入SIV M基因靶序列的重组质粒DNA为模板,用RiboMAX Large Scale RNA Production System-T7试剂盒进行体外转录,对体外转录产物经RQ1 DNA酶消化及纯化,即制备成含有靶扩增序列的RNA标准对照,命名为SIV-MRNA。用核酸蛋白分析仪测定SIV-M-RNA的浓度。按相应公式换算出的拷贝数为3.8×108copies/µL。
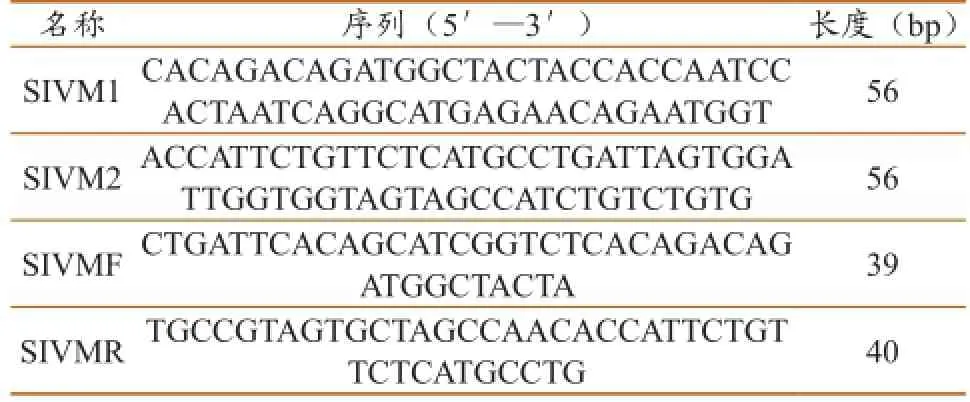
表2 用于制备RNA标准对照的寡核酸链
1.2.3提取总RNA。按常规TROZOL试剂方法,分别提取样本的总RNA,并于-80 ℃保存备用。
1.2.4优化荧光RT-PCR反应条件。使用One Step PrimeScript™ RT-PCR Kit(Perfect RealTime)试剂及其推荐的25 µL反应体系及扩增条件,以3.8×106copies/µL的SIV-M-RNA为模板,在Light Cycler® 480荧光PCR(Rochi)仪上,首先对不同浓度组合的引物和标记探针进行荧光RT-PCR方阵筛选试验,确定最适引物和探针使用浓度;然后在最适引物和标记探针浓度下,在56~61℃范围内,筛选最适的退火延伸温度。
1.2.5绘制标准曲线。将SIV-M-RNA用灭菌去离子水稀释成3.8×101~3.8×108copies /µL的浓度范围。每个稀释度分别取1 µL作为模板,在1.2.4优化的反应条件下进行荧光RT-PCR扩增。反应结束后以Ct值为横坐标、SIV-M-RNA模板起始拷贝数浓度的对数为纵坐标,绘制标准曲线。
1.2.6敏感性、重复性和特异性试验。将SIV-MRNA做10倍系列稀释。每个稀释度分别取1 µL作为模板,在1.2.4优化的反应条件下进行荧光RT-PCR扩增,确定该方法可以检出SIV-M-RNA的最低拷贝数;将3个稀释度(3.8×103~3.8×107copies /µL)的SIV-M-RNA为模板,按1.2.4优化的反应条件,分别进行组内和组间重复试验,确定该方法的可重复性;以SIV、CSFV、PRRSV、PEDV和TGEV的基因组RNA为模板,按1.2.4优化的反应条件,进行荧光RT-PCR扩增,同时设阴性对照,确定该方法的特异性。
1.2.7临床样本检测。对2012—2015年期间保存的938份猪鼻拭子样本,采用本研究建立的实时荧光RT-PCR方法进行SIV核酸检测,评价该方法的实用性。当Ct值小于37时判定为阳性,Ct值在37~40之间的判定为可疑;如重复试验结果的Ct值仍在37~40之间时判定为阴性,无Ct值时判定为阴性。
2 结果
2.1荧光RT-PCR反应优化条件
通过对不同浓度的引物和标记探针组合以及退火延伸温度的筛选试验,最后确定最适荧光RTPCR扩增条件为:在25 µL反应体系中,依次加入2×One Step RT-PCR bufferⅢ 12.5 µL,TaKaRa Ex TaqHS(5U/µL)0.5 µL,PrimeScript RT Enzyme MixⅡ0.5 µL,SIV-M-F(10.0 pmmol/µL)SIV-M-R(10.0 pmmol/µL)和SIV-M-P(4.0 pmmol/µL)各0.5 µL,SIV-M-RNA(×106copies /µL)模板1 µL,补足纯水至25 µL。反应参数为42 ℃ 5 min,95 ℃ 10 sec,然后95 ℃ 10 sec,60 ℃ 30 sec,45个循环。在每一次循环60 ℃退火结束前,采集HEX通道的荧光信号。在该优化荧光RT-PCR反应条件下,可获得典型的S型扩增曲线(图1)。
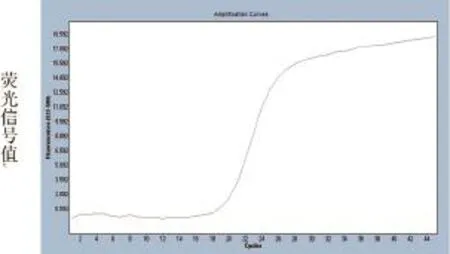
图1 SIV-M-RNA(3.8×106copies /µL)的实时荧光RT-PCR动力学曲线
2.2标准曲线
以3.8×101~3.8×108copies /µL的RNA标准对照为扩增模板,按优化反应条件进行荧光RT-PCR反应,扩增曲线见图2-A;以起始模板浓度的对数为X轴,Ct 值为Y轴绘制成的标准曲线见图2-B。Ct 值与RNA标准对照拷贝数之间的线性关系表达式为Y= -3.4365X+40.091,相关系数(R2)为0. 999 8,呈现良好的线性关系。
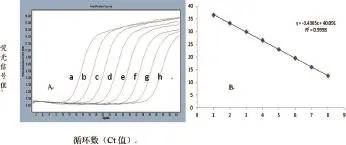
图2 SIV-M-RNA实时荧光RT-PCR扩增曲线(A)和标准曲线(B)
2.3敏感性试验
对不同稀释度的RNA标准对照,按优化后的反应条件进行荧光RT-PCR反应,扩增曲线见图2。由图2可知该方法最低可检出个38拷贝的RNA标准对照分子。
2.4重复性试验
选取3个浓度的RNA标准对照为模板,按优化的反应条件进行组内和组间重复试验。每个稀释度的Ct值和标准差(SD)及变异系数(CV)见表3。3个浓度的RNA标准对照的Ct值变异系数均小于1.0%,表明本试验所建立的荧光RT-PCR检测体系稳定,具有良好的重复性。

表3 实时荧光RT-PCR重复性试验结果
2.5特异性试验
以SIV、CSFV、PRRSV、PEDV和TGEV的基因组RNA为模板进行荧光RT-PCR扩增,扩增结果见图3。由图3可知,H1N1和H3N2亚型的SIV均呈特异性扩增,而CSFV、PRRSV、PEDV和TGEV的基因组RNA均无扩增曲线出现,表明该方法检测SIV核酸有良好的特异性。
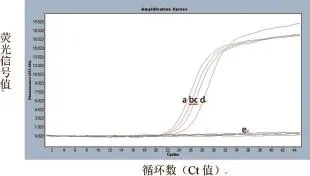
图3 荧光RT-PCR检测SIV的特异性
2.6临床样本检测
用该方法对2012—2015年保存的860份进口猪的鼻拭子样本和78份国内猪场猪鼻拭子样本进行SIV检测,结果见表4。由表4可知,860份进口猪鼻拭子样本的SIV检测结果均为阴性,在78份国内猪场猪鼻拭子样本中有17份为SIV检测结果阳性。

表4 938份实际样本的SIV实时荧光RT-PCR检测结果
3 讨论
一些研究表明,SIV作为一种猪呼吸道疾病综合症的原发性病原,在破坏猪呼吸道上皮的防御屏障后,极易使猪合并PRRSV、PCV2、肺炎支原体和胸膜肺炎放线杆菌感染或继发感染,从而导致呼吸道病程的延长和死亡率的增高,对猪群危害极大[2]。因此,对猪群SIV感染的监测可为调查猪呼吸道疾病综合症的病因及制定控制措施提供重要的病原学依据。此外,SIV不仅危害猪群,而且同时具有感染人和禽的潜力[6],因此SIV的检测具有重要的公共卫生意义。与传统的检测SIV方法相比,荧光RT-PCR检测SIV核酸技术具有快速而敏感的优势。目前国内研究人员已报道了多种检测SIV的荧光RT-PCR方法[8-9]。本试验建立的这种基于TaqMan 探针的通用型SIV荧光RT-PCR 检测方法具有良好的特异性,并显示出良好的定量线性关系和重复性。通过对860份进口猪的鼻拭子样本和78份国内猪场猪鼻拭子样本的SIV检测,结果表明本研究建立的通用型SIV荧光RT-PCR检测方法可用于临床中SIV的检测。
[1]杜宁,李德新,舒跃龙,等.猪流感病原学概述[J].病毒学报,2009,25(增刊):39-47.
[2]杨斌.规模化猪场猪呼吸道综合征的防控措施[J].中国猪业,2013(增刊2):141-144.
[3]李海燕,于康震,辛晓光,等.部分省市猪群猪流感的血清学调查及猪流感病毒的分离与鉴定[J].动物医学进展,2003,24(3):67-72.
[4]何淑仪,马骏,方博华,等.南地区猪场猪流感和甲型H1N1/2009流感病毒的血清学调查[J].中国预防兽医学报,2015,37(9):660-664.
[5]徐敏,贾春玲,杨德胜,等.广东省H1和H3亚型猪流感病毒抗体血清学调查[J].动物医学进展,2010,31(10):116-120.
[6]朱闻斐,舒跃龙.人感染猪流感病毒概述[J].病毒学报,2013,29(5):559-565.
[7]毕保良,李进涛.猪流感诊断技术研究进展[J].中国畜牧兽医,2009,36(10):179-183.
[8]张春明,乔传玲,陈艳,等.猪流感病毒M基因实时荧光定量PCR诊断方法的建立[J] .中国预防兽医学报,2008,30(10):805-809.
[9]徐敏,李志强,黄元,等.猪流感病毒一步法荧光定量RT-PCR诊断方法的建立[J].中国兽医科学,2011,41(10):1021-1025.
Development of a Real-time RT-PCR Assay with TaqMan Probe for Detecting Swine Influenza A Virus
Wang Jianhua,Chen Xiaojin,Xiao Yan,Wang Yuling,Tan Xufei,Zhao Dan,Zhang Junzhe,Chen Benlong,Wang Naifu,Dong Zhizhen,Zhao Xiaoping
(Animals and Plants and Food Inspection Center of Tianjin Entry-exit Inspection and Quarantine Bureau,Tianjin300456)
A Taqman probe-based real-time RT-PCR was developed with a pair of primers and a probe designed according to the conserved region of M gene sequence of swine influenza A virus (SIV). Results showed the assay was specific to detect subtype H1N1,H3N2 and H9N2 of swine influenza A virus and had no cross-reaction with classical swine fever virus(CSFV),porcine reproductive and respiratory syndrome virus(PRRSV),porcine epidemic diarrhea virus(PEDV)and transmissible gastroenteritis virus(TGEV). The real-time RT-PCR assay has a broad linear detection range for RNA standard control of M gene of SIV(SIV-M-RNA)from 3.8×101copies/µL to 3.8×108copies/µL,the standard curve equation was Y= -3.4365X+40.091,and the correlation coefficient of the assay was 0.999 8. This assay could detect 38 copies/µL of SIV-M-RNA at the lowest level. Three different concentrations of SIV-M-RNA were used to test the repeatability,and the coefficients of variation(CVs)of both inter-assay and intra-assay were less than 1.5%,showing good repeatability. 938 nasal swab samples were tested for SIV detection by the assay. No positivereaction was found for all 860 samples from imported pigs. 17 of 78 samples from domestic pigs were found to be positive for SIV detection. These results suggested that the newly established real-time RT-PCR would provide a rapid,sensitive and specific detection for swine influenza A virus.
swine influenza A virus;TaqMan probe;real-time RT-PCR
S852.65
B
1005-944X(2016)12-0085-04
10.3969/j.issn.1005-944X.2016.12.023
天津市科技支撑项目(13ZCZDNCO1300);天津市滨海新区惠民项目(2013-BK15H013)
(责任编辑:朱迪国)

