MK801对结肠癌细胞增殖、凋亡和迁移的影响
谢冬冰,孟建宇,郭玉婷,任霞,李雪
MK801对结肠癌细胞增殖、凋亡和迁移的影响
谢冬冰1,孟建宇2,郭玉婷3Δ,任霞4,李雪1
目的探究N-甲基-D-天冬氨酸受体亚型1(NMDAR1)在结肠癌细胞HT29和SW116中的表达,以及NMDAR1拮抗剂MK801对HT-29和SW116细胞生长抑制、凋亡和迁移的影响。方法采用免疫组织化学法检测结肠癌细胞HT-29和SW116细胞表面NMDAR1的表达;应用噻唑蓝(MTT)比色法测定62.5、125.0、250.0、500.0、1 000.0、2 000.0 μmol/L的MK801对于HT-29和SW116细胞增殖作用的影响;应用流式细胞术检测2 000 μmol/L的MK801对HT29和SW116细胞凋亡的影响;应用细胞划痕实验检测50 μmol/L MK801对于结肠癌细胞HT-29和SW116迁移能力的影响。结果结肠癌细胞HT-29和SW116均表达NMDAR1,且主要表达于细胞质中;各浓度的MK801对HT-29细胞,以及浓度为500.0、1 000.0、2 000.0 μmol/L的MK801对SW116细胞的生长抑制作用具有时间效应关系,24、48及72 h各MK801浓度组对HT-29和SW116细胞的抑制率随浓度升高整体呈增强趋势,但抑制率不呈明显的剂量效应关系;MK801具有促进HT-29和SW116细胞凋亡的作用,且主要表现诱导细胞早期凋亡;MK801可抑制HT-29和SW116细胞迁移。结论NMDAR1在结肠癌细胞胞质中表达,且NMDAR1拮抗剂MK801具有抑制肿瘤细胞生长、迁移,促进其早期凋亡的作用,有望成为新一代抗肿瘤药物。
结肠肿瘤;细胞增殖;细胞凋亡;细胞运动;体外研究;N-甲基-D-天冬氨酸受体亚型1;MK801;HT-29;SW116
脑肠肽是指在胃肠道和神经系统双重分布的肽类[1]。谷氨酸是哺乳动物中枢神经系统主要的兴奋性氨基酸,谷氨酸受体可分为离子型受体和G蛋白偶联的代谢型受体两大类[2]。N-甲基-D-天冬氨酸(N-Methyl-D-aspartate,NMDA)受体(NMDAR)为主要的离子型受体,其由NR1、NR2和NR3等亚基组成。NR1是NMDAR1的功能部分,构成离子通道[3]。近年来,越来越多的研究表明,NMDAR不仅在神经系统发育、疼痛感觉等中发挥着重要的作用,而且也参与了胃肠道组织细胞的增殖,被视为一种脑肠肽[4]。研究显示,NMDAR拮抗剂能抑制肿瘤细胞的增殖,并诱导肿瘤细胞的凋亡[5]。然而,有关NMDAR及其拮抗剂对于结肠癌作用的报道较少。MK801为非选择性NMDAR1拮抗剂,本文通过分析MK801对于结肠癌细胞HT-29及SW116增殖、凋亡、迁移作用的影响,探讨MK801用于结肠癌治疗的可行性。
1 材料与方法
1.1 主要试剂与仪器人结肠癌细胞株HT-29、SW116(中科院基础研究所,上海),MK801(MCE公司,美国),胎牛血清、DMEM培养基(Hyclone公司,美国),McCOY 5a培养基(吉诺生物医药技术有限公司),胰蛋白酶-EDTA消化液、噻唑蓝(MTT,Solarbio公司,中国),Rabbit Anti-NMDAR1、超敏二步法免疫组化试剂盒(武汉博士德生物工程有限公司),流式检测凋亡试剂盒AnnexinV-FITC Apoptosis DetectionKit I(BD公司,美国)。
1.2 方法
1.2.1 细胞培养人结肠癌HT-29细胞用McCOY 5a培养基,SW116细胞用DMEM培养基。培养基中均加入10%胎牛血清,同时加入100 U/mL青霉素、100 mg/L链霉素,接种至细胞培养瓶后,置于37℃、5%CO2培养箱中培养。取对数生长期细胞用于后续实验。
1.2.2 免疫组织化学法检测HT-29及SW116细胞表面NMDAR1的表达分别取对数生长期的HT-29和SW116细胞分别接种于24孔板,每种细胞均分为实验组和对照组,培养24 h待细胞贴壁后,吸弃培养液,磷酸盐缓冲液(PBS)洗细胞2次,5 min/次,加入4%多聚甲醛固定15 min,吸弃,PBS洗3次;加入0.3%的TritanX-100细胞打孔,室温10 min,吸弃,PBS洗3次;加入3%H2O210 min以灭活内源性酶,吸弃,PBS洗3次;加入5%BSA室温封闭30 min,吸弃。实验组加入NMDAR1抗体,4℃孵育过夜。对照组用PBS代替NMDAR1抗体。次日吸弃,PBS洗3次;加入二抗孵育30 min,吸弃,PBS洗4次;加入DAB试剂显色5 min,PBS终止,流水冲10 min,苏木精染核30 s,流水冲洗,1%乙醇盐酸返蓝,流水冲10 min,依次过体积分数85%、90%、95%、100%乙醇,二甲苯2次脱水,封片胶封片。显微镜下观察细胞染色情况,以细胞膜及细胞质染色为棕黄色至棕褐色为阳性反应。
1.2.3 MTT比色法检测MK801对HT-29和SW116细胞生长抑制的影响分别取处于指数生长期的HT-29和SW116细胞用胰酶进行消化,调整细胞浓度为1×105个/mL,以每孔100 μL接种于96孔板,培养24 h后弃去培养基,分别加入用培养基配置的浓度为62.5、125.0、250.0、500.0、1 000.0、2 000.0 μmol/L的MK801,以不加药物处理的细胞为对照组,继续培养24、48、72 h后,每孔加入5 g/L MTT 10 μL,并设置空白孔,37℃避光孵育4 h,弃去培养液,每孔加入100 μL的二甲基亚砜(DMSO),振荡15 min,酶标仪检测波长为492 nm的光密度(OD)值。计算细胞生长抑制率=(1-实验组OD值/对照组OD值)×100%。本实验每次设置3个复孔,重复实验3次。
1.2.4 流式细胞仪检测MK801对HT-29和SW116细胞凋亡的影响参照Annexin V细胞凋亡检测试剂盒说明书进行操作。HT-29和SW116细胞经2 000 μmol/L的MK801处理24 h,以未经药物处理的细胞为对照组,每组收集1×106个细胞,冷PBS洗涤2次,1 000 r/min离心3 min,弃上清液。将细胞重悬于500 μL的1×binding buffer,调整细胞浓度为1×106个/mL,取100 μL细胞置于流式细胞仪专用试管中,加5 μL AnnexinV FITC,避光室温反应15 min,加入5 μL碘化丙啶(PI)轻轻混匀,再加入400 μL 1×binding buffer,过滤膜,流式细胞仪检测凋亡情况。实验重复3次取平均值。
1.2.5 细胞划痕实验检测HT-29和SW116细胞体外迁移能力调整细胞密度为5×106个/mL,以每孔1 mL接种到12孔板上,培养24 h待细胞贴壁后,用10 μL枪头在孔板中央划1条宽度均一的划痕,PBS洗2遍以除去划下的细胞,加入培养基配置的50 μmol/L的MK801,以不加药物的培养基为阴性对照,拍照取样,记录划痕的位置。继续培养48 h,取相同位置拍照取样,用Pro-Plus软件计算细胞迁移前后划痕距离,并计算细胞迁移率=(迁移前距离-迁移后距离)/迁移前距离×100%,实验重复3次。
1.3 统计学方法采用SPSS 17.0软件进行统计学分析,所有计量资料以表示,2组间比较采用t检验,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 HT-29及SW116细胞中NMDAR1的表达情况NMDAR1在结肠癌HT-29和SW116细胞中均呈阳性表达,且主要表达于细胞胞质中,表现为细胞质中染色为棕黄色至棕褐色,而对照组仅表现为核染色,见图1。
2.2 MK801对HT-29及SW116细胞的生长抑制作用(1)组内随时间变化:除对照组外,各MK801浓度组对HT-29细胞的生长抑制率随时间延长呈增强趋势,而SW116细胞仅500.0、1 000.0及2 000.0 μmol/L组细胞生长抑制率随时间延长呈增强趋势,细胞生长抑制率具有时间效应关系(P<0.01),见表1、2。(2)各时点组间比较:24、48及72 h各MK801浓度组对HT-29和SW116细胞的生长抑制率随浓度升高整体呈增强趋势,但组间多重比较差异并非全部有统计学意义,抑制率不呈明显的剂量效应关系,见表1、2。
Tab.1The inhibitory effects of MK801 on the growth of HT-29 cells表1 MK801对HT-29细胞生长抑制的作用(n=3,%,)
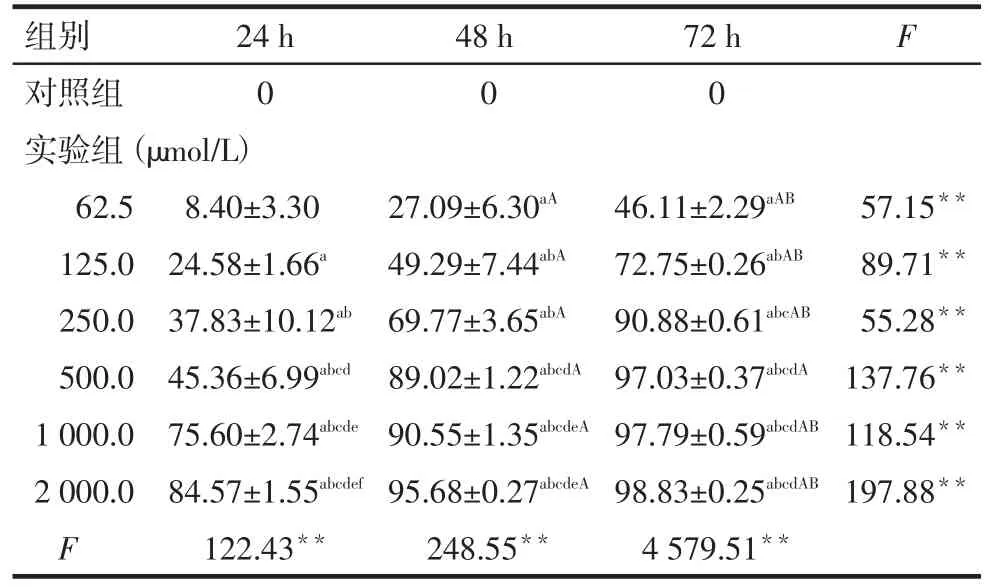
Tab.1The inhibitory effects of MK801 on the growth of HT-29 cells表1 MK801对HT-29细胞生长抑制的作用(n=3,%,)
**P<0.01,a~f分别表示与对照组、62.5、125.0、250.0、500.0及1 000.0 μmol/L组比较,P<0.05;A、B分别表示与24、48 h组比较,P<0.05,表2同
组别对照组实验组(μmol/L)62.5 125.0 250.0 500.0 1 000.0 2 000.0 F 24 h 0 48 h 0 72 h 0 F 8.40±3.30 24.58±1.66a 37.83±10.12ab 45.36±6.99abcd 75.60±2.74abcde 84.57±1.55abcdef 122.43**27.09±6.30aA 49.29±7.44abA 69.77±3.65abA 89.02±1.22abcdA 90.55±1.35abcdeA 95.68±0.27abcdeA 248.55**46.11±2.29aAB 72.75±0.26abAB 90.88±0.61abcAB 97.03±0.37abcdA 97.79±0.59abcdAB 98.83±0.25abcdAB 4 579.51**57.15**89.71**55.28**137.76**118.54**197.88**
Tab.2The inhibitory effects of MK801 on the growth of SW116 cells表2 MK801对SW116细胞生长抑制的影响(n=3,%,)

Tab.2The inhibitory effects of MK801 on the growth of SW116 cells表2 MK801对SW116细胞生长抑制的影响(n=3,%,)
组别对照组实验组(μmol/L)62.5 125.0 250.0 500.0 1 000.0 2 000.0 F 24 h 0 48 h 0 72 h 0 F 4.28±0.76a 13.83±2.05ab 18.91±1.42abc 24.58±2.14abcd 49.09±2.34abcde 78.58±1.08abcdef 901.58**7.81±3.49a 12.97±3.56a 23.16±2.67abc 50.60±2.42abcdA 66.32±4.73abcdeA 79.41±1.64abcdefA 321.24**6.76±1.90a 10.97±2.63a 23.04±2.26abc 45.33±2.88abcAB 80.79±1.66abcdeAB 84.36±1.56abcdeAB 885.579**1.80 0.81 3.68 90.86**73.95**73.95**
2.3 MK801对HT-29和SW116细胞凋亡的影响HT-29和SW116细胞中,实验组凋亡率均明显高于对照组(P<0.01),且主要为早期凋亡,见图2、表3。
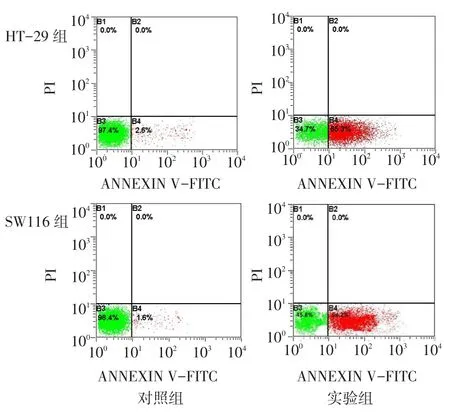
Fig.2The effects of MK801 on apoptotic rates of HT-29 and SW116 cells detected by Annexin V/propidium iodide staining图2 MK801对结肠癌HT-29、SW116细胞凋亡的影响
Tab.3Effects of MK801 on apoptosis and migration of HT-29 and SW116 cells表3 MK801对HT-29和SW116细胞凋亡和迁移能力的影响(n=3,%,)

Tab.3Effects of MK801 on apoptosis and migration of HT-29 and SW116 cells表3 MK801对HT-29和SW116细胞凋亡和迁移能力的影响(n=3,%,)
*P<0.05,**P<0.01
迁移率51.92±1.78 37.59±2.79 7.48**组别对照组实验组t HT-29凋亡率2.80±0.20 65.67±0.81 129.83**SW116凋亡率1.80±0.20 53.56±0.77 111.78**迁移率25.25±2.77 15.14±3.19 4.14*
2.4 MK801对HT-29细胞和SW116细胞迁移能力的影响HT-29细胞及SW116细胞中,实验组的迁移率均低于对照组(P<0.05),见表3、图3。

Fig.3Effects of MK801 on migration of HT-29 and SW116 cells(×100)图3 MK801对HT-29和SW116细胞迁移能力的影响(×100)
3 讨论
结直肠癌是消化系统常见的恶性肿瘤,美国2016年的癌症数据显示,结直肠癌在癌症发病率中位列第4,在癌症导致的死亡率中位于第2[6]。研究显示,在我国结直肠癌平均每年新发病例可达37.6万例,占全部恶性肿瘤发病的8.7%,居第5位;每年死于该病的患者有19.1万例,占由癌症导致死亡人数的6.7%,居第5位[7]。虽然伴随着分子生物技术的发展,对于结直肠癌的手术、化疗、放疗及分子靶向治疗方面取得了很大进展,但晚期患者由于发生多处转移,治愈率仍较低[8-9]。
NMDAR是兴奋性神经递质谷氨酸的离子型受体,主要存在于中枢神经系统中[1]。既往研究表明,NMDAR抑制剂对于肿瘤细胞具有抑制作用[10];而在消化道肿瘤的研究中,Watanabe等[11]研究表明,NMDAR可在胃癌细胞中表达,并且NMDAR拮抗剂能抑制胃癌细胞的增殖。Kim等[12]研究认为NMDAR拮抗剂能抑制食管癌的增殖。
本研究细胞免疫组织化学结果显示,HT-29细胞及SW116细胞胞质染色为棕黄色至棕褐色,表明结肠癌HT-29细胞及SW116细胞胞质中表达NMDAR1。细胞增殖实验显示,各浓度的MK801对HT-29细胞,以及浓度为500.0、1 000.0、2 000.0 μmol/L的MK801对SW116细胞的生长抑制作用具有时间效应关系,24、48及72 h各MK801浓度组对HT-29和SW116细胞的抑制率随浓度升高整体呈增强趋势,但抑制率不呈明显的剂量效应关系。细胞凋亡实验显示,实验组的凋亡率明显高于对照组,且主要表现为诱导细胞早期凋亡。细胞迁移实验显示,HT-29细胞及SW116细胞中,实验组的迁移率均低于对照组,表明MK801可抑制细胞迁移。该结果与Watanabe等[11]、Kim等[12]的研究结果相符。
另有研究认为,高浓度的Ca2+能促进肿瘤细胞的增殖,对于肿瘤细胞分化至关重要,而Ca2+对肿瘤细胞的形成过程也起着重要作用,并且影响细胞迁移[13]。本研究结果表明,NMDAR1在肿瘤细胞胞质中表达,并且NMDAR1拮抗剂MK801能抑制细胞的增殖、迁移,并促进细胞早期凋亡,而NMDAR1抑制剂的作用机制主要是通过抵抗细胞内的Ca2+浓度,从而降低肿瘤细胞Ca2+浓度,起到抑制细胞增殖、迁移,促进细胞凋亡的作用,因此,笔者认为MK801对肿瘤细胞的作用机制可能与Ca2+通道或Ca2+调节酶有关。
综上所述,谷氨酸离子型受体NMDAR1不仅在神经系统中表达,在外周组织细胞中亦有表达,可视为一种脑肠肽[1],而NMDAR1拮抗剂MK801对肿瘤细胞具有生长抑制作用,且可抑制肿瘤细胞迁移,并促进细胞早期凋亡,故其可能成为新一代的抗肿瘤药物,为临床治疗提供新途径。
(图1见插页)
[1]Okumura T.Brain-gut interaction in the pathophysiology of IBS[J]. Nihon Shokakibyo Gakkai Zasshi,2014,111(7):1334-1344.
[2]Blandford SN,Baldridge WH.The Effect of glutamate receptor agonists on mouse retinal astrocyte[Ca(2+)]i[J].Biomed Res Int,2016,2016:8178162.doi:10.1155/2016/8178162.
[3]Peltoniemi MA,Hagelberg NM,Olkkola KT,et al.Ketamine:A review of clinical pharmacokinetics and pharmacodynamics in anesthesia and pain therapy[J].Clin Pharmacokinet,2016,55(9):1059-1077.doi:10.1007/s40262-016-0383-6.
[4]Yamaguchi F,Hirata Y,Akram H,et al.FOXO/TXNIP pathway is involved in the suppression of hepatocellular carcinoma growth by glutamate antagonist MK-801[J].BMC Cancer,2013,13(1):468. doi:10.1186/1471-2407-13-468.
[5]Malsy M,Gebhardt K,Gruber M,et al.Effects of ketamine,s-ketamine,and MK 801 on proliferation,apoptosis,and necrosis in pancreatic cancer cells[J].BMC Anesthesiol,2015,15(1): 111.doi:10.1186/s12871-015-0076-y.
[6]Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.doi:10.3322/caac.21332.
[7]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.doi:10.3322/ caac.21338.
[8]Burotto M,Hartley ML,Marshall JL,et al.Future of targeted agents in metastatic colorectal cancer[J].Colorectal Cancer,2012,1(5): 433-443.doi:10.2217/crc.12.52.
[9]Zhou J,Li P,Xue X,et al.Salinomycin induces apoptosis in cisplatin-resistant colorectal cancer cells by accumulation of reactive oxygen species[J].Toxicol Lett,2013,222(2):139-145. doi:10.1016/j.toxlet.2013.07.022.
[10]Rzeski W,Turski L,Ikonomidou C.Glutamate antagonists limit tumor growth[J].Proc Natl Acad Sci USA,2001,98(11):6372-6377.doi:10.1073/pnas.091113598.
[11]Watanabe K,Kanno T,Oshima T,et al.The NMDA receptor NR2A subunit regulates proliferation of MKN45 human gastric cancer cells[J].Biochem Biophys Res Commun,2008,367(2):487-490.doi: 10.1016/j.bbrc.2007.12.167.
[12]Kim MS,Yamashita K,Baek JH,et al.N-methyl-D-aspartate receptor type 2B is epigenetically inactivated and exhibits tumorsuppressive activity in human esophageal cancer[J].Cancer Res,2006,66(7):3409-3418.doi:10.1158/0008-5472.CAN-05-1608.
[13]Roderick HL,Cook SJ.Ca2+signalling checkpoints in cancer: remodelling Ca2+for cancer cell proliferation and survival[J].Nat Rev Cancer,2008,8(5):361-375.doi:10.1038/nrc2374.
(2016-06-14收稿2016-07-13修回)
(本文编辑陆荣展)
Effects of MK801 on proliferation,apoptosis and migration of colorectal cancer cells
XIE Dongbing1,MENG Jianyu2,GUO Yuting3Δ,REN Xia4,LI Xue1
1 The Second Clinical College of Shandong University of TCM,Jinan 250014,China;2 The Institute of Technology of Shandong University of TCM;3 Department of Gastroenterology,the Second Affiliated Hospital of Shandong University of TCM;4 The Academy of Medical Science of Shandong Province△
ObjectiveTo explore the expression of the N-methyl-D-aspartate receptor type 1(NMDAR1)in the colorectal cancer cells(CRC),and to examine the effects of NMDAR1 antagonists MK801 on proliferation,apoptosis and migration of colorectal cancer cell line HT-29 and SW116 cells.MethodsThe immunocytochemistry method was used to examine the expressions of NMDAR1 in HT-29 and SW116 cells.MTT assay was used to detect the effects of MK801(62.5, 125.0,250.0,500.0,1 000.0,2 000.0 μmol/L)on the proliferation of HT-29 and SW116 cells.The flow cytometry was used to analyze the effect of MK801(2 000 μmol/L)on cell apoptosis of HT-29 and SW116 cells.Wound healing assay was used to detect the effect of MK801(50 μmol/L)on the migration of HT-29 or SW116 cells.ResultsThe NMDAR1 was expressed in both HT-29 and SW116 cells,and mainly in the cytoplasm.MTT assay showed that there were inhibitory effects of different concentrations of MK 801(62.5,125.0,250.0,500.0,1 000.0,2 000.0 μmol/L)on the proliferation of HT-29 cells,and inhibitory effects of different concentrations of MK801(500.0,1 000.0,2 000.0 μmol/L)on SW116 cells,in a time-dependent manner.For 24,48 and 72 h,the inhibitory effects of MK801 on proliferation rates of HT-29 and SW116 cells were increased with the increased concentrations of MK801.MK801 showed an effect to induce cell apoptosis in HT-29 and SW116 cells,and mainly for early apoptosis.Wound healing assay indicated that MK801 inhibited the cell migration of HT-29 and SW116 cells.ConclusionResults suggest that there is expression of NMDAR1 in colorectal cancer cells. The NMDAR1 antagonist MK801 can inhibit the proliferation,induce cells early apoptosis and inhibit cells migration.It maybe a new generation of antitumor drugs.
colonic neoplasms;cell proliferation;apoptosis;cell movement;in vitro;N-methyl-D-aspartate receptor subtype 1;MK801;HT-29;SW116
R735.35
A
10.11958/20160486
山东省自然科学基金资助项目(Y2008C141)
1山东中医药大学第二临床学院(邮编250014);2山东中医药大学理工学院;3山东中医药大学附属第二医院消化科;4山东省医学科学院基础所
谢冬冰(1990),女,硕士在读,主要从事消化道疾病诊治的研究
Δ通讯作者E-mail:zhmqlw@sina.com

