一株阿里地区产纤维素酶菌株的筛选与鉴定
何佳佳,关琳燕,刘小舟,周亚婷,文习东,林凌*
(安徽师范大学生命科学学院,安徽芜湖241000)
一株阿里地区产纤维素酶菌株的筛选与鉴定
何佳佳,关琳燕,刘小舟,周亚婷,文习东,林凌*
(安徽师范大学生命科学学院,安徽芜湖241000)
从西藏阿里地区冈仁波齐山脉附近筛选得到了一株产纤维素酶的细菌G1,经形态观察与16S rDNA的序列分析鉴定其为地衣芽孢杆菌(Bacillus licheniformis)。该菌株在30℃、pH 7的初始条件下培养76 h后产酶量达到最高,酶活力为0.3 U/mL。酶学性质研究表明,B.licheniformisG1所产纤维素酶的分子质量约为65 ku,其最适反应温度为55℃,在30~60℃范围内保持50%以上的活力;其最适反应pH为6.0,在pH 5.0~6.0范围内保持95%左右的酶活力;此外,Mn2+对其纤维素酶活力有明显的促进作用,而Cu2+、Mg2+、乙二胺四乙酸(EDTA)对该酶活有较强的抑制作用。
阿里地区;纤维素酶;地衣芽孢杆菌;酶学性质
西藏是我国传统的五大牧区之一,被誉为“世界屋脊”,而阿里地区是世界屋脊的屋脊,以高原寒带草原为主,生态系统以其自身的临界性和生物独特的适应机理为基本特征,分布着特有、珍稀的生物资源[1]。因此,开发阿里地区土壤微生物资源能为我国生物资源的保护和利用做出实质性的贡献。而纤维素材料是目前解决人类面临的粮食问题、能源问题和环境问题的最有前景的资源,研究开发纤维素资源有着深远的意义。纤维素酶是多组分酶系,能通过协同作用水解纤维素β-1,4葡萄糖苷键,使纤维素水解成为纤维二糖和葡萄糖[2]。目前,纤维素酶的应用已进入了食品、酿造、饲料、纺织、能源等工业领域,有关纤维素酶的应用途径仍在不断开拓,潜力很大[3]。在酿酒行业中,纤维素酶能提高酒类产品的出品率[4],而且地衣芽孢杆菌具有促进酿酒酵母产2-甲基丁酸和4-乙烯基愈创木酚等风味物质的功能,从而进一步提高酒的口感和品质[5]。因而产纤维素酶的地衣芽孢杆菌在酿酒行业中具有良好的应用前景。
从西藏阿里地区的冈仁波齐山脉附近土壤样品中筛选到了一株产中性纤维素酶的地衣芽孢杆菌(Bacillus licheniformis)菌株,并对其酶学性质进行初步研究,期望能为该酶在酿造工业和能源方面的开发和应用奠定一定的基础,并为丰富阿里地区生物资源库的工作提供实验方法和理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
土壤样品采集自西藏阿里地区冈仁波齐山附近,取样坐标为东经81.3°,北纬31°,海拔4 675 m。
1.1.2 试剂
刚果红染色液:称取刚果红粉末溶解于蒸馏水中,使其终质量浓度为1 g/L。
刚果红脱色液:终浓度为1 mol/L的NaCl溶液。
3,5-二硝基水杨酸显色剂(3,5-dinitrosalicylic acid,DNS):称取分析纯的NaOH 104 g,分析纯3,5-二硝基水杨酸30 g,分析纯酒石酸钾钠910 g,重蒸苯酚25 g和无水亚硫酸钠25 g溶于2 500 mL水,贮存于棕色瓶中,避光保存,放置一星期后过滤使用。
羧甲基纤维素钠(carboxymethylcellulose-Na,CMC-Na)溶液:准确称取1 g羧甲基纤维素钠并用pH 6.0磷酸二氢钠-柠檬酸缓冲液溶解定容至100 mL,配制成终质量浓度为10 g/L的CMC-Na缓冲溶液。
1.1.3 培养基
纤维素富集培养基(1 L):MgSO40.1 g,CaCl20.1 g,(NH4)2SO42.0 g,K2HPO42.0 g,KH2PO40.5 g,NaCl 6 g,琼脂15 g,CMC-Na 10 g,pH调节至7.0。
发酵液体培养基(1 L):酵母粉5 g,NaCl 10 g,蛋白胨10 g,CMC-Na 1 g,pH调节至7.4。
纤维素筛选培养基(1 L):在纤维素富集培养基中加入酵母粉1 g。
快速检验培养基:琼脂1.5%,CMC-Na 1%。
1.2 仪器与设备
iCycler型PCR仪:美国伯乐公司;SKY2102C型恒温摇床:上海苏坤实业有限公司;UV-1700型紫外分光光度仪:日本岛津公司;SW-CJ-2FD型超净工作台:苏州净化设备有限公司;5415D型台式高速离心机:德国Eppendorf公司;DHP-360型恒温培养箱:常州中捷实验仪器制造有限公司;超滤管(孔径为10 ku):MILLIPORE(中国)有限公司。
1.3 实验方法
1.3.1 产纤维素酶菌株初筛
量取100 mL的无菌水倒入带有玻璃珠的三角瓶中,称取土壤样品1g并充分混匀于无菌水中,形成10-2稀释液,然后再按10倍稀释法依次添加无菌水稀释成10-3、10-4、10-5、10-6的稀释液。取10-3、10-4、10-5三个稀释度的稀释液各0.1 mL涂布于纤维素富集培养基平板上,置入28℃恒温培养箱中倒置培养2d,初步筛选出能利用该纤维素的若干菌株。
1.3.2 产纤维素酶菌株复筛
待上述菌落长出后,用灭菌的牙签挑取生长良好的单一菌落依次点种于纤维素筛选培养基上,置入28℃恒温培养箱中倒置培养3 d,待长出菌落后,用刚果红染色液染色10 min,倒去染液后用适量1 mol/L的NaCl溶液脱色20 min,依据透明圈直径和菌落直径比值的大小来判断和选择高产纤维素酶菌株[6]。
1.3.3 细菌的分子鉴定
细菌基因组DNA的提取:将菌株接种到5mL培养基中,180 r/min,28℃培养过夜。取细菌培养液5 mL,10 000 r/min离心1 min后弃去上清液。用TIANGEN基因组纯化试剂盒提取筛选所得菌株的基因组DNA。
细菌16S rDNA基因扩增及分子鉴定:以菌株基因组DNA为模板,以16S rDNA通用引物进行PCR扩增,并将产物送至南京金斯瑞生物技术公司进行DNA序列测定,用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)中的BLAST软件将所得序列与GenBank数据库中的16S rDNA序列进行分析比较,并用MEGA7.0软件构建系统发育树。其中,引物序列为:27F:5′-AGAGTTTGATCC TGGCTCAG-3′,1492R:5′-TACGGY TACCTTGTTACG ACT T-3′。
1.3.4 摇瓶发酵实验
将分离得到菌种接种于5 mL发酵液体培养基中活化24 h后,按1%的接种量接种于100 mL发酵液体培养基中,于28℃、180 r/min摇床中进行摇瓶发酵90 h,同时测定菌液各阶段波长600 nm处的OD600nm值。将所得发酵液进行4℃、10 000 r/min离心10 min,收集上清液作为粗酶液用于各阶段的酶活测定。
1.3.5 纤维素酶活测定
葡萄糖标准曲线的绘制:分别吸取1 mg/mL的葡萄糖标准溶液0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL于比色管中,加入蒸馏水至2 mL,配制成一系列不同浓度梯度的葡萄糖溶液。充分摇匀后,向各管中加入2 mL DNS溶液摇匀后沸水浴5 min,取出冷却至室温后,用蒸馏水定容至20 mL,充分混匀。利用分光光度计在波长540 nm处测定各管溶液的光密度值并记录结果。以葡萄糖含量(mg)为横坐标,对应的吸光度值为纵坐标,绘制葡萄糖标准曲线。
酶活测定方法:取6个EP管,分别加入50 μL用0.2 mol/L pH 6.0的磷酸氢二钠-柠檬酸缓冲液配制的1%CMC-Na溶液,在实验组中加入50 μL适当稀释的酶液,分别于55℃反应1 h后,在对照组中加入100 μL DNS和50 μL适当稀释的酶液,实验组中加入100 μL DNS试剂终止反应,样品置于沸水浴中煮沸5 min,冷却后加入800 μL蒸馏水稀释定容至1 mL,以蒸馏水的吸光值为空白对照,于波长540 nm处测定该酶液的吸光度值,并根据标准曲线(y=0.975 5x+ 0.064 05)计算还原糖含量。以每分钟生成1 μmol葡萄糖所需的酶量作为一个酶活单位,计算出纤维素酶的酶活力,以U/mL表示[7]。
1.3.6 酶学性质研究
酶的最适温度测定是按照酶活测定方法,取适当稀释的酶液分别在30℃、40℃、45℃、50℃、55℃、60℃、70℃、80℃、90℃、100℃条件下测定酶活,以最高的酶活计为100%计算相对酶活力(%)。酶的热稳定性测定是将酶在上述不同温度条件下保温1 h,迅速冷却后,参照1.3.5酶活测定方法测定残余酶活力(%)。
酶的最适pH值测定是按照酶活测定方法,以不同缓冲液(pH值3.0~8.0为磷酸二氢钠-柠檬酸缓冲液,pH值9.0~11.0为甘氨酸-氢氧化钠缓冲液)校准浓缩酶液的pH值,在酶反应的最适温度条件下测定酶活力,最高酶活计为100%,参照1.3.5酶活测定方法计算各反应体系相对酶活。
酶促进剂和抑制剂研究是在相同条件下,向反应液中分别加入不同的离子或有机试剂,包括K+、Na+、Li+、NH4+、Cu2+、Co2+、Rb2+、Mg2+、Ca2+、Zn2+、Mn2+、二甲亚砜(dimethylsulfoxide,DMSO)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Triton X-100、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),使其终浓度为1 mmol/L,同时以不添加离子或有机试剂的反应液作为100%对照,在酶反应的最适条件下测定各离子对酶活力的影响,以残余酶活(%)表示。
1.3.7 蛋白质分子质量大小测定
纤维素酶蛋白的分离纯化(超滤法):取一定量菌液于离心管中,于高速冷冻离心机中8 000 r/min离心10 min后取上清作为粗酶液。取20 mL粗酶液分批加入滤膜孔径为10 ku的超滤管中依次离心(每次离心后弃去下层废液),最后得超滤后的浓缩酶1 mL,再稀释至7 mL备用(浓缩比为1∶20)。
非变性聚丙烯酰胺凝胶电泳:将十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)电泳体系[8]中的SDS均换成去离子水后,将超滤后的浓缩酶和非变性上样缓冲液1∶1混合后上样进行非变性凝胶电泳。待电泳完成后,取出凝胶,并将其放置在快速检验平板上孵育2 h后取出平板上的凝胶,用考马斯亮蓝染色30 min后用相应脱色液对其进行脱色处理。同时对快速检验平板进行刚果红染色10 min,再进行脱色处理。
SDS聚丙烯酰胺凝胶电泳:将非变性胶上与快速检验平板上检验出活性的相匹配条带切割下来,并切成颗粒状收集于EP管中,加入200 μL磷酸缓冲液于4℃静置24 h。取上清液和上样缓冲液1∶1混合后作为上样液进行电泳。待电泳完成后,取出凝胶用考马斯亮蓝染色30 min,用脱色液进行脱色处理。根据蛋白质分子质量标准,确定B.lincheniformisG1菌株所产纤维素酶的分子质量大小。
2 结果与分析
2.1 菌株的分离与鉴定

图1 菌株的菌落形态Fig.1 Colony morphology of strains
从西藏冈仁波齐附近的土壤中筛选得到的菌株菌落形态如图1所示,水解圈结果见图2。菌落呈乳白色,半干燥,边缘丝状分枝,其革兰氏染色呈阳性。如图2所示,菌株在纤维素筛选培养基上生长良好(图2a),经刚果红染色后形成了明显的透明水解圈(图2b),且水解圈直径与菌落直径的比值为1.7,表明菌株具有良好的产纤维素酶活性。

图2 筛选菌株的水解圈Fig.2 Hydrolyzation circle of the screened strains
2.2 菌株16SrDNA系统进化树的构建

图3 菌株的16S rDNA的电泳结果Fig.3 16S rDNA electrophoresis results of the strain

图4 B.lincheniformisG1的16S rDNA系统发育树Fig.4 Phylogenetic tree ofB.lincheniformisG1 based on 16S rDNA analysis
以菌株G1的总DNA为模板,以16S rDNA通用引物进行PCR扩增,并送至南京金斯瑞生物公司测序,扩增结果见图3。测序所获得的序列用BLAST在NCBI数据库中进行序列比对,最后使用MEGA 7.0中的Neighbor-joining法[9]构建系统发育树,结果见图4。由图4可知,该菌株与芽孢杆菌属(Bacillus)表现良好的同源性,且与地衣芽孢杆菌属(Bacillus licheniformis)同源关系最近,高达99%。同时结合图1中菌落的形态特征和测序结果,初步鉴定其为地衣芽孢杆菌(Bacillus lincheniformis),命名为B.lincheniformisG1。
2.3 摇瓶发酵与产酶曲线

图5 菌株的发酵产酶曲线Fig.5 Enzyme production curve of strain fermentation
对摇瓶发酵的各个阶段菌液吸光度值和纤维素酶活力进行测定,绘制菌株生长曲线与产酶曲线见图5。由图5可知,该菌的生长延滞期为8 h,从第12小时开始逐步进入对数生长期。培养48 h后该菌进入稳定期,并于第76小时逐渐进入衰退期。该菌的产酶曲线显示,在其处于延滞期时就开始产微量的纤维素酶,并在菌体的对数生长期逐渐积累纤维素酶,之后在菌体的稳定期仍然保持较高的产酶速率,且在第76小时纤维素酶积累量最多,酶活达到0.3 U/mL,为最高酶活的94%。随后,其产酶速率随着菌体生长的衰退而逐步下降。由此可以看出,该菌的产酶曲线与生长曲线保持一致,二者表现出耦联的特性。
2.4 蛋白质分子质量测定

图6 G1菌株的所产纤维素酶的凝胶电泳分析及酶谱Fig.6 SDS-PAGE and zymogram analyses of the cellulase from strainB.lincheniformisG1
通过蛋白质非变性凝胶电泳鉴定B.licheniformisG1菌株所产纤维素酶的酶谱,结果如图6所示。由图6可知,浓缩胶板上脱色后只有1条清晰的水解带,说明发酵粗酶液中只含有一种纤维素酶活性成分,对应的分子质量大小为65 ku左右,与已经克隆出来的地衣芽孢杆菌GXN 151的纤维素基因cel 5A编码的蛋白的分子质量(约59.6 ku)大小一致[10]。
2.5 酶学性质研究
2.5.1 酶的最适温度与热稳定性

图7 反应温度对酶活力的影响Fig.7 Effect of reaction temperature on enzyme activity
不同反应温度对酶活的影响结果如图7所示,该酶在55℃时的酶活力最高,达0.3 U/mL。此外,该酶在30~70℃时保持较高的酶活力,达最高酶活的40%左右。
将该酶在不同温度下保温1 h后,置于最适条件下反应测定纤维素酶活力,结果如图8所示。该酶在低温区(30~60℃)酶活力稳定性较好,有较高的耐受性,能保持50%以上的活力,当温度高于70℃时,酶活力迅速下降,表明该纤维素酶对此温度较为敏感,容易变性丧失活性。

图8 酶的热稳定性Fig.8 Thermal stability of cellulase
2.5.2 酶的最适pH
测定酶在不同pH缓冲液中的酶活力,结果如图9所示。由图9可知,该酶在pH值6.0的条件下酶活力最高,说明这是一类中性纤维素酶。此外,该酶在pH值为5.0~6.0之间表现高达95%左右的纤维素酶活力,这一点对反应中酶活性的控制具有重要意义。
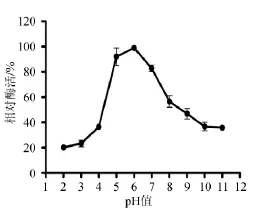
图9 pH对酶活力的影响Fig.9 Effect of pH on enzyme activity
2.5.3 金属离子对酶活力的影响
在pH值6.0、最适温度55℃的条件下测定各离子和有机试剂对纤维素酶活力的影响,以不加金属离子的酶活设为100%,结果如图10所示。由图10可知,NH4+、Ca2+、Mn2+、SDS均对该酶有促进作用,其中Mn2+促进作用最明显,达到了120%。而Cu2+、Mg2+、EDTA对酶活有较强的抑制作用,其他离子对酶的作用不明显。
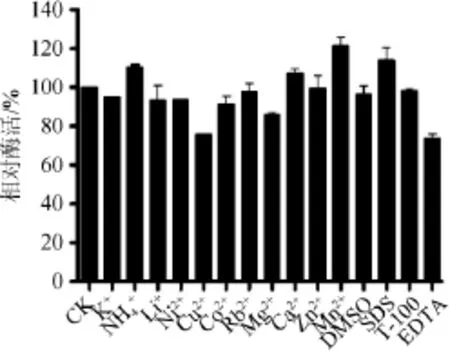
图10 金属离子对酶活力的影响Fig.10 Effect of metallic ions on enzyme activity
2.6 讨论
现如今,利用纤维素生产乙醇已经掀起了全世界研究的热潮[11],通过统合生物加工技术,在天然产醇菌株如酿酒酵母中重组表达纤维素酶使之能利用纤维素产醇[12-13],能够有效地降低成本。有研究表明,在混合培养发酵体系中添加地衣芽孢杆菌,能够影响酿酒酵母的乙醇及有机酸代谢,这对于白酒品质调控及微生物间相互作用都具有重要意义[14]。本实验中的B.lincheniformisG1菌株其摇瓶培养时纤维素酶积累量最高为0.3 U/mL单位的酶活力,与已报道的地衣芽孢杆菌LY02菌株按1.5%接种量时所产纤维素酶的活力(诱变前为0.535 1 U/mL,诱变后0.718 7 U/mL)较为接近,而且所产的纤维素酶表现出更好的耐热性(30~70℃)和更大范围的pH适应性(pH 5.0~8.0)[15]。
3 结论
本实验从西藏阿里地区的冈仁波齐山脉附近土壤中筛选得到一株产纤维素酶菌株,通过形态学与分子生物学鉴定,确定该菌株为地衣芽孢杆菌(Bacillus licheniformis),命名为B.lincheniformisG1。对B.lincheniformisG1所产纤维素酶的酶学性质研究后发现,其所产纤维素酶的分子质量约为65 ku,该酶最适温度为55℃,最适pH值为6.0,属于中性纤维素酶。同时,该酶的温度耐受范围较广,能在30~60℃范围内保持50%以上的活力;在pH 5.0~6.0范围内保持95%左右的酶活力,因而对于偏酸性的环境较为适应。此外,大多数的离子与有机试剂对该酶的活力影响不大,其中Mn2+对酶活力有明显的促进作用,而Cu2+、Mg2+、EDTA对该酶活力表现出抑制作用。
本实验所采集的B.lincheniformisG1菌株的栖息地——西藏阿里地区,位于我国西部,区内高寒缺氧,自然条件恶劣,生物资源开发利用较少,因此在能源和资源的利用上存在较大的空白,可为阿里地区生物资源的综合开发和利用做出重要的贡献,并且有望在酿酒和能源行业中发挥实质性的作用。
[1]张英.西藏阿里高寒草原四种牧草根际促生菌资源筛选及促生机理研究[D].兰州:甘肃农业大学,2013.
[2]ZHANG Y H P.Reviving the carbohydrate economy via multi-product lignocellulose biorefineries[J].J Ind Microbiol Biot,2008,35(5):367-375.
[3]刘森林,邢苗,刘刚,等.碱性纤维素酶革兰氏阴性菌株筛选及酶学性质研究[J].微生物学通报,2005,32(4):91-94.
[4]邓天福,杜开书,李广领.纤维素酶及其在酿造业中的应用[J].中国酿造,2011,30(12):17-19.
[5]凌杰.白酒酿造中地衣芽孢杆菌与酿酒酵母的相互作用及应用研究[D].无锡:江南大学,2013.
[6]KIM J M,KONG I S,YU J H.Molecular cloning of an endoglucanase gene from an alkalophilicBacillussp.and its expression inEscherichia coli[J].Appl Environ Microb,1987,53:2656-2659.
[7]江国忠.高产纤维素酶枯草芽孢杆菌的筛选、应用及其产酶条件研究[D].南昌:南昌大学,2010.
[8]Sambrook J H,RUSSELL D W.Molecular cloning:a laboratory manual [M].北京:科学出版社,2002:31-37.
[9]邵娜娜,轩换玲,罗锋,等.一株产低温纤维素酶放线菌的分离与产酶研究[J].食品工业科技,2015,36(24):159-163,168.
[10]刘永生,冯家勋,段承杰,等.能降解天然纤维素的地衣芽孢杆菌GXN151的分离鉴定及其一个纤维素酶基因(cel5A)的克隆和测序分析[J].广西农业生物科学,2003(2):132-138.
[11]杨华军,邹少兰,刘成,等.纤维素酶在酿酒酵母中的表达研究[J].中国生物工程杂志,2014(6):75-83.
[12]HAHN-H GERDAL B,GALBE M,GORWA-GRAUSLUND M F,et al. Bio-ethanol-the fuel of tomorrow from the residues of today[J].Trends Biotechnol,2006,24:549-556.
[13]LYND L R,ZYL W H V,MCBRIDE J E,et al.Consolidated bioprocessing of cellulosic biomass:an update[J].Curr Opin Biotechnol, 2005,16(5):577-583.
[14]孟醒,吴群,徐岩.酿酒酵母与地衣芽孢杆菌相互作用及基于蛋白组学的作用机制分析[J].微生物学通报,2015(9):1679-1688.
[15]余祖华,丁轲,侯奎,等.产纤维素酶地衣芽孢杆菌的诱变选育及其产酶条件优化[J].中国畜牧兽医,2016(4):1006-1011.
Screening and identification of a cellulase-producing strain from Ngari prefecture
HE Jiajia,GUAN Linyan,LIU Xiaozhou,ZHOU Yating,WEN Xidong,LIN Ling*
(College of Life Sciences,Anhui Normal University,Wuhu 241000,China)
A cellulase-producing bacterium,named as G1,was isolated from the soil of the Kangrinboqe Mountains in Ngari prefecture of Tibet.The strain was identified asBacillus licheniformisaccording to the morphological identification and 16S rDNA sequence analysis.The optimized enzyme production could be obtained when the strain was cultivated for 76 h at 30℃with initial pH 7,and the maximum cellulase activity was 0.3 U/ml.The property analysis demonstrated that the molecular weight of the cellulase produced byB.licheniformisG1 was 65 ku,and its optimum reaction condition was temperature 55℃,pH 6.0.Moreover,the enzyme maintained more than 50%of its activity in the range of 30-60℃,and 95%of CMCase activity was obtained at the pH range of 5.0-6.0.Furthermore,Mn2+had obvious promoting effect on cellulase activity,while Cu2+,Mg2+,EDTA had strong inhibitory effect on the enzyme activity.
Ngari prefecture;cellulase;Bacillus licheniformis;enzymatic property
Q816
0254-5071(2016)11-0064-05
10.11882/j.issn.0254-5071.2016.11.013
2016-06-02
安徽省自然科学基金资助项目(1208085QC56);《分子生物学》国家级质量工程双语教学示范课程资助项目(高教函[2009]19号)
何佳佳(1995-),女,本科生,研究方向为微生物学。
*通讯作者:林凌(1980-),男,副教授,博士,研究方向为酶学。

