原发性颅内脑膜血管肉瘤1例报告并文献复习☆
游鸿海 梅文忠 吴喜跃 黄志鹏 康德智
·论 著·
原发性颅内脑膜血管肉瘤1例报告并文献复习☆
游鸿海*梅文忠*吴喜跃*黄志鹏*康德智*
目的 探讨原发性颅内血管肉瘤的流行病学、临床特点及诊治方法。方法回顾性分析我院1例原发性颅内脑膜血管肉瘤患者的病因、临床症状、影像学表现、治疗方法及随访情况,并检索相关文献,进行文献复习及总结分析。结果 患者,女,30岁,以“突发头痛伴左侧肢体麻木”就诊,颅脑影像学检查示:右顶叶占位。经过规范的手术治疗,术后放化疗以及贝伐珠单抗靶向治疗,病理结果提示:血管肉瘤。患者术后7个月出现颅内脑膜血管肉瘤复发伴颅高压危象并出现肺部转移,再次行手术切除颅内病灶,于发病10个月后因“全身多脏器功能衰竭”死亡。结论 原发性颅内血管肉瘤的发病率极低;临床表现主要与肿瘤所在的部位、大小等有关;确诊方法主要依靠术后病理。手术切除是治疗颅内血管肉瘤的首选方法,术后放疗、替莫唑胺化疗以及抗血管生成靶向药物治疗的效果仍不理想。
原发性中枢神经系统肿瘤 血管肉瘤 脑膜
血管肉瘤是指发生于血管、淋巴管内皮细胞的恶性肿瘤,其发生部位以皮肤、软组织以及肝脾、乳腺、骨等组织器官常见。而原发性中枢神经系统血管肉瘤(primary angiosarcoma of the central nervous system)是一种极为罕见的颅内肿瘤病理类型,在我国仅有数例颅内血管肉瘤的病例报道[1],而起源于脑膜的血管肉瘤在全球仅见1例报道[2]。原发性中枢神经系统血管肉瘤是一种富血管的高度恶性肿瘤,容易局部复发,预后差。我们对福建医科大学附属第一医院神经外科1例原发性颅内脑膜血管肉瘤患者进行病例报告及文献复习。
1 资料
患者,女,30岁,以“突发头痛伴左侧肢体麻木1 d”为主诉入院。既往史、个人史、家族史无特殊。检查:神志清楚,颈强直,左侧肢体浅感觉稍减退,四肢肌力、肌张力正常,双侧巴氏征阴性。颅脑MRI示:右顶叶近圆形不均匀等长T1、等长T2信号灶,周围可见明显指状水肿,增强扫描病灶明显强化,中心呈星状未强化区,左顶部脑膜增厚强化(图1)。头颅CTA:右顶部团块状高密度灶,边缘清楚,形态规则,可见钙化,周边脑实质大片状水肿,可见供血动脉及回流静脉,考虑富血供肿瘤,脑膜瘤?血管周细胞瘤?(图1)。

图1 患者术前颅脑MRI平扫+增强:平扫相(图D)示右顶叶近圆形不均匀等长T1、等长T2信号灶,周围可见明显指状水肿;增强相(图A-C)示病灶明显强化,中心呈星状未强化区,左顶部脑膜增厚强化。颅脑CTA(图E-F):右顶部团块状高密度灶,边缘清楚,形态规则,可见钙化,周边脑实质大片状水肿,可见供血动脉及回流静脉
完善术前准备后,于入院后10d行手术切除治疗。术中见肿瘤瘤体质韧呈黄褐色,表面血管怒张,血供极丰富,包膜与周围脑组织粘连、浸润,瘤体大小约2 cm×3 cm,予完整切除。术后复查颅脑MRI示右顶叶肿瘤全切除。术后病理所见:右顶叶大脑镰旁肿物,镜下见肿瘤细胞弥漫生长,伴有弥漫性出血、大片状坏死,脑组织内可见肿瘤浸润,排列成片,小巢、条索、血窦样及原始血管结构;部分细胞呈梭形,部分细胞呈上皮样;细胞异型性明显,胞浆丰富,核分裂易见;免疫组化标记:CD31、Fli、F8、SMA、Vim、S-100(+);CD34内皮细胞(+);CD68灶(+);Syn、CD56、GFAP胶质(+);EMA、CKp、CAM5.2(-);Ki-67(+,5%)。首都医科大学宣武医院病理科示:免疫组化标记CD31(+),F8(+),GFAP(-)。结合临床及影像,诊断脑膜血管肉瘤。见图2。
术后予规范化放射治疗,配合75mg/(㎡.d)替莫唑胺化疗,贝伐珠单抗靶向治疗(每两周10mg/ kg)。患者术后7个月出现颅内脑膜血管肉瘤复发伴颅高压危象(图3),并出现肺部转移,再次行手术切除颅内病灶(图3),于发病10个月后因“全身多脏器功能衰竭”死亡。
2 讨论
原发于中枢神经系统的血管肉瘤十分罕见。目前病因仍不明,可能与外伤、淋巴水肿、放疗、异物、化学物质以及各种感染有关,其分子生物学基础很可能与抑癌基因K-ras和P53突变有关[3]。有研究发现,所有血管肉瘤均有原癌基因ets-1和基质金属蛋白酶-1(MMP-1)mRNA及其蛋白的高表达,在向周围浸润的癌细胞和受侵组织中有原癌基因ets-1的转录,因此ets-1可能与血管肉瘤的侵袭性有关,并且可能通过上调MMP-1的转录而发挥作用[4]。另有人发现血管肉瘤可有碱性成纤维生长因子及其受体的表达,从而认为血管肉瘤内皮细胞可合成碱性成纤维生长因子,后者在肿瘤生长和侵袭中发挥重要作用[5]。因此,原癌基因ets-1和碱性成纤维生长因子在肿瘤生长和侵袭中发挥作用。本例是1名放疗科医生,因此推测长期暴露射线之中可能是导致疾病发生的原因之一。
血管肉瘤约占成人恶性肿瘤的1%,原发于颅内的血管肉瘤仅有0.5%,男女发病比例3:1,发病年龄2周~72岁,平均年龄38岁,发生于幕上脑实质的居多,常见于顶叶。经文献检索,近26年来报道了约22例颅内血管肉瘤[6],包括成人及小儿,发生于脑膜的仅有1例报道[2]。国内在2012年前无病例报道,近5年共报道4例,而本例是国内首例报道原发于脑膜的血管肉瘤病例。
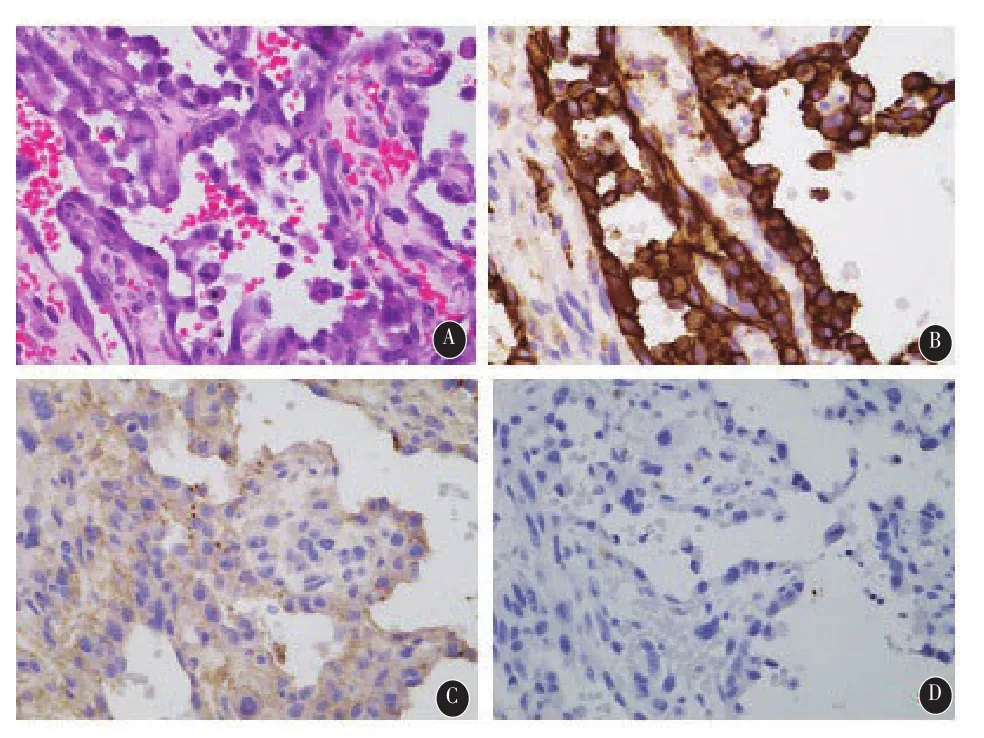
图2 术后病理图片(×400):HE染色(图A)见肿瘤细胞弥漫生长,伴有弥漫性出血、大片状坏死,脑组织内可见肿瘤浸润,排列成片,小巢、条索、血窦样及原始血管结构;部分细胞呈梭形,部分细胞呈上皮样;细胞异型性明显,胞浆丰富,核分裂易见;免疫组化:CD31(+)(图B),F8(+)(图C),GFAP(-)(图D)

图3 术后7个月颅脑MRI及颅脑CT示(图A-B):颅内脑膜血管肉瘤复发伴颅高压危象;肺部CT(图C)示双肺多发转移灶
颅内血管肉瘤的临床表现多样化,多与发生部位有关,常因出血而急性起病,文献报道的原发性脑内血管肉瘤可发生于额、颞、顶、枕叶以及后颅窝,以单发为主,多发少见。林亚洲等[7]报道了1例原发性脑内血管肉瘤为多发颅内病灶合并双肺及肝内多发转移。原发性脑内血管肉瘤的影像学还是具有一定的特征:CT平扫呈高密度肿块,其内可见斑点状钙化,CT增强扫描呈边缘明显强化及中心低密度区(出血),磁共振T1WI显示相同于灰质信号肿块,周围以低信号环与正常脑组织区分;T2WI显示肿块内出血呈低信号,周围脑组织水肿[8]。
本例的影像学表现与此类似,此外功能成像对该肿瘤的鉴别诊断亦有一定的价值:DWI常提示实性部分呈明显高信号;MRS常显示肿瘤实性部分CHO值未见明显升高,较正常区域稍有减低,但CHO/NAA比值较正常区域升高,提示肿瘤实性部分细胞增殖活跃,但尚未达到中枢神经系统高级别肿瘤波谱诊断标准。本例患者与脑膜关系密切,术前被误诊为右顶脑膜血管周细胞瘤,回顾性分析二者的影像学特点,血管周细胞瘤的CT平扫呈略高密度,病灶内不出现钙化,MRI信号变化复杂,T1WI呈等或等低信号,T2WI呈高混杂信号;肿瘤区血供丰富,有的能见到流空血管信号;增强扫描肿瘤明显不均匀强化,其内坏死囊变灶未见明显强化[9]。此外,颅内血管肉瘤还经常与富血管的脑膜瘤、海绵状血管瘤、出血性转移瘤及高级别胶质瘤等相混淆。
原发性颅内血管肉瘤的预后差,其平均存活时间约为6个月至2年,5年生存率为7%~10%。手术后常复发,转移多见,局部淋巴结、肺、肝、脾为常见转移部位,大多数患者因肿瘤广泛转移而死亡[10]。本例患者于术后7个月出现颅内脑膜血管肉瘤复发伴颅高压,并出现肺部转移,最终因“全身多脏器功能衰竭”死亡。
原发性颅内血管肉瘤在2016年WHO中枢神经系统肿瘤国际分类(ICD-O)中编码为9120/3[11],未明确级别。光镜下见大量高分化血管组织、异型内皮细胞及灶状坏死,大面积含铁血黄素沉积。肿瘤性的血管向周围的胶原纤维和脂肪组织浸润,是高分化血管肉瘤的诊断要点,而坏死是低分化血管肉瘤的另一典型组织学特征。免疫组织化学常为FⅧ-AG、CD31、CD34、vWF呈弥漫性阳性,即可确立诊断。
原发于颅内的血管肉瘤尚无理想的治疗方法,目前首选手术。目前术后放化疗方案是:术后予60 Gy的放疗,合并使用替莫唑胺75mg/(㎡·d)及贝伐单抗(10 mg/kg)2周,并给予替莫唑胺及贝伐单抗维持性治疗[12]。本例患者经手术治疗后进行规范的放化疗以及贝伐单抗治疗,术后7个月仍出现颅内脑膜血管肉瘤复发伴颅高压危象,以及肺部转移,于发病10个月后因“全身多脏器功能衰竭”死亡。原发性颅内血管肉瘤的预后差,虽经规范的综合治疗后生存期仍低,术后辅助治疗的效果仍不肯定,替莫唑胺由于能透过血脑屏障,可能取得良好的效果,使用贝伐单抗治疗颅内血管肉瘤鲜有报道过,尚在摸索阶段。
[1]刘文广,管伟,左建东,等.综合治疗原发性脑内血管肉瘤一例报道并文献复习[J].中华神经医学杂志,2014,13(3):306-307.
[2]MENA H,RIBAS JL,ENZINGER FM,et al.Primary angiosar⁃coma of the central nervous system.J Neurosurg 1991,75():73-76.
[3]BALAMURALIG,PLESSISDG,WENGOYM,etal. Thorotrast-induced primary cerebral angiosarcoma:case report [J].Neurosurgery,2009,65:210-211.
[4]NAITO S,SHIMIZU K,NAKASHIMA M.Overexpression of Ets-1 transcription factor in angiosarcoma of the skin[J].Pathlo Res Parct,2000,196(2):103-109.
[5]YAMAMOTO T,UMDA T,YOKOZEKI H,et al.Expression of basic fibroblast growth factor and its receptor in angiosarcoma[J]. J Am Acad Dermatol,1999,41(1):127-129.
[6]KRISTINE JOYCE LINAY,MARIE CHRISTINE BERNARDO, EPHRAIM MARANAN,et al.A rare case of primary CNS an⁃giosarcoma presenting as an incomplete gerstmann syndrome:a case report and review of literature[J].Neuro Oncol,2014 Nov,16 (suppl 5).
[7]林亚洲,王开磊,陈迎春,等.原发性脑内血管肉瘤1例[J].转化医学电子杂志,2014,1(4):167.
[8]李庆国,李莹,李海峰,等.原发性脑内血管肉瘤一例[J].中华放射学杂志,2012,46(7):664-665.
[9]唐姗姗,陈燕萍,余国威,等.颅内血管周细胞瘤的影像学分析[J].临床放射学杂志,2010,29(2):256-258.
[10]ANA T,LUISA M,IVAN B,et al.Primary angiosarcoma of the pericardium:case report and review of the literature[J].Kardiol Pol,2010,68(7):802-803.
[11]杨学军,江涛.解读《世界卫生组织中枢神经系统肿瘤分类(2016年)》[J].中国神经精神疾病杂志,2016,42(6):321-329.
[12]HACKNEY JR,PALMER CA,RILEY KO,et al.Primary cen⁃tral nevous system angiosarcoma:two case report[J].J Med Case REP,2012,6(1):251.
(责任编辑:甘章平)
R651
A
10.3969/j.issn.1002-0152.2016.09.008
☆福建省临床重点专科建设项目经费资助(编号:2012-SLCZD-2)
*福建医科大学附属第一医院神经外科(福州350005)
�(E-mail:13705964171@163.com)
2016-05-18)

