产后抑郁与血清皮质醇及糖皮质激素受体基因启动子甲基化的相关性
王 崴, 穆 鑫, 王延明, 陈 策, 马青艳, 贾 敏, 姜文慧, 朱 峰
(1西安交通大学第一附属医院精神心理科,西安 710061; 2西北妇女儿童医院生殖中心; 3延安大学附属医院妇产科; 4西安交通大学第一附属医院转化医学中心;*通讯作者:E-mail:zhufeng0714@163.com)
产后抑郁与血清皮质醇及糖皮质激素受体基因启动子甲基化的相关性
王 崴1, 穆 鑫2, 王延明3, 陈 策1, 马青艳1, 贾 敏1, 姜文慧1, 朱 峰4*
(1西安交通大学第一附属医院精神心理科,西安 710061;2西北妇女儿童医院生殖中心;3延安大学附属医院妇产科;4西安交通大学第一附属医院转化医学中心;*通讯作者:E-mail:zhufeng0714@163.com)
目的 研究产后抑郁患者糖皮质激素受体基因启动子甲基化改变及下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴功能的改变及可能机制。 方法 应用爱丁堡产后抑郁量表,评估产后42-56 d产妇抑郁水平,筛选出22名产后抑郁症妇女和26名人口统计特征匹配的健康产妇,开展病例对照研究。应用酶联免疫吸附法检测晨起血清基础皮质醇的改变和低剂量地塞米松抑制后血清皮质醇的改变。应用重亚硫酸盐测序法检测外周血糖皮质激素受体(glucocorticoid receptor,GR)基因启动子1F区甲基化改变。 结果 与健康对照相比,产后抑郁患者血清基础皮质醇水平显著升高(P<0.001);而在3.5 μg/kg地塞米松抑制后,产后抑郁患者血清皮质醇下降幅度减弱(P<0.001)。产后抑郁患者外周血GR基因启动子1F区甲基化水平显著升高(P<0. 001)。此外,Spearman相关分析表明GR基因1F启动子区整体甲基化水平与地塞米松抑制后血清皮质醇下降显著负相关(r=-0.589 4,P=0.002),而与血清基础甲基化水平无显著相关性(P>0.05)。 结论 产后抑郁患者伴随HPA轴功能增强,而GR基因1F启动子区甲基化上调和该基因表达下调削弱HPA轴负反馈调控是HPA轴功能上调的潜在机制。
产后抑郁; 下丘脑-垂体-肾上腺轴; 糖皮质激素受体; DNA甲基化
产后抑郁(postpartum depression)是产妇分娩后2-4周逐渐显现,维持6-8周甚至更久的,以情绪低落为主要特征的精神障碍[1]。近年来,受生活压力增加及分娩年龄推迟等因素影响,产后抑郁的患病率在我国呈上升趋势。过去10年,流行病学研究揭示中国大陆地区产后抑郁的患病率从14%增加至约20%[2,3]。产后抑郁严重危害产妇身心健康,降低母亲抚育能力,阻碍新生儿生长发育,并对整个家庭产生负性影响[1]。以往研究认为性激素改变引起的神经内分泌系统紊乱是产后抑郁发生的病理基础[4,5]。此外,机体下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴紊乱是促进产后抑郁发生的重要机制[6-8]。回顾文献,我们发现以往对产后抑郁患者血清内HPA轴相关激素的研究,主要关注清晨皮质醇基线水平改变,且结果并不一致[7,8]。皮质醇受到机体节律周期调节,并对外界应激刺激敏感,其分泌受较多因素影响[9]。相比基础皮质醇水平,地塞米松抑制试验(dexamethasone suppression test,DST)后皮质醇的变化是HPA轴活性的敏感指标,并可反应HPA轴负反馈功能[10];在重度抑郁症患者中,该试验检测出明显异常的皮质醇调控改变,是标记抑郁状态的稳定分子改变[10]。而在产后抑郁中,该试验检测意义尚不清楚。最后,尽管已经发现产后抑郁伴随出现HPA轴紊乱,但是该神经内分泌轴失调的潜在机制并不清楚。近年来,发现人糖皮质激素受体(glucocorticoid receptor, GR)启动子1F甲基化修饰是影响GR表达和调控HPA轴功能的重要分子机制[11,12],而其在产后抑郁HPA轴功能改变中的潜在作用尚未被研究。本研究以清晨基础血清皮质醇改变为指标分析产后抑郁患者HPA轴功能改变,并探索HPA轴功能紊乱中涉及的GR负反馈抑制机制及GR受体基因启动子甲基化修饰机制。
1 材料与方法
1.1 研究对象
选取2015年度在郧西县妇幼保健院和延安大学附属医院分娩的243名产妇,于产后42-56 d进行随访,筛选出22名产后抑郁产妇和26名健康产妇。根据产后抑郁诊断标准[13]:①爱丁堡产后抑郁量表(Edinburgh postnatal depression Scale,EPDS)评分≥13分。②随访时,产妇符合美国精神病学会DSM-Ⅳ中产褥期抑郁症的诊断标准,即符合以下5条或5条以上症状特征:心境低落或情绪抑郁;兴趣缺乏或丧失,没有愉悦感;较分娩刚结束时,体重下降大于10%;睡眠质量差、失眠或嗜睡;精神运动性兴奋或阻滞;有疲劳感或乏力感;感到生活毫无意义或有自责、自罪感;认知能力减退或注意力难以集中;反复出现死亡念头。
1.2 血清标本采集和皮质醇定量
产后抑郁和健康对照患者禁食至少8 h后,于次日早晨7 ∶00-8 ∶00在医院从肘静脉采集4 ml外周血,2 ml血保存于含肝素钠的采血管中,-20 ℃用于后续DNA分析。另外2 ml血保存于普通生化采血管中,3 000 r/min下离心10 min,取上清液,转移至离心管,并保存于-80 ℃下直至皮质醇浓度测定。基础状态血清采集后第3天晚11 ∶00,两组产妇按照3.5 μg/kg剂量服用地塞米松;并于第4天清晨7 ∶00-8 ∶00再次采集血清。采用商品化酶联免疫吸附试验试剂盒(英国Abcam公司;货号:ab108665)测定血清中皮质醇浓度。检测的敏感度为2.44×10-6g/L,批次内变异≤9%,批次间变异≤9.8%。地塞米松服药后,血清皮质醇下降值超过5×10-6g/L,视为个体对药物抑制有反应[14]。
1.3 重亚硫酸盐测序
从抑郁患者及对照中,根据随机对照表每组随机挑选12名个体,开展外周血GR基因1F启动子区亚硫酸盐测序分析。应用北京天根公司全血DNA提取试剂盒提取外周血基因组DNA。应用Nanodrop 2000分光光度计测定DNA浓度。取800 ng DNA进行亚硫酸盐转化(德国Qiagen公司,Epitech Bisulfite试剂盒)。对重亚硫酸盐修饰后的DNA,应用针对GR基因1F启动子区的特异性引物进行巢式聚合酶链式反应(polymerase chain reaction,PCR)扩增。第一轮PCR正反向引物分别为:5′-GTGGTGGGGGATTTG-3′和5′-ACCTAATCTCTCTAAAAC-3′;第二轮PCR正反向引物分别为5′-TTTTTGAAGTTTTTTTAGAGGG -3′和 5′-AATTTCTCCAATTTCTTTTCTC -3′。扩增产物为321 bp的DNA片段,包含39个CpG二核苷酸[15]。PCR反应产物经过20 g/L琼脂糖凝胶电泳分离后,切下含有目的DNA片段凝胶,经过回收和纯化,将目的片段克隆进质粒并转染进感受态大肠杆菌中。菌液涂布至培养平板,每个样本挑选30个阳性克隆,进行过夜摇菌。提取细菌DNA后,应用ABI 3730测序仪,针对目的片段进行序列测定。
1.4 统计学处理

2 结果
2.1 病例和对照之间人口统计资料比较
与对照组相比,产后抑郁组在年龄、民族、体质量指数、受教育年限、抑郁病史、吸烟和饮酒情况、月收入、过去孕产史、分娩方式和喂养方式上无显著差异(P>0.05,见表1)。
表1 病例组与健康对照组人口统计学特征比较
Table 1 Comparison of clinical features between the cases and the healthy controls
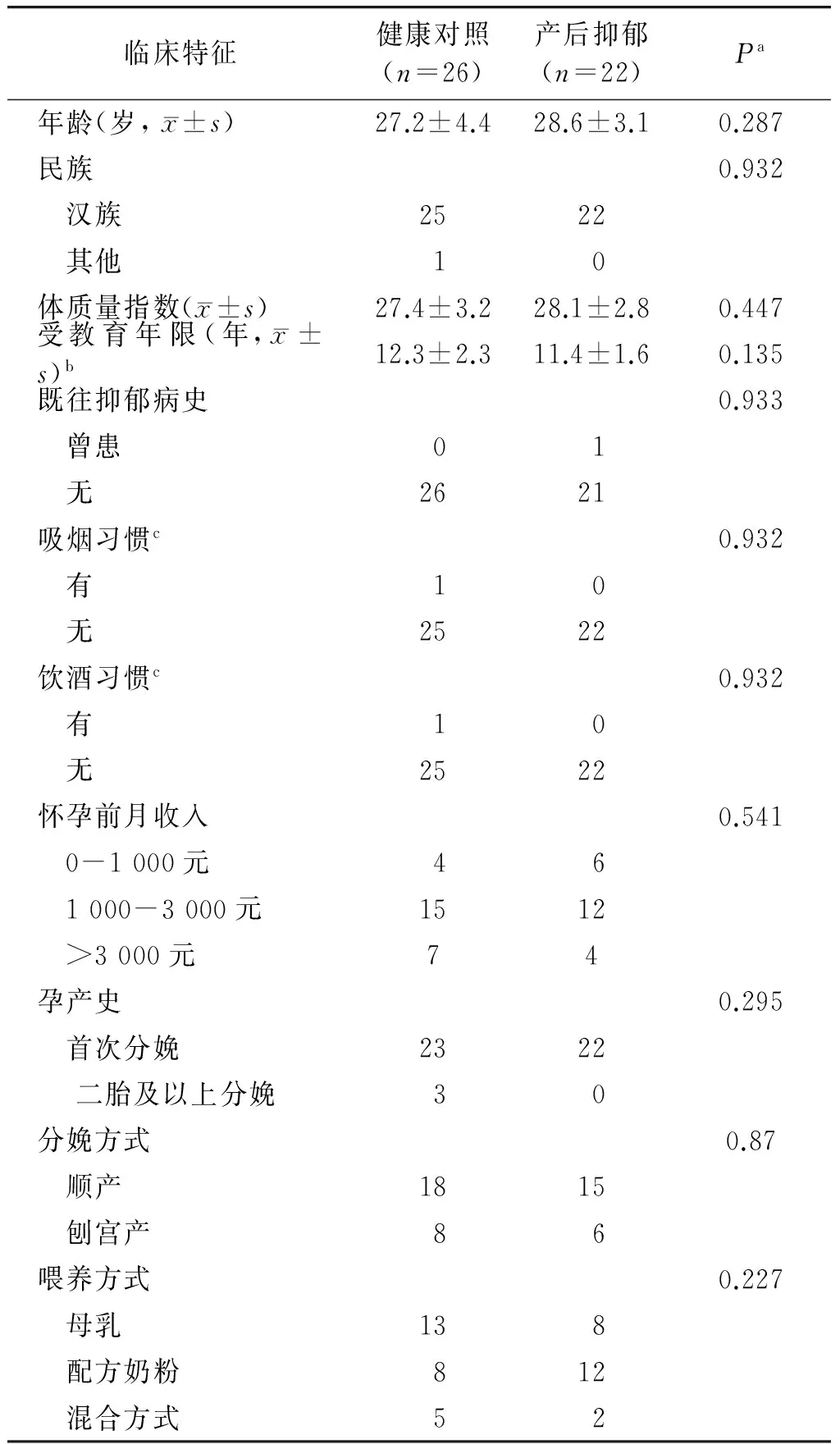
临床特征健康对照(n=26)产后抑郁(n=22)Pa年龄(岁,x±s)27.2±4.428.6±3.10.287民族0.932 汉族2522 其他10体质量指数(x±s)27.4±3.228.1±2.80.447受教育年限(年,x±s)b12.3±2.311.4±1.60.135既往抑郁病史0.933 曾患01 无2621吸烟习惯c0.932 有10 无2522饮酒习惯c0.932 有10 无2522怀孕前月收入0.541 0-1000元46 1000-3000元1512 >3000元74孕产史0.295 首次分娩2322 二胎及以上分娩30分娩方式0.87 顺产1815 刨宫产86喂养方式0.227 母乳138 配方奶粉812 混合方式52
a应用卡方检验、Mann-WhitneyU检验或t检验计算P值;b从小学开始计算;c怀孕前3年内的吸烟和饮酒习惯
2.2 病例和对照之间血清皮质醇的比较
产后抑郁患者清晨血清基础皮质醇水平与健康对照相比显著上调[(25.6±5.1)×10-5g/Lvs(16.7±4.8)×10-5g/L,P<0.001];地塞米松抑制后,抑郁患者血清皮质醇下降值较对照组显著减少[(4.0±1.2)×10-5g/Lvs(5.9±1.6)×10-5g/L,P<0.001,见图1]。此外,抑郁产妇中对低剂量地塞米松抑制有反应个体的比例显著低于对照组[4/22vs15/26,P=0.013]。
2.3 GR基因启动子甲基化与血清皮质醇的相关性
与健康对照相比,产后抑郁患者GR基因启动子1F区内第4、13、30、31、32个CpG二核苷酸位点胞嘧啶甲基化水平显著增加(P<0.05),多重检验校正后仍具有统计学意义(P<0.001)。此外,抑郁患者GR基因1F区整体甲基化水平也较对照上调(P<0.001)。GR基因1F区整体甲基化水平与地塞米松抑制后血清皮质醇浓度显著负相关(r=-0.589 4,P=0.002),而与血清基础皮质醇水平无显著相关(P>0.05,见图2)。
3 讨论
应激在抑郁状态的发生和维持中均发挥了重要作用。皮质醇释放是机体面对应激的正常反应,也是应激激活HPA轴功能的生理指标[16]。皮质醇释放后,通过激活盐皮质激素受体和糖皮质激素受体产生神经内分泌调控,引发消化、代谢、循环等机能改变,以适应应激刺激[16]。适度的皮质醇是机体应对应激的正常反应,而持久和过度的皮质醇释放则是多种疾病发生的基础。本研究发现产后抑郁状态的产妇血清基础皮质醇浓度显著高于无抑郁状态产妇,提示产后抑郁伴随肾上腺分泌功能增强。血清皮质醇与围生产期抑郁的关系研究由来已久,然而结果并不一致[17]。最近的一项综述回顾过去20余年已经开展的47项相关研究,指出肾上腺皮质醇症增多(hypercortisolemia)与一过性抑郁状态有关,而肾上腺皮质醇减少症(hypocortisolemia)则与慢性产后抑郁相关[17]。我们的研究仅发现产后抑郁患者晨起血清基础皮质醇上调,这些数据不足以判断个体是否具有皮质醇增多症。机体皮质醇主要在白天分泌,觉醒后1 h内分泌达到高峰,然后逐渐减少,个体间生物节律差异是血清皮质醇水平个体间差异的重要来源[16]。皮质醇分泌的波动要求多时点动态记录其变化,方可明确分泌方式和分泌量特征,然而受到患者依从性和血清皮质醇检测手段制约,实现较困难。近年来有应用唾液皮质醇替代血清皮质醇进行研究的趋势,然而唾液皮质醇对肾上腺皮质醇分泌的代表性受到一定质疑[18]。HPA轴负反馈调控是维持血清皮质醇稳定的重要生理机制,而其负反馈失调也是多种精神疾病发生的基础[19],因此在分析产后抑郁患者血清基础皮质醇改变之外,探索其中HPA轴负反馈失调机制,对深入理解产后抑郁发生的病理机制具有重要意义。
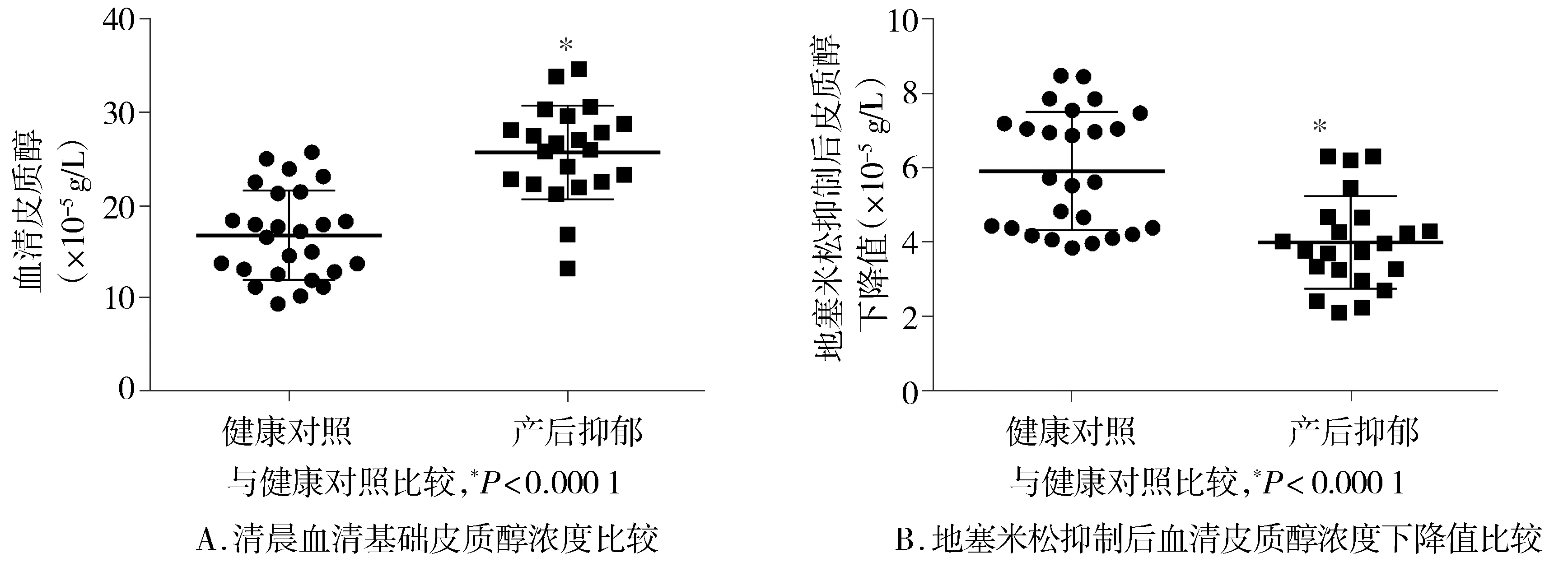
图1 产后抑郁患者血清基础皮质醇浓度及低剂量地塞米松抑制后血清皮质醇的改变Figure 1 The basal serum cortisol concentration and the changes of cortisol after dexamethasone treatment in the patients with postpartum depression and the healthy controls
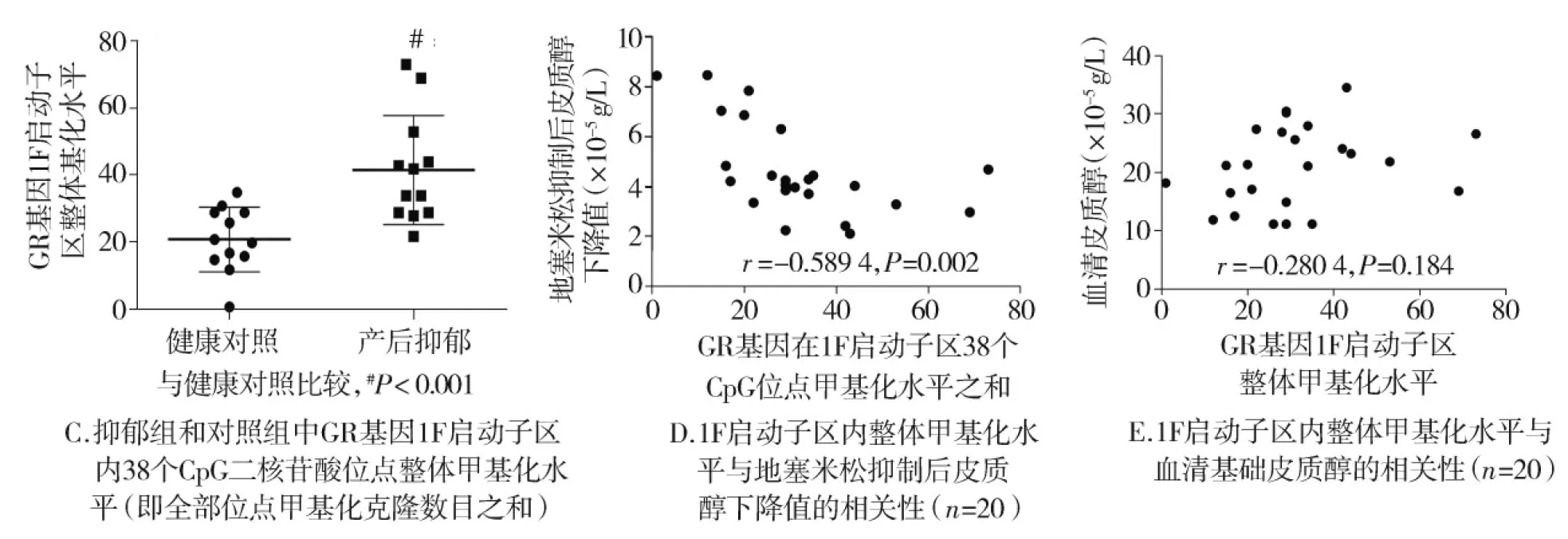
图2 产后抑郁患者外周血GR基因1F启动子区甲基化修饰改变及其与血清基础皮质醇和地塞米松抑制后皮质醇的相关性 Figure 2 DNA methylation alteration of GR gene 1F promoter in peripheral blood of PPD patients and its correlations with basal serum cortisol concentration and the decrease of cortisol after dexamethasone treatment
我们应用DST评估抑郁症患者HPA轴抑制功能。正常情况下低剂量地塞米松可以通过激活垂体GR发挥对肾上腺皮质醇分泌功能的抑制作用。HPA轴功能正常时,DST后个体血清基础皮质醇往往有大于5×10-5g/L的下降幅度,被视为DST反应阳性[10,14]。而在HPA轴功能受损时,DST后血清皮质醇改变常表现异常。之前研究证实低剂量地塞米松对重症抑郁患者血清皮质醇的抑制能力减弱[10],与之相似,我们发现产后抑郁患者HPA轴负反馈抑制功能显著削弱。表现为:①低剂量地塞米松抑制后DST阳性表现者的比例下降;②DST后血清皮质醇下降值显著减少。这些结果说明产后抑郁患者与普通重型抑郁有相似的HPA轴功能失调机制。此外,这些结果也提示下丘脑对肾上腺负反馈抑制功能减弱是抑郁发作后血清皮质醇过度分泌的基础。目前对产后抑郁发生中HPA轴负反馈功能紊乱的机制认识仍然非常有限,以往研究已经证实在HPA轴功能调控中GR受体发挥了核心作用。皮质醇升高后可在多个水平上抑制其过度增加,以保证内环境稳定。皮质醇可直接激活海马和垂体的GR进而降低HPA轴活性,也可间接作用于脑皮质边缘结构来削弱HPA轴活性。因此我们猜测GR功能失调可能是产后抑郁患者HPA轴功能削弱的原因。
通过重亚硫酸盐测序,我们发现产后抑郁患者外周血GR基因1F启动子区域甲基化水平上调。DNA甲基化是一种重要的表观遗传机制,该修饰水平升高与基因表达抑制密切相关。以往研究证实外周血GR基因1F启动子区域甲基化水平上调与自杀、抑郁、双相障碍、创伤后应激障碍和生命早期社会应激显著相关[20-22]。而生命早期创伤性经历是产后抑郁的重要风险因素[23]。这些发现提示,生命早期经历对GR基因的表观修饰可能是后期产后抑郁易感性增加的原因。尽管我们仅研究了外周血GR基因甲基化修饰,然而以往研究揭示脑内GR基因甲基化修饰与外周血相似[24]。此外,GR基因甲基化上调可降低GR基因表达。甲基化修饰的CpG位点阻遏了转录因子NGFI-A与基因组结合从而抑制转录起始[25]。由于地塞米松通过垂体激活GR,削弱ACTH产生来抑制HPA轴活性。因此启动子甲基化引起的GR表达下调,可能干扰地塞米松抑制作用。我们发现GR基因1F启动子区整体甲基化水平与DST后血清皮质醇下降显著相关,也证实了这种猜测。
综上所述,我们的结果发现产后抑郁患者伴随HPA轴活性增强,而GR基因1F启动子区甲基化上调和该基因表达下调削弱HPA轴负反馈调控是HPA轴功能上调的潜在机制。
[1] Goodman SH.Depression in mothers[J].Annu Rev Clin Psychol,2007,3:107-135.
[2] 周雅,徐济达.南京巿产后抑郁的发生率及相关影响因素研究[J].江苏卫生保健,2009,11(4):41-42.
[3] 张荣莲,陈起燕,李艳华.产后抑郁症发病因素的探讨[J].中华妇产科杂志,1999,34(4):231-233.
[4] Hendrick V,Altshuler LL,Suri R.Hormonal changes in the postpartum and implications for postpartum depression[J].Psychosomatics,1998,39(2):93-101.
[5] McCoy SJ,Beal JM,Watson GH.Endocrine factors and postpartum depression.A selected review[J].J Reprod Med,2003,48(6):402-408.
[6] Yim IS,Glynn LM,Schetter CD,etal.Risk of postpartum depressive symptoms with elevated corticotropin-releasing hormone in human pregnancy[J].Arch Gen Psychiatry,2009,66(2):162-169.
[7] Jolley SN,Elmore S,Barnard KE,etal.Dysregulation of the hypothalamic-pituitary-adrenal axis in postpartum depression[J].Biol Res Nurs,2007,8(3):210-222.
[8] Glynn LM,Davis EP,Sandman CA.New insights into the role of perinatal HPA-axis dysregulation in postpartum depression[J].Neuropeptides,2013,47(6):363-370.
[9] Madalena KM,Lerch JK.Glucocorticoids and nervous system plasticity[J].Neural Regen Res,2016,11(1):37-41.
[10] Sher L,Oquendo MA,Burke AK,etal.Combined dexamethasone suppression-corticotrophin-releasing hormone stimulation test in medication-free major depression and healthy volunteers[J].J Affect Disord,2013,151(3):1108-1112.
[11] Turecki G,Meaney MJ.Effects of the social environment and stress on glucocorticoid receptor gene methylation:A systematic review[J].Biol Psychiatry,2016,79(2):87-96.
[12] Li-Tempel T,Larra MF,Sandt E,etal.The cardiovascular and hypothalamus-pituitary-adrenal axis response to stress is controlled by glucocorticoid receptor sequence variants and promoter methylation[J].Clin Epigenetics,2016,8:12.
[13] Thombs BD,Benedetti A,Kloda LA,etal.Diagnostic accuracy of the Edinburgh Postnatal Depression Scale(EPDS) for detecting major depression in pregnant and postnatal women:protocol for a systematic review and individual patient data meta-analyses[J].BMJ Open,2015,5(10):e009742.
[14] Watson S,Gallagher P,Smith MS,etal.The dex/CRH test-is it better than the DST[J].Psychoneuroendocrinology,2006,31(7):889-894.
[15] Yehuda R, Flory JD,Bierer LM,etal.Lower methylation of glucocorticoid receptor gene promoter 1F in peripheral blood of veterans with posttraumatic stress disorder[J].Biol Psychiatry,2015,77(4):356-364.
[16] Tsigos C,Chrousos GP.Hypothalamic-pituitary-adrenal axis,neuroendocrine factors and stress[J].J Psychosom Res,2002,53(4):865-871.
[17] Seth S,Lewis AJ,Galbally M.Perinatal maternal depression and cortisol function in pregnancy and the postpartum period:a systematic literature review[J].BMC Pregnancy Childbirth,2016,16(1):124.
[18] Poll EM,Kreitschmann-Andermahr I,Langejuergen Y,etal.Saliva collection method affects predictability of serum cortisol[J].Clin Chim Acta,2007,382(1/2):15-19.
[19] Xiong F,Zhang L.Role of the hypothalamic-pituitary-adrenal axis in developmental programming of health and disease[J].Front Neuroendocrinol,2013,34(1):27-46.
[20] Perroud N,Dayer A,Piguet C,etal.Childhood maltreatment and methylation of the glucocorticoid receptor gene NR3C1 in bipolar disorder[J].Br J Psychiatry,2014,204(1):30-35.
[21] Palma-Gudiel H,Cordova-Palomera A,Leza JC,etal.Glucocorticoid receptor gene(NR3C1) methylation processes as mediators of early adversity in stress-related disorders causality:a critical review[J].Neurosci Biobehav Rev,2015,55:520-535.
[22] Tyrka AR,Parade SH,Welch ES,etal.Methylation of the leukocyte glucocorticoid receptor gene promoter in adults:associations with early adversity and depressive,anxiety and substance-use disorders[J].Transl Psychiatry,2016,6(7):e848.
[23] Koh YW,Chui CY,Tang CSK,etal.The prevalence and risk factors of paternal depression from the antenatal to the postpartum period and the relationships between antenatal and postpartum depression among fathers in Hong Kong[J].Depress Res Treat,2014,2014:127632.
[24] Cao-Lei L,Suwansirikul S,Jutavijittum P,etal.Glucocorticoid receptor gene expression and promoter CpG modifications throughout the human brain[J].J Psychiatr Res,2013,47(11):1597-1607.
[25] Weaver IC,Hellstrom IC,Brown SE,etal.The methylated-DNA binding protein MBD2 enhances NGFI-A(egr-1)-mediated transcriptional activation of the glucocorticoid receptor[J].Philos Trans R Soc Lond B Biol Sci,2014,369(1652):20130513.
Association of postpartum depression with serum cortisol and promoter methylation of glucocorticoid receptor gene
WANG Wei1, MU Xin2, WANG Yanming3, CHEN Ce1, MA Qingyan1, JIA Min1, JIANG Wenhui1, ZHU Feng4*
(1DepartmentofPsychiatry,FirstAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710061,China;2ReproductiveMedicineCenter,NorthwestWomen’sandChildren’sHospital;3DepartmentofGynecologyandObstetrics,AffiliatedHospitalofYan’anUniversity;4CenterforTranslationalMedicine,FirstAffiliatedHospitalofXi’anJiaotongUniversity;*Correspondingauthor,E-mail:zhufeng0714@163.com)
ObjectiveTo investigate functional alteration of hypothalamic-pituitary-adrenal axis and promoter methylation modification of glucocorticoid receptor(GR) gene in patients with postpartum depression(PPD) and the underlying mechanism.MethodsTwenty-two PPD females and 26 healthy women were enrolled in the study to finish the mental evaluation using Edinburgh postnatal depression scale and the interview of psychiatrists at 42-56 d after their delivery. Serum cortisol was quantified using enzyme-linked immunosorbent assay. The methylation was determined by bisulfite sequencing.ResultsCompared with healthy controls, the basal cortisol concentration in serum significantly increased in patients with PPD(P<0.001). After the suppression with dexamethasone(3.5 μg/kg), the decrease of serum cortisol levels in patients with PPD was less than in controls(P<0.001). Moreover, the promoter methylation level of GR gene increased in peripheral blood of patients with PPD compared with the controls. Spearman correlation analysis indicated that the overall methylation level of GR gene 1F promoter was negatively correlated with the decrease of cortisol following the dexamethasone suppression(r=-0.589 4,P=0.002), but not to the basal serum cortisol level(P>0.05).ConclusionThe function of HPA axis increases following PPD, which is associated with methylation modification of GR gene promoter.
postpartum depression; hypothalamic-pituitary-adrenal axis; glucocorticoid receptor; DNA methylation
国家自然科学基金资助项目(31401066);陕西省自然科学基金资助项目(2016JQ8026)
王崴,男,1976-03生,硕士,主治医师,E-mail: xianwv@sina.com
2016-09-21
R749
A
1007-6611(2016)11-1032-06
10.13753/j.issn.1007-6611.2016.11.018

